Fertility analysis and 2n gametes induction of Lilium FA hybrids ‘Jiaoyang’ in short growth period
-
摘要:目的 探究百合远缘杂种‘骄阳’百合的花粉与雌配子的育性,通过诱导提高、恢复配子的育性,在多倍体优秀种质渗入育种中加以应用。方法 以‘骄阳’百合为试验材料,通过醋酸洋红染色法观测花粉育性,观察其花粉母细胞减数分裂进程,采用秋水仙素注射法诱导2n配子,通过与兰州百合杂交以验证2n花粉育性;为探究雌配子的育性,以‘骄阳’百合为母本与兰州百合杂交,通过直接授粉法与切割柱头授粉法,以子房膨大率、有胚种子数、发芽率加以衡量雌配子的育性。结果 ‘骄阳’百合在花粉母细胞减数分裂过程中存在染色体与细胞质不均等分离的现象,产生大量非整倍体小孢子,不能发育成可育的花粉,雄配子没有育性。通过秋水仙素处理后,产生部分有活力的2n花粉,适宜的秋水仙素诱导浓度为0.10%,最高诱导率为86.00%,与兰州百合杂交时未能结实。当‘骄阳’百合作母本与兰州百合杂交时可以结实,雌配子具有育性并产生非整倍配子,通过切割柱头法授粉,子房膨大率由11.91%提高至65.02%。结论 ‘骄阳’百合的花粉不育,利用秋水仙素可以诱导2n花粉的产生并恢复一定的育性;而雌配子可育,作为母本杂交能获得有胚种子并发芽。研究‘骄阳’百合的育性有助于进一步对不同杂种系间百合进行种质渗入,对培育综合性状优良的百合新品种具有重要价值。Abstract:Objective This paper aims to explore the fertility of pollen and female gametes of Lilium
FA hybrids ‘Jiaoyang’, and to improve and restore the fertility of gametes by artificial induction, so as to apply it in polyploid introgression breeding. Method The pollen fertility of L. FA hybrids ‘Jiaoyang’ was observed by the method of acetic acid magenta staining, and the process of meiosis of its pollen mother cells was observed. 2n gametes were induced by colchicine injection, and 2n pollen fertility was verified by hybridization with L. davidii var. unicolor. In order to explore the fertility of female gametes, L. FA hybrids ‘Jiaoyang’ was used as female parents crossed with L. davidii var. unicolor through direct pollination and cut-style method. The fertility of female gametes was measured by the expansion rate of ovary, the number of embryo seeds and the germination rate.Result During the meiosis of pollen mother cells, there were unequal segregation of chromosomes and cytoplasm in L. FA hybrids ‘Jiaoyang’, which produced a large number of aneuploid microspores, could not develop into fertile pollen, resulting in no fertility. After colchicine treatment, some 2n pollen was produced. The optimum concentration of colchicine was 0.10%, and the highest induction rate was 86.00%. The female gametes were fertile and produced aneuploidy gametes. By cut-style method, the ovary expansion rate increased from 11.91% to 65.02%.Conclusion Colchicine can induce 2n pollen production and restore certain fertility in the pollen of L. FA hybrids ‘Jiaoyang’, while the female gametes can be fertile, and the embryo seeds can be obtained and germinated crossed as the female parent. The study on the fertility of L. FA hybrids ‘Jiaoyang’ is helpful for further introgression among different groups of lilies, and is of great value for cultivating new varieties with excellent comprehensive characters. -
磨削是木材加工中必不可少的重要工序,所用磨具大多为砂带,主要用于工件定厚和表面抛光。砂带磨削具有“冷态磨削”和“弹性磨削”的特点,是一种高精度、高效率、低成本的加工技术。材料去除率和表面粗糙度作为最常用的砂带磨削性能指标,是衡量砂带磨削效率、砂带寿命,以及评定加工质量的重要指标。材料去除率是指磨削过程中砂带在单位时间内去除被磨削材料的质量百分比,该指标直接影响到工件的定厚效果和表面粗糙度。影响砂带材料去除率的主要因素有砂带制造工艺、砂带目数、磨削压力、磨削速度和磨削延续长度。任青剑等[1]进行了300M超高强度钢的切入式磨削实验,发现在微观形貌方面,磨粒间距较大的砂带多是因磨粒磨损而失效,这是磨削效率降低的一个原因,但针对磨削效率降低的其他原因及其影响因素的探究仍然不够深入。Torrance[2]建立了磨料磨损模型,并将该方法应用于磨削过程中磨削力和金属材料去除率之间关系的预测以及磨料劣化的预测中。由于木材种类繁多,各项性质差异较大,此模型在木材磨削领域的应用存在局限性,仍需进一步研究探索。表面粗糙度的影响因素主要是关于木材特性的,包括纹理、密度、含水率等。刘博等[3]研究发现磨削表面质量会受到木材材性和加工工艺等因素的影响。Tian等[4]使用磨削效率测试系统和表面粗糙度测量仪进行磨削实验,分析比较了3种试材磨削效率和表面粗糙度的变化规律以及相关因素对磨削效率和表面粗糙度的影响,结果表明:磨削效率与表面粗糙度的变化趋势是随磨削次数的增加而逐渐降低,且同一树种、相同的磨削次数下,横向磨削时的磨削效率高于纵向磨削时的磨削效率。该实验在较为宏观的层面下进行探讨,缺乏对于砂带与试件表面微观形貌的进一步研究与分析。
砂带在磨削材料过程中将不可避免地产生磨损,且砂带的磨损是多个因素共同作用的结果,如磨削压力、砂带速度、工件材料等,在磨削不同材料或不同的磨削条件下的砂带磨损形式也会有差异。Ferguson等[5]在进行磨料磨损实验时,通过改变磨料磨粒尺寸、磨削压力、滑动速度和滑动距离来评估复合材料的磨损率。Malinov等[6]发现随着磨削压力的增加,Fe-B合金的耐磨性降低,磨损机制从微切割变为微切割和微耕的混合模式。在实际生产中,砂带生产厂家无法提供准确的砂带使用寿命,多依赖熟练工人的经验来判别砂带的使用寿命,这在一定程度上影响企业的生产效率和经济效益。随着人工智能和传感技术的发展,木材加工智能化已成为重要的发展方向,智能化控制一方面是提高机械设备的智能化控制程度,更重要的一方面是使切削(包括磨削)过程和结果可控,也就是根据要求达到相应的材料去除效率和表面加工质量[7]。比如美国将砂带磨削应用于汽车制造业的FMS生产线上,从磨削过程和设备控制两方面共同调控以达到最终的生产过程智能化。美国3M公司发明的微晶复制砂带使磨粒形状细致均匀且统一,使得磨削过程变得更加精密和高效[8]。
有关木材磨削方面的研究基础较为薄弱,而金属磨削理论并不完全适用于木材,对于木材砂带磨损和磨削效率方面的研究则是少之又少,砂带磨损机理也尚不明晰,这严重阻碍了木材加工技术和砂带制造技术向高效智能方向的发展。针对以上问题,本研究对水曲柳试件开展砂带磨削实验,分析砂带磨损机理及磨粒磨损对材料去除率和表面粗糙度的影响,进一步完善木材磨削理论,并为发展适用于木材的砂带磨削技术提供理论支持。
1. 材料和方法
1.1 材 料
水曲柳(Fraxinus mandshurica)材质坚韧致密,富弹性,纹理通直,刨面光滑,胶接、油漆性能较好,具有良好的装饰性能,在建筑、飞机、造船、仪器、运动器材、家具等行业应用广泛,因此本研究选用水曲柳作为实验材料,其气干密度为0.76 g/cm3,含水率为5.41%。制备的试件尺寸为46 mm(长) × 46 mm(宽) × 24 mm(厚);所有试件取自边材,表面平整,无明显缺陷。本研究所选用砂带为60目普通布基疏植砂型砂带(JW342,DEER,韩国)。
1.2 研究方法
1.2.1 砂带磨削实验装置
本研究所使用的实验装置如图1所示。该装置主要由使工作平台作直线往复运动的驱动系统和提供恒定磨削压力的气动装置组成。将砂带展平放置在工作平台上,调节两端的张紧轮,确保砂带张紧固定;将木制试件放置于夹具内,调节夹紧螺母完成试件的装夹;通过立式布置的带直线导轨的气缸(ADNGF-50-40-A,FESTO,德国),为试件提供恒定的磨削压力(约为100 N);随着试件材料不断去除,其厚度也逐渐减小,试件夹具可沿立式滑轨在气缸导杆行程内下移,使试件与砂带表面始终相接触;驱动系统带动工作平台沿水平滑轨作往复直线运动(平均速度约为0.3 m/s),同时智能计数装置完成磨削次数记录。
1.2.2 材料去除率表征及表面形貌分析
在本研究中,材料去除率定义为每磨削1 000次后试件的质量变化率。每磨削一次则磨削长度为50 mm,可将磨削次数累计与磨削长度进行换算。实验过程中,采用精密分析天平(BSA4235,Sartorious,德国)对试件和砂带进行称重,且每次称重前使用高压气枪(额定压力为3.0 MPa)去除试件和砂带表面的磨屑,进而计算相应的材料去除率和砂带的质量变化情况,直至材料去除率降至3%以内,认为此时砂带寿命已达极限,砂带上的磨粒已无法完成对试件材料的有效切除。采用3D轮廓仪(VR5000,KEYENCE,日本)对磨削过程中试件磨削表面和砂带表面进行扫描,再通过专业分析软件(VR Series version 3.2.0.277)测定试件磨削表面以及砂带的表面粗糙度,并使用扫描电子显微(日立S-3400N Ⅱ)对试件的磨削表面形貌进行分析。实验中对水曲柳分别进行顺纹磨削(磨削方向平行于木材纹理方向)和横纹磨削(磨削方向垂直于木材纹理方向)。
2. 结果与讨论
2.1 横纹磨削
横纹磨削时,磨粒的切削方向与木材纤维方向基本垂直,磨粒多呈负前角或小后角,锋利的刃口将木材纤维拦腰截断,木材纤维基本上以剥离的形式去除[9-10]。观察发现图2a中有较多细窄且清晰的单个磨粒磨削痕迹,而图2b、2c中这种磨削痕迹则逐渐减少,直至较宽的磨削痕迹占绝大多数。由于现有的磨粒制备技术及植砂工艺,新砂带上的磨粒等高性不好,如图3a所示,切削刃曲率半径很小且参差不齐,所以磨削初期会在试件表面上留下细窄、清晰的磨削痕迹。
随着磨削次数增加,高度较高的磨粒由于与试件接触深度加大,会首先发生破碎和脱落,这也就是所谓的“初锐阶段”[11]。从图4b中明显看出,初锐阶段大约在磨削次数5 000次以内,砂带上的磨粒在发生脱落和破碎之外,磨粒的磨损也同时发生,此时砂带质量减小的速率较快,只是砂带脱落、破碎和磨损所占比例不同。图5b中对应的砂带表面粗糙度较高,即磨粒高度之间差异较大,所以更易压入试件进行磨削,故此时对应图4a处材料去除率极高。
初锐阶段结束后,在图3b中可观察到砂带表面相同高度磨粒的个数明显增加,主要由于试件与磨粒之间的相互作用使得磨粒尖端钝化为小平面,其等高性变好且高度变矮,材料去除率会随之下降。此时磨粒协同干涉作用逐渐显著,从图2b中可以看出在一条较宽的磨削痕迹中有许多条细小的磨削痕迹,但是并没有非常明显且完整的单个磨粒的磨削痕迹,这是由于前一个磨粒所产生的磨削痕迹会被后续的磨粒进行进一步“加工”,而最终体现出来的磨削痕迹是众多磨粒共同作用的效果,消除了之前单个磨粒的磨削痕迹,使磨削痕迹的界限变得模糊,这种多磨粒干涉效应[12]也是使工件表面变光滑的最关键因素。
随着磨削阶段到达中、后期,从图2c中可以看出磨粒将木纤维从两侧挤出翘起,在试件表面犁出凹痕,只能切除少量材料,故材料去除率呈下降趋势并在一定程度上影响了试件表面的粗糙度。从图5可以看出,磨削中期试件表面的粗糙度是比较高的,但磨削后期由于磨粒钝化更加明显且高度更低,如图3c,砂带表面等高性进一步增加,表面的粗糙度迅速降低,磨粒与试件表面接触深度变浅,试件表面发生弹塑性变形,导致几乎无法去除材料,表面凹痕更浅,故可见图5a在中、后期表面粗糙度明显下降。观察图4b可得磨削中期到后期砂带质量基本是线性减小的,也就说明砂带的磨损、脱落、破碎最终达到一个较为平衡的阶段。
2.2 顺纹磨削
顺纹磨削时,切削方向与木材纤维方向基本平行,磨粒是从木材纤维的端向切入木材[13]。与横纹磨削类似,在初期阶段磨粒顶端的曲率半径较小,切削刃较为锋利,如图6a,砂带上磨粒的等高性较差,易压入木材做有效切削,从图7a中可观察到初期阶段试件表面有多条清晰且完整的磨粒磨削痕迹。
对比图8a与图4a发现,水曲柳横纹磨削时材料去除率整体大于顺纹磨削的材料去除率,且顺纹磨削时材料去除率的下降速率大于横纹的下降速率。这说明砂带在顺纹磨削时更难去除材料,主要由于顺纹磨削过程中,磨粒切入木材时是从木纤维的端头切入,加之磨粒一般为负前角,很难依靠锋利的刃口将木纤维切断,更多的是将其牵扯拉断[14]。从图8b中也可发现此时砂带的磨损速率更快,导致砂带使用寿命也更短。
随磨削次数增加,砂带磨粒高度降低,顶端刃口曲率半径不断增大,在图7b中可以看到许多较宽的磨削痕迹且在凹痕两侧有较多毛刺及翘起的木纤维,故在图9a中可明显观察到试件表面粗糙度增高。在磨削中期,从图6b可看出,砂带上磨粒脱落,破碎所占比例较大,等高性增大,磨粒与试件的接触深度降低且切割纤维能力减弱,在试件表面发生更多的是耕犁现象,木纤维在多次牵拉下被扯断,如图7b左侧示意图。
至磨削后期,观察图7c发现部分磨削痕迹被木屑填埋,翘起的毛刺被抹平,且凹痕大多较浅,故可见图9a中试件表面粗糙度明显下降。如图6c,此时磨粒整体高度下降,磨粒磨损情况严重,大多仅摩擦试件表面,几乎无法切除材料,同时将折断、翘起的木纤维碾平并填充空隙,使得表面粗糙度降低。但是不难从图9b中发现,顺纹磨削时后期砂带的表面粗糙度更大,这也和切削方式和磨粒破碎形式有关,因为在顺纹切削时纤维大多被拉断,所以磨粒更易受拉力造成破碎和脱落,这也是砂带在顺纹和横纹磨削时的一个主要差异[15]。
2.3 材料去除率、表面粗糙度灰色预测模型
在砂带寿命范围内,累计磨削长度与磨削过程中材料去除率、表面粗糙度间有着密切联系,但由于样本量少[16-17],且存在如木材非均质、砂带植砂磨粒分布偶然性等较多未知因素,较难建立磨削长度与材料去除率、表面粗糙的回归模型。20世纪80年代邓聚龙教授创立了一种就数找数的方法,即灰色系统生成法。其研究对象是“部分信息已知,部分信息未知”的“小样本”、“贫信息”不确定性系统,用于解决“小样本”、“贫信息”的不确定性问题,这种方法容错率较高,也易于实现模糊控制[18]。因此本研究采用均值GM(1,1)预测模型建立磨削长度与材料去除率、表面粗糙度间的灰色预测模型,如图10所示。
2.3.1 模型预测
在本次模型中,系列特征序列为材料去除率和表面粗糙度,相关因素序列为磨削长度,模型原始数据及建模步骤如下:
第一步,根据表1、2中数据,建立初始材料去除率序列
X(0)1 、表面粗糙度序列X(0)2 。表 1 横纹磨削模型数据Table 1. Model data of transverse sanding序号
No.磨削长度
Sanding length/m表面粗糙度
Surface roughness/μm材料去除率
Material removal rate/%1 200 41.178 15.11 2 400 39.723 13.48 3 600 40.546 15.71 4 800 51.551 7.27 5 1 000 54.409 12.66 6 1 200 63.536 11.39 7 1 400 60.472 8.35 8 1 600 67.846 9.61 注:为提高所建灰色模型的预测精度,选取数据均在砂带最佳使用寿命范围内。下同。Notes: to improve the precision of the established gray model, the selected data is located in the range of optimal abrasive belt life. Same as below. 表 2 顺纹磨削模型数据Table 2. Model data of longitudinal sanding序号
No.磨削长度
Sanding length/m表面粗糙度
Surface roughness /μm材料去除率
Material removal rate/%1 100 42.572 14.57 2 200 78.737 14.96 3 300 69.976 11.70 4 400 79.229 12.13 5 500 71.151 7.43 6 600 79.812 11.40 7 700 81.305 8.46 8 800 81.221 5.77 9 900 74.79 6.53 10 1 000 78.662 4.86 X(0)1=(X(0)1(1),X(0)1(2),X(0)1(3),⋯,X(0)1(n−1),X(0)1(n))X(0)2=(X(0)2(1),X(0)2(2),X(0)2(3),⋯,X(0)2(n−1),X(0)2(n)) 式中:
X(0)1(n) 代表材料去除率第n个数据的原始数值;X(0)2(n) 代表表面粗糙度第n个数据的原始数值;n表示原始数列的个数,本文横纹磨削时n = 8,顺纹磨削时n = 10。第二步,均值GM(1,1)建模。
(1)对原始数据做一次累加得
X(1)1 和X(1)2 ,原始序列的1-AGO生成;(2)
X(1)(n) 表示原始序列第n个数的一阶累加数值,X(0)(n) 表示原始序列第n个数值,构造数据矩阵B和数据向量Y;B=[−12(X(1)(1)+X(1)(2)1−12(X(1)(2)+X(1)(3)1⋮⋮−12(X(1)(n−1)+X(1)(n)1],Y=[X(0)(2)X(0)(3)⋮X(0)(n)] GM(1,1)模型可表示为
Y=Bu ,即[X(0)(2)X(0)(3)⋮X(0)(n)]=[−12(X(1)(1)+X(1)(2)1−12(X(1)(2)+X(1)(3)1⋮⋮−12(X(1)(n−1)+X(1)(n)1][ˆaˆb] (3)计算待估向量
ˆu ;ˆu=(ˆa,ˆb)T=(BT⋅B)−1BTY 式中:a为发展灰数,表示序列的发展趋势;b为内生控制灰数,表示数据间的变化关系。
(4)建立模型。
dX(1)1dt+a1X(1)=b1 dX(1)2dt+a2X(1)=b2 式中:t表示序号1,2,······,n−1,n的连续变量;a1、b1分别为计算材料去除率预估向量的发展灰数和内生控制灰数;a2、b2分别为计算表面粗糙度预估向量的发展灰数和内生控制灰数。
第三步,模型检验。
从图11a中数据计算得到:横纹磨削过程中,材料去除率平均模拟相对误差为18.362%,表面粗糙度的平均模拟相对误差为5.170%。从图11b中数据计算可得:顺纹磨削过程中,材料去除率平均模拟相对误差为13.491%,表面粗糙度的平均模拟相对误差为4.603%。
2.3.2 结果分析
由图11可知:采用灰色模型均值GM(1,1)的预测平均模拟相对误差都是在20%以内。考虑预测系统本身局限性,以及木质材料的各向异性导致原始数据的随机性较高,本身规律性不是很明显的情况下,这些因素都加大了预测难度,一定程度上影响了模拟预测的准确性。故本模型适用于预测水曲柳磨削过程中,磨削长度分别与材料去除率、表面粗糙度之间关系的预测,对实际生产具有借鉴意义。
3. 结 论
木材磨削过程中材料去除行为会影响木材加工表面质量,其影响因素主要有磨削方向、材料种类以及磨削过程中砂带的磨损情况。本文主要研究了水曲柳在不同磨削方向时的材料去除率和试件、砂带表面粗糙度变化情况,探究了磨粒磨损过程及其与材料去除率之间的关系,得出以下结论:
(1)磨削过程中磨削方向对砂带磨损的影响不同,顺纹磨削对砂带上磨粒的磨损大于横纹磨削。磨粒的磨损对材料去除率有较大的影响,磨粒磨损程度越大,材料去除率越小。当材料去除率降低至3%时,可认为达到砂带使用寿命,应及时更换砂带。
(2)磨削过程中,砂带上磨粒的等高性对材料去除率也有较大影响。等高性越差,材料去除率越高。随磨削次数增加,砂带材料去除能力不断下降,试件表面粗糙度则呈现先增大后减小的趋势。
(3)采用灰色模型均值GM(1,1)的预测平均模拟相对误差都是在20%以内。适用于水曲柳磨削过程中磨削长度分别与材料去除率、表面粗糙度之间关系的预测。
-
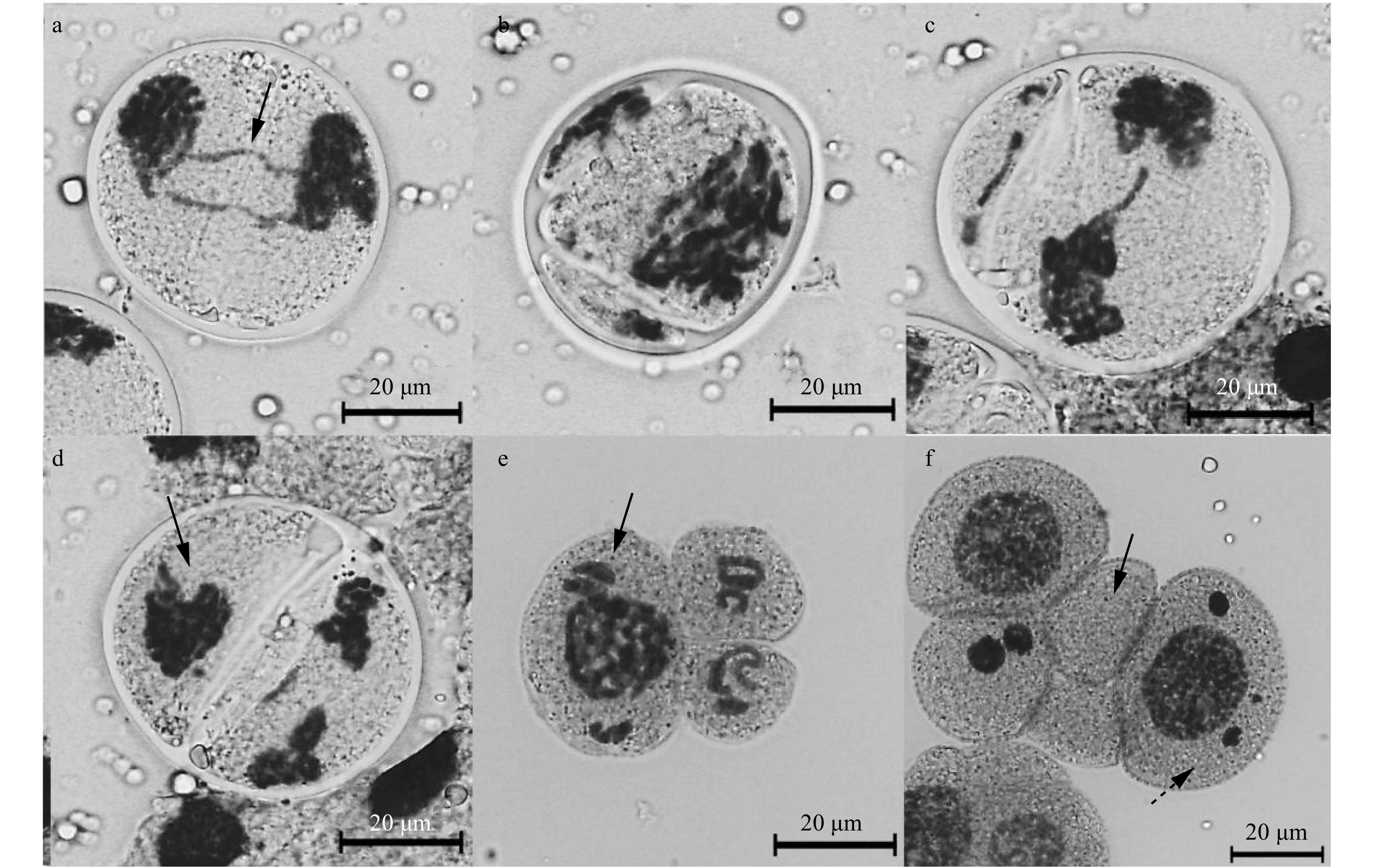
图 2 ‘骄阳’百合花粉母细胞减数分裂异常
a. 染色体桥;b. 核质不均等分离的三分体;c. 二分体时期细胞质不均等分裂与后期Ⅱ的落后染色体;d. 末期Ⅱ子核融合;e. 不同染色体数目小孢子;f.具多核小孢子与无染色体小孢子。标尺 = 20 μm。a, chromosome bridges; b, unequal separation of chromosomes of triad;c, unequal division of cytoplasm and lagging chromosomes of anaphase Ⅱ; d, a fused nucleus in a daughter cell of telophase Ⅱ; e, microspores with different chromosome numbers; f, multinucleated microspore and non nucleated microspores. Bar = 20 μm.
Figure 2. Meiosis abnormality of the PMCs of L. FA hybrids ‘Jiaoyang’
图 3 ‘骄阳’百合自然花粉与2n花粉形态
a.对照组花形态;b.秋水仙素诱导 2n花粉花形态;c. 10倍镜下自然花粉;d. 10倍镜下2n花粉;e. 40倍镜下自然花粉;f. 40倍镜下2n花粉。标尺 = 10 mm(a ~ b),200 μm(c ~ f)。a, flower morphology of the control group; b, flower morphology of colchicine induced 2n pollen in treatments; c, natural pollen under 10× microscope; d, 2n pollen under 10× microscope; e, natural pollen under 40× microscope; f, 2n pollen under 40× microscope. Bar = 10 mm (a−b), 200 μm (c−f).
Figure 3. Natural pollen and 2n pollen of L. FA hybrids ‘Jiaoyang’
表 1 ‘骄阳’百合花蕾长度与小孢子母细胞发育进程的对应关系
Table 1 Relationship between bud length and development of pollen mother cells (PMC) s for L. FA hybrids ‘Jiaoyang’
花蕾长度
Length of flower bud/mm花药长度
Length of anther/mm花药颜色
Color of anther减数分裂进程
Stage of meiosis< 20 < 9.06 白色 White 间期 Interphase 20 ~ 24 10.73 ~ 11.64 淡黄色 Light yellow 前期Ⅰ Prophase Ⅰ、中期Ⅰ Metaphase I、后期Ⅰ Anaphase Ⅰ、末期Ⅰ Telophase Ⅰ 24 ~ 26 11.13 ~ 13.62 黄绿色 Yellowish green 前期Ⅱ ProphaseⅡ、中期Ⅱ MetaphaseⅡ、后期Ⅱ AnaphaseⅡ、四分体时期 Tetrad period > 26 > 14.72 橘红色 Tangerine 四分体时期 Tetrad period、小孢子 Microspore 表 2 骄阳’百合自然花粉与秋水仙素诱导后花粉染色率
Table 2 Pollen staining rates of natural pollen and colchicine induced pollen of L. FA hybrids ‘Jiaoyang’
花粉类型
Pollen type染色花粉数
Number of stained pollen未染色花粉数
Number of unstained pollen花粉染色率
Pollen staining rate/%自然花粉
Natural pollen0 580 0.00 秋水仙素诱导后花粉
Colchicine induced pollen222 246 47.44 表 3 不同秋水仙素浓度处理‘骄阳’百合2n花粉直径与诱导率
Table 3 2n pollen diameter and induction rates of L. FA hybrids ‘Jiaoyang’ treated with differentconcentrations colchicine
处理浓度
Treatment concentration/%花粉直径
Pollen
diameter/μm2n花粉诱导率
2n pollen
induction rate/%0.00 63.31 ± 8.16d 0.00 0.05 92.92 ± 22.74c 33.00 0.10 112.93 ± 18.21a 83.00 0.20 100.44 ± 17.87b 63.00 0.30 98.27 ± 17.90b 57.00 注:不同小写字母代表差异显著(P < 0.05)。Note: different lowercase letters represent significant differences (P < 0.05). 表 4 ‘骄阳’百合与兰州百合的杂交结果
Table 4 Hybridization results of L. FA hybrids ‘Jiaoyang’ and L. davidii var. unicolor
母本Female 父本Male 授粉方式 Pollination method 杂交花朵数Number of pollination flower 膨大子房数Number of enlarged ovary 子房膨大率Percentage of enlarged ovary /% 有胚种子数Number of embryonic seed 发芽率Germination rate/% 兰州百合
L. davidii var. unicolor‘骄阳’百合2n花粉
2n pollen of L. FA hybrids ‘Jiaoyang’常规授粉法
Conventional pollination120 0 0.00 0 0 ‘骄阳’百合
L. FA hybrids ‘Jiaoyang’兰州百合
L. davidii var. unicolor常规授粉法
Conventional pollination277 33 11.91 159 33.96 ‘骄阳’百合
L. FA hybrids ‘Jiaoyang’兰州百合
L. davidii var. unicolor切割柱头法
Cut-style method263 171 65.02 849 33.46 -
[1] Barba-Gonzalez R, Lim K B, Van Tuyl J M. Molecular cytogenetics in Lilium breeding[J]. Acta Horticulturae, 2014, 1027: 129−142.
[2] Zhou S J, Ramanna M S, Visser R G F, et al. Genome composition of triploid lily cultivars derived from sexual polyploidization of Longiflorum × Asatic hybrids (Lilium)[J]. Euphytica, 2008, 160(2): 207−215. doi: 10.1007/s10681-007-9538-8
[3] Zhang X Q, Cao Q Z, Jia G X. A protocol for fertility restoration of F1 hybrid derived from Lilium × formolongi ‘Raizan 3’ × Oriental hybrid ‘Sorbonne’[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2017, 129(3): 375−386. doi: 10.1007/s11240-017-1184-9
[4] Barba-Gonzalez R, Miller C T, Ramanna M S, et al. Nitrous oxide (N2O) induces 2n gametes in sterile F1 hybrids between Oriental × Asiatic lily (Lilium) hybrids and leads to intergenomic recombination[J]. Euphytica, 2006, 148(3): 303−309. doi: 10.1007/s10681-005-9032-0
[5] Ramanna M S, Jacobsen E. Relevance of sexual polyploidization for crop improvement : a review[J]. Euphytica, 2003, 133(1): 3−18. doi: 10.1023/A:1025600824483
[6] Lim K B, Ramanna M S, De Jong J H, et al. Indeterminate meiotic restitution (IMR): a novel type of meiotic nuclear restitution mechanism detected in interspecific lily hybrids by GISH[J]. Theoretical and Applied Genetics, 2001, 103(2−3): 219−230. doi: 10.1007/s001220100638
[7] Barba-Gonzalez R, Lokker A C, Lim K B, et al. Use of 2n gametes for the production of sexual polyploids from sterile Oriental x Asiatic hybrids of lilies (Lilium)[J]. Theor Appl Genet, 2004, 109(6): 1125−1132. doi: 10.1007/s00122-004-1739-0
[8] 张正海, 康向阳. 植物2n配子发生及其遗传标记研究进展[J]. 遗传, 2006, 28(1):105−109. doi: 10.3321/j.issn:0253-9772.2006.01.019 Zhang Z H, Kang X Y. Advances in researchs on genetic markers of 2n gemetes[J]. Hereditas, 2006, 28(1): 105−109. doi: 10.3321/j.issn:0253-9772.2006.01.019
[9] Bretagnolle F, Thompson J D. Gametes with the somatic chromosome number: mechanisms of their formation and role in the evolution of autopolyploid plants[J]. New Phytologist, 1995, 129(1): 1−22. doi: 10.1111/j.1469-8137.1995.tb03005.x
[10] Barba-Gonzalez R, Lim K B, Ramanna M S, et al. Occurrence of 2n gametes in the F1 hybrids of Oriental × Asiatic lilies (Lilium): relevance to intergenomic recombination and backcrossing[J]. Euphytica, 2005, 143(1−2): 67−73. doi: 10.1007/s10681-005-2657-1
[11] Luo J R, Arens P, Niu L X, et al. Induction of viable 2n pollen in sterile Oriental × Trumpet Lilium hybrids[J]. The Journal of Horticultural Science and Biotechnology, 2016, 91(3): 258−263. doi: 10.1080/14620316.2016.1148371
[12] Lim K B, Ramanna M S, Van Tuyl J M, et al. Genotypic and environmental variation in production of 2n-gametes of oriental × asiatic lily hybrids[J]. Acta Horticulturae, 2005, 673(3): 453−456.
[13] 廖晓珊, 吴青青, 张朝君, 等. 东方百合2n花粉诱导及鉴定研究[J]. 北方园艺, 2016, 40(8):56−60. Liao X S, Wu Q Q, Zhang C J, et al. Study on 2n pollen induction and identification of Lilium oriental[J]. Northern horticulture, 2016, 40(8): 56−60.
[14] 康向阳, 朱之悌, 张志毅. 高温诱导白杨2n花粉有效处理时期的研究[J]. 北京林业大学学报, 2000, 22(3):1−4. doi: 10.3321/j.issn:1000-1522.2000.03.001 Kang X Y, Zhu Z T, Zhang Z Y. Suitable period of high temperature treatment for 2n pollen of Populus tomentosa × P. bolleana[J]. Journal of Beijing Forestry University, 2000, 22(3): 1−4. doi: 10.3321/j.issn:1000-1522.2000.03.001
[15] 封紫, 刘瑞峰, 贾桂霞. 氟乐灵诱导百合2n花粉的研究[J]. 西北农业学报, 2012, 21(3):153−157. doi: 10.3969/j.issn.1004-1389.2012.03.030 Feng Z, Liu R F, Jia G X. Induction of 2n pollens by triflirallin in Longiflorum × Asiatic hybrid(Lilium)[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2012, 21(3): 153−157. doi: 10.3969/j.issn.1004-1389.2012.03.030
[16] Akutsu M, Kitamura S, Toda R, et al. Production of 2n pollen of Asiatic hybrid lilies by nitrous oxide treatment[J]. Euphytica, 2007, 155(1−2): 143−152. doi: 10.1007/s10681-006-9317-y
[17] Barba-Gonzalez R, Ramanna M S, Visser R G F, et al. Intergenomic recombination in F1 lily hybrids (Lilium) and its significance for genetic variation in the BC1 progenies as revealed by GISH and FISH[J]. Genome, 2005, 48(5): 884−894. doi: 10.1139/g05-057
[18] Zhou S J. Intergenomic recombination and introgression breeding in Longiflorum × Asiatic lilies[D]: Wageningen: Wageningen University and Research Centre, 2007.
[19] Cheng S P, Zong Y X, Wang X W. Sub-genome polyploidization effects on metabolomic signatures in triploid hybrids of Populus[J/OL]. Forests, 2019, 10(12): 1091[2020−04−20]. https://www.mdpi.com/1999-4907/10/12/1091.
[20] Xie K D, Xia Q M, Peng J, et al. Mechanism underlying 2n male and female gamete formation in lemon via cytological and molecular marker analysis[J]. Plant Biotechnology Reports, 2019, 13(2): 141−149. doi: 10.1007/s11816-019-00525-4
[21] 咸铖. 兰州百合繁殖生物学研究[D]. 沈阳: 沈阳农业大学, 2019. Xian C. Study on reproductive biology of Lilium davidii var. unicolor Salish [D]. Shenyang : Shenyang Agricultural University, 2019.
[22] 耿兴敏, 夏婷, 罗凤霞. 中国部分野生百合自交和组内及组间杂交亲和性研究[J]. 西北植物学报, 2013, 33(2):306−312. doi: 10.3969/j.issn.1000-4025.2013.02.015 Geng X M, Xia T, Luo F X. Study on self- and crosss-compatibility within Sinoartagon section and intersectional wild lilies in China[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2013, 33(2): 306−312. doi: 10.3969/j.issn.1000-4025.2013.02.015
[23] Van Tuyl J M, Van Diën M P, Van Creij M G M, et al. Application of in vitro pollination, ovary culture, ovule culture and embryo rescue for overcoming incongruity barriers in interspecific Lilium crosses[J]. Plant Science, 1991, 74(1): 115−126. doi: 10.1016/0168-9452(91)90262-7
[24] 刘凤栾, 杨利平, 尚爱芹, 等. KCl处理对百合柱头生理及结实的影响[J]. 武汉植物学研究, 2009, 27(4):403−406. Liu F L, Yang L P, Shang A Q, et al. Effects of KCl stress on physiology of Lilium stigma and seed setting[J]. Journal of Wuhan Botanical Research, 2009, 27(4): 403−406.
[25] 周树军. 现代百合品种培育的技术途径及其杂交特殊现象的机制[J]. 农业生物技术学报, 2014, 22(10):1189−1194. doi: 10.3969/j.issn.1674-7968.2014.10.001 Zhou S J. Technical ways of breeding modern lily (Lilium) cultivars and the mechanisms of the special phenomena of their hybridizations[J]. Journal of Agricultural Biotechnology, 2014, 22(10): 1189−1194. doi: 10.3969/j.issn.1674-7968.2014.10.001
[26] Fort A, Ryder P, Mckeown P C, et al. Disaggregating polyploidy, parental genome dosage and hybridity contributions to heterosis in Arabidopsis thaliana[J]. New Phytologist, 2016, 209(2): 590−599. doi: 10.1111/nph.13650
[27] Zhang W, Wang C, Xue L, et al. Production of pollenless triploid lily hybrids from Lilium pumilum DC. × ‘Brunello’[J/OL]. Euphytica, 2018, 214(10): 171 [2020−04−20]. https://doi.org/10.1007/s10681-018-2248-6.
[28] Barba-Gonzalez R, Lim K B, Zhou S, et al. Interspecific hybridization in lily: the use of 2n-gametes in interspecific lily hybrids[M]. Kagawa: Global Science Books, 2008.
[29] Marasek-Ciolakowska A, Nishikawa T, Shea D J, et al. Breeding of lilies and tulips: interspecific hybridization and genetic background[J]. Breeding Science, 2018, 68(1): 35−52. doi: 10.1270/jsbbs.17097
-
期刊类型引用(5)
1. 罗斌,杜瑶,柳浩雨,王钦悦,李春瑜,李黎,刘红光. 定组态砂带粒度对刨花板磨削的影响. 北京林业大学学报. 2024(09): 141-150 .  本站查看
本站查看
2. 施晨阳,赖文峰,文国卫,蒋天雨,朱晓如,吕增伟,张国防. 基于Maxent模型预测水曲柳的潜在适生区. 西北林学院学报. 2022(02): 149-156 .  百度学术
百度学术
3. 罗斌,张健,柳浩雨,李黎,刘红光,李昊. 木质材料磨削理论及技术研究进展. 木材科学与技术. 2022(04): 6-12 .  百度学术
百度学术
4. 杜瑶,田彪,张健,刘红光,罗斌. 中密度纤维板磨削时的砂带磨损研究及寿命评判. 北京林业大学学报. 2021(10): 126-134 .  本站查看
本站查看
5. 卢冬冬,杨铁牛,杨保健,叶榕伟,阳亚,杜华娜. 肉桂打磨方法优化. 农业工程. 2020(01): 73-78 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: