Characteristics of Lycium ruthenicum adapting to salinization stress after salt tolerance training
-
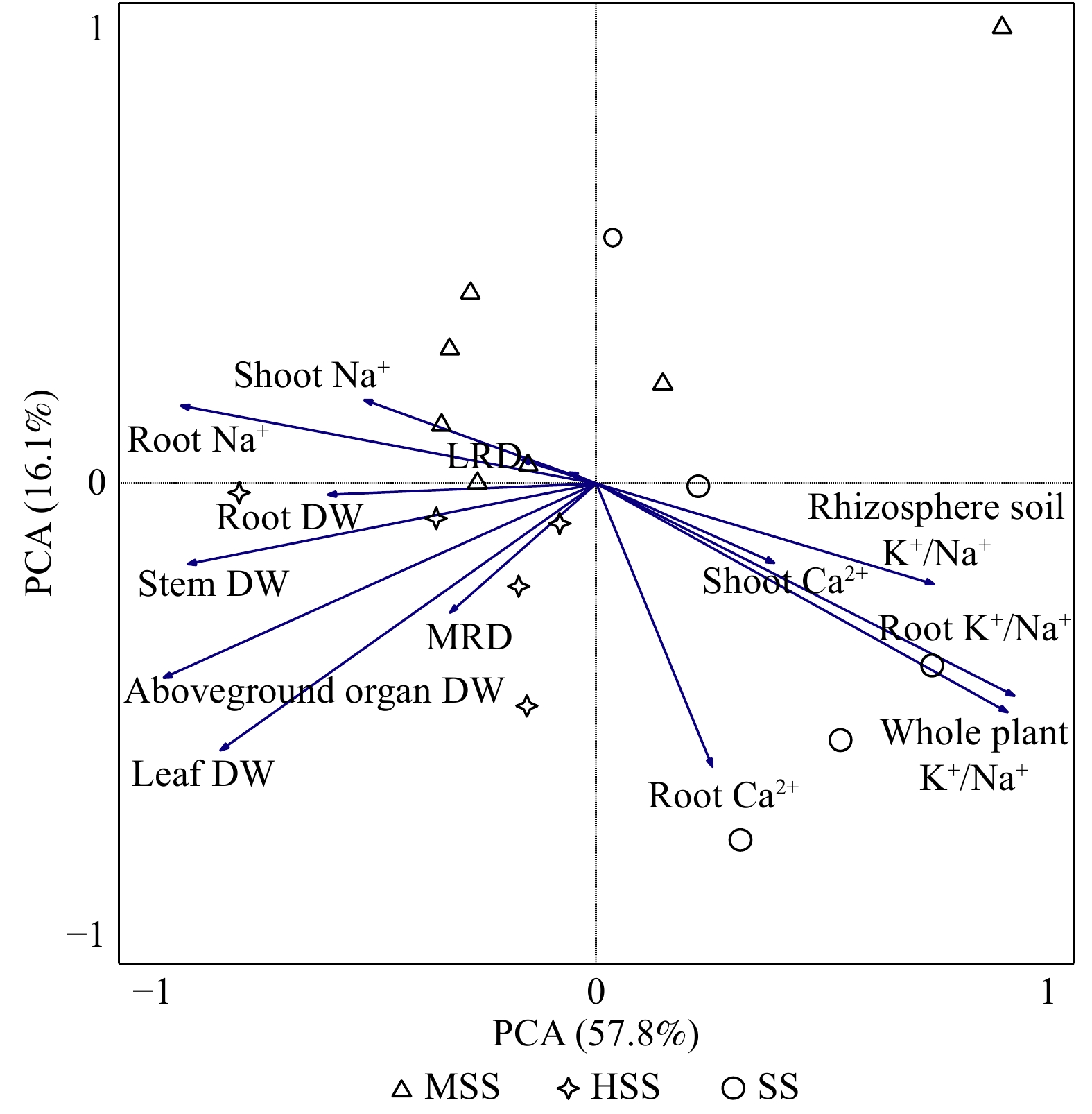
摘要:目的 明确耐盐锻炼黑果枸杞适应长期盐渍化胁迫的机理,为其修复极端干旱区盐渍化土壤提供依据。方法 应用回归分析及主成分分析低盐胁迫(MSS)、中盐胁迫(HSS)和高盐胁迫(SS)土壤黑果枸杞各器官K+、Na+和Ca2+区隔化特征,器官干质量和根系形态对盐胁迫的响应。结果 (1)NaCl浓度小于183.63 mmol/L,耐盐锻炼黑果枸杞植株成活率随着NaCl浓度增加而增大,NaCl浓度 ≥ 355.88 mmol/L植株全部死亡。随着NaCl浓度升高,花期到初果期果实相对生长速率显著减缓,初果期到果实完全成熟期果实相对生长速率加快。(2)HSS处理的根K+和Na+显著高于MSS和SS,茎中K+、Na+和Ca2+含量均显著低于MSS和SS。HSS处理的根和茎中K+/Na+和Ca2+/Na+差异不显著。SS处理的叶Ca2+分别是MSS和HSS的5和3倍。SS处理的根和茎Na+含量没有显著差异,根和叶Ca2+含量也没有显著差异。胁迫程度从MSS上升到SS,茎中Na+含量平均增加0.78 g/kg。(3)PCA分析表明,主成份1(PCA1)和主成份2(PCA2) 共解释了黑果枸杞适应盐胁迫的73.9%。PCA1可解释黑果枸杞盐胁迫的57.8%信息,其中,地上器官干质量对PCA1贡献最大,按照对PCA1贡献率大小排序为叶干质量、茎干质量、根干质量和主根直径。PCA1与根Na+含量、地上器官Na+含量和侧根直径呈显著负相关。株高、根Ca2+含量、茎粗、地上器官K+/Na+、根干质量、主根直径与PCA1呈正相关。植株K+/Na+、根系K+/Na+、根际土壤K+/Na+、根Ca2+含量和地上器官Ca2+含量可以解释PCA2盐胁迫的16.1%信息,上述指标均与PCA2呈显著负相关。结论 随着盐胁迫程度增加,叶维持高浓度Ca2+调控植株体K+/Na+,根和茎富集储存Na+能力显著增强,说明经过耐盐锻炼黑果枸杞倾向于不同器官协同分担盐胁迫以适应长期盐胁迫。Abstract:Objective For soil salinization restoration and sustainability in extreme arid areas, we investigated Lycium ruthenicum
adapting to long-term salinization stress. Method The K+, Na+ and Ca2+ compartmentalization of organs of L. ruthenicum in low salt stress (MSS), middle salt stress (HSS) and high salt stress (SS) soil were analyzed by regression analysis and principal component analysis, as well as the responses of dry mass and root morphology to salt stresses.Result (1) If concentration of NaCl at soil solution was below 183.63 mmol/L, the survival rate of salt-tolerance training plants increased with increasing concentration of NaCl, and all the plants died if concentration of NaCl was above 355.88 mmol/L. With increase of NaCl concentration, the relative growth rate of fruit significantly slowed down from flowering to early fruit, while accelerated from early fruit to full maturity. (2) The root K+ and Na+ treated by HSS were significantly higher than those treated by MSS and SS, and the contents of K+, Na+ and Ca2+ in stems were significantly lower than those treated by MSS and SS. There was significant differences neither K+/Na+ nor Ca2+/Na+ between roots and stems in HSS. The leaf Ca2+ in SS treatment was 5 and 3 folds of MSS and HSS, respectively. There was no significant difference in Na+ content between roots and stems, and no significant difference in Ca2+ content between roots and leaves. The stress increased from MSS to SS, the content of Na+ in the stem increased by 0.78 g/kg on average. (3) PCA analysis showed that principal component 1 (PCA1) and principal component 2 (PCA2) explained 73.9% information of L. ruthenicum under salt stress. PCA1 explained 57.8% of the salt stress of L. ruthenicum. Among them, dry mass of over-ground organs contributed the most to PCA1. According to these contributions to PCA1, leaf dry mass, stem dry mass, root dry mass and taproot diameter were to be top four. PCA1 was negatively correlated with Na+ content both in roots and aboveground organs and lateral root diameter. Plant height, root Ca2+ content, stem diameter, aboveground organ K+/Na+, root dry mass and taproot diameter were positively correlated with PCA1. The content of plant K+/Na+, root K+/Na+, rhizosphere soil K+/Na+, root Ca2+ and aboveground organ Ca2+ could explain 16.1% of PCA2.Conclusion With the increase of salt stress, leaves maintained high concentration of Ca2+ to regulate plant K+/Na+, and root and stem enrichment and storage capacity of Na+ were significantly enhanced, which indicate that L. ruthenicum tends to share salt stress cooperatively in different organs to adapt to long-term salt stress after salt tolerance training. -
在极端干旱的内陆河流域,水分是影响生态系统结构和功能的重要影响因子[1-2],也是影响植物生长发育的主要限制因素[3]。由于极端干旱区降水少,蒸发量大,河流补充的地下水成为植物生存与繁殖的主要水分来源[4-5]。地下水作为稳定的水源,能够综合反映水文过程引发的环境异质性[6],而水分和养分的稀缺和分布不均,使得植物对环境因子的变化更为敏感[3]。植物叶片和细根中的化学计量特征,是反映植物适应策略的重要指标[7],植物通过调整体内的元素含量及其计量比,优化对有限水分和养分的利用[8],以提高对极端干旱环境的适应性。因此,一方面,地下水可以直接影响植物的养分性状[9];另一方面,地下水可能通过与土壤因子的相互作用间接影响植物化学计量特征[3]。
碳、氮元素在植物生长、植物群落构建中起着至关重要的作用[10]。碳是植物体内干物质最主要的构成元素,是植物各种生理生化过程的能量来源[11]。氮是重要的营养和限制性元素[12-13],与植物养分吸收、固氮等生理过程密切相关[14-15],可能受到水分和土壤养分条件限制[16-17]。碳氮比是研究植物养分利用效率的重要指标,较高的碳氮比值表示较高的氮素利用效率[18],Rong等[19]的研究表明:具有较高碳氮比的植物采用低光合速率的防御性生活史策略,能使植物更好的适应极端环境。
不同功能群植物对土壤水分和养分需求不同[20],往往表现出不同的化学计量特征,并对环境变化的响应存在差异[21]。以往对极端干旱区的研究多集中在植物化学计量特征与土壤因子的关系上,研究表明草本植物为维持快速生长,相较于木本植物具有更高的叶片氮含量[22];土壤水分降低会限制木本氮的吸收和利用,导致叶片含氮量减少[23]。但目前对不同功能群植物化学计量特征对地下水梯度变化响应规律的研究仍较少,进一步了解不同功能群植物对地下水变化的养分反应对于预测全球气候变化背景下荒漠生态系统中的生物地球化学循环仍具有重要意义。
黑河流域是我国第二大干旱内陆河流域,其下游是个只有侧向流入而无侧向流出的半封闭盆地,下游干旱区的地下水主要受黑河干流河水调控[24-25]。黑河流域气候变化较小,水分来源单一,河流来水所导致的天然地下水梯度,使得黑河下游成为研究植物响应地下水位变化的理想区域。因此,本研究在黑河下游不同地下水位条件下,选择不同功能群植物为研究对象,通过对植物叶片和细根碳、氮含量及其化学计量特征的研究,试图解决以下两个科学问题:(1)在当前环境条件下,尤其是在极端干旱的荒漠地区,不同功能群植物碳氮化学计量及其比值有何特点? (2)地下水和土壤水盐等环境因子对不同功能群植物碳氮化学计量特征产生何种影响?本研究为深入认识和理解不同功能群植物生长对极端干旱环境的适应策略提供依据。
1. 研究区概况与研究方法
1.1 研究区概况
黑河是中国西北干旱区第二大内陆河。研究区位于黑河流域下游的内蒙古额济纳地区,地理位置40°50′ ~ 42°30′N、90°30′ ~ 101°20′E,该区属大陆性季风气候,年均气温为9.6 ℃,年平均降水量 < 35.2 mm,蒸散量为 2 300 ~ 3 700 mm。研究区植物种类贫乏,以耐干旱、耐盐碱的植物为主。
1.2 样地设置及样品处理
本研究在2019年7—8月植物生长季进行。根据与河道的距离,在黑河下游选择了22个采样点(图1)。为避免地形因素和人为干扰的影响,所有采样点都远离农田、牧场和灌溉渠道,且均位于坡度小于3°的平坦地面上。每个采样点内有一口井,地下水深度是使用Diver水位记录仪从 22 口井中测量的。同时,用全球定位系统记录采样点的经纬度。
在每个采样点区域内进行植物常见种样品采集,木本植物以胡杨(Populus euphratica)、多枝柽柳(Tamarix ramosissima)、黑果枸杞(Lycium ruthenicum)、沙拐枣(Calligonum sp.)、膜果麻黄(Ephedra przewalskii)、红砂(Reaumuria soongorica)、骆驼刺(Alhagi sparsifolia)、霸王(Zygophyllum xanthoxylon)等物种为主;草本植物以骆驼蓬(Peganum harmala)、苦豆子(Sophora alopecuroides)、胀果甘草(Glycyrrhiza inflata)、花花柴(Karelinia caspia)等物种为主(表1)。
表 1 采样点基本信息Table 1. Basic information of the sampling sites样点
Sample site地下水深度
Underground water depth/m木本植物 Woody plant 草本植物 Herb 优势种
Dominant species重要值
Importance value优势种
Dominant species重要值
Importance valueS1 1.46 多枝柽柳 Tamarix ramosissima 0.53 S2 1.51 胡杨 Populus euphratica 0.58 苦豆子 Sophora alopecuroides 0.37 S3 1.77 胡杨 Populus euphratica 0.63 苦豆子 Sophora alopecuroides 0.21 S4 1.78 胡杨 Populus euphratica 0.48 胀果甘草 Glycyrrhiza inflata 0.14 S5 1.96 多枝柽柳 Tamarix ramosissima 0.68 骆驼蓬 Peganum harmala 0.32 S6 2.00 黑果枸杞 Lycium ruthenicum 0.23 苦豆子 Sophora alopecuroides 0.49 S7 2.08 胡杨 Populus euphratica 0.48 芨芨草 Achnatherum splendens 0.42 S8 2.26 胡杨 Populus euphratica 0.54 苦豆子 Sophora alopecuroides 0.44 S9 2.30 多枝柽柳 Tamarix ramosissima 0.35 花花柴 Karelinia caspia 0.39 S10 2.49 白刺 Nitraria tangutorum 0.33 沙蒿 Artemisia desertorum 0.38 S11 2.56 多枝柽柳 Tamarix ramosissima 0.24 苦豆子 Sophora alopecuroides 0.70 S12 2.73 红砂 Reaumuria soongorica 0.80 沙蒿 Artemisia desertorum 0.10 S13 2.79 膜果麻黄 Ephedra przewalskii 0.43 驼蹄瓣 Zygophyllum fabago 0.14 S14 2.85 骆驼刺 Alhagi sparsifolia 0.70 花花柴 Karelinia caspia 0.38 S15 2.89 红砂 Reaumuria soongorica 0.37 花花柴 Karelinia caspia 0.54 S16 3.00 多枝柽柳 Tamarix ramosissima 0.83 骆驼蓬 Peganum harmala 0.26 S17 3.15 膜果麻黄 Ephedra przewalskii 0.85 S18 3.30 红砂 Reaumuria soongorica 0.71 骆驼蓬 Peganum harmala 0.12 S19 3.31 膜果麻黄 Ephedra przewalskii 0.47 S20 3.44 膜果麻黄 Ephedra przewalskii 0.54 S21 3.55 膜果麻黄 Ephedra przewalskii 0.85 S22 3.66 膜果麻黄 Ephedra przewalskii 0.66 叶片和细根样品均取自相同植株。对于植物叶片采集,从每个物种的至少5个植株中收集20片以上在向阳面完全展开的成熟叶片。所有叶片在60 ℃下烘干至恒质量。木本植物细根采集首先去除植物基茎附近的土壤,然后收集附着在主根上的细根样品(直径 < 2 mm)。草本植物通过挖取整株植物,获得整个根系的方法收集细根样品[26]。细根样品送到当地实验室用蒸馏水清洗并烘干。使用球磨仪(BM 500 Ball Mill,Anton Paar)将所有样品研磨成细粉。植物叶片与细根的全碳含量用重铬酸钾外加热法测定,全氮使用凯氏定氮酸消化法(Hanon K1100 凯氏定氮仪,中国)测定。
1.3 土壤因子测定
土壤样品取自0 ~ 20 cm、20 ~ 40 cm、40 ~ 60 cm、60 ~ 100 cm 4个土层。在实验室中将土壤样品去除根系和杂物后混合并过2 mm网筛,对其土壤理化性质(土壤全碳含量、全氮含量、全磷含量、土壤pH 和土壤电导率)进行测定。土壤含水量在105 ℃烘箱干燥48 h后通过质量分析测定。
1.4 数据分析
计算不同功能群碳氮含量平均值,并利用R语言中t检验进行组间差异显著性分析。利用stat程序包对影响因子进行一元线性回归分析;以 AIC进行前向选择,筛选具有最小 AIC 值的多元回归模型;剔除膨胀因子(VIF)大于10的解释变量[27]。最后利用方差分解法来进一步分析地下水、土壤因子对植物碳氮化学计量特征的相对作用。
2. 结果与分析
2.1 不同功能群植物碳氮化学计量特征
本研究中,叶片氮元素含量平均值为16.30 mg/g,细根氮元素含量平均值为11.81 mg/g;叶片碳元素含量平均值为408.54 mg/g,细根碳元素含量平均值为500.34 mg/g;叶片和细根的碳氮比分别为30.74、49.49。对于不同功能群,草本植物叶片氮含量显著高于木本植物,分别为18.66和15.06 mg/g,木本植物和草本植物之间具有显著差异(P < 0.05);草本植物叶片碳含量略高于木本植物,分别为429.05和396.80 mg/g,木本植物和草本植物之间没有显著差异(P > 0.05);木本植物细根氮含量、碳含量和碳氮比分别为12.61 mg/g、514.52 mg/g和45.35,其中氮含量和碳氮比与草本植物相比具有显著差异(P < 0.05)(表2)。
2.2 不同功能群植物碳氮化学计量特征与环境因子的关系
研究结果显示木本植物叶片氮含量与地下水深度成显著负相关,叶片碳氮比、细根氮含量、细根碳含量与地下水深度成显著正相关,叶片碳含量与地下水位的变化不相关(图2)。草本植物叶片和细根的碳氮化学计量特征与地下水不相关(图3)。
木本植物叶片氮含量、叶片碳氮比、细根碳含量、细根氮含量与土壤含水量显著相关;叶片和细根氮含量与土壤氮含量显著相关;叶片和细根碳氮比与土壤电导率和土壤pH显著相关。草本植物叶片氮含量、细根氮含量、叶片碳氮比、细根碳氮比均与土壤pH显著相关,叶片碳含量与土壤0 ~ 20 cm含水量显著相关,细根的碳、氮含量与土壤水分含量高低不相关(表3)。
表 2 不同功能群植物的叶片和细根养分组成Table 2. Nutrient composition of leaves and fine roots of different functional groups of plants指标 Index 总体 Total 木本植物 Woody plant 草本植物 Herb 叶片氮含量 Leaf N concentration/(mg·g−1) 16.30 ± 0.59 15.06 ± 0.75b 18.66 ± 1.02a 叶片碳含量 Leaf C concentration/(mg·g−1) 408.54 ± 10.89 396.80 ± 13.63a 429.05 ± 17.41a 叶片碳氮比 Leaf C∶N 30.74 ± 1.44 31.69 ± 1.83a 29.30 ± 2.54a 细根氮含量 Fine root N concentration/(mg·g−1) 11.81 ± 0.44 12.61 ± 0.47a 10.42 ± 1.03b 细根碳含量 Fine root C concentration/(mg·g−1) 500.34 ± 15.10 514.52 ± 18.92a 484.33 ± 26.14a 细根碳氮比 Fine root C∶N 49.49 ± 2.69 45.35 ± 3.09b 54.27 ± 5.14a 注:同行不同字母表示差异显著(P < 0.05)。 Note: different letters in the same line indicate significant difference (P < 0.05). 表 3 土壤因子对不同功能群植物化学计量的影响Table 3. Effects of soil factors on plant stoichiometry of different functional groups分类
Classification指标
Index电导率
Electrical conductivity土壤pH
Soil pH0 ~ 20 cm
含水量
0−20 cm
water content20 ~ 40 cm
含水量
20−40 cm
water content40 ~ 60 cm
含水量
40−60 cm
water content60 ~ 100 cm
含水量
60−100 cm
water content土壤总碳
Soil total carbon土壤全N
Soil total nitrogen土壤全P
Soil total phosphorus木本植物
Woody plant叶片氮含量
Leaf N concentration−0.10 0.14 0.50** 0.48** 0.37** 0.39** 0.27* 0.21** 0.13 叶片碳含量
Leaf C concentration0.03 0.04 −0.01 −0.05 −0.04 −0.24* −0.03 0.20 0.11 叶片碳氮比
Leaf C∶N0.30* −0.17 −0.28* −0.28* −0.25* −0.35** −0.15 −0.01 0.04 细根氮含量
Fine root N concentration0.25 −0.32 −0.41** −0.37** −0.34** −0.39** −0.37** −0.21** 0.19 细根碳含量
Fine root C concentration−0.07 −0.06 −0.34** −0.43** −0.45** −0.49** −0.27* −0.17 0.17 细根碳氮比
Fine root C∶N−0.27* 0.27* 0.21 0.11 0.09 0.03 0.18 0.11 −0.05 草本植物
Herb叶片氮含量
Leaf N concentration0.44* −0.40* −0.24 −0.30 −0.07 −0.18 −0.05 0.36 0.14 叶片碳含量
Leaf C concentration−0.17 0.26 0.46* 0.13 0.24 0.32 0.23 0.01 −0.16 叶片碳氮比
Leaf C∶N−0.38* 0.44* 0.32 0.18 0.04 0.20 0.02 −0.31 −0.26 细根氮含量
Fine root N concentration0.42* −0.45* −0.29 −0.25 −0.20 −0.29 −0.21 0.07 0.58 细根碳含量
Fine root C concentration−0.16 0.25 0.14 0.11 0.04 0.13 0.15 0.13 0.09 细根碳氮比
Fine root C∶N−0.38* 0.48** 0.21 −0.01 0.00 0.13 0.12 0.02 −0.10 注:* 表示相关性显著(P < 0.05);**表示相关性极显著(P < 0.01).Notes: * indicates significant correlation at P < 0.05 level; ** indicates extremely significant correlation at P < 0.01 level. 2.3 环境因子对不同功能群植物碳氮化学计量特征的作用
将10个环境因子分为地下水和土壤因子,土壤因子包括电导率、pH值、土壤含水量(0 ~ 20 cm、20 ~ 40 cm、40 ~ 60 cm、60 ~ 100 cm)、土壤全碳、全氮、全磷含量。对环境因子进行前向选择和AIC筛选。对于木本植物,地下水和土壤含水量为叶片和细根碳氮化学计量特征的显著影响因子(图4)。对于草本植物,土壤电导率为叶片氮含量的显著影响因子,土壤0 ~ 20 cm含水量为叶片碳含量的显著影响因子,土壤pH值为叶片碳氮比、细根氮含量和细根碳氮比的显著影响因子。
![]() 图 4 环境因子对木本植物叶片和细根的碳、氮化学计量特征的解释GW.地下水;SM1.土壤0 ~ 20 cm含水量;SM2.土壤20 ~ 40 cm含水量;SM4.土壤60 ~ 100 cm含水量;SEC.土壤电导率;STN.土壤全氮含量;NE.未解释率。NL.叶片氮含量;CL.叶片碳含量;CNL.叶片碳氮比;NR.细根氮含量;CR.细根碳含量;CNR.细根碳氮比。下同。GW, underground water; SM1, 0−20 cm soil water content; SM2, 20−40 cm soil water content; SM4, 60−100 cm soil water content; SEC, soil electrical conductivity; STN, soil total nitrogen content; NE, no-explanation rate. NL, leaf N concentration; CL, leaf C concentration; CNL, C∶N of leaf; NR, fine root N concentration; CR, fine root C concentration; CNR, C∶N of fine root. The same below.Figure 4. Explanation of environmental factors on the carbon and nitrogen stoichiometric characteristics of leaves and fine roots of woody plants
图 4 环境因子对木本植物叶片和细根的碳、氮化学计量特征的解释GW.地下水;SM1.土壤0 ~ 20 cm含水量;SM2.土壤20 ~ 40 cm含水量;SM4.土壤60 ~ 100 cm含水量;SEC.土壤电导率;STN.土壤全氮含量;NE.未解释率。NL.叶片氮含量;CL.叶片碳含量;CNL.叶片碳氮比;NR.细根氮含量;CR.细根碳含量;CNR.细根碳氮比。下同。GW, underground water; SM1, 0−20 cm soil water content; SM2, 20−40 cm soil water content; SM4, 60−100 cm soil water content; SEC, soil electrical conductivity; STN, soil total nitrogen content; NE, no-explanation rate. NL, leaf N concentration; CL, leaf C concentration; CNL, C∶N of leaf; NR, fine root N concentration; CR, fine root C concentration; CNR, C∶N of fine root. The same below.Figure 4. Explanation of environmental factors on the carbon and nitrogen stoichiometric characteristics of leaves and fine roots of woody plants采用方差分解的方法得到不同环境因子对木本植物和草本植物的单因子解释率。结果表明:对于木本植物解释率最高的为叶片氮含量,为74.8%;解释率最低为叶片碳氮比,为53%(图4)。对于草本植物,模型整体解释率显著低于木本植物(图5)。
3. 讨 论
3.1 植物碳、氮含量及其计量比特征
碳元素是结构性物质[28],氮元素作为生态系统的营养元素及限制性元素,是植物蛋白质与遗传物质的重要组成部分[29-30],碳氮元素对植物的生长发育起着至关重要的作用。本实验中细根碳含量高于全球尺度的细根平均碳含量,也高于中国陆地生态系统细根平均碳含量[31],前人研究表明较高的碳含量有助于植物提高自身的抵御能力,因此极端干旱区植物倾向于提高碳含量来抵抗干旱[22]。叶片氮含量和细根氮含量相较于Han等[13]、李玉霖等[32]、宁志英等[33]在全国尺度、北方典型荒漠、科尔沁沙地主要植物的研究结果较低。植物碳氮比代表植物吸收营养元素时同化碳的能力,可反映植物营养元素的利用效率和固碳能力[34]。本研究中叶片碳氮比高于Zhang 等[35]研究的2139种森林植物的碳氮比,也高于Zhang等[36]在河西走廊荒漠植物叶片碳氮比,根系碳氮比含量高于何茂松等[37]研究的新疆45种荒漠植物根系碳含量。在额济纳地区局部尺度上,植物碳氮化学计量特征是较低的氮含量,较高的细根碳含量以及较高的碳氮比,表明在生长季额济纳地区植物具有较高的元素利用效率,较高的碳氮比比可能归因于它们对贫瘠营养环境的适应性[38-39]。
不同功能群植物碳、氮化学计量特征存在差异,往往被认为是防御和适应策略差异的体现[40]。本研究中草本植物叶片氮含量显著高于木本植物,与Wright等[22]、Gusewell等[41]研究发现的草本植物叶氮元素含量较高于灌木植物相一致,表明生长周期短、生长快速的物种需要更多的氮[42-43]。这强调了不同功能群植物在极端干旱环境下养分利用对策的差异。木本植物细根的氮含量高于草本植物,这是因为木本植物比草本植物具有更多的枝叶,具有蒸发量大,蒸腾拉力更强的特点,所消耗的物质能量更多,为运输营养物质,会促使木本植物根合成更多含氮高的转运蛋白[21]。木本植物叶片碳氮比高于草本植物,这是因为木本植物多为深根性植物,通过增加叶片中碳的分配,降低植物光合速率,从而减缓生长速度的方式,提高对高温和极端干旱环境的抵御能力,因此导致叶片碳氮比较高。这一研究结果进一步说明了不同功能群植物对养分的利用和及对不利环境条件的适应策略存在差异。此外,叶片相比细根较高的氮含量这一结果与Zhang等[44]的研究结果相一致,因为氮在光合作用和呼吸中具有重要作用,植物将更多的氮分配给更多的活跃器官。
3.2 不同功能群植物沿地下水位梯度碳氮化学计量变化特征
植物生长发育与所处生境密切相关,木本和草本植物元素含量及其计量比的差异反映了不同功能群植物对环境条件变化的响应[45]。Li等[46]的研究表明,极端干旱区河流水补给的地下水是植物和土壤的主要水分来源。本研究发现木本植物叶片氮含量、叶片碳氮比、根系碳氮含量及比值与地下水深度显著相关,且优势植物种内碳氮元素及其比值的变化与功能群整体变化趋势相一致。具体表现为,随着地下水埋深增加,叶片碳含量与地下水位的变化不相关,说明相比于氮含量,参与光合作用的叶片碳含量更加稳定[47]。木本植物细根碳含量显著上升,这一结果与安申群等[48]对塔里木典型荒漠植物根系碳含量不随水分条件变化产生大的变异的研究结果不同,这说明在区域尺度上,环境因子对植物的影响存在差异。这一结果可能是因为木本植物为了吸收更多的土壤水分,促进根系向土壤深层生长,会在根部积累更多碳[49-50]。随着地下水深度的增加,细根氮含量与地下水深度呈显著正相关,这一结果与前人的研究相一致[51],表明植物倾向于增加氮浓度以提高水分利用效率[52]。地下水位降低引起叶片氮含量降低,根系氮含量升高,木本植物的叶片和细根的氮含量表现出不同的变化趋势。这可能是木本植物的地上部分和地下部分存在权衡关系,在水分条件变差时,更倾向于提高根系氮含量以促进对水的吸收利用,适应干旱胁迫[43]。草本植物的研究结果与木本植物不同,这种差异可能是不同功能群植物采取不同适应机制的体现。草本植物碳氮化学计量特征与地下水深度并不相关,而是与土壤电导率和土壤pH值显著相关。草本植物为应对盐碱胁迫,其自身代谢成本增加,光合速率受到抑制,生产力下降,从而使得草本植物叶片的固碳能力降低[53-54]。这与草本植物叶片碳含量与土壤表层含水量成显著正相关的研究结果相符。草本植物根系较浅,生长周期较短,为适应干旱盐碱环境,在生长季生长过程中,充分利用有限水分资源,保持体内较高氮含量,快速生长,提高自身对极端多变环境的适应能力[55]。
3.3 不同功能群植物碳氮化学计量特征的影响因素
本文研究发现,木本植物的碳氮元素含量及碳氮比与地下水深度显著相关,与土壤含水量显著相关,表明在额济纳地区木本植物的碳氮化学计量特征主要受水分影响。这是因为在极端干旱的额济纳地区,蒸发量大,降水量少,由黑河来水等水文活动所形成的地下水梯度,导致生境在水资源可利用性表现出明显的空间异质性,木本植物碳氮化学计量特征更易受到水分条件引起的干旱胁迫的约束[52]。草本植物的碳氮化学计量特征与土壤电导率和土壤pH值显著相关,与地下水不相关,这表明土壤盐碱度主要限制草本植物生长[56]。土壤中的可溶性盐能够限制植物根部吸收土壤水分和养分离子[57],而相对草本植物,木本植物的根系分布更深,结构更复杂,可以吸收和利用深层土壤的水分和养分,不易受土壤高盐碱性的强烈影响[58]。草本植物根系分布较浅,一般生长在地下水较浅的地方,因此不易受地下水的显著影响。
本研究对环境因子进行前向选择和AIC筛选后进行方差分解,可以看出地下水和土壤含水量可以解释木本植物碳氮化学计量特征的48%以上,这进一步说明水分条件是额济纳地区木本植物碳氮化学计量特征的主要影响因素。对于草本植物,环境因子可以解释草本植物碳氮化学计量特征的20%左右,此外还存在80%的未解释变异,这说明还存在其他因素对草本植物碳氮化学计量特征的影响,如突发降水[59-60]、植物间的相互作用[56]等。因此,在今后的研究中,应该在本研究基础上综合考虑多种因素的影响,进行多尺度长期调查,以便更准确地对黑河下游地区植物化学计量特征进行研究。
4. 结 论
本研究对黑河下游额济纳地区植物碳氮化学计量特征进行调查,结果表明:该地区植物具有细根碳含量高、氮含量低、碳氮比高的特征,草本植物叶片氮含量和碳含量高于木本植物,木本植物细根氮含量和碳含量高于草本植物。水分条件是该地区木本植物碳氮化学计量特征变化的主要驱动因子,草本植物主要受土壤盐分的制约。本研究丰富了局域尺度上植物叶片和细根碳氮化学计量学特征及其驱动因素的研究,有助于进一步了解生态系统养分循环和预测荒漠生态系统对环境变化的响应。
-
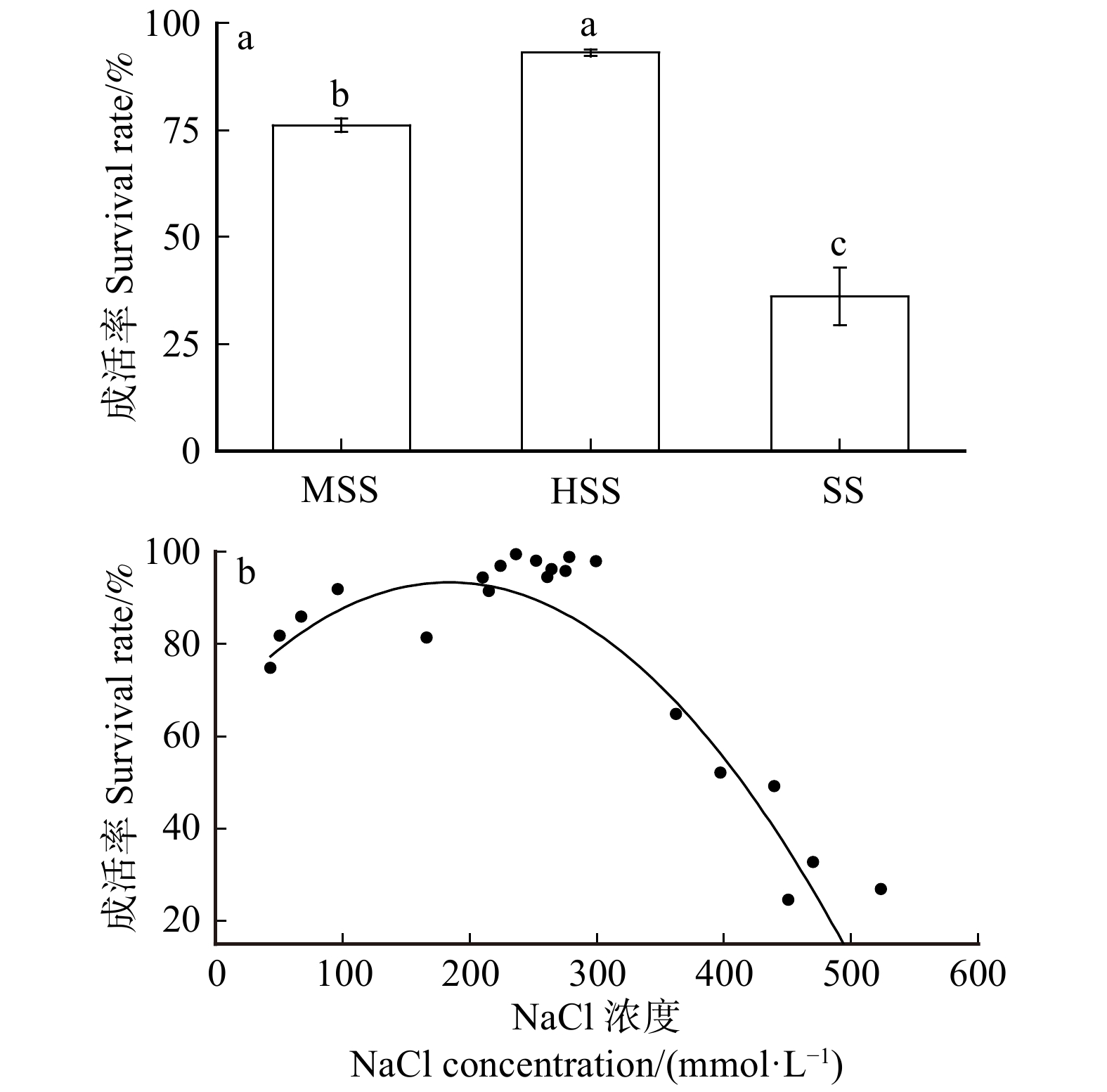
图 1 不同盐渍化土壤黑果枸杞植株成活率及模型
a. 不同盐渍化土壤黑果枸杞植株成活率,不同小写字母表示各处理植株成活率差异显著(P < 0.05);b. 植株成活率与土壤NaCl浓度二次函数模型。a, plant survival rates of L. ruthenicum in different salinized soil,different lowercase letters mean significant differences in plant survival rate among treatments (P < 0.05); b, quadratic model equation between plant survival rate and NaCl concentration of soil.
Figure 1. Survival rate and model of L. ruthenicum with different salinized soil
图 2 花期至初果期和初果期至果实完全成熟期果实相对生长速率对土壤盐胁迫的响应
不同小写字母表示不同盐渍化程度相同时期差异显著,不同大写字母表示不同时期相同盐胁迫果实相对生长速率差异显著(P < 0.05)。Different lowercase letters represent significant differences in varied salinized degree at the same period; different capital letters represent significant differences in the relative growth rate of fruit in different periods under same salt stress degree (P < 0.05).
Figure 2. Relative growth rates of fruit response to soil salinized stress during the two periods, respectively from flowering to early fruiting stage and from early fruiting to fructescence-later stage
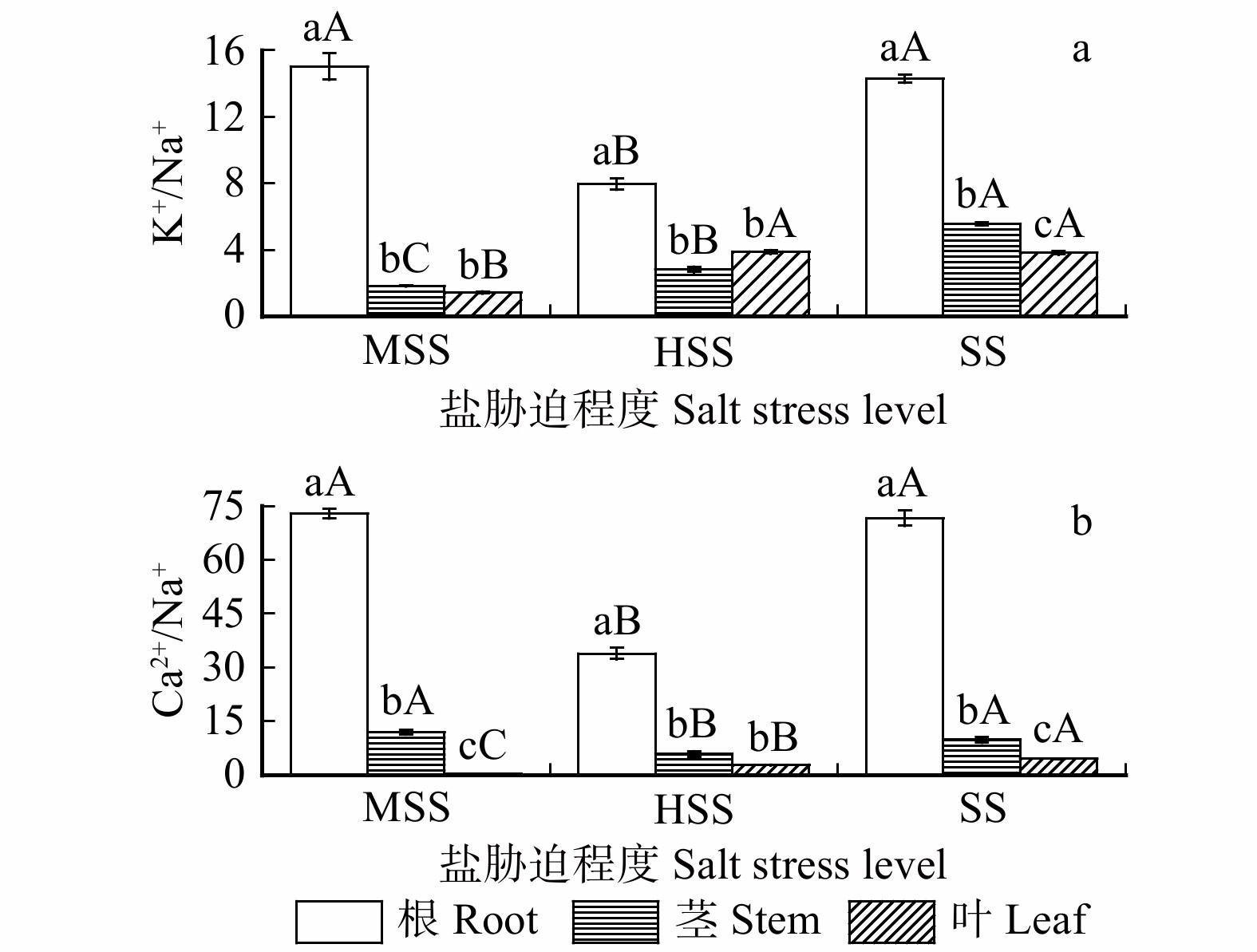
图 3 不同盐渍化土壤各器官K+/Na+和Ca2+ / Na+变化规律
不同大写字母表示不同盐渍化土壤相同器官差异显著,不同小写字母表示同一盐渍化土壤不同器官差异显著(P < 0.05)。Different capital letters indicate significant differences among varied organs under different salinized soils. Different lowercase letters indicate significant differences among varied organs under same salinized soil (P < 0.05).
Figure 3. Variations in K+/Na+ and Ca2+/Na+ of varied organsunder different salt stress levels
表 1 土壤溶液平均NaCl浓度和pH值
Table 1 Average NaCl concentration and pH value of soil solution
土层深度
Soil depth/cm高盐胁迫
High salt
stress (SS)中盐胁迫
Middle salt
stress (HSS)低盐胁迫
Low salt
stress (MSS)pH NaCl/
(mmol·L−1)pH NaCl/
(mmol·L−1)pH NaCl/
(mmol·L−1)0 ~ 20 8.84 690 8.57 382 8.32 180 0 ~ 40 8.95 475 8.79 305 8.44 150 40 ~ 60 9.06 386 8.49 217 8.16 102 表 2 3种盐渍化土壤黑果枸杞根、茎、叶中Na+、K+和Ca2+含量
Table 2 Contents of Na+, K+ and Ca2+of root, stem, leaf of L. ruthenicum in three kinds of salinized soil
g/kg 指标
IndexMSS HSS SS 根 Root 茎 Stem 叶 Leaf 根 Root 茎 Stem 叶 Leaf 根 Root 茎 Stem 叶 Leaf Na+ 0.63cB 2.22bB 23.31aA 1.11cA 3.12bA 9.51aB 0.70cB 3.00bAB 10.00aB K+ 6.04cB 13.34bA 33.83aC 7.84bA 8.84bB 36.93aB 5.80cB 12.41aB 38.28aA Ca2+ 53.24aA 26.88bA 9.12cC 28.63aC 18.57bC 27.62aB 42.38aB 23.29bB 45.90aA 注:不同小写字母表示相同盐渍化水平不同器官Na+、K+和Ca2+含量差异显著,不同大写字母不同盐渍化水平相同器官Na+、K+和Ca2+含量差异显著(P < 0.05)。Notes: different lowercase letters represent significant differences in Na+, K+ and Ca2+ contents of different organs under the same salinization level. Different capital letters represent significant differences in Na+, K+ and Ca2+ contents of same organs under varied salinization levels (P < 0.05). 表 3 不同器官及根际土壤K+/Na+、Na+和Ca2+ Pearson相关性分析
Table 3 Pearson correlation analysis on K+/Na+, Na+ and Ca2+ of different organs and rhizosphere soil
项目
Item根K+/Na+
Root K+/Na+植株K+/Na+
Whole plant K+/Na+根际土壤K+/Na+
Rhizosphere soil K+/Na+茎Na+
Shoot Na+根Na+
Root Na+植株Ca2+
Whole plant Ca2+根 K+/Na+ Root K+/Na+ 1 0.988** 0.784** −0.296 −0.657** 0.397 植株 K+/Na+ Whole plant K+/Na+ 1 0.702** −0.286 −0.652** 0.496* 根际土壤K+/Na+ Rhizosphere soil K+/Na+ 1 −0.218 −0.598* 0.107 茎 Na+ Stem Na+ 1 0.629** −0.418 根 Na+ Root Na+ 1 −0.488* 植株 Ca2+ Whole plant Ca2+ 1 注:*和**分别代表P < 0.05, P < 0.01相关性显著。下同。Notes: * and ** represent significant correlations at P < 0.05 and P < 0.01, respectively. The same below. 表 4 不同器官干质量、K+/Na+、Na+和Ca2+相关性分析
Table 4 Correlation analysis on K+/Na+, Na+ and Ca2+of different organs or organ dry mass
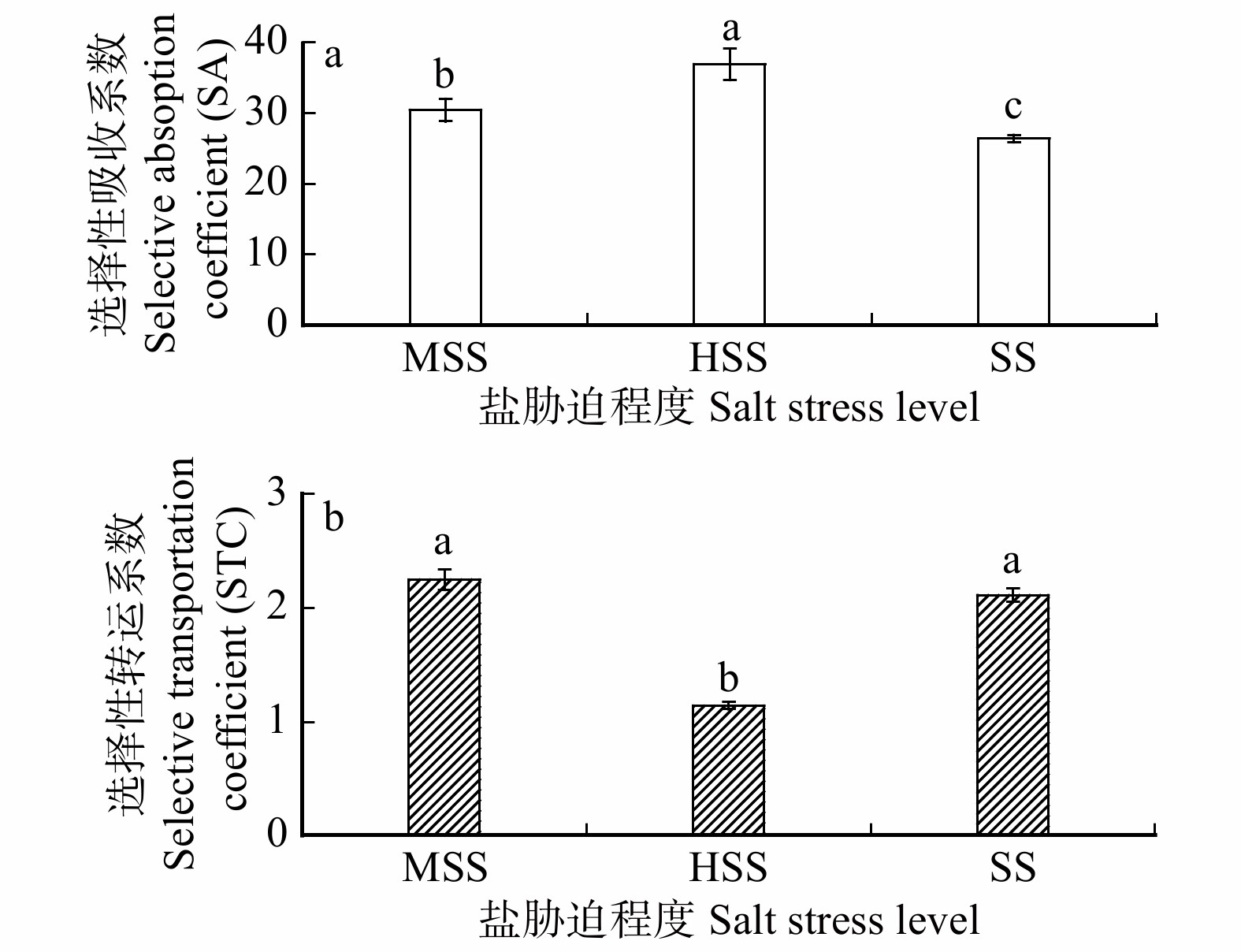
项目
Item选择吸
收系数
SA选择性转
运系数
STC主根平
均直径
Main root
diameter (MRD)侧根平
均直径
Lateral root
diameter (LRD)根干
质量
Root dry
mass (DW)叶干
质量
Leaf DW茎干
质量
Stem DW地上器官
干质量
Aboveground
organ DW根K+/Na+ Root K+/Na+ 0.931** −0.722** −0.127 −0.184 −0.379 −0.444 −0.532* −0.521* 植株K+/Na+ Whole plant K+/Na+ 0.975** −0.647** −0.059 −0.174 −0.385 −0.451 −0.508* −0.512* 根际土壤 K+/Na+
Rhizosphere soil K+/Na+0.537* −0.983** −0.408 −0.081 −0.197 −0.478 −0.586* −0.569* 茎Na+ Stem Na+ −0.284 0.132 −0.116 −0.268 0.08 0.259 0.298 0.297 根Na+ Root Na+ −0.618** 0.568* 0.139 0.048 0.505* 0.703** 0.752** 0.775** 植株Ca2+ Whole plant Ca2+ 0.509* −0.073 −0.033 0.084 −0.462 −0.155 −0.334 −0.264 表 5 植株选择性吸收盐离子能力,耐盐性与植株根系形态及不同器官干质量相关性分析
Table 5 Correlation analysis on selective absorption of salt properties, salt toleranceand plant root morphology and dry mass of different organs
项目
Item选择吸
收系数
SA选择性转
运系数
STC主根平
均直径
MRD侧根平
均直径
LRD根干
质量
Root DW叶干
质量
Leaf DW茎干
质量
Stem DW地上器官干质量
Aboveground
organ DW选择吸收系数 SA 1 −0.485* 0.053 −0.159 −0.39 −0.431 −0.444 −0.466 选择性转运系数 STC 1 0.433 0.064 0.167 0.495* 0.582* 0.575* 主根平均直径 MRD 1 0.378 0.462 0.467 0.503* 0.517* 侧根平均直径 LRD 1 0.494* 0.231 0.153 0.203 根干质量 Root DW 1 0.600* 0.722** 0.706** 叶干质量 Leaf DW 1 0.767** 0.934** 茎干质量 Stem DW 1 0.945** 地上器官干质量 Aboveground organ DW 1 -
[1] Qadir M, Nangia V, Murtaza G, et al. Economics of salt‐induced land degradation and restoration[J]. Natural Resources Forum, 2014, 38: 282−295. doi: 10.1111/1477-8947.12054.
[2] Litalien A, Zeeb B. Curing the earth: A review of anthropogenic soil salinization and plant-based strategies for sustainable mitigation[J/OL]. The Science of the Total Environment, 2020, 698: 134235 (2020−01−01) [2020−02−06]. https://doi.org/j.scitotenv.2019.134235.
[3] 冯雷, 李雪, 徐万里, 等. 不同盐渍化土壤栽培的黑果枸杞品质评价[J]. 中国农业科技导报, 2020, 22(10):167−174. Feng L, Li X, Xu W L, et al. Evaluation of nutritional components of Lycium ruthenicum Murr. in salinized gradient soils[J]. Journal of Agricultural Science and Technology, 2020, 22(10): 167−174.
[4] Feng L, Xu W L, Sun N C, et al. Efficient improvement of soil salinization through phytoremediation induced by chemical remediation in extreme arid land northwest China[J]. International Journal of Phytoremediation, 2019, 22(14): 1−8.
[5] 中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1999. Editorial Board of Chinese Flora. Flora of China[M]. Beijing: Science Press, 1999.
[6] 王桔红, 陈文. 黑果枸杞种子萌发及幼苗生长对盐胁迫的响应[J]. 生态学杂志, 2012, 31(4):804−810. Wang J H, Chen W. Responses of seed germination and seedling growth of Lycium ruthenicum to salt stress[J]. Chinese Journal of Ecology, 2012, 31(4): 804−810.
[7] 杨永义, 倪强, 马瑞, 等. 混合盐(NaCl + NaHCO3)和NaCl对黑果枸杞种子萌发和幼苗生长的影响[J]. 干旱区资源与环境, 2019, 33(7):168−173. Yang Y Y, Ni Q, Ma R, et al. Effects of mixed salt (NaCl + NaHCO3) and NaCl on seed germination and seedling growth of Lycium ruthenium Murr[J]. Journal of Arid Land Resources and Environment, 2019, 33(7): 168−173.
[8] 毛金枫, 聂江力, 吴姿锐, 等. 不同土壤环境下黑果枸杞茎、叶形态结构比较[J]. 植物研究, 2017, 37(4):529−534. doi: 10.7525/j.issn.1673-5102.2017.04.007. Mao J F, Nie J L, Wu Z R, et al. Comparison of morphology and structure of stem and leaf of Lycium ruthenicum Murr. under different soil conditions[J]. Bulletin of Botanical Research, 2017, 37(4): 529−534. doi: 10.7525/j.issn.1673-5102.2017.04.007.
[9] 王静, 马腾斋, 邱佳俊, 等. NaCl胁迫对黑果枸杞幼苗生理及生化指标的影响[J]. 北方园艺, 2019, 429(6):65−70. Wang J, Ma T Z, Qiu J J, et al. Effects of NaCl stress on physiological and biochemical characteristics of Lycium ruthecium Murr. seedling[J]. Northern Horticulture, 2019, 429(6): 65−70.
[10] Dai F B, Li A J, Rao S P, et al. Potassium transporter LrKUP8 is essential for K+ preservation in Lycium ruthenicum, a salt-resistant desert shrub[J]. Genes, 2019, 10(8): 600−613. doi: 10.3390/genes10080600.
[11] Jose A M, Maria O, Agustina B V, et al. Plant responses to salt stress: adaptive mechanisms[J]. Agronomy, 2017, 7(1): 18−55. doi: 10.3390/agronomy7010018.
[12] 杨万鹏, 马瑞, 杨永义, 等. NaCl处理对黑果枸杞生长、生理指标的影响[J]. 分子植物育种, 2019, 17(13):4437−4447. Yang W P, Ma R, Yang Y Y, et al. Effects of NaCl treatment on the growth and physiological indexes of Lycium ruthenicum[J]. Molecular Plant Breeding, 2019, 17(13): 4437−4447.
[13] Flowers T J, Colmer T D. Salinity tolerance in halophytes[J]. New Phytologist, 2010, 179(4): 945−963.
[14] Zhang L, Tian L H, Zhao J F, et al. Identification of an apoplastic protein involved in the initial phase of salt stress response in rice root by two-dimensional electrophoresis[J]. Plant Physiology, 2009, 149(2): 916−28. doi: 10.1104/pp.108.131144.
[15] Wang X Q, Liu Z, He Y. Responses and tolerance to salt stress in bryophytes[J]. Plant Signaling & Behavior, 2008, 3(8): 516−518.
[16] 许兴, 郑国琦, 周涛, 等. 宁夏枸杞耐盐性与生理生化特征研究[J]. 中国生态农业学报, 2002, 10(3):70−73. Xu X, Zheng G Q, Zhou T, et al. Research on character of physiology and biochem istry and salt-tolerance of wolfberry in Ochr-Sierozems soil of Ningxia[J]. Chinese Journal of Eco-agriculture, 2002, 10(3): 70−73.
[17] Zeng L H, Shannon M C. Salinity effects on seedling growth and yield components of rice[J]. Crop Science, 2000, 40(4): 996−1003. doi: 10.2135/cropsci2000.404996x.
[18] Shabala S. Signaling by potassium: another second messenger to add to the list?[J]. Journal of Experimental Botany, 2017, 68(15): 4003−4007. doi: 10.1093/jxb/erx238.
[19] Katschnig D, Broekman R, Rozema J. Salt tolerance in the halophyte Salicornia dolichostachya Moss: growth, morphology and physiology[J]. Environmental & Experimental Botany, 2013, 92(3): 32−42.
[20] Abideen Z, Koyro H W, Huchzermeyer B, et al. Moderate salinity stimulates growth and photosynthesis of Phragmites karka by water relations and tissue specific ion regulation[J]. Environmental & Experimental Botany, 2014, 105: 70−76.
[21] Seifikalhor M, Aliniaeifard S, Shomali A, et al. Calcium signaling and salt tolerance are diversely entwined in plants[J/OL]. Plant Signaling & Behavior, 2019, 14(11): 1665455 (2019−09−28) [2020−01−12]. https://doi.org/10.1080/15592324.2019.1665455.
[22] Sabir J S M, Omri A E, Banaganapalli B, et al. Unraveling the role of salt-sensitivity genes in obesity with integrated network biology and co-expression analysis[J/OL]. PLoS One, 2020, 15(2): e0228400 (2020−02−06) [2020−03−05]. https://doi.org/10.1371/journal.pone.0228400.
[23] Naidoo G, Kift J. Responses of the saltmarsh rush Juncus kraussii to salinity and waterlogging[J]. Aquatic Botany, 2006, 84(3): 217−225. doi: 10.1016/j.aquabot.2005.10.002.
[24] Liang Y, Chen Q, Liu Q, et al. Exogenous silicon (Si) increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (Hordeum vulgare L.)[J]. Journal of Plant Physiology, 2003, 160(10): 1157−1164. doi: 10.1078/0176-1617-01065.
[25] Fall F, Diouf D, Fall D, et al. Growth and physiological responses of Sporobolus robustus Kunth seedlings to salt stress[J]. Arid Soil Research & Rehabilitation, 2016, 31(1): 46−56.
[26] Khan M H, Panda S K. Alterations in root lipid peroxidation and antioxidative responses in two rice cultivars under NaCl-salinity stress[J]. Acta Physiologiae Plantarum, 2008, 30(1): 81−89.
[27] Kaya C, Aydemir S, Sonmez O, et al. Regulation of growth and some key physiological processes in salt-stressed maize (Zea mays L.) plants by exogenous application of asparagine and glycerol[J]. Acta Botanica Croatica, 2013, 72(1): 157−168. doi: 10.2478/v10184-012-0012-x.
[28] Li W, Zhou M, Zheng Y, et al. Characterization of CbCAX51, a cold responsive Ca2+/H+ exchanger from Capsella bursa-pastoris modulating cold tolerance in plants[J]. International Journal of Agriculture & Biology, 2017, 19(4): 817−824.
[29] Negrão S, Schmöckel S M, Tester M. Evaluating physiological responses of plants to salinity stress[J]. Annals of Botany, 2017, 119(1): 1−11. doi: 10.1093/aob/mcw191.
-
期刊类型引用(6)
1. 崔恒久,曾教科,李雯,黄海杰,彭世清,郭冬,蒲金基,周永凯,李辉亮. 腰果CBF基因家族的鉴定及响应冷胁迫的表达模式. 热带作物学报. 2024(03): 473-480 .  百度学术
百度学术
2. 韩立群,张捷,赵钰,梅闯,马凯. 新疆野生核桃JfDREB1A基因的克隆与原核表达分析. 西北农业学报. 2023(07): 1050-1057 .  百度学术
百度学术
3. 赵淑玲,王永斌,蹇小勇,郭兴贵,朱福民,杨静静,霍发喜. 平欧杂交榛研究进展. 现代化农业. 2023(09): 46-49 .  百度学术
百度学术
4. 夏蕴,巢建国,谷巍,盛业龙,王玉卓,惠西珂,王凯,王圆圆. 倒春寒胁迫与恢复对茅苍术生长、生理及关键酶基因的影响. 中成药. 2020(08): 2187-2191 .  百度学术
百度学术
5. 宋静武,彭磊. 核桃CBF基因在低温胁迫中表达. 湖北林业科技. 2019(02): 7-13 .  百度学术
百度学术
6. 刘晓丹,王霞,杨祥波. 非生物胁迫下山腊梅CpCBF基因的表达模式分析. 黑龙江农业科学. 2017(12): 18-21 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: