Bioinformatics and stress response expression analysis of poplar HSF family genes
-
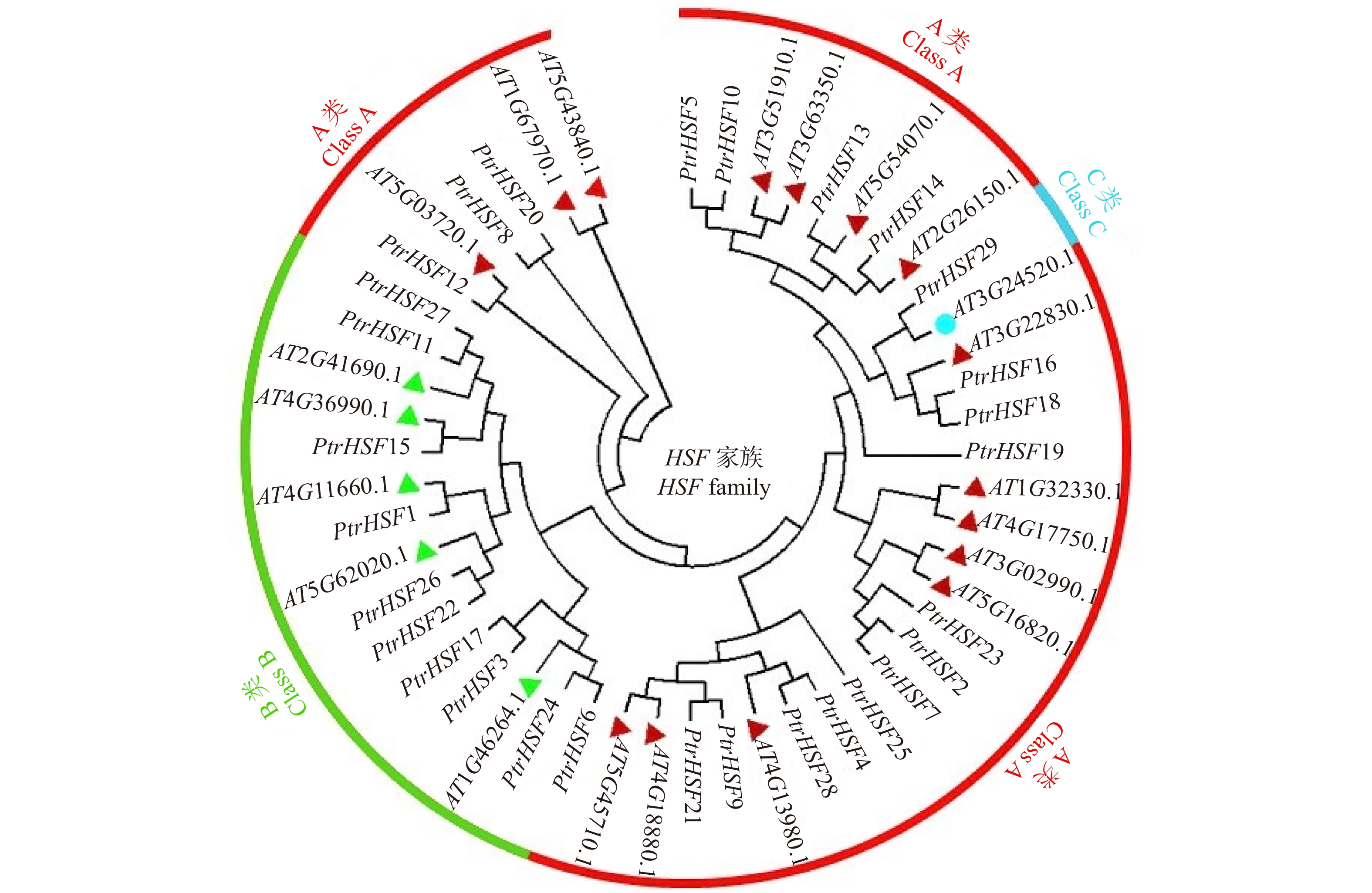
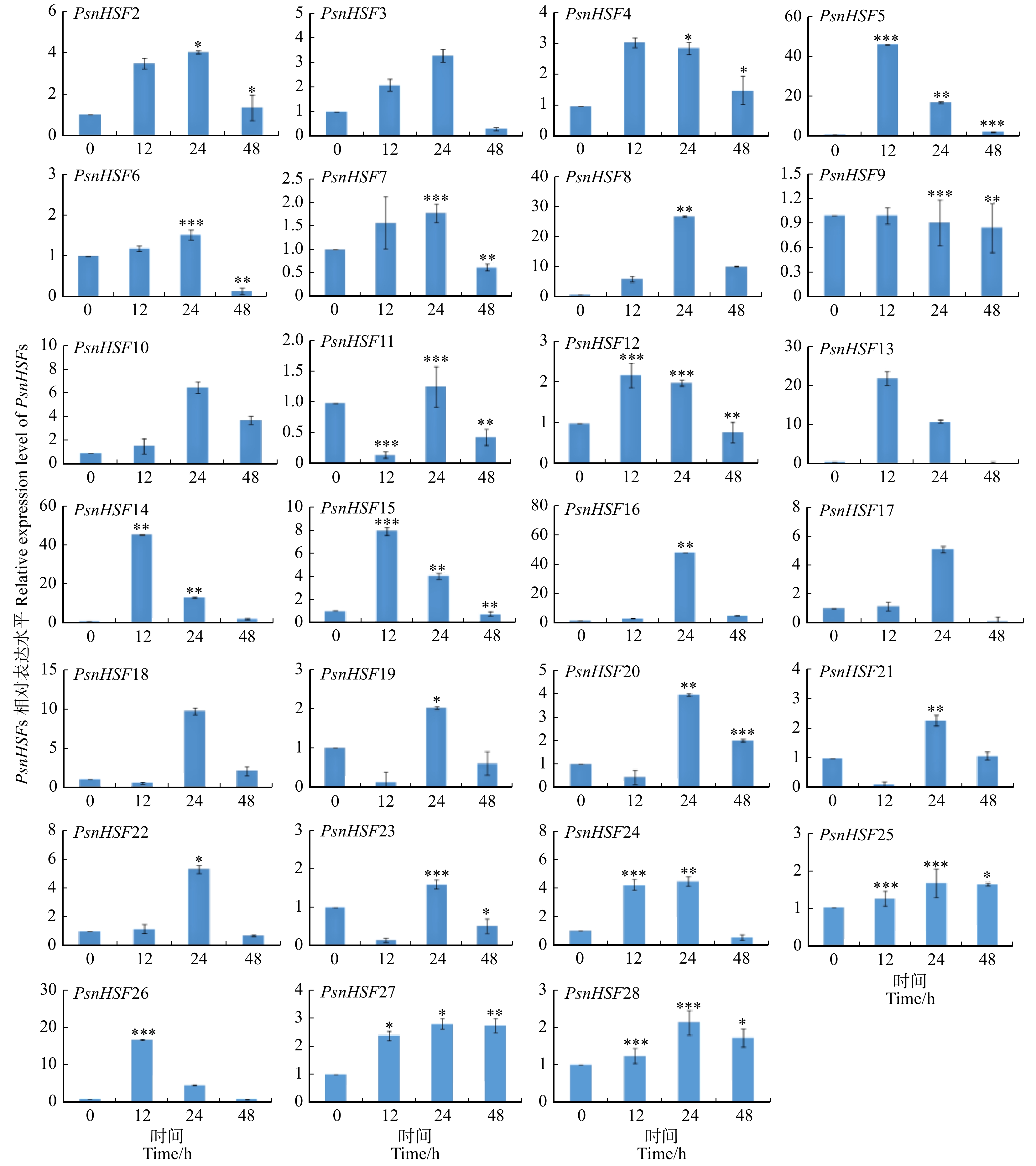
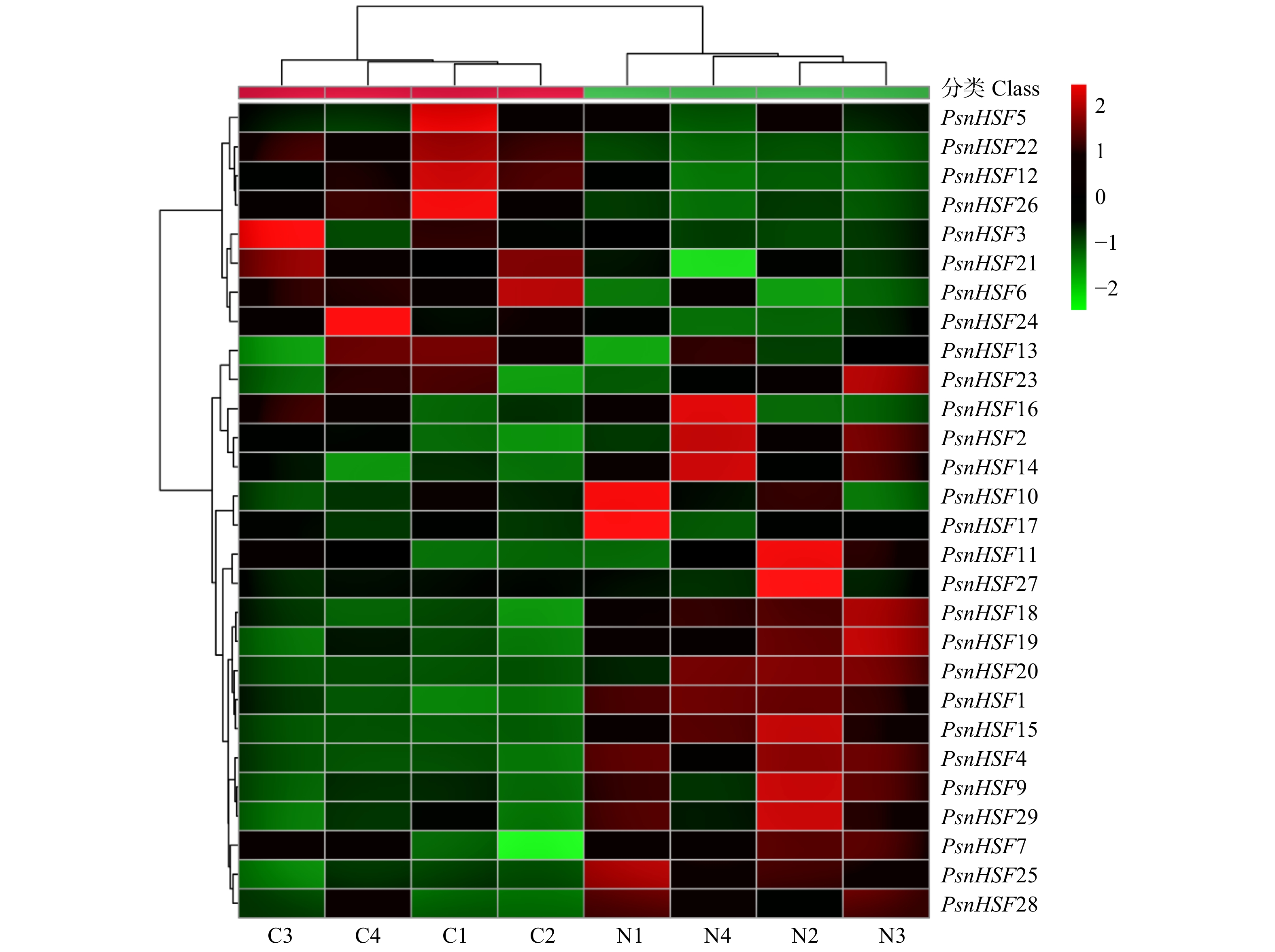
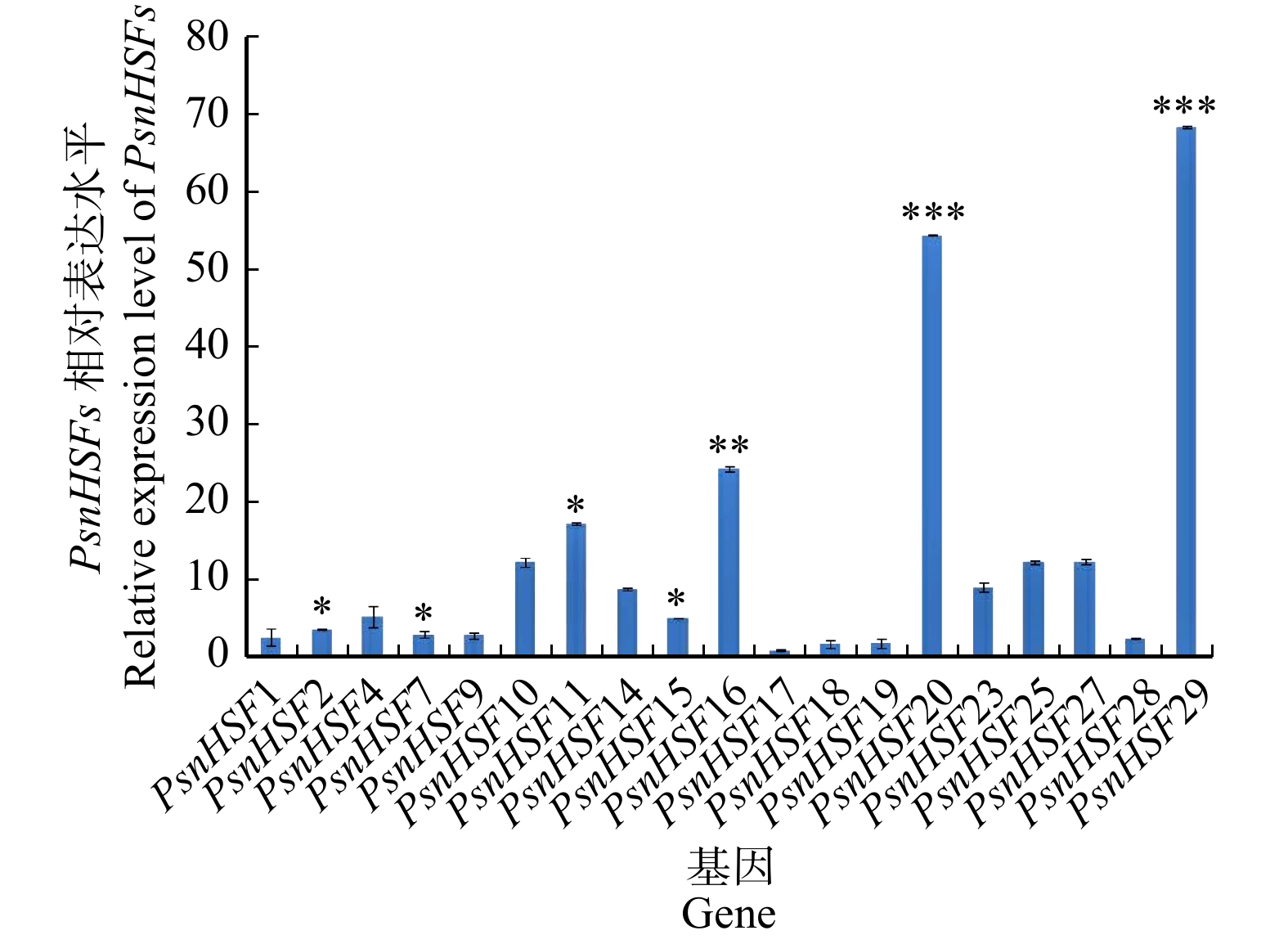
摘要:目的 探究小黑杨热激转录因子HSF在应答高温和高盐胁迫时发挥的关键作用。保守结构域和顺式作用元件预测等对杨树HSF转录因子家族基因进行生物信息学分析。本研究以小黑杨为材料,经过37 ℃高温胁迫半个月后观察其形态变化;将小黑杨在37 ℃下分别处理0、12、24、48 h,采用RT-qPCR对小黑杨组织中的PsnHSFs基因进行时空表达分析;将小黑杨于150 mmol/L NaCl胁迫分别处理0、24 h,通过RNA-seq分析PsnHSFs基因的相对表达量变化,并通过RT-qPCR进行验证。结果 通过结构特征和系统发育比较将29个HSF转录因子家族基因分成A、B和C三个亚家族,各亚家族分别包含18、10和1个HSF基因;HSF编码的氨基酸序列长度介于209 ~ 595之间,均为亲水性蛋白;其N端具有高度保守的DBD结构域,由三个保守基序构成;HSF基因启动子序列中包含DRE core、ABRE和TC-rich等多种顺式作用元件。小黑杨经37 ℃高温处理后其株高仅为对照的76.51%,叶片呈卷曲状,叶表面粗糙,叶面积显著减小且苗干多侧枝柔软无韧性。RT-qPCR与RNA-seq结果表明,PsnHSFs被高温、高盐胁迫诱导表达。高温处理后其株高仅为对照的76.51%,叶片呈卷曲状,叶表面粗糙,叶面积显著减小且苗干多侧枝柔软无韧性。RT-qPCR与RNA-seq结果表明,PsnHSFs被高温、高盐胁迫诱导表达。家族基因以及揭示HSF参与木本植物胁迫应答的分子机制调控具有参考意义。Abstract:Objective This paper aims to investigate the key role of heat shock transcription factor HSF of Populus simonii × P. nigra in response to high temperature and high salt stress.Method Bioinformatics analysis of poplar HSF transcription factor family genes was carried out through multi-sequence alignment, phylogenetic tree construction, analysis of protein physicochemical properties, conserved domains and cis-acting element prediction. In this study, P. simonii × P. nigra was used as a material, and its morphological changes were observed after 37 ℃ high temperature treatment for half a month and the PsnHSFs genes were analyzed for spatio-temporal expression after 37 ℃ high temperature treatment for 0, 12, 24 and 48 h. In addition, P. simonii × P. nigra seedlings were used for 150 mM NaCl stress treatment for 0 and 24 h, the relative expression level of PsnHSFs was analyzed by RNA-seq and verified by RT-qPCR.Result The 29 HSF genes were divided into three subfamilies of A, B and C by structural characteristics and phylogenetic comparison, each subfamily contained 18, 10 and 1 genes. The sequence length of amino acid HSF encoding was between 209 and 595. The HSF proteins were hydrophilic proteins; the N-terminal had a highly conserved DBD domain composed of three conserved motifs. The promoter sequences of the HSF genes contained a variety of cis-acting elements such as DRE core, ABRE and TC-rich elements. After high temperature treatment, the plant height was only 76.51% of control. The leaf was curled and rough, the leaf area was significantly reduced, and the trees had multiple branches which were soft and inflexible. RT-qPCR and RNA-seq results showed that PsnHSFs were induced by high temperature and high salt stress.Conclusion The growth and development of poplar was significantly affected by high temperature, the PsnHSFs genes of poplar play an important role in response to high temperature and high salt stress. This study provides a reference for understanding the HSF family genes in poplar and revealing the molecular mechanism of HSF involved in stress response in woody plants.
-
Keywords:
- Populus simonii × P. nigra /
- PsnHSFs /
- bioinformatics /
- stress response
-
板栗(Castanea mollissima)属于壳斗科(Fagaceae)栗属(Castanea)植物,是我国重要的木本粮食树种之一,其果实营养价值高,除富含淀粉外,还有蛋白质、脂肪、矿物质和维生素等营养物质,深受消费者喜爱,具有较高的经济价值[1]。目前我国板栗种植规模和总产量均居世界第一,但由于板栗喜光,枝条顶端优势强,结果部位外移快且自交不亲和,其结实率低,效益低下[2]。因此,培育具有优质、高产、短枝型等优良性状的板栗新品种具有重要的现实意义。
现阶段分子辅助育种已被广泛应用到植物育种工作中,但板栗新品种的培育仍以杂交育种为主[3],如:新品种‘明丰2号’(C. mollissima ‘Mingfeng 2’)是以‘燕明’(C. mollissima ‘Yanming’)为母本、‘燕山早丰’(C. mollissima ‘Yanshanzaofeng’)为父本杂交培育而来[4];‘南垂5号’(C. mollissima ‘Nanchui5’)则是以母本‘垂枝’(C. mollissima ‘Chuizhi’)与父本‘南沟1号’(C. mollissima ‘Nangou1’)杂交培育得来[5]。在杂交授粉过程中,如何提高成功率,以获取丰富的杂种资源是板栗育种亟待解决的问题。较高活性的花粉和柱头是授粉成功的关键[6],准确掌握花粉与柱头活性检测方法,探明其日变化规律,明确最适杂交授粉时间,可有效提高板栗杂交育种成功率。
目前,植物花粉活力检测方法多样,如2,3,5-三苯基氯化四氮唑(TTC)染色法、碘–碘化钾(I2-KI)法、MTT染色法、离体萌发法、墨水染色法等[7−9]。在柱头可授性检测方面,多数学者采用联苯胺–过氧化氢法[10−11]检测柱头可授性,部分研究采用MTT染色法[12]、直接授粉法等[13]。前期板栗花粉活力研究发现,不同板栗品种采用不同花粉活力测定方法,结果存在较大差异。陈可可[14]采用TTC染色法检测5个板栗品种花粉活力发现,‘泰安薄壳栗’(C. mollissima ‘Taianbaoke’)花粉活力最高可达72.18%;覃腾[15]以广西4个板栗品种为研究对象,采用离体萌发法检测其花粉活力,发现‘封开2号’(C. mollissima ‘Fengkai2’)萌发率最高,但仅为15.76%。在板栗柱头可授性研究方面,王倩[16]采用联苯胺–过氧化氢法检测了不同时期燕山板栗柱头可授性,发现盛花期柱头可授性最强;周晶[17]采用联苯胺–过氧化氢法检测板栗‘燕山红’(C. mollissima ‘Yanshanhong’)柱头可授性发现,柱头可授性高峰值出现于盛花期单日08:00—12:00。以上研究对花粉活力和柱头可授性的测定方法和日变化规律进行了初步探索,但并未将花粉活力、柱头可授性日变化规律与其坐果率、结实率、空苞率等进行综合分析。
为准确把握板栗最适授粉时间,提高板栗杂交育种成功率,为后期的良种培育提供充足的杂种资源,本研究首次以河北省迁西县主栽国审板栗品种‘燕山早丰’(果肉质地细腻、味香甜、熟食品质上等、丰产、质感效应较强)为母本[18−19],父本选择具有多粒、矮化等特异性状的‘王钱大栗’(C. mollissima ‘Wangqiandali’)、‘短枝芽变’(C. mollissima ‘Duanzhiyabian’)、‘三屯红栗’(C. mollissima ‘Santunhongli’),采用联苯胺–过氧化氢法、MTT法检测母本柱头可授性,采用TTC染色法、I2-KI法、醋酸洋红染色法、离体萌发法等检测花粉活力,通过研究盛花期花粉活力、柱头可授性、不同时间授粉对结实情况的影响,筛选‘燕山早丰’柱头可授性和杂交花粉活力的适宜检测方法,探明两者的日变化规律,筛选出最适杂交授粉时间。研究结果将为板栗人工杂交育种的成功提供理论指导,同时对解析板栗生殖生物学特性及繁殖机制具有重要意义。
1. 材料与方法
1.1 试验地概况
试验地位于河北省唐山市迁西县北京林业大学经济林(板栗)育种与栽培试验实践基地(40°18′ N,118°54′ E),属暖温带大陆性季风气候,年平均气温10.1 ℃,最低月平均气温−6.5 ℃,最高月平均气温25.4 ℃。年平均降水量817 mm,其中5—10月降雨量657.6 mm,占全年降水量的88%。年平均相对湿度59%,年平均无霜期176 d,全年日照2 581.5 h,日照充足。该地属于低山丘陵区,土壤质地为沙壤土,pH 6.44,有机质含量2.89 mg/g,土壤肥力为中等水平[20]。
1.2 试验材料
材料为11 年生板栗品种‘燕山早丰’‘王钱大栗’‘短枝芽变’‘三屯红栗’,长势优良,无病虫害,株行距4 m × 3 m,平均树高4.3 m,冠幅4.0 m × 4.5 m,树体为三主枝,开张角度 > 60°,树形为自然开心形。
1.3 研究方法
1.3.1 试验设计
参照周晶[17]研究结果,选择盛花期进行人工授粉。选取长势一致且健壮的板栗试验树60株,包括‘燕山早丰’45株,‘王钱大栗’‘短枝芽变’‘三屯红栗’各5株。40株‘燕山早丰’作为母本进行柱头可授性检测与授粉试验,5株‘燕山早丰’用于花粉活力检测;‘王钱大栗’‘短枝芽变’‘三屯红栗为父本,用于花粉活力日变化规律研究与授粉试验。各杂交授粉组合为 ‘燕山早丰’♀ × ‘王钱大栗’♂、‘燕山早丰’♀ × ‘短枝芽变’♂、‘燕山早丰’♀ × ‘三屯红栗’♂和1个自交组合‘燕山早丰’♀ × ‘燕山早丰’♂。
1.3.2 人工授粉
每授粉组合选择10株母树,每棵母树去雄套袋后,于盛花期单日08:00—18:00每隔2 h进行杂交授粉。采用随机区组设计,以单株为试验小区,共10个重复。各授粉组合每株母树每授粉时段在冠层中部东、南、西、北4个方向外围各均匀选取3个长势相近且健壮的雌花簇,1个授粉时段每母株共选取12个雌花簇,每个授粉组合每时段授粉120个雌花簇,4个组合共选取2 400个雌花簇。授粉时去掉套袋,用毛笔蘸取花粉轻轻点涂雌花柱头上,授粉完成后立即套袋。
1.3.3 花粉活力测定方法筛选
在上午08:00—10:00,采集‘燕山早丰’雄花盛花期的雄花序,每株树均从东、南、西、北4个方向取样,混合后分别采用TTC染色法[21]、醋酸洋红染色法[22]、I2-KI染色法[23]、离体萌发培养法[24]测定花粉活力,并以清水作为对照,筛选板栗花粉活力适宜检测方法。
1.3.4 花粉活力日变化规律研究
在08:00—18:00每隔2 h采集‘燕山早丰’‘王钱大栗’‘短枝芽变’‘三屯红栗’的雄花盛花期的花粉,选择1.3.3筛选出的花粉活力检测方法进行花粉活力日变化规律研究。
1.3.5 柱头可授性检测方法筛选
从40株‘燕山早丰’授粉母株中随机选取15株,在雌花盛花期每株树冠层中部东、南、西、北4个方向各均匀选取3个雌花簇,在上午08:00—10:00采集柱头,分别利用联苯胺–过氧化氢法[25]和MTT染色法[26]测定柱头可授性,并以清水作为对照,筛选板栗柱头可授性适宜检测方法。联苯胺–过氧化氢法判定标准:若柱头周围产生气泡数量多且体积较大,则柱头可授性很强(+++);若柱头周围产生大量小气泡,则柱头可授性较强(++);若柱头周围产生少量气泡,则柱头可授性较弱(+);若柱头无气泡产生,则柱头无可授性(−)。MTT染色法判定标准:若柱头具有可授性,则柱头被染成深蓝色或黑色,颜色由浅变深,柱头可授性由弱变强;若没有可授性,则柱头没有颜色反应。
1.3.6 柱头可授性日变化规律研究
在08:00—18:00每隔2 h采集‘燕山早丰’盛花期的柱头,选择1.3.5筛选出的柱头可授性检测方法进行柱头可授性日变化规律研究。
1.3.7 结实情况统计
授粉20 d后去除纸袋,使球苞自然生长,统计坐果率、落果率,9月上旬果实成熟后,计算结实率、空苞率。坐果率为未凋落雌花簇数与授粉雌花簇数的比值,落果率为凋落雌花簇数与授粉雌花簇数的比值,空苞率为空苞数与授粉雌花簇数的比值,结实率为果实成熟时的结实苞数与授粉雌花簇数的比值[15]。
1.4 数据分析
试验数据采用Excel软件进行整理,SPSS 26.0进行方差分析。
2. 结果与分析
2.1 花粉活力适宜检测方法筛选
花粉在清水处理的情况下,颜色均为淡黄色,接近半透明,分为形状规则的卵圆形与形状不规则两种形态(图1a)。0.5%和2%的TTC染色法的染色效果均不明显,延长染色时间后花粉依旧呈淡黄色(图1b,1c),故此方法不适合板栗花粉活力检测。醋酸洋红染色法效果明显,有活力的花粉呈鲜红色,形状呈规则的卵圆形,而无活力花粉未着色,体积小且形状不规则(图1d);该方法操作简单,染色时间短,效果好,有活力花粉与无活力花粉较易辨别,可作为板栗花粉活力检测方法。I2-KI染色法染色效果明显,有活力花粉颜色呈深棕色,无活力花粉不着色,但两者之间存在色浅、黄褐色的花粉,花粉活力较难判别,故此方法也不适合板栗花粉活力检测(图1e)。离体萌发培养法可以直接观察到花粉的萌发情况(图1f),可判断花粉是否具有活力,但花粉离体培养耗时较长,且培养条件较为严苛,易染菌,需要在无菌且温度恒定的环境下培养,花粉整体萌发率较低。
综合反应条件、反应时间、判断标准等方面,发现醋酸洋红染色法更适合进行板栗盛花期单日花粉活力规律研究。
2.2 不同板栗品种盛花期单日花粉活力变化规律
采用醋酸洋红染色法测定不同板栗品种单日内花粉活力变化规律,结果如表1所示。各品种盛花期单日内花粉活力均保持在75%以上,但不同品种板栗花粉在单日内不同时间活力存在差异。‘短枝芽变’和‘三屯红栗’单日内花粉活力波动较小,最高值均出现在10:00—12:00。‘燕山早丰’‘王钱大栗’单日内花粉活力波动相对较大,但花粉活力最高值也出现在10:00—12:00,最低值出现时段存在差异。其中,‘燕山早丰’10:00—12:00花粉活力显著高于16:00—18:00,‘王钱大栗’10:00—12:00花粉活力显著高于其余时间花粉活力。综上,以这4个品种为父本时,应该选择上午10:00—12:00采集花粉,此时花粉活力最高。
表 1 不同板栗品种盛花期花粉活力变化Table 1. Changes in pollen viability of different chestnut cultivars at full flowering stage% 时段 ‘燕山早丰’ ‘短枝芽变’ ‘王钱大栗’ ‘三屯红栗’ 08:00—10:00 84.78ab 90.47a 83.71b 88.58a 10:00—12:00 90.71a 91.32a 87.26a 88.97a 12:00—14:00 80.65ab 88.93a 75.34c 82.23a 14:00—16:00 81.14ab 90.63a 79.49c 83.76a 16:00—18:00 78.63b 86.89a 78.26c 80.53a 注:不同小写字母表示同一品种单日内不同时间花粉活力存在显著差异(P < 0.05)。下同。 2.3 柱头可授性适宜检测方法筛选
采用联苯胺–过氧化氢法检测‘燕山早丰’柱头可授性,由于板栗柱头形状结构限制,染色效果不佳,仅有柱头尖端可观察到轻微蓝色反应;但其表面气泡反应明显,区分度较高。柱头表面只产生少量气泡,且气泡体积较小,柱头可授性较弱,标记为+,记1分(图2a-1);柱头表面产生较多小气泡,柱头可授性较强,标记为++,记2分(图2a-2);柱头表面迅速产生大量气泡,且均匀附着整个柱头,柱头可授性最强,标记为+++,记3分(图2a-3)。
采用MTT染色法检测柱头可授性,短时间内柱头表面无明显颜色变化,避光染色1 h后,染色情况较为明显,有活力的柱头顶部变为黑色,且随着柱头可授性增强,染色长度逐渐增大。具体而言,仅有柱头尖端部分染色,染色面积微小,呈点状,此柱头可授性较弱(图2b-1);柱头尖端面积染色面积增大,其柱头底部也部分染色,即柱头可授性较强(图2b-2);柱头尖端染色部分延伸至柱头中部,且花柱上端也有部分染色,此柱头可授性极强(图2b-3)。
综上,联苯胺–过氧化氢法和MTT染色法都可以判断板栗柱头可授性强弱。综合考虑染色时长、可操作性等因素,在实际生产中,采用联苯胺–过氧化氢法检测板栗柱头可授性更适宜。因而,选择联苯胺–过氧化氢法进行板栗盛花期单日柱头可授性变化规律研究。
2.4 ‘燕山早丰’盛花期单日柱头可授性变化规律
表2显示:‘燕山早丰’盛花期单日内不同时段柱头均具有可授性,整体呈现出“上升—下降—上升—下降”的变化趋势。上午08:00—10:00柱头就已经具有较强可授性,10:00—12:00可授性达到最高,柱头表面具有大量气泡;随后急剧下降,12:00—14:00可授性要明显低于其他时段,之后可授性又重新升高,于14:00—16:00达到日变化第2个高峰,16:00—18:00可授性降低(图3)。
表 2 联苯胺–过氧化氢法检测‘燕山早丰’盛花期单日不同时间柱头可授性Table 2. Detecting single day stigma receptivity during full flowering period of ‘Yanshanzaofeng’ by benzidine-hydrogen peroxide method时段 柱头反应 柱头可授性 08:00—10:00 浸泡在溶液中3 ~ 5 min后,柱头表面出现大量气泡,且体积较大 +++ 10:00—12:00 浸泡溶液3 min左右,柱头表面出现大量气泡,气泡密集且体积较大 +++ 12:00—14:00 浸泡溶液5 min后,柱头表面出现少量气泡,体积较小 + 14:00—16:00 浸泡溶液5 min后,柱头表面出现气泡,气泡密集 +++ 16:00—18:00 浸泡溶液5 min后,柱头表面出现大体积气泡,但数量较少 ++ 注:+++. 柱头可授性极强;++. 柱头可授性较强;+. 柱头具可授性。 2.5 盛花期单日不同授粉时间对板栗结实情况的影响
各杂交组合中,不同时间授粉落果率与坐果率均无显著差异,但结实率与空苞率在不同授粉时间存在显著差异(图4)。 ‘燕山早丰’ × ‘王钱大栗’杂交组合在盛花期08:00—10:00与10:00—12:00时段授粉,其结实率分别高达79.30%与80.36%,显著高于12:00—14:00与16:00—18:00两个授粉时段(图4);且在10:00—12:00时段授粉,3粒坚果球苞结实率相较于其他授粉时段最高,达55.10%(表3);空苞率在10:00—12:00授粉时段最低,仅为14.74%,而16:00—18:00授粉时段的空苞率高达37.88%,二者差异达到显著水平。
表 3 各授粉组合盛花期单日不同时间授粉结实情况Table 3. Pollination and seed setting at different times of a single day during blooming period of each pollination combination授粉组合 授粉时段 结实率(1粒)/% 结实率(2粒)/% 结实率(3粒)/% 总结实率/% ‘燕山早丰’♀ × ‘王钱大栗’♂ 08:00—10:00 10.76a 14.71a 53.83a 79.30a 10:00—12:00 9.64a 15.62a 55.10a 80.36a 12:00—14:00 12.24a 17.78a 30.58b 60.60bc 14:00—16:00 5.21a 20.96a 44.24ab 70.42ab 16:00—18:00 12.35a 12.92a 29.86b 55.12c ‘燕山早丰’♀ × ‘短枝芽变’♂ 08:00—10:00 10.59a 8.07ab 40.69a 59.35a 10:00—12:00 4.98a 7.40ab 43.72a 56.10a 12:00—14:00 7.13a 3.25b 26.20ab 36.59b 14:00—16:00 5.67a 12.61a 34.56a 52.85a 16:00—18:00 7.28a 8.01ab 23.62ab 38.90ab ‘燕山早丰’♀ × ‘三屯红栗’♂ 08:00—10:00 3.25b 19.76a 53.41a 76.42a 10:00—12:00 10.60a 17.28ab 50.98a 78.86a 12:00—14:00 14.65a 17.31ab 29.02b 60.98ab 14:00—16:00 13.82a 17.32ab 39.06ab 70.20ab 16:00—18:00 11.38a 16.50b 29.02b 56.91b ‘燕山早丰’♀ × ‘燕山早丰’♂ 08:00—10:00 23.80a 4.70a 2.82a 31.32a 10:00—12:00 21.12a 4.17ab 2.50ab 27.79ab 12:00—14:00 17.63a 3.25ab 1.95ab 22.83ab 14:00—16:00 20.07a 3.96ab 2.38ab 26.40ab 16:00—18:00 16.84a 2.73b 1.64b 21.21b 注:不同小写字母表示同一授粉组合单日内不同时段授粉后结实情况存在显著差异(P < 0.05)。 在‘燕山早丰’ × ‘短枝芽变’杂交组合中,结实率在08:00—10:00授粉时段最高(59.35%),10:00—12:00时段的结实率与08:00—10:00时段相比略有下降(56.10%),并显著高于12:00—14:00授粉时段(图4);3粒坚果球苞结实率以10:00—12:00时段最高(43.72%)(表3);空苞率则以10:00—12:00授粉时段最低(27.64%),12:00—14:00与16:00—18:00的空苞率则高达46.34%与44.59%,均显著高于10:00—12:00(图4)。
在‘燕山早丰’ × ‘三屯红栗’杂交组合中,08:00—10:00、10:00—12:00授粉时段的结实率较高,达76.42%、78.86%,16:00—18:00结实率最低(56.91%),与上午差异达到显著水平(图4);3粒坚果球苞结实率以08:00—10:00时段最高(53.41%),10:00—12:00时段略有下降(50.98%)(表3);空苞率则在10:00—12:00授粉时段最低(8.94%),显著低于12:00—14:00和16:00—18:00授粉时段。
在‘燕山早丰’ × ‘燕山早丰’自交组合中,结实率均在30%左右(图4)。在08:00—10:00授粉时段,结实率最高(31.32%),空苞率最低(30.38%);在16:00—18:00授粉时段结实率最低(21.21%)(图4)。结实的球苞大多只含有1粒坚果,2粒坚果球苞与3粒坚果球苞结实率均以08:00—10:00最高,16:00—18:00最低;空苞率则以12:00—14:00最高,达53.54%(表3)。相比其他杂交组合,自交组合中的结实率较低,落果率与空苞率较高;但是结实率最高值出现在上午授粉时段,这与其他杂交组合相同(图4)。
综合不同板栗品种授粉组合在不同时时段授粉后的结实指标可以得出,结实率和3粒坚果球苞结实率最高值均出现在上午。因此,为提高板栗杂交授粉结实率,应选择上午进行板栗杂交授粉。
3. 讨 论
3.1 花粉活力检测
前人系统研究花粉活力发现,不同植物有不同的适宜检测方法。如:花生(Arachis hypogaea)花粉活力的最适检测方法为离体萌发法与红墨水染色法[7],薄壳山核桃(Carya illinoinensis)的花粉采用MTT染色法着色效果最佳[8],多花黄精(Polygonatum cyrtonema)的花粉活力最适检测方法为TTC染色法[27]。TTC试剂是依靠呼吸作用产生的NADH2或NADPH2对花粉进行染色。本试验中TTC试剂无法使板栗花粉着色,这可能是由于板栗自身呼吸作用产生的脱氢酶较少,无法达到理想的染色状态。此外,利用I2-KI对花粉进行染色时,染色效果会因直链淀粉与支链淀粉的比例不同而产生差异[28]。当花粉直链淀粉含量高时,会被试剂染为蓝色,如芝麻(Sesamum indicum)[23]、油茶(Camellia oleifera)[29];反之则为紫红色,如花生[7]、百合(Lilium lancifolium)[30]等。醋酸洋红染液则是根据花粉内物质积累量对花粉进行染色,正常花粉物质积累较多,对醋酸洋红的吸附作用与亲和力强,易被染为深红色,反正,呈淡红色或无色,如油菜(Brassica campestris)[31]。本研究中,醋酸洋红染色法、I2-KI染色法均可将‘燕山早丰’花粉成功染色,但是醋酸洋红染色法操作简单,染色快速,有活力花粉与无活力花粉易辨别,结果准确;而I2-KI染色法中存在浅色、黄褐色的介于有活力和无活力之间的花粉,活力界定具有主观性,花粉活力较难准确判别。因而,建议生产上使用醋酸洋红染色法检测‘燕山早丰’花粉活力。
3.2 柱头可授性检测
利用联苯胺–过氧化氢法检测柱头可授性,主要是依靠柱头表面有活力的过氧化氢酶,试剂中的过氧化氢在酶的作用下产生强氧化性的原子氧,将联苯胺氧化变色,并产生气泡。故当柱头表面气泡体积较大,数量较多时,柱头具有较强可授性,反之则柱头可授性较弱。此方法已广泛用于植物柱头可授性检验,如川贝母(Fritillaria cirrhosa)[32]、兜兰(Paphiopedilum)[33]等。MTT染色法检测柱头可授性主要依据柱头表面活性酶与试剂反应变色原理,可授性较强的柱头被染为深色,且染色面积较大,反之柱头颜色较浅[34−35]。本试验采用联苯胺–过氧化氢法和MTT染色法检验‘燕山早丰’的柱头可授性,其反应结果与其他植物基本相同,但MTT染色法检验板栗柱头可授性耗时较长,可能导致错过最适授粉时间。因此,在生产上可选取联苯胺–过氧化氢法快速检测柱头可授性,为杂交授粉提供指导。
3.3 花粉活力与柱头可授性日变化规律
花粉活力是决定授粉成功的重要因素,柱头是植物承接花粉的部位,二者对于准确把握植物授粉时间有重要意义,共同决定植物育种成功率[36]。不同植物的花粉活力与柱头可授性变化规律不同[23,37],因此,植物育种授粉前,应准确掌握花粉活力和柱头的变化规律,由此得到最适授粉时间,提高育种成功率。
本研究发现,上午08:00—12:00柱头可授性与花粉活力均较强,而在正午12:00—14:00柱头可授性较弱,且此时花粉活力显著降低,这可能与空气温度、湿度变化有关。板栗柱头为针状形,在雌花成熟过程中可观察到柱头尖端有蛋白质、脂类、多糖等分泌物溢出[38],中午温度升高,空气湿度降低,导致柱头分泌物内酶活性降低,柱头可授性降低。这与温度对甜樱桃(Prunus avium)柱头可授性的影响结果[39]相一致。此外,正午高温导致板栗花粉活力降低,这与辣椒(Capsicum annuum)的研究结果[40]相似。正午过后,气温降低,日照强度减弱,柱头内酶活性增强,柱头可授性与花粉活力回升;傍晚气温继续下降导致柱头可授性与花粉活力又重新降低。本研究得出的柱头可授性变化规律与周晶[17]对板栗柱头可授性的研究结果基本一致,且本研究中板栗花粉活力检测方法和变化规律方面的内容也弥补了板栗相关研究的缺失。
3.4 杂交授粉时间与结实情况
授粉时间显著影响授粉受精完成情况,如周建辉等[41]对厚皮甜瓜(Cucumis melo)进行不同时间杂交授粉,发现06:00—12:00授粉种子发芽率较高。对西瓜(Citrullus lanatus)[42]、西葫芦(Cucurbita pepo)[43]的研究也证实上午授粉比下午效果好,主要表现为坐果率较高,结籽数量多。此外,对玉米(Zea mays)进行不同时间授粉处理,发现不同自交系均在09:00—11:00和16:00—18:00授粉果穗的结实性状较好[44]。这与本研究得到的板栗08:00—12:00与14:00—16:00杂交授粉结实情况较好的结果相似,即最适授粉时间均避开了正午时段。除可以根据授粉结实情况筛选植物授粉时间外,也可根据柱头可授性和花粉活力筛选植物的适宜授粉时间。对青杨派树种进行柱头可授性检测,发现最佳授粉期为花序顶部露出芽鳞84 ~ 96 h[45]。本研究中,上午10:00—12:00进行授粉结实效果优良,这与前期柱头可授性与花粉活力变化规律的结果相符合,进一步验证了此时段为板栗最适杂交授粉时间。
通过将3个杂交授粉组合与自交授粉结实情况相对比,可以看出‘燕山早丰’存在明显的自交不亲和现象,其自交落果率与空苞率均较高,而结实率较低。不同杂交授粉组合间结实情况也存在差异,以‘王钱大栗’‘三屯红栗’为父本的授粉组合的结实率和3粒坚果球苞结实率与以‘短枝芽变’为父本的授粉组合存在较大差距,即存在明显的花粉直感效应,这与前人的研究结果[19]一致。后续在进行板栗杂交育种和种质优化时,宜选取性状优良的品种为父本,以丰富子代板栗优良性状。
4. 结 论
本研究首次以国审板栗品种‘燕山早丰’为试验对象,筛选其柱头可授性与花粉活力的高效便捷检测方法,并在此基础上以其为母本进行了多组合的分时段授粉,从而筛选出板栗适宜的杂交授粉时段。研究得到以下主要结论。
(1)板栗‘燕山早丰’柱头可授性最适检测方法为联苯胺–过氧化氢法,花粉活力最适检测方法为醋酸洋红染色法。
(2)盛花期单日内柱头可授性呈“上升—下降—上升—下降”趋势,且以10:00—12:00时间段柱头可授性最强,此时段不同父本板栗品种的花粉活力也最高。
(3)不同杂交组合中,总结实率与3粒坚果球苞结实率最高值均出现在08:00—12:00。
综合上述结果,实际生产中建议在上午10:00—12:00对‘燕山早丰’杂交授粉。研究结果不仅为优化板栗人工杂交授粉技术,提高板栗杂交授粉成功率,以获得充足的杂种资源提供了理论指导,同时有助于丰富板栗生殖生物学内容,揭示其繁殖机制。本研究设置的授粉试验时间梯度为2 h,在后续研究中可将时间梯度细化,以期筛选出更加精确的最适授粉时间,从而获得更理想的结实效果。
-
图 3 小黑杨高温胁迫生长状态
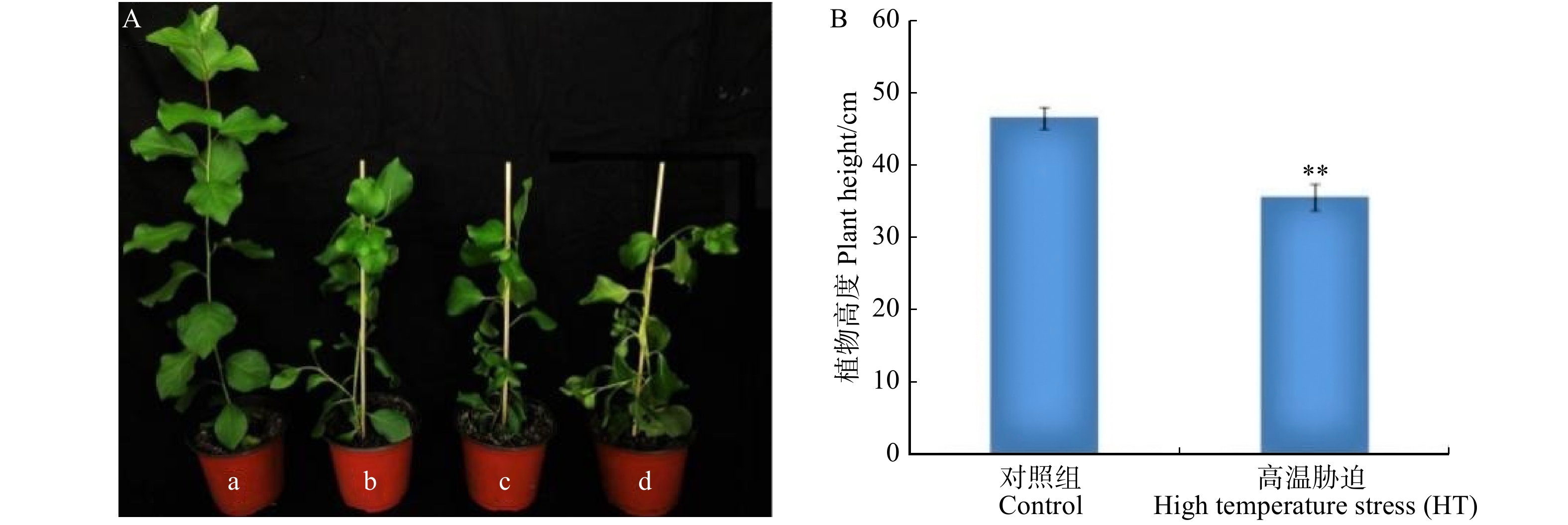
A. 小黑杨非胁迫和胁迫生长状态;a为对照,b、c、d为37 ℃高温处理小黑杨;B. 小黑杨对照和高温胁迫处理半个月的株高。数据均为平均值 ± 标准差;星号表示胁迫处理植株与非胁迫处理植株之间的差异性,*、**、***分别表示在P < 0.05、P < 0.01、P < 0.001水平上差异显著。下同。A, non-stress and stress growth state of P. simonii × P. nigra; a, control; b, c, d, P. simonii × P. nigra trees under 37 ℃ high temperature treatment; B, plant height of P. simonii × P. nigra under control and HT for half a month. The data annotation in the picture is average value ± SD; the asterisk indicates that the difference between stressed and non-stressed plants. *, **, *** indicate significant difference at P < 0.05, P < 0.01, P < 0.001 level, respectively. The same below.
Figure 3. Growth state of P. simonii × P. nigra under high temperature stress
图 4 小黑杨高温胁迫叶片状态
A.形态学上端向下第3片到第11片小黑杨叶片;B.小黑杨第6片叶表面;a.对照;b、c、d. 37 ℃高温处理小黑杨。A, the 3rd to 11th leaves of P. simonii × P. nigra from apical side; B, surface of the 6th leaf of P. simonii × P. nigra; a, control; b, c, d, P. simonii × P. nigra under 37 ℃ high temperature treatment.
Figure 4. Leaf state of P. simonii × P. nigra under high temperature stress
表 1 小黑杨PsnHSFs转录因子基因定量引物
Table 1 Quantitative primers for PsnHSFs transcription factor genes of Populus simonii × P. nigra
基因名称 Gene name 基因编号 Gene ID 正向引物(5′—3′) Forward primer (5′−3′) 反向引物(3′—5′) Reverse primer (3′−5′) PsnHSF1 Potri.001G108100.1 CTACGATGGCGGCATCAGCTG CAGCTGATGCCGCCATCGTAG PsnHSF2 Potri.001G138900.1 GCTTAGGACTATCAGTCGGCG CCTCTTAAGCCTCTCTACCTC PsnHSF3 Potri.001G273700.1 CCCAACACCATCACCAGCACT GATTATCTTCTGAGAGTGCAG PsnHSF4 Potri.001G320900.1 CCTACTTTTGTTGAACACCTT TACTGTGATTTTCCACAAGAC PsnHSF5 Potri.002G048200.1 ATGAATCCATATCTAACAGTG GTATCATGTAAACCTTCCATC PsnHSF6 Potri.002G124800.1 CAGCTCAGCCACAAGTAGCCA GTGAATCACACCAGTTGTTGG PsnHSF7 Potri.003G095000.1 GCTTAGGATTATCAGTCGGCG CTTCCTCGAGCCCAAATTTCC PsnHSF8 Potri.004G042600.1 GCGAGCCCAGCACGTTTCCAG CTAGTTCCATTTTCTCTCTTC PsnHSF9 Potri.004G062300.1 GTATCTTTTGTGACCCGAGTG GAAGTCACCGTCTGATTATCC PsnHSF10 Potri.005G214800.1 GATCTAGTAGAGGTGGTGGTG CATACCCTTGCATTTCCAACG PsnHSF11 Potri.006G049200.1 GGACTAACAAGCAACAACCTA CTAGTAAGCTCAGTGCTCAAG PsnHSF12 Potri.006G115700.1 GGAGAGATTGGTTCATCAAGG GTGATGTTTCTCCAATCAGGC PsnHSF13 Potri.006G148200.1 ATGAATACAAGAGAAATGCAG CTTCAACTCATTGAGACTATC PsnHSF14 Potri.006G226800.1 GACATCTCTCACAGACCACAC CTAAGCCTTACAATCTCTGCC PsnHSF15 Potri.007G043800.1 GACAGCGGCTGCGTCTCCGAC GACGTTGACGTGGACCCCAGG PsnHSF16 Potri.008G157600.1 CATCTTCTCAAGAGTATTAGG CTTGCTTGTCTCGCCTTAATC PsnHSF17 Potri.009G068000.1 CAATATCCCAGCACCATCACC CTGAGAGGGCAGTTAGGATAT PsnHSF18 Potri.010G082000.1 CTCCTCAAACTCAGACTTCTC CTTCACTAGTTCCACCATTAG PsnHSF19 Potri.010G104300.1 CTCAGGGCACAGACAATCGAA CTCAACTTCCTTCCAGAGACC PsnHSF20 Potri.011G051600.1 GTGAGCCTAGTATGTTTCCAG CAGTTCAAGTTTCTCTCTTCG PsnHSF21 Potri.011G071700.1 CATACAGCAAACTATAGTGTC GTATAGATAACCAATTCTAGG PsnHSF22 Potri.012G138900.1 GCCATGGTGAAAACGTCGTCG CTCTTCATCTCCGTCAACTCC PsnHSF23 Potri.013G079800.1 CTGTTCATGGTAACCTACCAC TCTAACAAGTTCCTGCATGAG PsnHSF24 Potri.014G027100.1 CAGCTCAGCCACAAGTAGCTA GAGAGATGCTGGTTCTGCTTG PsnHSF25 Potri.014G141400.1 GTTCTCCAATTGCAAACCTGG CAACATGGCACACTTCTTCAC PsnHSF26 Potri.015G141100.1 GTGGCGACGGTGGCGCAAGTG CCGGCGAAGAACTCCTCGTCG PsnHSF27 Potri.016G056500.1 CATGGTCTAGCAAGCAACAAC GTAAGCTCAGTGCTCAAGACC PsnHSF28 Potri.017G059600.1 CTGCTTTTGTTGAACATCTTG AGAACTACAGTGATTTTCGAC PsnHSF29 Potri.T137400.1 CTGAAGAATATAGTTCGCAGG CATAATTATATCTTCATCATC 表 2 杨树HSF转录因子基因理化性质
Table 2 Physical and chemical properties of HSF transcription factor genes in poplar
基因名称
Gene name基因编号
Gene ID基因群
Gene
group氨基酸个数
Amino acid
number连锁群
Linkage
group蛋白分子质量
Molecular mass
of protein/Da等电点
Isoelectric
point (PI)脂肪指数
Aliphatic
index (AI)不稳定系数
Instability
index (II)总平均亲水性
Grand average of
hydropathicity
(GRAVY)PtrHSF1 Potri.001G108100.1 B2b 343 Chr01 36 826.6 4.71 69.15 55.66 −0.559 PtrHSF2 Potri.001G138900.1 A1d 595 Chr01 65 369.3 5.51 74.57 64.08 −0.532 PtrHSF3 Potri.001G273700.1 B4d 270 Chr01 31 292.3 7.15 70.37 56.72 −0.610 PtrHSF4 Potri.001G320900.1 A5b 490 Chr01 54 702.7 6.01 70.67 56.61 −0.770 PtrHSF5 Potri.002G048200.1 A7b 359 Chr02 41 148.3 5.13 67.41 57.79 −0.808 PtrHSF6 Potri.002G124800.1 B4a 364 Chr02 40 440.7 8.15 73.90 51.74 −0.468 PtrHSF7 Potri.003G095000.1 A1a 507 Chr03 55 694.9 4.61 70.81 58.55 −0.601 PtrHSF8 Potri.004G042600.1 A1 209 Chr04 24 028.4 9.50 70.53 57.40 −0.655 PtrHSF9 Potri.004G062300.1 A4a 407 Chr04 46 642.1 4.91 62.04 57.47 −0.843 PtrHSF10 Potri.005G214800.1 A7a 359 Chr05 40 692.4 5.37 61.42 66.48 −0.914 PtrHSF11 Potri.006G049200.1 B3 226 Chr06 26 377.0 9.06 76.77 51.80 −0.753 PtrHSF12 Potri.006G115700.1 A3 444 Chr06 49 881.0 4.86 66.94 61.80 −0.634 PtrHSF13 Potri.006G148200.1 A9 430 Chr06 48 496.8 5.40 73.23 51.38 −0.626 PtrHSF14 Potri.006G226800.1 A2 388 Chr06 43 856.9 4.70 73.30 56.80 −0.592 PtrHSF15 Potri.007G043800.1 B1 285 Chr07 31 018.9 4.57 59.58 37.61 −0.853 PtrHSF16 Potri.008G157600.1 A6b 348 Chr08 40 084.0 4.90 75.89 57.84 −0.692 PtrHSF17 Potri.009G068000.1 B4b 272 Chr09 31 530.7 7.19 72.68 57.32 −0.586 PtrHSF18 Potri.010G082000.1 A6a 358 Chr10 41 335.3 4.90 67.21 55.43 −0.788 PtrHSF19 Potri.010G104300.1 A8b 392 Chr10 44 690.9 4.42 70.61 43.14 −0.705 PtrHSF20 Potri.011G051600.1 A1 211 Chr11 24 383.6 9.79 63.84 53.41 −0.772 PtrHSF21 Potri.011G071700.1 A4a 406 Chr11 46 266.6 5.02 66.28 54.95 −0.793 PtrHSF22 Potri.012G138900.1 B2a 301 Chr12 33 366.2 4.77 67.94 50.83 −0.667 PtrHSF23 Potri.013G079800.1 A1b 499 Chr13 55 091.5 5.62 65.03 57.66 −0.619 PtrHSF24 Potri.014G027100.1 B4c 368 Chr14 41 038.2 8.17 68.10 52.12 −0.564 PtrHSF25 Potri.014G141400.1 A4b 443 Chr14 50 781.7 6.17 65.15 62.50 −0.806 PtrHSF26 Potri.015G141100.1 B2c 286 Chr15 31 751.8 4.86 80.66 50.80 −0.470 PtrHSF27 Potri.016G056500.1 B3b 228 Chr16 26 486.0 7.30 71.84 55.59 −0.732 PtrHSF28 Potri.017G059600.1 A5a 485 Chr17 54 386.4 5.84 69.01 57.90 −0.752 PtrHSF29 Potri.T137400.1 C1 339 Scaffold-294 37 981.9 5.27 77.05 51.81 −0.409 表 3 杨树HSF家族基因启动子顺式作用元件
Table 3 Cis-acting elements of HSF family gene promoter in poplar
作用元件 Acting element 序列 Sequence 功能 Function Gap-box CAAATGAA(A/G)A 光响应元件的一部分 Part of light responsive element Box4 ATTAAT 与光相关的保守DNA模块的一部分 Part of a conserved DNA module involved in light DRE core GCCGAC 脱水反应元件 Dehydration responsive element MYC CATTTG 参与低温反应 Involved in chilling response MYB CAACCA MYB 结合位点 MYB binding site ARE AAACCA 无氧诱导所必需的 Essential for anaerobic induction ABRE ACGTG 参与脱落酸反应 Involved in abscisic acid responsiveness TGACG-motif TGACG 参与了MeJA反应 Involved in MeJA-responsiveness TC-rich repeats ATTCTCTAAC 参与防御和压力反应 Involved in defense and stress responsiveness TCA-element CCATCTTTTT 参与水杨酸反应 Involved in salicylic acid responsiveness LTR CCGAAA 参与低温反应 Involved in low-temperature responsiveness MBS CAACTG 参与干旱诱导 Involved in drought-inducibility MBS І aaaAaaC(G/C)GTTA 参与类黄酮生物合成基因调控 Involved in flavonoid biosynthetic gene regulation GARE-motif TCTGTTG 赤霉素反应元件 Gibberellins-responsive element AE-box AGAAACTT 光响应模块的一部分 Part of a module for light response WUN-motif AAATTACT 创伤反应元件 Wound-responsive element P-box CCTTTTG 赤霉素反应元件 Gibberellin-responsive element TGA-box 生长素反应元件的一部分 Part of an auxin-responsive element ERE ATTTTAAA 乙烯反应元件 Ethylene-responsive element G-box CACGTC/TACGTG 光响应性和结合其他特定压力调节的元件
Light responsiveness and combines with other regulatory elements under specific stress -
[1] Kerchev P, van der Meer T, Sujeeth N, et al. Molecular priming as an approach to induce tolerance against abiotic and oxidative stresses in crop plants[J]. Biotechnology Advances, 2020, 40: 107503. doi: 10.1016/j.biotechadv.2019.107503.
[2] Przemysław Ł K, Dominika R, Eva I, et al. Influence of abiotic stress factors on the antioxidant properties and polyphenols profile composition of green barley (Hordeum vulgare L.)[J]. International Journal of Molecular Sciences, 2020, 21(2): 397.
[3] Yang X H, Liang Z, Lu C. Genetic engineering of the biosynthesis of glycinebetaine enhances photosynthesis against high temperature stress in transgenic tobacco plants[J]. Plant Physiology, 2005, 138(4): 2299−2309. doi: 10.1104/pp.105.063164.
[4] Gao S, Han H, Feng H L, et al. Overexpression and suppression of violaxanthin de-epoxidase affects the sensitivity of photosystem II photoinhibition to high light and chilling stress in transgenic tobacco[J]. Journal of Integrative Plant Biology, 2010, 52(3): 332−339. doi: 10.1111/j.1744-7909.2010.00891.x.
[5] Lu Y. Identification and roles of photosystem II assembly, stability, and repair factors in Arabidopsis[J]. Frontiers in Plant Science, 2016, 7: 168.
[6] Murata N, Allakhverdiev S I, Nishiyama Y. The mechanism of photoinhibition in vivo: re-evaluation of the roles of catalase, a-tocopherol, non-photochemical quenching, and electron transport[J]. Biochimica et Biophysica Acta, 2012, 1817(8): 1127−1133. doi: 10.1016/j.bbabio.2012.02.020.
[7] Min L, Li Y Y, Hu Q, et al. Sugar and auxin signaling pathways respond to high-temperature stress during anther development as revealed by transcript profiling analysis in cotton[J]. Plant Physiology, 2014, 164(3): 1293−1308. doi: 10.1104/pp.113.232314.
[8] Hirt H, Shinozaki K. Plant responses to abiotic stress[M]. Berlin: Springer Heidelberg, 2004: 4.
[9] Huang Y C, Niu C Y, Yang C R, et al. The heat stress factor HSFA6b connects ABA signaling and ABA-mediated heat responses[J]. Plant Physiology, 2016, 172(2): 1182−1199.
[10] Nover N, Bharti K, Döing P, et al. Arabidopsis and the heat stress transcription factor world: how many heat stress transcription factors do we need?[J]. Cell Stress & Chaperones, 2001, 6(3): 177−189.
[11] Zhang J, Jia H X, Li J B, et al. Molecular evolution and expression divergence of the Populus euphratica Hsf genes provide insight into the stress acclimation of desert poplar[J]. Scientific Reports, 2016, 6: 30050. doi: 10.1038/srep30050
[12] Guo M, Liu J H, Ma X, et al. The plant heat stress transcription factors (HSFs): structure, regulation, and function in response to abiotic stresses[J]. Frontiers in Plant Science, 2016, 7: 114.
[13] Zupanska A K, LeFrois C, Ferl R J, et al. HSFA2
functions in the physiological adaptation of undifferentiated plant cells to spaceflight[J]. International Journal of Molecular Sciences, 2019, 20(2): 390. doi: 10.3390/ijms20020390. [14] Zang D, Wang J X, Zhang X, et al. Arabidopsis heat shock transcription factor HSFA7b positively mediates salt stress tolerance by binding to an E-box-like motif to regulate gene expression[J]. Journal of Experimental Botany, 2019, 70(19): 5355−5374. doi: 10.1093/jxb/erz261.
[15] 姚文静. 杨树转录因子ERF76基因耐盐功能研究[D]. 哈尔滨: 东北林业大学, 2016. Yao W J. Functional analysis of poplar transcription factor ERF76 gene on salt-stress tolerance[D]. Harbin: Northeast Forestry University, 2016.
[16] Tang M J, Xu L, Wang Y, et al. Genome-wide characterization and evolutionary analysis of heat shock transcription factors (HSFs) to reveal their potential role under abiotic stresses in radish (Raphanus sativus L.)[J]. BMC Genomics, 2019, 20(1): 1−13. doi: 10.1186/s12864-018-5379-1.
[17] Scharf K D, Berberich T, Ebersberger I, et al. The plant heat stress transcription factor (Hsf) family: structure, function and evolution[J]. Biochimica et Biophysica Acta (BBA): Gene Regulatory Mechanisms, 2012, 1819(2): 104−119. doi: 10.1016/j.bbagrm.2011.10.002.
[18] Peteranderl R, Rabenstein M, Shin Y K, et al. Biochemical and biophysical characterization of the trimerization domain from the heat shock transcription factor[J]. Biochemistry, 1999, 38(12): 3559−3569. doi: 10.1021/bi981774j.
[19] 李春艳. AP1基因转化双单倍体小黑杨及其数字基因表达谱分析[D]. 哈尔滨: 东北林业大学, 2013. Li C Y. Genetic transformation of AP1 gene in haploid Populus simonii × P. nigra and the DEGS analysis[D]. Harbin: Northeast Forestry University, 2013.
[20] 牛京萍, 刘轶, 由香玲. 小黑杨花粉植株的获得及遗传转化[J]. 福建林业科技, 2016, 43(4):13−16. Niu J P, Liu Y, You X L. Induction and genetic transformation of pollen haploid plants of Populus simonii × P. nigra[J]. Fujian Forestry Science and Technology, 2016, 43(4): 13−16.
[21] Deutsch F, Kumlehn J, Ziegenhagen B, et al. Stable haploid poplar callus lines from immature pollen culture[J]. Physiologia Plantarum, 2004, 120(4): 613−622.
[22] 彭儒胜, 赵大根, 张兴芬, 等. 杨树单倍体育种及其影响因素[J]. 防护林科技, 2007, 25(6):59−60, 73. doi: 10.3969/j.issn.1005-5215.2007.06.023. Peng R S, Zhao D G, Zhang X F, et al. Haploid breeding of poplar and its influencing factors[J]. Shelterbelt Technology, 2007, 25(6): 59−60, 73. doi: 10.3969/j.issn.1005-5215.2007.06.023.
[23] 王家玉, 赵威威. 银中杨、小黑杨树种的特性分析[J]. 科技风, 2011, 24(7):203. doi: 10.3969/j.issn.1671-7341.2011.07.179. Wang J Y, Zhao W W. Characteristics of Populus alba × P. berolinensis and Populus simonii × P. nigra[J]. Technology Wind, 2011, 24(7): 203. doi: 10.3969/j.issn.1671-7341.2011.07.179.
[24] von Koskull-Döring P, Scharf K D, Nover L. The diversity of plant heat stress transcription factors[J]. Trends in Plant Science, 2007, 12(10): 452−457. doi: 10.1016/j.tplants.2007.08.014.
[25] Liu B, Hu J J, Zhang J. Evolutionary divergence of duplicated Hsf genes in Populus[J]. Cells, 2019, 8(5): 438. doi: 10.3390/cells8050438.
[26] Akerfelt M, Morimoto R I, Sistonen L. Heat shock factors: integrators of cell stress, development and lifespan[J]. Nature Reviews Molecular Cell Biology, 2010, 11(8): 545−555. doi: 10.1038/nrm2938
[27] Fitter A H. Rapid changes in flowering time in British plants[J]. Science, 2002, 296: 1689−1691. doi: 10.1126/science.1071617.
[28] Alcazar R, Parker J E. The impact of temperature on balancing immune responsiveness and growth in Arabidopsis[J]. Trends Plant Sci, 2011, 16(12): 666−675. doi: 10.1016/j.tplants.2011.09.001.
[29] Gray S B, Brady S M. Plant developmental responses to climate change[J]. Developmental Biology, 2016, 419(1): 64−77. doi: 10.1016/j.ydbio.2016.07.023.
[30] Zha Q, Xi X J, He Y, et al. Transcriptomic analysis of the leaves of two grapevine cultivars under high-temperature stress[J]. Scientia Horticulturae, 2020, 265: 109265.
[31] 李思达. 小黑杨PxbHLH01/02基因在逆境胁迫中的功能分析[D]. 哈尔滨: 东北林业大学, 2018. Li S D. Functional analysis of PxbHLH01/02 genes in Populus simonii × P. nigra under stress condition[D]. Harbin: Northeast Forestry University, 2018.
[32] Charng Y Y, Liu H C, Liu N Y, et al. A heat-inducible transcription factor, HsfA2, is required for extension of acquired thermotolerance in Arabidopsis[J]. Plant Physiology, 2007, 143(1): 251−262. doi: 10.1104/pp.106.091322.
[33] Jung H S, Crisp P A, Estavillo G M, et al. Subset of heat-shock transcription factors required for the early response of Arabidopsis to excess light[J]. Proceedings of the National Academy of Sciences, 2013, 110(35): 14474−14479. doi: 10.1073/pnas.1311632110.
[34] 刘中原, 刘峥, 徐颖, 等. 白桦HSFA4转录因子的克隆及耐盐功能分析[J]. 林业科学, 2020, 56(5):69−79. Liu Z Y, Liu Z, Xu Y, et al. Cloning and salt tolerance analysis of transcription factor HSFA4 from Betula platyphylla[J]. Forestry Science, 2020, 56(5): 69−79.
[35] Perez-Salamo I, Papdi C, Rigo G, et al. The heat shock factor A4A confers salt tolerance and is regulated by oxidative stress and the mitogen-activated protein kinases MPK3 and MPK6[J]. Plant Physiology, 2014, 165(1): 319−334. doi: 10.1104/pp.114.237891.
[36] Chauhan H, Khurana N, Agarwal P, et al. A seed preferential heat shock transcription factor from wheat provides abiotic stress tolerance and yield enhancement in transgenic Arabidopsis under heat stress environment[J]. PLoS ONE, 2013, 8(11): e79577. doi: 10.1371/journal.pone.0079577.
[37] Bian X H, Li W, Niu C F, et al. A class B heat shock factor selected for during soybean domestication contributes to salt tolerance by promoting flavonoid biosynthesis[J]. New Phytologist, 2020, 225(1): 268−283. doi: 10.1111/nph.16104.




 下载:
下载: