Purification and composition of heartwood pigment of Pterocarpus macrocarpus
-
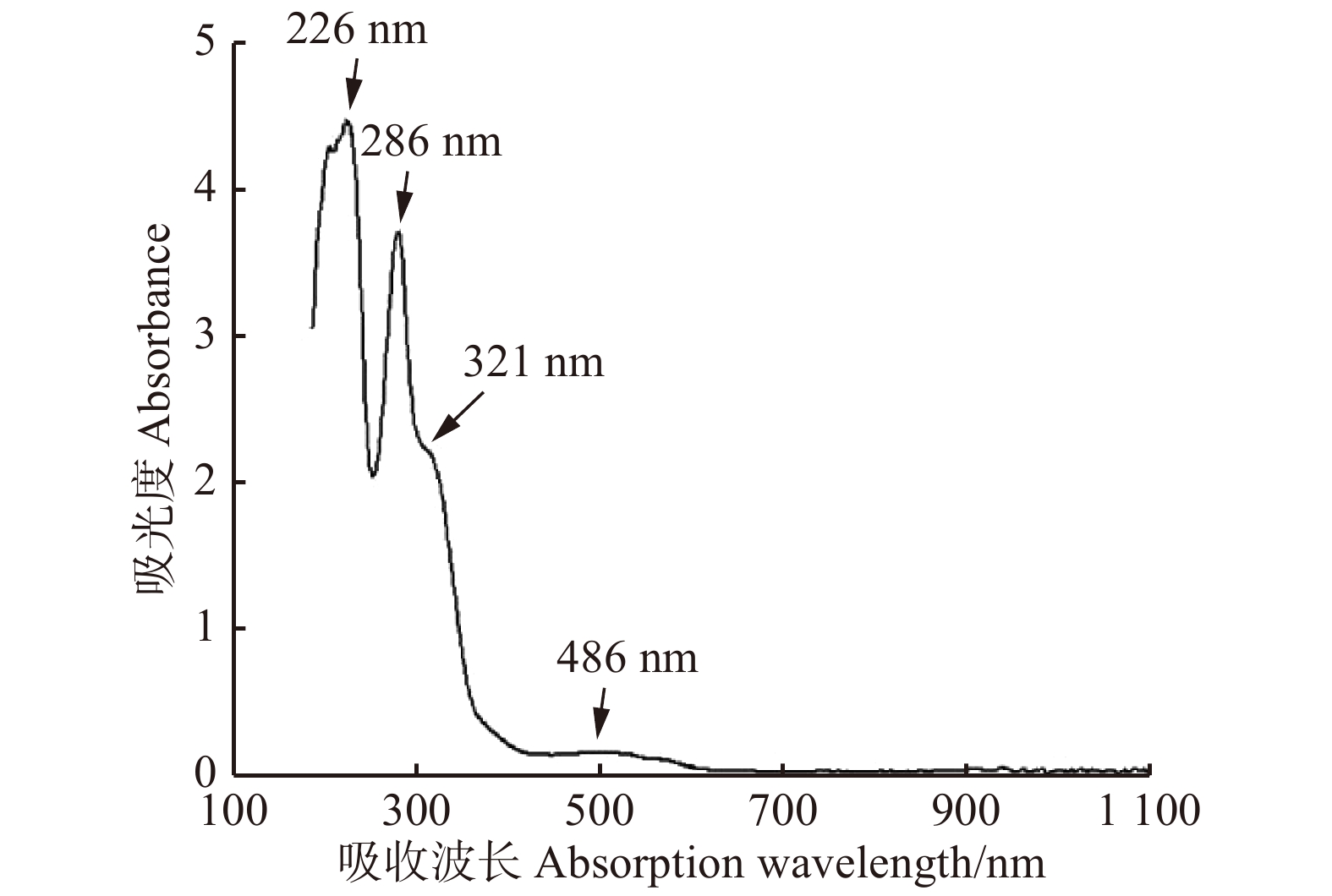
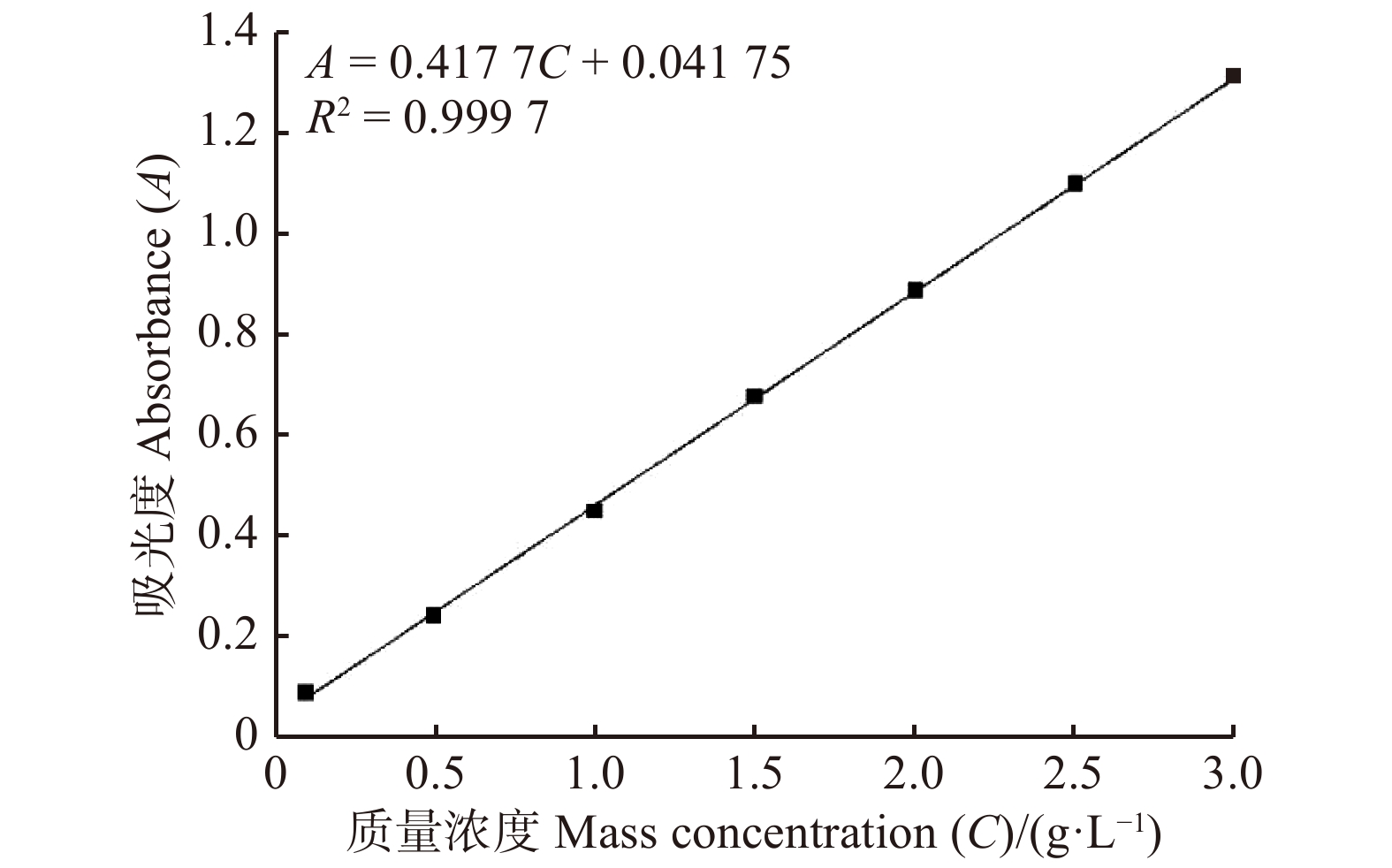
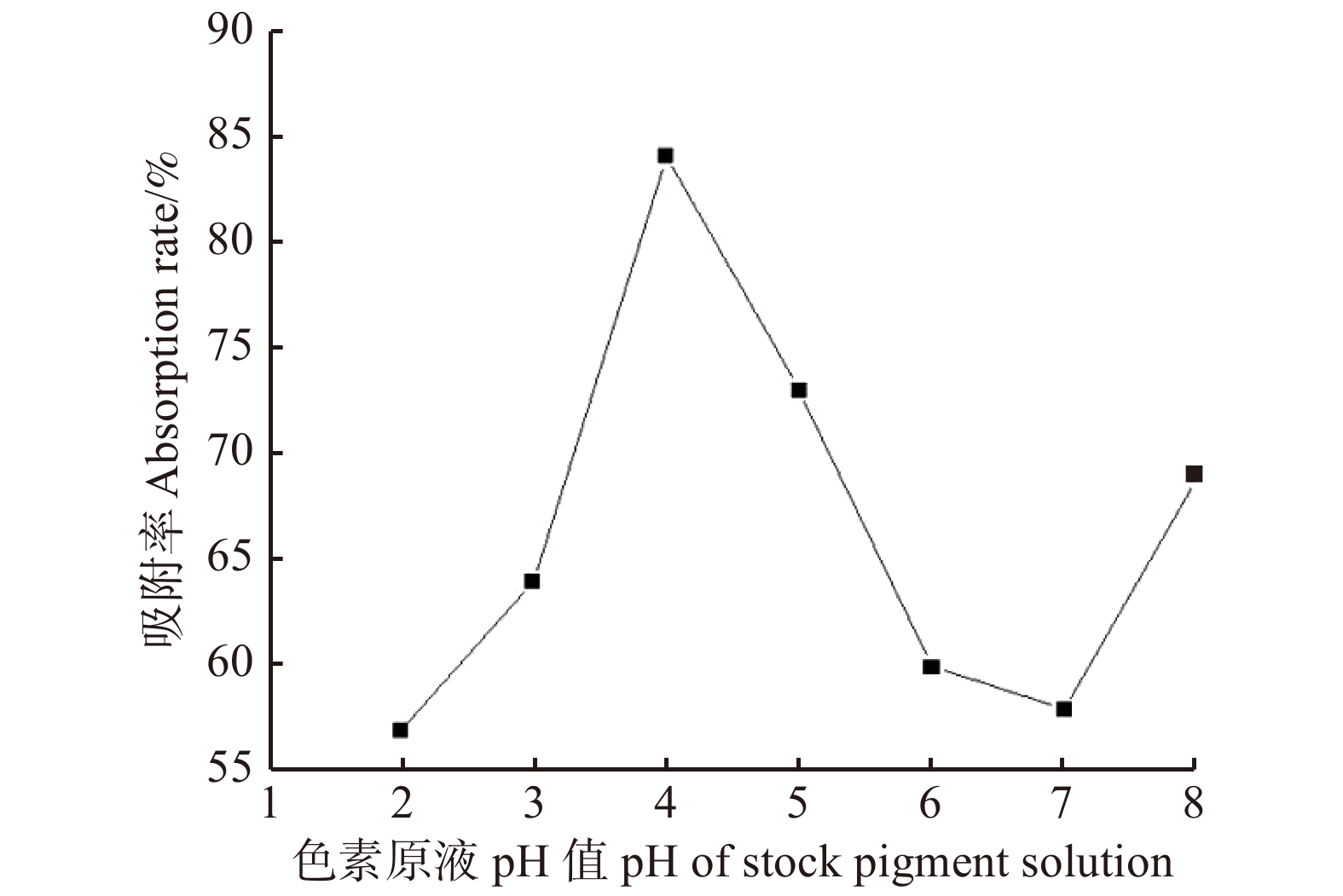
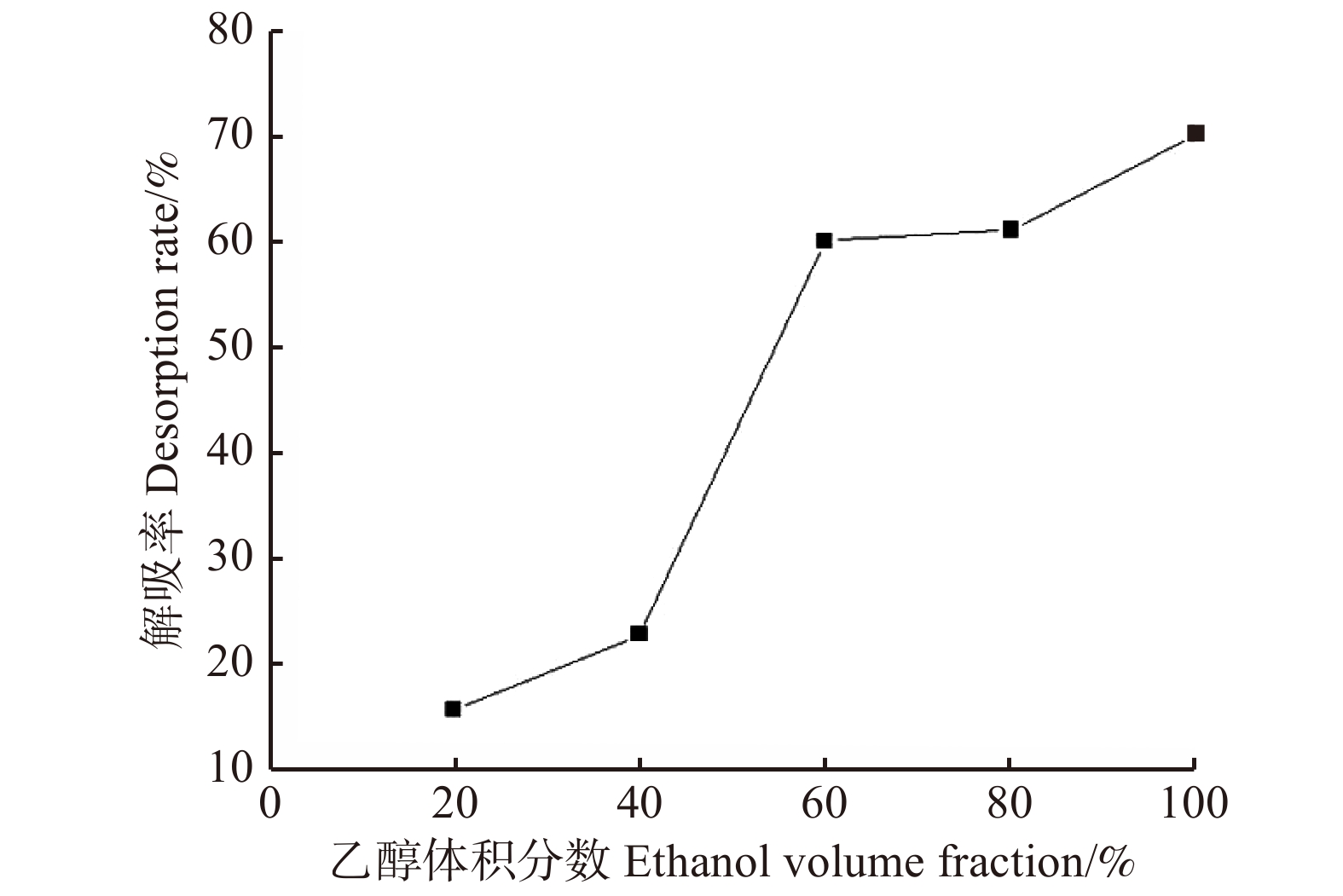
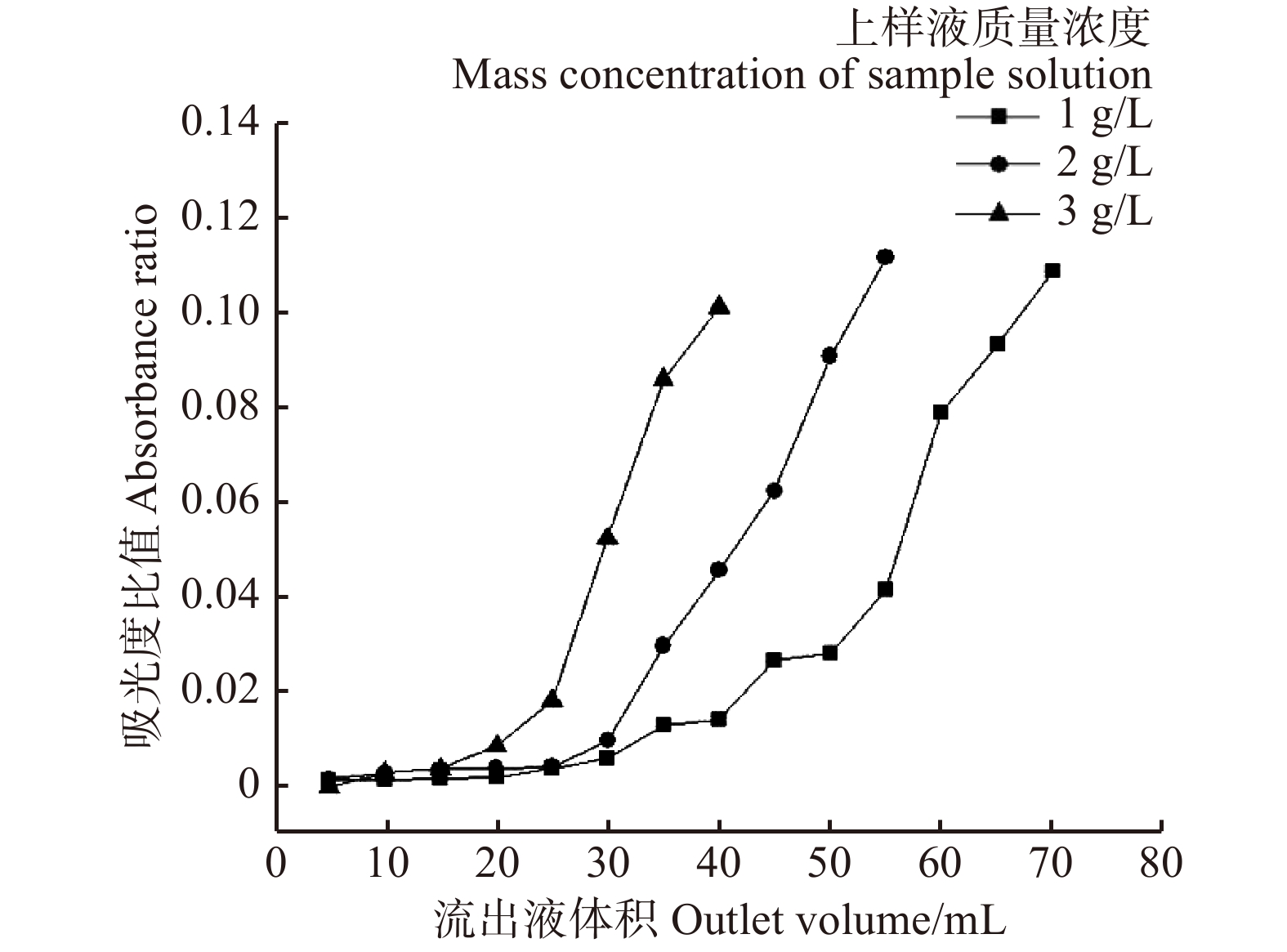
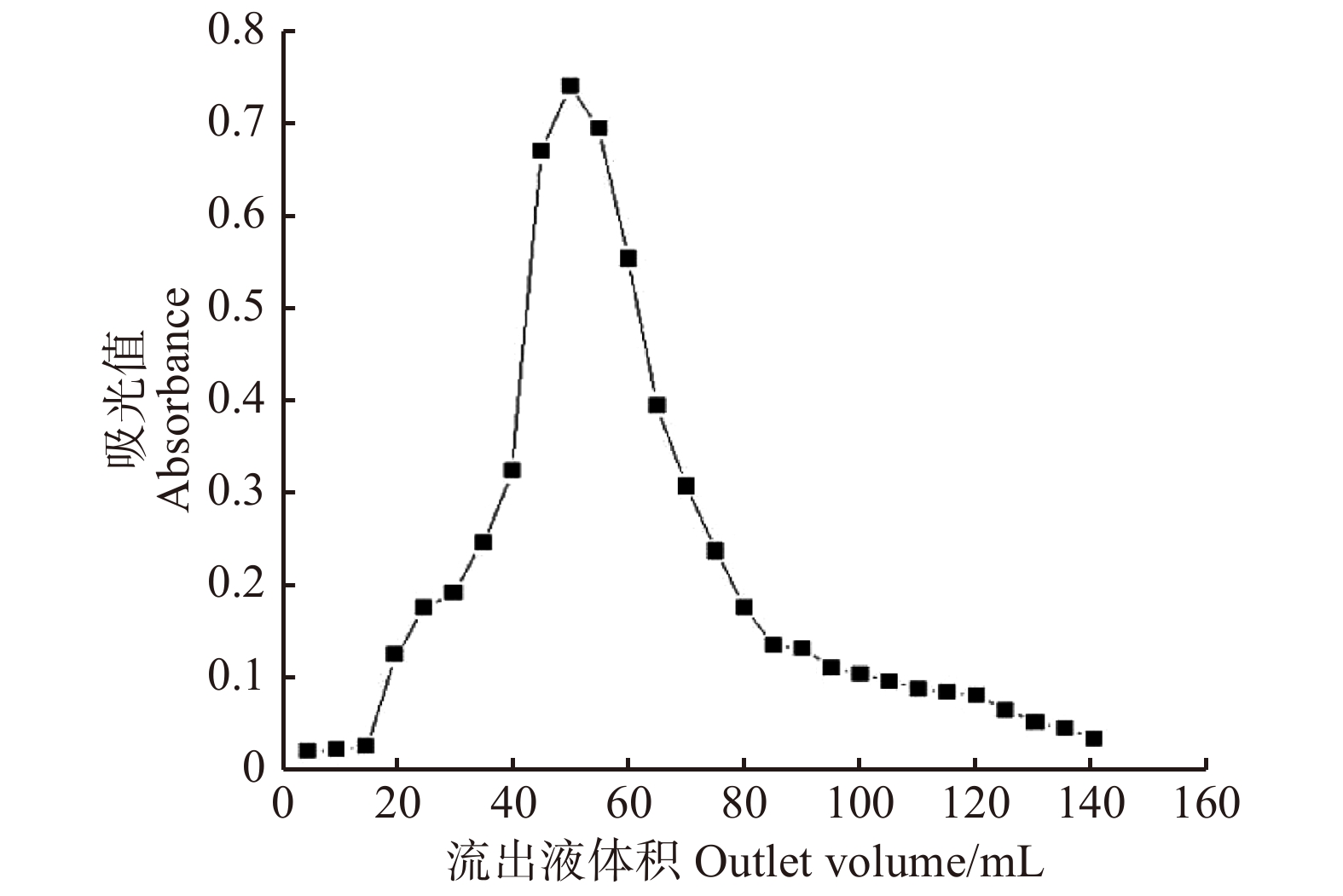
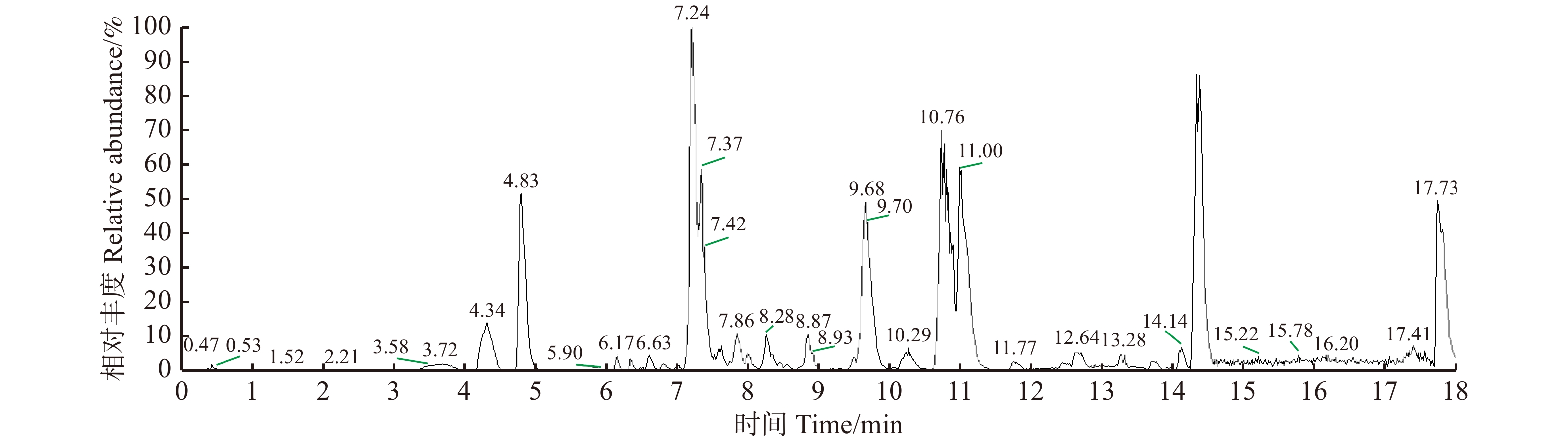
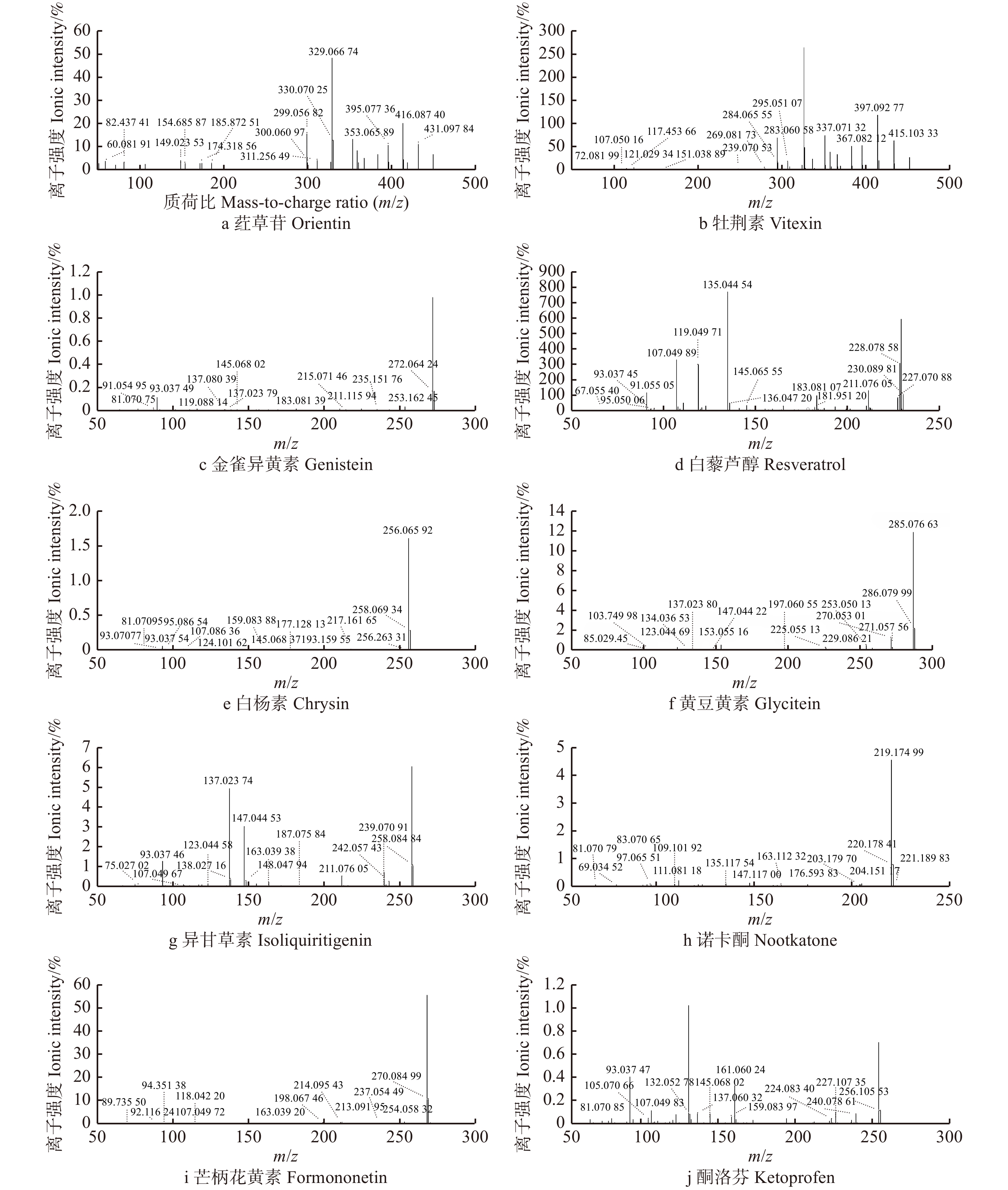
摘要:目的 研究大果紫檀心材色素的纯化工艺及成分,为其心材形成机理提供理论基础。方法 以大果紫檀心材为原料,使用7种溶剂抽提大果紫檀心材色素,测定波长并建立心材色素质量浓度的标准曲线。选用10种大孔树脂纯化心材色素, 分别测定吸附率、吸附量、解吸率和解吸量,确定吸附效果最佳的树脂。在DA-201树脂的动态吸附过程中,以色素质量浓度为指标探究不同因素的影响大小,确定最佳吸附条件。使用超高效液相色谱串联四极杆–静电场轨道阱高分辨质谱仪联用技术(UPLC-Q-EXCTIVE-MS)对纯化后的心材色素分离与鉴定。结果 选用乙醇作为提取溶剂,提取液的色差值为55.15。将486 nm作为测定波长,建立了标准曲线。大孔树脂DA-201的吸附–解吸值最佳,其吸附量和吸附率分别是10.07 g/L和80.19%,解吸量和解吸率分别是7.06 g/L和70.07%。在DA-201大孔树脂的静态吸附过程中,最佳条件为pH值4和洗脱剂乙醇浓度100%。在动态吸附过程中,最佳吸附条件分别为吸附流速2.0 mL/min,上样液质量浓度2 g/L;最佳解吸条件分别为洗脱流速1 mL/min,洗脱剂用量100 mL。对纯化后的心材色素分析,从中分离鉴定出10种黄酮类和醇类化合物,分别为荭草苷、牡荆素、金雀异黄素、白藜芦醇、白杨素、黄豆黄素、异甘草素、诺卡酮、芒柄花黄素和酮洛芬。结论 用DA-201型大孔吸附树脂纯化大果紫檀心材色素工艺稳定,获得了最佳吸附和解吸条件,同时确定了心材色素成分。Abstract:Objective In order to provide scientific basis for forming mechanism of Pterocarpus macrocarpus heartwood, we investigated the purification process of heartwood pigment and component identification.Method The pigment of Pterocarpus macrocarpus heartwood was extracted by 7 solvents. The wavelength was measured to established a standard curves of the heartwood pigment concentration. In the purification process of the heartwood pigment, absorption efficiency, absorption concentration, desorption efficiency and desorption concentration of 10 kinds of macroporous resins were measured to determine the resin with the best absorption effect. In the process of dynamic absorption and desorption, the mass concentration of pigment was used as an indicator to explore the influence of different factors on DA-201 macroporous resin, and then determine the best absorption process. UPLC-Q-EXCTIVE-MS was used to separate and identify the components of purified pigment.Result Ethanol was selected as the extraction solvent, and the chromatic aberration of solutions was 55.15. The 486 nm was used as the measurement wavelength to establish a standard curve. The optimum absorption conditions of DA-201 were as follows: static absorption concentration was 10.07 g/L, absorption rate was 80.19%. The optimum desorption conditions of DA-201 were as follows: static desorption concentration was 7.06 g/L, desorption rate was 70.07%. In the static absorption process of DA-201 macroporous resin, the optimum conditions were: pH value was 4, eluent ethanol concentration was 100%. In the dynamic absorption process of DA-201 macroporous resin, the optimal absorption conditions for pigment were: the absorption flow rate was 2.0 mL/min, the mass concentration of the sample solution was 2 g/L. The optimum conditions of desorption effect were: the elution flow rate was 1 mL/min and the eluent volume was 100 mL. UPLC-Q-EXCTIVE-MS was used to separate and identify 10 flavonoids and alcohol compounds from the purified pigment, which were orientin, vitexin, genistein, resveratrol, chrysin, glycitein, isoliquiritin, nocarone, formononetin, ketoprofen.Conclusion DA-201 macroporous resin can purify the pigment of Pterocarpus macrocarpus heartwood effectively, and the components of the pigment are determined simultaneously.
-
在当前全球气候不断变暖的背景下,中国气候发展趋势变化明显,其升温速度远远超过了同期的全球平均水平[1];作为由中纬度向高纬度过渡的地区,东北地区在过去50年中平均温度每10年增加0.3 ℃[2]。长白山位于我国东北温带季风气候区,其森林面积大,生境条件多样,且受到人为活动干扰少,是研究气候变化对森林生态系统影响的理想区域[3],近年来该地区生态环境受气候变化的影响被广泛关注[2]。
树木的生长和发育与气候因子紧密相关,它可以对环境变化和极端气候产生长期的响应并将其记录在年轮宽度信息之中[4-5]。树木年轮由于具有定年准确、分辨率高、连续性强、分布广泛、易于采样等特点[6],已成为研究气候变化对树木生长的影响和重建过去气候变化的关键资源[7-8]。近年来,已有大量研究运用树木年轮学从不同角度探讨长白山森林生长对全球气候变化的响应。例如:高露双等[9]通过研究阔叶红松(Pinus koraiensis) 林建群树种的生长−气候关系指出,不同树种的径向生长与气候因子之间的关系有所不同;王守乐等[10]研究了同一生境下不同树种对季节性气候的响应及其动态关系;于健等[11]研究了长白山地区群落交错带不同树种的径向生长对气候变暖的响应,但大部分研究仍集中于阔叶红松林中共存的两个树种与气候因子之间的关系,还缺乏对于云冷杉针阔混交林中多个共存树种径向生长对气候变化响应的研究。
汪清地区是长白山云冷杉针阔混交林的重要分布区,已有众多学者对该地区云冷杉针阔混交林进行研究,包括林分结构[12]、进界模型[13]、林下更新[14]等多个方面。为了解该地区云冷杉针阔混交林中不同树种对气候因子的响应特征及升温后气候因子对不同树种生长的影响。本研究以吉林汪清金沟岭林场云冷杉针阔混交林为研究对象,对臭冷杉(Abies nephrolepis)、鱼鳞云杉(Picea jezoensis)和红松3种常见树种进行采样,建立树木年轮宽度标准年表,分析其对气候因子的响应特征,探讨不同树种径向生长与气候因子的关系及升温对其生长的影响,为该地区树木的保护提供依据。
1. 研究区概况与研究方法
1.1 研究区概况
研究区位于吉林省延边汪清林业局金沟岭林场(43°17′ ~ 43°25′N、130°05′ ~ 130°20′E),属长白山系老爷岭山脉雪岭支脉,经营面积16 286 hm2。全场四面环山,以低山丘陵地貌为主,海拔500 ~ 1 200 m,坡度多在 5° ~ 25°。林区属温带大陆性季风气候,年均温4 ℃左右,年降水量600 ~ 700 mm。林区属低山灰化土灰棕壤区,母岩为玄武岩。研究区内的主要树种有臭冷杉、鱼鳞云杉、红松、红皮云杉(Picea koraiensis)、白桦(Betula platyphylla)、落叶松(Larix gmelinii)、枫桦(Betula costata)、紫椴(Tilia amurensis)、花楷槭(Acer ukurunduense)、色木槭(Acer mono)、青楷槭(Acer tegmentosum)、胡桃楸(Juglans mandshurica)、水曲柳(Fraxinus mandshurica)、黄檗(Phellodendron amurense)等;草本植物以苔草(Carex tristachya)和禾本科(Gramineae)为主。
1.2 样品的采集与处理
2019年8月在典型云冷杉天然林,海拔710 m,西北坡向,按照径级选取生长良好的臭冷杉、鱼鳞云杉和红松作为取样目标,利用口径为5.15 mm的树木生长锥在胸高(1.3 m)位置钻取年轮样芯(尽可能通过髓芯)。为减少对树木的损害,每株树仅钻取一根样芯。臭冷杉、鱼鳞云杉和红松分别钻取了65、25和55根样芯。将采集的样芯进行编号并记录每株树的生境信息。将样品带回实验室后,对年轮样芯进行风干和打磨等处理。打磨时用200目、400目、600目的砂纸依次打磨,直到年轮界限在显微镜下清晰可见。
1.3 建立年表
1.3.1 年表的制作方法
利用LINTABTM6.0年轮宽度测量仪(测量精度为0.001 mm)及配套的TSAP软件测量年轮宽度。利用 COFECHA 程序[15]对定年和测量结果进行检验,剔除与主序列相关性差以及难以交叉定年的样芯,将保留的样芯用于建立年表。为消除其他非气候因素导致的生长趋势,利用R语言“dplr”包中的ModNegExp方法对树轮宽度序列进行去趋势和标准化处理[16],建立3个树种标准年表。
1.3.2 标准年表统计参数
年轮宽度指数、信噪比、样本一阶自相关系数、样本间相关系数、平均敏感度、树木年轮的标准差、样本总体代表性等见文献。
(1)年轮宽度指数。在建立树木年轮宽度年表时,将树木年轮宽度序列用统计学方法进行曲线拟合,得到树木生长的期望值(Yi),树木年轮实际宽度值(Wi)与期望值(Yi)的比值为年轮宽度指数(Ii)。
Ii=WiYi (1) (2)信噪比。信噪比(signal-to-noise ratio,RSN)用于表示样本中所包含环境信息多少的统计量,其值为树木年表中气候信息与非气候噪声之比,若数值越大,则年表中包含的气候信息越多。
RSN=N¯rbt1−¯rbt (2) 式中:N代表样本数,
¯rbt 代表不同样芯间的平均相关系数。(3)平均敏感度。平均敏感度(mean sensitivity,SM)用于衡量年轮宽度的逐年变化,是无量纲值,其值越高,树木生长对气候变化越敏感,受到气候因子的限制作用越强。
SM=1n−1n−1∑i=1|2(xi+1−xi)xi+1+xi| (3) 式中:xi和xi + 1分别是第i个和第i + 1个年轮的宽度值;n为该树轮样本的年轮总数。
(4)样本总体代表性。样本总体代表性(expressed population signal,SEP)表示采集的树轮样本能够代表采样点森林总体生长趋势的百分比值,是决定采样是否成功的一项指标,其值越大,建立的树轮年表越具有理论年表的特征,采样工作越成功。
SEP=¯rbt¯rbt+(1−¯rbt)/N (4) 样本总体代表性的阈值通常设定为0.85[17]。
1.4 气象数据
从中国气象科学数据共享网(http://cdc.cma.gov.cn/home.do)获取距离采样点最近的汪清气象站(43°18′N、129°47′E,海拔244.8 m)的气象资料,时间为60年(1958—2018 年)。气象要素包含逐月的最低气温、最高气温、平均气温和总降水量。根据气象站内的降水量和温度数据使用R软件的“SPEI”包来计算标准化降水蒸散指数(standardized precipitation evapotranspiration index,SPEI)。利用 Mann-Kendall(M-K)方法[18]对年平均气温进行突变分析。
1.5 统计分析
利用Pearson相关分析分别对臭冷杉、鱼鳞云杉及红松的径向生长对逐月气候因子的响应进行分析。考虑到前一年气候的条件可能对树木当年径向生长存在影响[19],故选用上一年6月至当年9月的气候数据用于分析。为研究升温突变(1985年)后树木生长与气候关系的变化,对1985年升温前后主要气候因子与臭冷杉、鱼鳞云杉、红松径向生长的关系进行比较。利用滑动相关分析探讨径向生长与气候因子的动态关系,滑动窗口为32年。利用R软件计算各年表的参数,所有相关分析利用DendroClim2002程序[20]进行,使用Origin 2019软件绘制图表。
2. 结果与分析
2.1 气候因子变化特征分析
该区域具有雨热同期的规律,最低平均气温出现在1月(约−18 ℃),最高平均气温在7月(约6 ℃)。降水集中在5—9月,最大降水量在8月,10 月份开始降水逐渐减少,12月份降水量最低(图1)。
Mann-Kendall的检验结果为1978年后正常的统计值时间序列UFk > 0,表明近40年平均气温呈增加趋势,且1985年为年平均气温升高的突变点(图2)。1958—1985年年均气温为4 ℃,1986—2018年年均气温为4.65 ℃,比突变前增加了0.65 ℃。1958—1985年年均降水量为44.58 mm,1986—2018年年均降水量为47.51 mm,增温突变后的年均降水量大于突变前。1958—1985年期间,平均气温以0.01 ℃/a的速率上升,但变化趋势不显著,平均最低气温以0.04 ℃/a的速率显著上升,平均最高气温变化趋势不显著,降水量以0.44 mm/a的速率显著下降,标准化蒸散指数以0.01的速率显著下降。1986—2018年期间平均最低气温以0.03 ℃/a的速率显著下降,平均最高气温以0.04 ℃/a的速率显著上升,平均气温、降水量和标准化蒸散指数变化均不显著。总体而言,汪清地区在1958—2018年期间高温变高,低温变低,平均气温升高,降水量及干旱情况不变。
2.2 标准年表的统计特征
臭冷杉、鱼鳞云杉和红松年表整体变化趋势差异显著,特别是在1985年前后(图3)。1985年前臭冷杉年轮指数有明显下降趋势(−0.03 a−1,R2 = 0.77),鱼鳞云杉和红松年轮指数下降趋势较弱;1985年后臭冷杉年轮指数出现显著上升趋势(0.05 a−1,R2 = 0.89),鱼鳞云杉次之(0.04 a−1,R2 = 0.81),红松年轮指数上升趋势较弱。
如表1所示,3个树种年表序列长度的平均值为110年,其中红松年表的时间跨度最长,达120年(1898—2018年),臭冷杉、鱼鳞云杉年表时间跨度分别为118年(1900—2018年)、92年(1926—2018年)。平均敏感度(SM)为0.16 ~ 0.27,信噪比(RSN)为6.14 ~ 19.98,臭冷杉的值均为最大。3个树种的平均敏感度、信噪比等指标均较高,说明所建立的年表包含较多的气候信息,对气候变化敏感,适用于气候因子分析。一阶自相关系数为0.81 ~ 0.86,说明汪清地区臭冷杉、鱼鳞云杉、红松年轮受前一年气候因子影响较大。样本总体代表性(SEP)高达0.86 ~ 0.92,均超过了可接受的临界阈值,表明样本包含的信号基本代表当地的总体特征。3个树种相比,虽然臭冷杉标准年表的一阶自相关系数低于鱼鳞云杉,但其平均敏感度、标准差、信噪比、样本总体代表性均高于另外两个树种,说明臭冷杉更适用于气候研究。总体上,各项年表特征均表明,臭冷杉、鱼鳞云杉和红松年表均适用于树木年轮气候学分析。
表 1 标准年表的统计特征及公共区间分析Table 1. Statistical characteristics and common interval analysis of the standard chronology统计特征 Statistic characteristics 臭冷杉 Abies nephrolepis 鱼鳞云杉 Picea jezoensis 红松 Pinus koraiensis 时间跨度 Time span 1900—2018 1926—2018 1898—2018 平均值 Mean value 0.93 0.96 0.95 平均敏感度 Mean sensitivity (SM) 0.27 0.16 0.22 标准差 Standard deviation (SD) 0.40 0.38 0.30 一阶自相关系数 First-order autocorrelation coefficient (AC) 0.81 0.86 0.81 公共区间 Common interval 1969—2011 1969—2011 1959—2013 信噪比 Signal-to-noise ratio (RSN) 19.98 6.14 11.21 样本间相关系数 Correlation coefficient between samples (Rbar) 0.40 0.31 0.32 样本总体代表性 Sample population representativeness (SEP) 0.95 0.86 0.92 2.3 不同树种径向生长对气候因子的响应特征
由图4、5可知,臭冷杉、鱼鳞云杉和红松径向生长均与上年生长季末期(9月)平均气温及上年、当年7月最低气温呈显著正相关(P < 0.05);鱼鳞云杉和红松与降水、标准化降水蒸散指数(SPEI)无显著性关系(P > 0.05);臭冷杉和红松与生长季前期(4—5月)最高气温呈显著正相关(P < 0.05)。此外臭冷杉径向生长与当年7月和上年7月平均气温呈显著正相关(P < 0.05),与当年5月和上年11月降水、SPEI呈显著正相关(P < 0.05);鱼鳞云杉与上年6月平均气温呈显著正相关(P < 0.05),与当年5月最高气温呈显著正相关(P < 0.05)。这表明臭冷杉年表较鱼鳞云杉和红松年表对气候因子响应更加敏感。臭冷杉径向生长受到气温和降水的制约,而鱼鳞云杉和红松径向生长的主要限制因子为温度。
2.4 不同树种径向生长对升温的响应差异
由于汪清地区的气候因子(气温和降水量)在1985年前后具有明显差别(图1、2),因此分两个时间段(1985—1985年和1986—2018年)分别评估温度和降水量对3个树种生长的影响。由图6可知,1958—1985年,臭冷杉和红松与上年9月、当年6月降水量呈显著正相关(P < 0.05),鱼鳞云杉与上年8、9月降水量呈显著正相关(P < 0.05),各树种与平均气温均未达到显著性水平(P > 0.05)。1986—2018年,臭冷杉径向生长与当年4月和7月平均气温呈显著正相关(P < 0.05),鱼鳞云杉径向生长与平均气温均未达到显著水平(P > 0.05),红松径向生长与当年4月平均气温呈显著正相关(P < 0.05),各树种与降水量均未达到显著性水平(P > 0.05)。由此可见,升温突变前后臭冷杉、鱼鳞云杉和红松径向生长与气候因子相关性均发生改变,主要表现为升温突变后径向生长与气温相关性增强但是与降水量相关性减弱。
2.5 不同树种径向生长−气候关系的时间稳定性
由图7可知,上年6月和当年4、6月平均气温对臭冷杉径向生长的影响具有一定的长期稳定性。臭冷杉标准年表与上年9月、当年9月平均气温由显著负相关转为显著正相关,与当年6、7月平均气温由不显著相关转为显著正相关,说明夏季气温对臭冷杉生长的影响逐渐增强,秋季气温对臭冷杉径向生长由抑制作用转为促进作用。气温对红松的影响与臭冷杉和鱼鳞云杉相比,抑制作用较少。当年7月降水量与臭冷杉由显著负相关转为不显著相关,而与鱼鳞云杉和红松由不显著相关转为显著正相关。当年9月降水量对红松由促进作用变为抑制作用。上年6、7、12月和当年6、7、9月降水量对臭冷杉径向生长具有较明显的抑制作用,尤其是上年6月,显著相关关系持续时间长达11年(2005—2016)。
3. 讨 论
3.1 臭冷杉、鱼鳞云杉和红松径向生长−气候关系差异
研究结果表明:臭冷杉、鱼鳞云杉和红松径向生长与均与上年9月平均气温呈显著正相关,这主要因为树木的生长集中在6—9月,上年9月为上个生长季的末期,而当上个生长季结束时较高的温度有利于延长生长季,保证树木正常的代谢活动,使树木能够储存更多的营养物质以供下一个生长季开始时树木的生长,从而表现出促进作用[21]。3个树种径向生长均与当年7月最低气温呈显著正相关,这可能是因为研究区在7、8月降水集中,水分充足,有利于增强植物的蒸腾作用,促进叶片气孔开放和CO2吸收,在水分充足的条件下,生长季的温度升高有助于提高酶的活性,增加细胞生产速率,进而促进树木径向生长[22]。以上结果表明同一区域不同树种径向生长对气候的响应具有一定的相似性,与杨婧雯等[23]的研究结果一致,这可以解释为树木对区域气候信号的共同响应[24]。
本研究中,臭冷杉径向生长与生长季前期降水有较强相关性,生长季前期(当年5月)降水量的增加,不仅可以有效补充土壤水分,缓解生长季温度过高造成的水分不足,还可以促进细胞运输营养物质和合成蛋白质,从而促进宽轮的形成[25]。树木需要通过根系从土壤吸收足够的水分来维持自身生理活动,作为喜湿、耐荫、浅根性树种,臭冷杉的生长很容易受到水分胁迫[24],因此臭冷杉生长受温度和降水的共同影响。鱼鳞云杉径向生长与5月最高气温均呈显著正相关,可能是因为5月温度的升高不仅可以促进地面积雪的融化,温暖土壤和茎分生组织,使土壤早日解冻,还可以提高光合作用,增加细胞生产速率,进而促进早期树木的生长[26-27]。红松径向生长与当年4月最高气温呈显著正相关,春季树木结束休眠转入生长季,较高的生长季前期温度可以促进生长季提前开始,从而延长生长季,而适宜的温度可以促进树木形成层活动,因此生长季前期足够的热量有利于树木形成宽轮[24]。该地区不同树种的生长与气候因子之间的关系存在一定差异可能是受树种遗传特性的影响[28]。此外,韩艳刚等[29]对长白山关于径向生长−气候关系已发表的文献总结的结果也显示长白山地区不同树种对气候因子的响应有所不同,在川西高原[30]、大兴安岭[23]等地的研究同样表明不同树种对气候因子的响应有差异。
3.2 气候变暖对不同树种径向生长的影响
本研究结果显示:升温突变(1985年)后,臭冷杉、鱼鳞云杉和红松径向生长与气温的正相关性增加,即升温突变后3个树种径向生长对气温的敏感性增加,且其径向生长具有与气温升高相一致的趋势;这与Andreu等[24]研究发现的树木生长随着气温升高对气候的敏感性增加的结果一致,而与王守乐等[10]研究显示的树木径向对气候的敏感性降低的结果不同。目前,已有很多研究提出气候变暖对树木径向生长影响。树木的径向生长随着气候变暖可能出现加快[31]、降低[32]、及变化不明显[33]等多种情况。这也验证了气候变暖后树木径向生长对气候因子的响应存在差异。
此外,结果显示,气温升高有利于3个树种的径向生长,这与于健等[11]在位于1 125 m海拔的研究地得出的气候变暖抑制鱼鳞云杉生长的研究结果不同。通常情况下,海拔可以改变树木的生长速度,进而影响树木生长与气候的关系。Zhu等[34]研究表明鱼鳞云杉对气候变暖的响应存在海拔差异,快速升温加速了高海拔鱼鳞云杉的径向生长,而减少了低海拔鱼鳞云杉的径向生长。但是本研究在海拔低于于健等[11]研究的情况下气候变暖仍然促进树木径向生长,这可能是由于气温的阈值效应,树木生长之所以会出现对气候因子响应的敏感性变化主要是因为该效应,气温的升高满足了树木生长的下限阈值,而逐渐突破了树木生长所需要的上限阈值[35]。当气温高于树木生长的上限阈值后,会使其蒸发、蒸腾作用加剧,从而导致土壤水分有效性降低,此时水分可能变成限制因素,出现干旱胁迫现象[31]。目前升温可能未超过臭冷杉、鱼鳞云杉和红松径向生长的临界温度,且由于汪清地区降水量充足(图1),故升温并未对该地区云冷杉林造成干旱胁迫,进而表现出对其径向生长的促进作用。李波[13]在2017年对汪清地区云冷杉林的研究中同样发现该地区年均温促进树木的径向生长。即使目前汪清地区树木生长并未受到气温升高的抑制作用,但是随着未来气候的持续变暖,该地区树木生长对气候的响应仍需持续关注。
4. 结 论
本研究表明,相比较而言,臭冷杉标准年表统计参数值高于鱼鳞云杉和红松,其对气候变化的响应更敏感,更适用于树轮气候学的研究。长白山汪清地区臭冷杉、鱼鳞云杉和红松径向生长对于特定气候因子的响应有一致性,上年生长季末期(9月)平均气温及上年、当年7月最低气温促进3个树种径向生长。同时,该地区树木径向生长−气候因子之间的关系也有着显著的差异,臭冷杉生长受气温和降水的制约,鱼鳞云杉和红松生长的主要限制因子为温度。这可能主要是因为树种的生理特征以及种间遗传因素存在差异。1985年升温前树木径向生长有显著下降趋势,升温后则出现上升趋势。升温突变后,臭冷杉、鱼鳞云杉和红松与气温和降水的相关性变化存在明显差异,气温对树木径向生长的促进作用增加而降水的促进作用减弱。总体而言,目前气温的升高促进汪清地区云冷杉林常见树种的径向生长。
-
表 1 供试10种大孔吸附树脂的理化性质
Table 1 Physical and chemical characteristics of the 10 tested macro-porous absorption resins
树脂型号
Resin No.极性
Polarity骨架
Scaffold比表面积
Specific surface area/(m2·g−1)平均孔径
Mean pore size /nm粒径
Particle size /mm外观
AppearanceADS-17 非极性 Nonpolarity 苯乙烯型 Styrene type 90 ~ 150 25 ~ 30 0.32 ~ 0.25 白色球状 White orb D101 非极性 Nonpolarity 苯乙烯型 Styrene type 500 ~ 550 90 ~ 100 1.18 ~ 1.24 白色球状 White orb D3520 非极性 Nonpolarity 苯乙烯型 Styrene type 480 ~ 520 85 ~ 90 2.10 ~ 2.15 白色球状 White orb HPD100 非极性 Nonpolarity 苯乙烯型 Styrene type 650 ~ 700 80 ~ 90 1.20 ~ 1.24 白色球状 White orb X-5 非极性 Nonpolarity 苯乙烯型 Styrene type 500 ~ 600 29 ~ 30 1.20 ~ 1.24 白色球状 White orb AB-8 弱极性 Low-polarity 苯乙烯型 Styrene type 450 ~ 500 130 ~ 140 0.73 ~ 0.77 白色球状 White orb DA-201 弱极性 Low-polarity 苯乙烯型 Styrene type 150 ~ 200 23 ~ 25 0.75 ~ 0.85 白色球状 White orb HPD722 弱极性 Low-polarity 苯乙烯型 Styrene type 485 ~ 530 13 ~ 14 0.30 ~ 1.25 白色球状 White orb HC-200 弱极性 Low-polarity 苯乙烯型 Styrene type 150 ~ 260 45 ~ 75 0.40 ~ 0.90 白色球状 White orb HPD400 中极性 Semi-polarity 苯乙烯型 Styrene type 550 ~ 600 90 ~ 100 0.30 ~ 1.25 白色球状 White orb 表 2 样品流动相梯度洗脱条件
Table 2 Gradient elution conditions of mobile phase for samples
洗脱时间
Elution time/
min流速
Flow velocity/
(mL·min−1)流动相A
Mobile
phase A流动相B
Mobile
phase B0 0.3 90%CH2OH 10%CH3OH 2.0 0.3 90%CH2OH 10%CH3OH 20.0 0.3 10%CH2OH 90%CH3OH 22.0 0.3 10%CH2OH 90%CH3OH 22.1 0.3 90%CH2OH 10%CH3OH 26.0 0.3 90%CH2OH 10%CH3OH 表 3 不同溶剂对大果紫檀木粉提取后色差值的对比
Table 3 Comparison of color chromatic aberration of Pterocarpus macrocarpus powder with different solvents
溶剂
Solvent石油醚
Petroleum ether苯
Benzene乙酸乙酯
Ethyl acetate蒸馏水
Distilled water正丁醇
N-butanol甲醇
Methanol乙醇
Ethanol颜色
Color无色
Transparent color浅黄
Buff棕色
Brown深棕
Dark brown粉红
Pink红
Red红
Red色差值
Color chromatic aberration8.35 12.81 31.82 32.56 52.33 55.01 55.15 表 4 10种大孔吸附树脂对大果紫檀色素原液的静态吸附结果
Table 4 Static absorption of pigment stock solution in Pterocarpus macrocarpus by ten types of macroporous resins
型号
Model No.吸附量
Absorption
quantity/(g·L−1)吸附率
Absorption
rate/%解吸量
Desorption
quantity/(g·L−1)解吸率
Desorption
rate/%ADS-17 8.80 70.07 5.77 65.52 D101 8.04 64.05 5.65 70.26 D3520 8.64 68.84 5.79 67.01 HPD100 8.92 71.04 5.93 66.50 X-5 7.90 62.90 4.90 62.00 AB-8 7.86 62.54 5.15 65.56 DA-201 10.07 80.19 7.06 70.07 HPD722 7.56 60.17 5.55 73.47 HC-200 8.36 66.56 5.34 63.85 HPD400 8.04 64.02 5.44 67.61 表 5 大果紫檀心材色素中化学成分离子结构信息
Table 5 Characterization of chemical constituents in pigment from Pterocarpus macrocarpus heartwood
序号
No.保留时间
Retention
time/min分子式
Formula实测分子量
Measured
molecular mass理论分子量
Theoretical
molecular mass二级离子分子量
Molecular mass of
secondary ion化学成分
Chemical
component文献来源
Reference source1 4.714 C21H20O11 449.100 [M+H]+449.100 431.097
353.065 60.081荭草苷
OrientinZhou et al.[16] 2 5.071 C21H20O10 433.105 [M+H]+433.105 415.103
367.082 283.060牡荆素
VitexinPereira et al.[17] 3 6.065 C15H10O5 271.060 [M+H]+271.052 253.162
119.086金雀异黄素
GenisteinAngeloni et al.[18] 4 6.387 C14H12O3 229.070 [M+H]+229.078 145.065
119.049白藜芦醇
ResveratrolVlase et al.[19] 5 6.514 C15H10O4 255.065 [M+H]+255.057 177.128
159.083白杨黄素
Chrysin李伟等[20]
Li W et al.[20]6 6.825 C16H12O5 285.068 [M+H]+285.068 253.050
137.023黄豆黄素
GlyciteinWu et al.[21] 7 7.770 C15H12O4 257.081 [M+H]+257.073 147.044
137.023异甘草素
IsoliquiritigeninXie et al.[22]
马若克[23]
Ma R K[23]8 7.807 C15H22O 219.174 [M+H]+219.167 204.151
163.112 135.117诺卡酮
NootkatoneXie et al.[24] 9 7.864 C16H12O4 269.080 [M+H]+268.073 254.058
237.054芒柄花黄素
TaxifolinWu et al.[25] 10 9.947 C14H12O3 255.102 [M+H]+255.094 240.078
105.070酮洛芬
Ketoprofen李前荣等[26]
Li Q R et al.[26] -
[1] 翟东群, 姜笑梅, 殷亚方. 红木资源现状及变化趋势[J]. 木材工业, 2014, 28(2):26−30. doi: 10.3969/j.issn.1001-8654.2014.02.006. Zhai D Q, Jiang X M, Yin Y F. Status and trends of hongmu resources[J]. Wood Industry, 2014, 28(2): 26−30. doi: 10.3969/j.issn.1001-8654.2014.02.006.
[2] 刘小金, 徐大平, 杨曾奖, 等. 海南尖峰岭大果紫檀心材比例及精油成分组成[J]. 森林与环境学报, 2017, 37(2):241−245. Liu X J, Xu D P, Yang Z J, et al. Heartwood proportion and essential oil composition of Pterocarpus macrocarpus in Jianfeng Mountain, Hainan Island[J]. Journal of Forests and Environment, 2017, 37(2): 241−245.
[3] 张鹏, 卫燕霞, 刘炀, 等. 大果紫檀心材抽提物发色成分及其对颜色的影响[J]. 林产化学与工业, 2018, 38(5):77−84. doi: 10.3969/j.issn.0253-2417.2018.05.011. Zhang P, Wei Y X, Liu Y, et al. Extraction of chromogenic component from Pterocarpus macrocarpus Kurz heartwood and its effect on wood color[J]. Forest Products Chemistry and Industry, 2018, 38(5): 77−84. doi: 10.3969/j.issn.0253-2417.2018.05.011.
[4] 刘雨诗, 刘娟汝, 张存艳, 等. 微波萃取葛根总黄酮工艺及其抗氧化活性研究[J]. 时珍国医国药, 2020, 31(1):68−72. Liu Y S, Liu J R, Zhang C Y, et al. Microwave extraction technology of total flavonoids from radix puerarise and its antioxidant activity[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(1): 68−72.
[5] 朱续娜, 张耀丽, 王翔. 大果紫檀水浸液的荧光光谱研究[J]. 林业工程学报, 2017, 2(4):46−50. Zhu X N, Zhang Y L, Wang X. Fluorescence spectra of Pterocarpus macarocarpus Kurz aqueous extraction solution[J]. Journal of Forestry Engineering, 2017, 2(4): 46−50.
[6] 龙军, 李宁, 刘志高, 等. 大果紫檀超临界CO2萃取工艺的研究[J]. 江西农业学报, 2018, 30(6):88−91. Long J, Li N, Liu Z G, et al. Research on supercritical CO2 extraction technology of Pterocarpus macrocarpus[J]. Jiangxi Journal of Agriculture, 2018, 30(6): 88−91.
[7] 张玉超, 李娜, 乔东东, 等. D-101大孔树脂分离纯化葛根异黄酮的工艺探讨[J]. 西北农林科技大学学报(自然科学版), 2009, 37(11):161−167, 174. Zhang Y C, Li N, Qiao D D, et al. Discussion on technique for separation and purification of Radix puerarise isoflavonoids by D-101 macroporous resin[J]. Journal of Northwest A&F University (Natural Science Edition), 2009, 37(11): 161−167, 174.
[8] 宋国斌, 席国萍. 液液萃取和大孔吸附树脂纯化银杏外种皮黄酮类化合物的比较研究[J]. 化学与生物工程, 2011, 28(10):70−71. doi: 10.3969/j.issn.1672-5425.2011.10.018. Song G B, Xi G P. Comparative study on purification of flavonoids in the testa of Ginkgo bilobal by liquid-liquid extraction and macroporous adsorption resin[J]. Chemistry and Bioengineering, 2011, 28(10): 70−71. doi: 10.3969/j.issn.1672-5425.2011.10.018.
[9] 陈玉和, 陆仁书, 郑睿贤. 泡桐单板染色因素对色差的影响[J]. 木材工业, 2000(4):10−12. Chen Y H, Lu R S, Zheng R X. Effects of Paulownia veneer dyeing factors to the chromatism[J]. China Wood Industry, 2000(4): 10−12.
[10] 冯靖, 彭效明, 李翠清, 等. 大孔树脂纯化银杏叶中总黄酮的工艺研究[J]. 应用化工, 2019, 48(10):2339−2343,2349. doi: 10.3969/j.issn.1671-3206.2019.10.017. Feng J, Peng X M, Li C Q, et al. Purification of total flavonoids from ginkgo leaves by macroporous resin[J]. Applied chemical Industry, 2019, 48(10): 2339−2343,2349. doi: 10.3969/j.issn.1671-3206.2019.10.017.
[11] 赵昕. 黑胡萝卜中花色苷的提取、纯化及单体制备[D]. 烟台: 烟台大学, 2019. Zhao X. Extraction, purification and monomer preparation of anthocyanins from Daucus carota var. L.[D]. Yantai: Yantai University, 2019.
[12] 陈育全, 林毓嫱, 蒋文中, 等. 急性甲醇中毒致双眼失明1例[J]. 中华卫生应急电子杂志, 2020, 6(2):127−128. doi: 10.3877/cma.j.issn.2095-9133.2020.02.017. Chen Y Q, Lin Y Q, Jiang W Z, et al. A case of blindness caused by acute methanol poisoning[J]. Chinese Journal of Hygiene Rescue, 2020, 6(2): 127−128. doi: 10.3877/cma.j.issn.2095-9133.2020.02.017.
[13] 陈辉. 几种紫檀属木材内含物的比较研究[D]. 南京: 南京林业大学, 2015. Chen H. The conparison and research of several Pterocarpus wood extracts[D]. Nanjing: Nanjing Forestry University, 2015.
[14] 段宙位, 谢辉, 何艾, 等. 大孔树脂纯化菠萝蜜果皮黄酮工艺[J]. 食品工业科技, 2017, 38(13):186−190. Duan Z W, Xie H, He A, et al. Purification of flavonoids from jackfruit peel with macroporous resin[J]. Food Industry Science and Technology, 2017, 38(13): 186−190.
[15] 王静. 榛子壳棕色素提取、纯化及性质研究[D]. 哈尔滨: 东北林业大学, 2010. Wang J. Extraction, purification and characteristics of brown pigment from hazelnut shell[D]. Harbin: Northeast Forestry University, 2010.
[16] Zhou X, Peng J, Fan G, et al. Isolation and purification of flavonoid glycosides from Trollius ledebouri using high-speed counter-current chromatography by stepwise increasing the flow-rate of the mobile phase[J]. Journal of Chromatography A, 2005, 1092(2): 216−221. doi: 10.1016/j.chroma.2005.07.064.
[17] Pereira C A M, Yariwake J H, Mc Cullagh M. Distinction of the c-glycosylflavone isomer pairs orientin/isoorientin and vitexin/isovitexin using HPLC-MS exact mass measurement and in-source CID[J]. Phytochem Analysis, 2010, 16(5): 295−301.
[18] Angeloni S, Navarini L, Khamitova G, et al. A new analytical method for the simultaneous quantification of isoflavones and lignans in 25 green coffee samples by HPLC-MS/MS[J/OL]. Food Chemistry, 2020: 126924 [2020−09−30]. http://DOI:10.1016/j.foodchem.2020.126924." target="_blank">10.1016/j.foodchem.2020.126924">http://DOI:10.1016/j.foodchem.2020.126924.
[19] Vlase L, Kiss B, Leucuta S E, et al. A rapid method for determination of resveratrol in wines by HPLC-MS[J]. Journal of Liquid Chromatography and Related Technologies, 2009, 32(14): 2105−2121. doi: 10.1080/10826070903126989.
[20] 李伟, 冯育林, 黎田儿, 等. UPLC-Q-TOF/MS技术结合诊断离子方法快速分析连钱草中黄酮类化合物[J]. 质谱学报, 2016, 37(6):504−516. doi: 10.7538/zpxb.youxian.2016.0028. Li W, Feng Y L, Li T E, et al. Rapid analysis on flavonoids in Glechoma longituba (Nakai) kupr by UPLC-Q-TOF/MS couple with diagnostic Ions[J]. Chinese Journal of Mass Spectrometry, 2016, 37(6): 504−516. doi: 10.7538/zpxb.youxian.2016.0028.
[21] Wu Q, Wang M, Sciarappa W J, et al. LC/UV/ESI-MS analysis of isoflavones in edamame and tofu soybeans[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 2763−2769. doi: 10.1021/jf035053p.
[22] Xie J, Zhang Y, Wang W, et al. Identification and simultaneous determination of glycyrrhizin, formononetin, glycyrrhetinic acid, liquiritin, isoliquiritigenin, and licochalcone A in licorice by LC-MS/MS[J]. Acta Chromatographica, 2014, 26(3): 507−516. doi: 10.1556/AChrom.26.2014.3.9.
[23] 马若克. 降香黄檀叶抽提物主要化学成分研究[D]. 南宁: 广西大学, 2019. Ma R K. The main chemical composition of Dalbergia odorifera T. chen leaves extration[D]. Nanning: Guangxi University, 2019.
[24] Xie J, Sun B, Wang S, et al. Isolation and purification of nootkatone from the essential oil of fruits of Alpinia oxyphylla Miquel by high-speed counter-current chromatography[J]. Food Chemistry, 2009, 117(2): 375−380. doi: 10.1016/j.foodchem.2009.04.011
[25] Wu F L, Li P Y, Dong Q H, et al. Absorbed components analysis of Zhitong huazheng capsules in rat serum by UPLC-Q-TOF/MS[J]. China Journal of Chinese Materia Medica, 2018, 43(21): 4339−4346.
[26] 李前荣, 张福田, 尹浩. 酮洛芬β-环糊精包合物的化学电离–飞行时间质谱研究[J]. 质谱学报, 2004, 25(10):49−50. Li Q R, Zhang F T, Yin H. Study on inclusion complex of ketoprofen and β-cyclodextrin by chemical ionization-time of flight mass spectrometry[J]. Journal of Mass Spectrometry, 2004, 25(10): 49−50.
-
期刊类型引用(3)
1. 刘索名,王君杰,燕云飞,姜立春. 小兴安岭兴安落叶松人工林冠幅模型构建. 北京林业大学学报. 2023(05): 79-87 .  本站查看
本站查看
2. 李应涛,刘时良,孙海龙,王卫霞,向玮. 云冷杉针阔混交林单木枝下高和冠幅模型构建. 森林与环境学报. 2022(03): 289-296 .  百度学术
百度学术
3. 佟艺玟,陈东升,冯健,高慧淋. 基于线性分位数混合效应的辽东山区红松冠幅模型. 应用生态学报. 2022(09): 2321-2330 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: