Optimization of chromosome pretreatment method and its application in karyotype analysis of Paeonia × lemoinei ‘High Noon’
-
摘要:目的 染色体核型信息是植物遗传育种研究的重要基础。亚组间远缘杂交育种是现代牡丹育种的重要方向。牡丹组植物染色体形态相似度高,远缘杂种的核型分析需要大量高质量的染色体制片。预处理是影响染色体制片质量的关键环节,通过改良预处理方法,提高染色体制片质量和效率,对获得牡丹远缘杂种准确的核型数据、研究牡丹远缘杂交育种的遗传规律具有重要意义。方法 本研究以‘正午’牡丹幼嫩花蕾中的雌蕊为材料,量化分析了4 ℃条件下不同预处理液和预处理时间对染色体收缩程度和分散程度的影响,统计了不同预处理效果下核型数据的差异。结果 用对二氯苯饱和水溶液或对二氯苯-α-溴萘混合液进行预处理,均能取得良好的效果。在4 ℃下用对二氯苯饱和水溶液预处理36 ~ 72 h,或对二氯苯-α-溴萘混合液预处理24 ~ 48 h,可稳定获得大量收缩适度、分散良好的染色体制片。利用大量高质量的染色体制片获得了‘正午’牡丹更多的核型信息:其核型公式为2n = 2x = 10 = 8m(2SAT) + 2st(2SAT),随体位于第4、8、9、10号染色体短臂上,其中9、10号染色体上的随体比4、8号染色体上的随体更容易观察到。结论 通过改进预处理效果能有效提高‘正午’牡丹染色体制片质量和效率,获得更加丰富、准确的核型信息。本研究采用的量化方法能从染色体收缩程度和分散程度两个方面有效评价染色体制片质量,筛选出的预处理方法稳定、高效,为远缘杂种牡丹染色体核型分析和进一步遗传学研究奠定了良好的基础。Abstract:Objective Chromosome karyotype information is an important basis for plant genetics and breeding research. The inter-subsectional distant hybridization is a significant direction in modern tree peony breeding. Because of the high morphological similarity of chromosomes in Paeonia sect. Moutan, the karyotype analysis of distant hybrids requires a large number of high-quality chromosome preparations. Pretreatment is a key link affecting the quality of chromosome preparation. It is of great significance to obtain the accurate karyotype and study the genetic law of distant hybridization of tree peony by improving the quality and efficiency of chromosome preparation with the promoted pretreatment method.Method In this study, we used the pistils from the young flower buds of Paeonia × lemoinei ‘High Noon’ to quantify the influence of different pretreatment solutions and pretreatment time on the degree of chromosome contraction and dispersion at 4 ℃, and to analyze the differences of karyotype under diverse pretreatment effects.Result Pretreatment with p-dichlorobenzene or p-dichlorobenzene-α-bromonaphthalene could get excellent chromosome preparation. After being pretreated with p-dichlorobenzene for 36−72 h or p-dichlorobenzene-α-bromonaphthalene for 24−48 h at 4 °C, a large number of chromosomes with moderate contraction and good dispersion could be stably obtained. More karyotype information of P. × lemoinei ‘High Noon’ was obtained by a large number of high-quality chromosome preparations. The karyotype formula was 2n = 2x = 10 = 8m (2SAT) + 2st (2SAT), and the satellites were located on the short arm of chromosome 4, 8, 9 and 10, among which the satellites on the chromosome 9 and 10 were more easily observed than those on the chromosome 4 and 8.Conclusion Improving the pretreatment effect could effectively promote the quality and efficiency of chromosome preparation of P. × lemoinei ‘High Noon’, and obtain more abundant and accurate karyotype information. The quantitative method used in this study could effectively evaluate the quality of chromosome preparation from the two aspects of chromosome contraction and dispersion. The selected pretreatment method is stable and efficient, which lays a favorable foundation for karyotype analysis and further genetic research of distant hybrid of tree peony.
-
Keywords:
- Paeonia × lemoinei ‘High Noon’ /
- pretreatment /
- chromosome /
- karyotype analysis
-
牡丹(Paeonia section Moutan)为芍药科(Paeoniaceae)芍药属名贵的观赏和药用植物[1]。传统观赏牡丹(P. suffruticosa)具有1500多年的栽培历史,形态和分子证据显示,牡丹组革质花盘亚组内5个近缘种参与了其形成[2]。随着中国西南地区分布的滇牡丹(P. delavayi)被发现,20世纪初开始,肉质花盘亚组的远缘种参与到牡丹的杂交育种中,培育出了一系列花色新颖、花期长、适应性强的亚组间远缘杂交品种,这些品种也被称为“现代牡丹”[3],并被归入一个杂交种:P. × lemoinei [4]。牡丹组植物为二倍体,染色体基数为5,其革质花盘亚组种类的核型公式主要有2n = 2x = 6m + 2sm + 2st和2n = 2x = 8m + 2st,极少数为2n = 2x = 8m + 2sm[5-8];肉质花盘亚组的滇牡丹不同居群间核型呈现一定的差异,其核型公式通常有3种:2n = 2x = 10 = 6m + 2sm + 2st,2n = 2x = 10 = 7m + 1sm + 2st,2n = 2x = 10 = 5m + 2sm + 3st[9-12]。‘正午’牡丹(P. × lemoinei ‘High Noon’)是一个广为栽培的亚组间杂交品种,其母本为滇牡丹,父本为牡丹(P. suffruticosa)。这类杂种的染色体核型分析理论上应该把不同染色体组的染色体分开统计[13],但牡丹组植物染色体形态相似度高,通过常规的核型分析难以区分杂种中的不同染色体组,因此核型分析时至少需要将10条染色体分别统计[14]。然而由于牡丹大部分染色体形态相似,1 ~ 4号染色体通过相对长度和臂比不易准确识别,仅第5号染色体比其他染色体明显更短、臂比更大,需要染色体收缩适度、分散较好的足够数量染色体制片才能获得准确的染色体核型信息。
材料预处理是影响染色体制片质量的关键环节之一[15],牡丹染色体制片普遍用对二氯苯饱和水溶液预处理3 ~ 8 h [16-21],但在制片实践中经常存在染色体收缩不足、重叠严重以及重复性较差的问题,尤其是在大量进行染色体制片时质量很难得到保证。对二氯苯-α-溴萘混合液作用力强,可以在较短时间内使染色体明显缩短[13],许多学者认为其效果要优于对二氯苯和α-溴萘的单一溶液[15,22]。然而对二氯苯-α-溴萘混合液预处理8 ~ 12 h在‘正午’牡丹染色体制片中取得的效果仍然不理想[14],不足以准确研究这类亚组间杂种牡丹的染色体核型。稳定的预处理温度、适宜的预处理液成分和预处理时间,是获得理想预处理效果的主要因素[15]。因此,本论文以亚组间杂种牡丹‘正午’的幼嫩雌蕊为材料,研究4 ℃条件下预处理液成分和预处理时间对染色体收缩和分散程度的影响,以期进一步提高染色体制片质量,增强可重复性,为批量化获得高质量的牡丹染色体制片和更准确的牡丹染色体核型信息提供参考。
1. 材料与方法
选取北京林业大学鹫峰实验林场栽培的‘正午’牡丹成年植株,春季上午采集直径1 cm左右的花蕾,去掉外围组织,保留其幼嫩雌蕊。称取对二氯苯结晶20 g置于棕色试剂瓶中,加入45 ℃的蒸馏水500 mL,振摇约2 min,室温静置过夜后,获得对二氯苯饱和水溶液。在500 mL对二氯苯饱和水溶液中加入2滴α-溴萘并充分振摇,静置后即为对二氯苯-α-溴萘混合液[15]。分别用对二氯苯饱和水溶液和对二氯苯-α-溴萘混合液在4 ℃条件下预处理,预处理12、24、36、48、60、72 h后的材料分别用Carnoy氏固定液(无水乙醇∶冰醋酸 = 3∶1)在4 ℃条件下固定24 h,而后转入到70%的乙醇中−20 ℃保存备用。取幼嫩心皮用蒸馏水冲洗干净,而后放入1 mol/L HCl中,在60 ℃水浴条件下解离10 min,蒸馏水冲洗干净后用卡宝品红染色5 min,并用压片法制片[15],Leica DM500光学显微镜下观察并拍照。
每个处理选取10个拍照清晰的细胞,按照染色体长度和臂比将每个细胞中的10条染色体依次单独编号[14]。用制图软件CAD量取9号和10号染色体的长度,以两者之和评价该细胞中的染色体收缩程度;统计每个细胞的10条染色体中与其他染色体完全不重叠的条数,用以评价该细胞中的染色体分散程度。核型分析时选取10张染色体清晰、收缩程度相近的照片,量取每条染色体的长短臂,按李懋学和陈瑞阳[23]的标准进行核型数据统计。有关数据用EXCEL和SPSS软件进行计算和统计分析。
2. 结果与分析
2.1 预处理方法对染色体收缩的影响
预处理液和预处理时间对染色体收缩程度都有影响。单独用对二氯苯饱和水溶液预处理12 h后染色体长度为15.03 μm,36 h开始显著缩短到10.75 μm,36 ~ 72 h染色体长度没有显著变化,平均长度保持在11 μm左右。用对二氯苯-α-溴萘混合液预处理12 h后染色体长度为13.55 μm,24 h就开始显著缩短到11 μm左右,之后不再明显变化,与单独用对二氯苯预处理时达到的长度接近(图1,表1)。
表 1 不同预处理液和预处理时间对染色体收缩程度的影响Table 1. Effects of different pretreatment solutions and pretreatment time on chromosome contraction预处理时间
Pretreatment time/h染色体长度 (平均值 ± 标准差)
Chromosome length (mean ± SD)/μm对二氯苯
p-dichlorobenzene对二氯苯-α-溴萘
p-dichlorobenzene-α-bromonaphthalene12 15.03 ± 1.94a 13.55 ± 2.02a 24* 14.49 ± 2.05a 10.86 ± 1.15b 36 10.75 ± 1.12b 11.05 ± 0.96b 48 11.44 ± 1.21b 11.85 ± 1.30b 60 11.43 ± 1.64b 10.82 ± 0.90b 72 10.53 ± 0.84b 10.96 ± 1.67b 注:染色体长度测量的是‘正午’牡丹第9号和10号两条染色体长度的总和;同一列中不同小写字母表示使用该预处理液处理不同时间后染色体长度差异显著(P < 0.05);*表示使用两种预处理液处理24 h的染色体长度差异显著(P < 0.05)。Notes: chromosome length represents the sum of the length of No. 9 chromosome and No. 10 chromosome of P. × lemoinei ‘High Noon’; different lowercase letters in the same column mean significant differences in chromosome length after treatment with the pretreatment solution for different time (P < 0.05); * means significant difference in chromosome length between the two pretreatment solutions for 24 h (P < 0.05). 对二氯苯预处理36 ~ 72 h或对二氯苯-α-溴萘预处理24 ~ 72 h均可以使染色体充分收缩(表1)。预处理液中添加α-溴萘有加快染色体收缩进程的作用。
2.2 预处理方法对染色体分散的影响
对二氯苯饱和水溶液预处理12 h后完全未重叠的染色体仅为3.3条,24 h时为4.6条,与12 h相比无明显差异,36 h后开始显著上升到7.6条,72 h时继续显著上升,达到9.5条。对二氯苯-α-溴萘混合液预处理12 h后未重叠染色体为4.9条,24 h后显著上升至7.0条,36 ~ 72 h不再有显著变化,但60 ~ 72 h略有下降至6条左右,与12 h相比无显著差异(图1,表2)。
表 2 不同预处理液和预处理时间对染色体分散程度的影响Table 2. Effects of different pretreatment solutions and pretreatment time on chromosome dispersion预处理时间
Pretreatment time/h染色体未重叠条数(平均值 ± 标准差)
Number of chromosomes without overlap
(mean ± SD)对二氯苯
p-dichlorobenzene对二氯苯-α-溴萘
p-dichlorobenzene-α-bromonaphthalene12 3.3 ± 2.05a 4.9 ± 2.21a 24* 4.6 ± 2.01a 7.0 ± 1.79b 36 7.6 ± 1.80b 8.1 ± 1.45b 48 7.5 ± 1.43b 7.0 ± 1.90b 60* 8.2 ± 1.78bc 6.1 ± 1.97ab 72* 9.5 ± 1.02c 5.9 ± 2.74ab 注:同一列中不同小写字母表示使用该预处理液处理不同时间后染色体分散程度差异显著(P < 0.05);*表示使用两种预处理液处理24、60和72 h的染色体分散程度差异显著(P < 0.05)。Notes: different lowercase letters in the same column mean significant differences in chromosome dispersion after treatment with the pretreatment solution for different time (P < 0.05); * means significant differences in chromosome dispersion between the two pretreatment solutions for 24, 60 and 72 h (P < 0.05). 对二氯苯预处理36 ~ 72 h和对二氯苯-α-溴萘预处理24 ~ 48 h均可以得到较好的分散效果,可以满足染色体制片的需要(表2)。用对二氯苯单独预处理时,没有明显的毒害作用;而对二氯苯-α-溴萘混合液预处理时,随着处理时间的延长,染色体分散程度呈先上升之后略有回落的趋势,时间过长会使染色体发生粘连,影响分散效果。
![]() 图 1 不同预处理方法对‘正午’牡丹染色体制片的影响1. 对二氯苯预处理;2. 对二氯苯-α-溴萘预处理;a ~ f. 预处理时间分别为12、24、36、48、60和72 h。1, pretreatment solution is p-dichlorobenzene; 2, pretreatment solution is p-dichlorobenzene-α-bromonaphthalene;a−f, pretreatment time is 12, 24, 36, 48, 60 and 72 h.Figure 1. Effects of different pretreatment methods on chromosome preparation of P. × lemoinei ‘High Noon’
图 1 不同预处理方法对‘正午’牡丹染色体制片的影响1. 对二氯苯预处理;2. 对二氯苯-α-溴萘预处理;a ~ f. 预处理时间分别为12、24、36、48、60和72 h。1, pretreatment solution is p-dichlorobenzene; 2, pretreatment solution is p-dichlorobenzene-α-bromonaphthalene;a−f, pretreatment time is 12, 24, 36, 48, 60 and 72 h.Figure 1. Effects of different pretreatment methods on chromosome preparation of P. × lemoinei ‘High Noon’2.3 染色体制片效果对核型数据的影响
将上述处理的染色体制片依据染色体收缩程度差异显著性分析结果(表1)分成A和B两组,A组:染色体收缩程度较低(表1中标a的处理),分散效果也较差(表2),对应的预处理方法为对二氯苯预处理12、24 h与对二氯苯-α-溴萘预处理12 h;B组:染色体收缩程度较高(表1中标b的处理),分散效果较好(表2),对应的预处理方法为对二氯苯预处理36 ~ 72 h与对二氯苯-α-溴萘预处理24 ~ 72 h,每组分别选取10个清晰细胞进行核型分析。两组数据得到的核型公式均为2n = 2x = 10 = 8m(2SAT) + 2st(2SAT),其中B组染色体标本核型数据的标准差比A组略小(表3,表4),说明其数据分布比较集中,较高收缩程度的染色体制片有利于获得较准确的核型数据。
表 3 A组染色体标本核型数据(平均值 ± 标准差)Table 3. Karyotype parameters of group A chromosome sample (mean ± SD)染色体序号
Chromosome No.相对长度
Relative length/%臂比
Arm ratio染色体类型
Chromosome type1 12.04 ± 0.42 1.33 ± 0.12 m 2 11.36 ± 0.39 1.15 ± 0.13 m 3 11.02 ± 0.38 1.15 ± 0.13 m 4 10.57 ± 0.31 1.50 ± 0.09 m* 5 10.24 ± 0.25 1.35 ± 0.08 m 6 10.02 ± 0.20 1.24 ± 0.11 m 7 9.68 ± 0.34 1.28 ± 0.10 m 8 8.83 ± 0.60 1.61 ± 0.09 m* 9 8.38 ± 0.61 4.13 ± 0.27 st* 10 7.87 ± 0.30 3.73 ± 0.27 st* 注:m. 具中部着丝粒染色体;st. 具近端部着丝粒染色体;*. 随体染色体,随体长度未计算在染色体长度内;下同。Notes: m, chromosome with median region; st, chromosome with subterminal region; *, sat-chromosome, the length of satellite is not included; the same below. 表 4 B组染色体标本核型数据(平均值 ± 标准差)Table 4. Karyotype parameters of group B chromosome sample (mean ± SD)染色体序号
Chromosome No.相对长度
Relative length/%臂比
Arm ratio染色体类型
Chromosome type1 11.91 ± 0.43 1.45 ± 0.10 m 2 11.17 ± 0.31 1.19 ± 0.09 m 3 10.91 ± 0.25 1.14 ± 0.07 m 4 10.67 ± 0.26 1.46 ± 0.11 m* 5 10.27 ± 0.19 1.36 ± 0.11 m 6 10.06 ± 0.19 1.20 ± 0.11 m 7 9.73 ± 0.24 1.41 ± 0.10 m 8 8.92 ± 0.46 1.67 ± 0.07 m* 9 8.63 ± 0.55 3.89 ± 0.13 st* 10 7.74 ± 0.39 3.44 ± 0.15 st* 2.4 不同预处理效果对随体染色体识别的影响
在观察的375个有丝分裂中期细胞中,有随体染色体出现的细胞有47个,占比为12.53%。其中染色体收缩程度较低的A组染色体制片中,随体染色体细胞占比为25.37%,染色体收缩程度较高的B组染色体制片中,随体染色体细胞占比仅为9.74%(表5)。由此可见,染色体收缩程度较高的细胞更不容易观察到随体。
表 5 观察到随体染色体的细胞比例Table 5. Proportion of cell observed satellite chromosomes项目
Item观察到随体的细胞数
Number of observed satellite cell1个随体
1 satellite2个随体
2 satellites3个随体
3 satellites观察的有丝分裂中期细胞总数
Number of observed
metaphase cell随体细胞所占比率
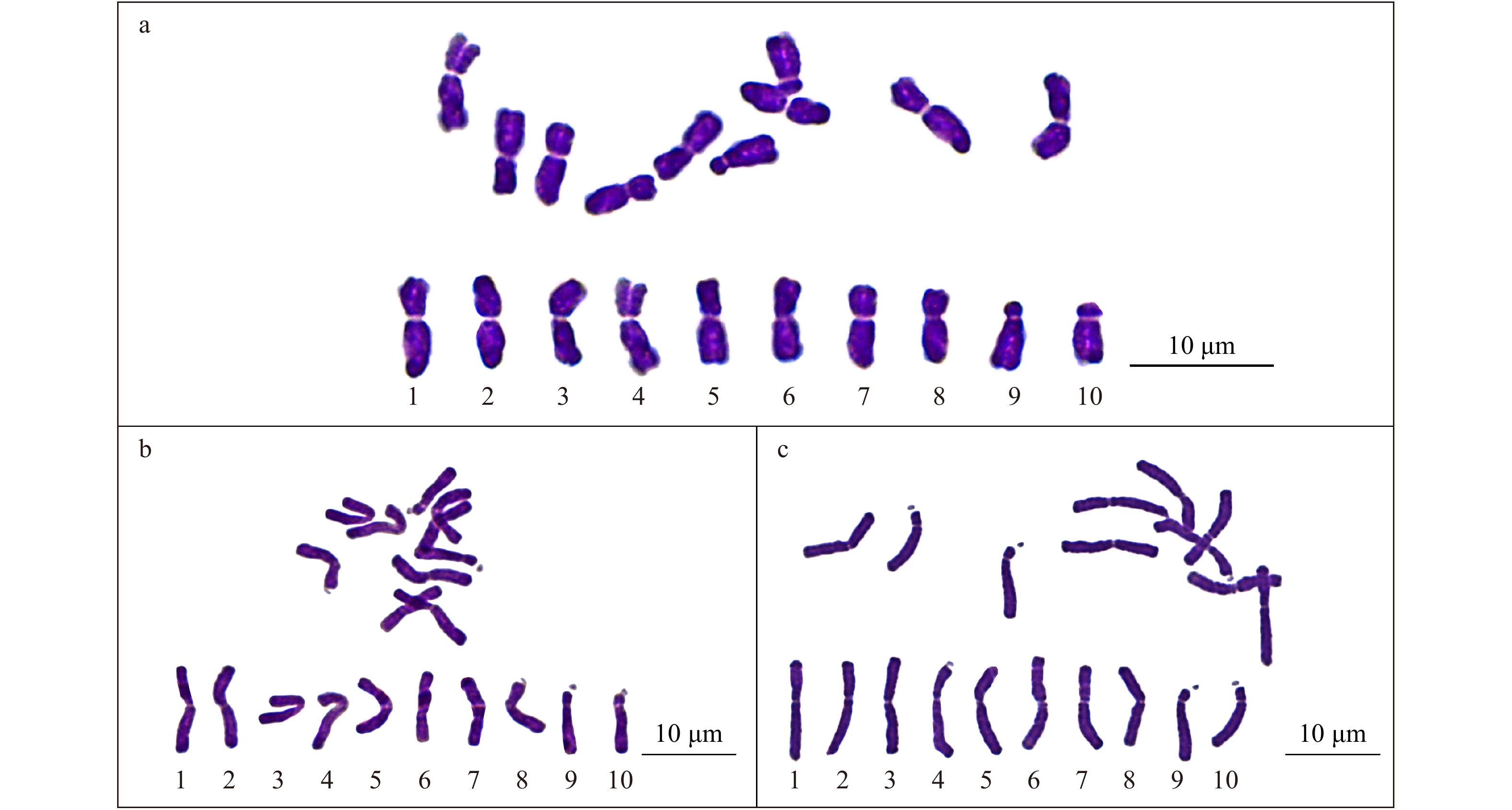
Proportion of satellite cell/%合计 Total 47 24 21 2 375 12.53 A组 Group A 17 9 8 0 67 25.37 B组 Group B 30 15 13 2 308 9.74 在‘正午’牡丹10条染色体中,分别在第4、8、9、10号染色体的短臂上观察到随体(图2)。观察到随体的细胞中,同时观察到的随体个数绝大部分是1 ~ 2个,极少数为3个(表5)。其中在9号和10号染色体上的随体更容易被观察到,4号和8号染色体上的随体不容易观察到(表6)。
![]() 图 2 ‘正午’牡丹中期染色体及核型a. 对二氯苯预处理72 h;b. 对二氯苯-α-溴萘预处理24 h;c. 对二氯苯-α-溴萘预处理36 h。a, p-dichlorobenzene pretreated for 72 h; b, p-dichlorobenzene-α-bromonaphthalene pretreated for 24 h; c, p-dichlorobenzene-α-bromonaphthalene pretreated for 36 h.Figure 2. Metaphase chromosomes and karyotype of P. × lemoinei ‘High Noon’表 6 不同随体染色体被观察到的次数Table 6. Number of different satellite chromosomes observed
图 2 ‘正午’牡丹中期染色体及核型a. 对二氯苯预处理72 h;b. 对二氯苯-α-溴萘预处理24 h;c. 对二氯苯-α-溴萘预处理36 h。a, p-dichlorobenzene pretreated for 72 h; b, p-dichlorobenzene-α-bromonaphthalene pretreated for 24 h; c, p-dichlorobenzene-α-bromonaphthalene pretreated for 36 h.Figure 2. Metaphase chromosomes and karyotype of P. × lemoinei ‘High Noon’表 6 不同随体染色体被观察到的次数Table 6. Number of different satellite chromosomes observed项目
Item观察到的随体染色体总数
Number of observed satellite chromosome4号染色体
No.4 chromosome8号染色体
No.8 chromosome9号染色体
No.9 chromosome10号染色体
No.10 chromosome合计 Total 72 3 3 32 34 A组 Group A 25 2 2 11 10 B组 Group B 47 1 1 21 24 3. 讨论与结论
3.1 预处理方法的改进
对二氯苯价廉而易得,配制及使用方便,适用范围广,使染色体更易分散[22],经常被单独用来做预处理药品。α-溴萘饱和水溶液作用比较缓和,对染色体缩短效果缓慢,单独作为预处理液应用并不广泛,通常仅用于禾本科和水生植物染色体的预处理[15,22]。而对二氯苯-α-溴萘混合液作用力强,可以在较短时间内使染色体明显缩短[13],其效果优于二者的单一溶液[15,22],但其对细胞的毒害较大,处理温度过高或时间延长,易导致染色体粘连、聚缩以至最终使染色体液化[13]。在本研究中,两种预处理液都对染色体收缩和分散有很好的效果,而对二氯苯和α-溴萘混合使用可以加快染色体收缩进程。但对二氯苯-α-溴萘处理到60 ~ 72 h,染色体分散程度略有下降,而对二氯苯处理到72 h时并没有观察到明显的染色体粘连现象。对二氯苯预处理36 ~ 72 h或对二氯苯-α-溴萘预处理24 ~ 72 h,染色体可充分收缩;对二氯苯预处理36 ~ 72 h或对二氯苯-α-溴萘预处理24 ~ 48 h,染色体分散效果较好。综合考虑染色体收缩程度和分散效果,可以选择对二氯苯预处理36 ~ 72 h,或对二氯苯-α-溴萘混合液处理24 ~ 48 h。
与绝大部分牡丹染色体制片方法中采用3 ~ 8 h的预处理相比[5-8,10-12,16-19],本研究筛选出的适宜预处理时间要长得多,这可能与本研究采用的4 ℃条件有密切关系。牡丹染色体制片的文献中预处理温度绝大多数没有标明[5,7-8,11,16,19],或采用较高的温度(室温[12,18,20-21]或10 ~ 20 ℃[10,17])。其他植物染色体制片的文献中,预处理温度有些没有详细标明[24-31],一些采用较高温度(室温[12]或10 ~ 20 ℃[32-33]),一些采用较低温度(0 ~ 7 ℃)[27,34-37]。预处理温度较低时,药品的毒害作用会相对较弱,相应延长处理时间,可以得到更好的染色体预处理效果[22]。本研究采用的预处理温度为4 ℃,虽然所需预处理时间较长,但经过预处理的染色体收缩和分散良好,避免了较高温度下预处理容易出现的过度收缩或严重粘连的现象[15]。4 ℃的预处理温度使用普通的冰箱即可实现,相较于室温等其他温度条件而言,温度更稳定可控,处理效果的可重复性也较好。
3.2 染色体制片质量的量化评价方法
在其他植物预处理方法对染色体制片影响的研究中,绝大部分使用的量化评价指标是有丝分裂指数和有丝分裂中期指数[26,30,32,36],衡量的是预处理对积累细胞中期分裂相的作用,而对于染色体形态的评价则多以照片和描述为主[25-27,29-30,32],没有量化指标来评价染色体收缩和分散的程度。本研究采用染色体长度和染色体未重叠数两个指标评价染色体制片质量,量化了染色体收缩和分散的程度,通过数据统计分析衡量了不同预处理方法处理效果的差异(表1、表2),使制片质量的评价更加客观准确,也为不同研究之间的比较提供了可能,为牡丹染色体制片质量的评价提供了一种可借鉴的新方法。
3.3 ‘正午’牡丹核型数据结果差异分析
本研究得到的‘正午’牡丹核型公式与之前研究的结果(2n = 2x = 10 = 7m + 1sm + 2st(1SAT))[14]有较明显的不同。差异主要体现在:(1)8号染色体的臂比:本研究为1.61和1.67,而之前的研究结果为1.71;(2)随体染色体数量:本研究为4条,之前的研究结果为1条。两次研究的预处理方法不同,染色体收缩及分散的效果也有差异。本实验两种制片效果获取的核型数据,其相对长度和臂比均略有差异。其中染色体收缩程度较高的标本中,大部分染色体相对长度和臂比的标准差比收缩程度较低的标本略小,说明提高染色体的收缩和分散程度,可以提高核型数据的准确性。此外,本研究用于核型分析的染色体标本由原来的5个增加到10个,可能也在一定程度上影响了获得的核型数据。本研究通过改进染色体制片质量,获得大量染色体制片,也观察到了更多的随体染色体,为更准确地识别染色体提供了依据。
3.4 ‘正午’牡丹染色体随体的特点
牡丹染色体浓缩程度及制片技术的差异,导致随体的识别与观察比较困难,观察到的随体数目和位置并不稳定;再加上种及品种或居群间差异较大,通常难以作为核型分析的稳定特征[38]。太白山紫斑牡丹(P. rockii)最多见到6个随体[5],但也有研究未观察到随体[6];杨山牡丹(P. ostii)最多也观察到6个随体,其中第2、5对染色体短臂上成对出现,第1、4对染色体短臂上成单出现[8];矮牡丹(P. jishanensis)、卵叶牡丹(P. qiui)、四川牡丹(P. decomposita)野生种的第5对染色体上均观察到随体,大部分种的第4对染色体也有随体存在[7]。滇牡丹不同居群中最多观察到6个随体[12],而有的居群中未观察到随体[11]。大花黄牡丹(P. ludlowii)染色体的短臂和长臂上均观察到随体,随体位置和随体染色体数量在不同居群间也有差异[39]。
在本研究中,‘正午’牡丹的第4、8、9、10号染色体的短臂上观察到随体,较之前的研究新发现了3条(第4、8、9号)随体染色体[14]。其中第9、10号染色体(对应野生牡丹的第5对染色体)上更容易观察到随体,第4、8号染色体的随体不易观察到。研究表明,浓缩程度较高的染色体更不容易观察到随体,浓缩程度较低的染色体上更容易看到随体(表5),可见预处理效果对随体的观察具有重要影响。即便如此,不同收缩程度的染色体标本均极难通过少量制片观察到全部随体染色体(表6)。因此,牡丹染色体核型分析中随体染色体的观察可能需要使用大量不同收缩程度的染色体标本共同完成。
-
图 1 不同预处理方法对‘正午’牡丹染色体制片的影响
1. 对二氯苯预处理;2. 对二氯苯-α-溴萘预处理;a ~ f. 预处理时间分别为12、24、36、48、60和72 h。1, pretreatment solution is p-dichlorobenzene; 2, pretreatment solution is p-dichlorobenzene-α-bromonaphthalene;a−f, pretreatment time is 12, 24, 36, 48, 60 and 72 h.
Figure 1. Effects of different pretreatment methods on chromosome preparation of P. × lemoinei ‘High Noon’
图 2 ‘正午’牡丹中期染色体及核型
a. 对二氯苯预处理72 h;b. 对二氯苯-α-溴萘预处理24 h;c. 对二氯苯-α-溴萘预处理36 h。a, p-dichlorobenzene pretreated for 72 h; b, p-dichlorobenzene-α-bromonaphthalene pretreated for 24 h; c, p-dichlorobenzene-α-bromonaphthalene pretreated for 36 h.
Figure 2. Metaphase chromosomes and karyotype of P. × lemoinei ‘High Noon’
表 1 不同预处理液和预处理时间对染色体收缩程度的影响
Table 1 Effects of different pretreatment solutions and pretreatment time on chromosome contraction
预处理时间
Pretreatment time/h染色体长度 (平均值 ± 标准差)
Chromosome length (mean ± SD)/μm对二氯苯
p-dichlorobenzene对二氯苯-α-溴萘
p-dichlorobenzene-α-bromonaphthalene12 15.03 ± 1.94a 13.55 ± 2.02a 24* 14.49 ± 2.05a 10.86 ± 1.15b 36 10.75 ± 1.12b 11.05 ± 0.96b 48 11.44 ± 1.21b 11.85 ± 1.30b 60 11.43 ± 1.64b 10.82 ± 0.90b 72 10.53 ± 0.84b 10.96 ± 1.67b 注:染色体长度测量的是‘正午’牡丹第9号和10号两条染色体长度的总和;同一列中不同小写字母表示使用该预处理液处理不同时间后染色体长度差异显著(P < 0.05);*表示使用两种预处理液处理24 h的染色体长度差异显著(P < 0.05)。Notes: chromosome length represents the sum of the length of No. 9 chromosome and No. 10 chromosome of P. × lemoinei ‘High Noon’; different lowercase letters in the same column mean significant differences in chromosome length after treatment with the pretreatment solution for different time (P < 0.05); * means significant difference in chromosome length between the two pretreatment solutions for 24 h (P < 0.05). 表 2 不同预处理液和预处理时间对染色体分散程度的影响
Table 2 Effects of different pretreatment solutions and pretreatment time on chromosome dispersion
预处理时间
Pretreatment time/h染色体未重叠条数(平均值 ± 标准差)
Number of chromosomes without overlap
(mean ± SD)对二氯苯
p-dichlorobenzene对二氯苯-α-溴萘
p-dichlorobenzene-α-bromonaphthalene12 3.3 ± 2.05a 4.9 ± 2.21a 24* 4.6 ± 2.01a 7.0 ± 1.79b 36 7.6 ± 1.80b 8.1 ± 1.45b 48 7.5 ± 1.43b 7.0 ± 1.90b 60* 8.2 ± 1.78bc 6.1 ± 1.97ab 72* 9.5 ± 1.02c 5.9 ± 2.74ab 注:同一列中不同小写字母表示使用该预处理液处理不同时间后染色体分散程度差异显著(P < 0.05);*表示使用两种预处理液处理24、60和72 h的染色体分散程度差异显著(P < 0.05)。Notes: different lowercase letters in the same column mean significant differences in chromosome dispersion after treatment with the pretreatment solution for different time (P < 0.05); * means significant differences in chromosome dispersion between the two pretreatment solutions for 24, 60 and 72 h (P < 0.05). 表 3 A组染色体标本核型数据(平均值 ± 标准差)
Table 3 Karyotype parameters of group A chromosome sample (mean ± SD)
染色体序号
Chromosome No.相对长度
Relative length/%臂比
Arm ratio染色体类型
Chromosome type1 12.04 ± 0.42 1.33 ± 0.12 m 2 11.36 ± 0.39 1.15 ± 0.13 m 3 11.02 ± 0.38 1.15 ± 0.13 m 4 10.57 ± 0.31 1.50 ± 0.09 m* 5 10.24 ± 0.25 1.35 ± 0.08 m 6 10.02 ± 0.20 1.24 ± 0.11 m 7 9.68 ± 0.34 1.28 ± 0.10 m 8 8.83 ± 0.60 1.61 ± 0.09 m* 9 8.38 ± 0.61 4.13 ± 0.27 st* 10 7.87 ± 0.30 3.73 ± 0.27 st* 注:m. 具中部着丝粒染色体;st. 具近端部着丝粒染色体;*. 随体染色体,随体长度未计算在染色体长度内;下同。Notes: m, chromosome with median region; st, chromosome with subterminal region; *, sat-chromosome, the length of satellite is not included; the same below. 表 4 B组染色体标本核型数据(平均值 ± 标准差)
Table 4 Karyotype parameters of group B chromosome sample (mean ± SD)
染色体序号
Chromosome No.相对长度
Relative length/%臂比
Arm ratio染色体类型
Chromosome type1 11.91 ± 0.43 1.45 ± 0.10 m 2 11.17 ± 0.31 1.19 ± 0.09 m 3 10.91 ± 0.25 1.14 ± 0.07 m 4 10.67 ± 0.26 1.46 ± 0.11 m* 5 10.27 ± 0.19 1.36 ± 0.11 m 6 10.06 ± 0.19 1.20 ± 0.11 m 7 9.73 ± 0.24 1.41 ± 0.10 m 8 8.92 ± 0.46 1.67 ± 0.07 m* 9 8.63 ± 0.55 3.89 ± 0.13 st* 10 7.74 ± 0.39 3.44 ± 0.15 st* 表 5 观察到随体染色体的细胞比例
Table 5 Proportion of cell observed satellite chromosomes
项目
Item观察到随体的细胞数
Number of observed satellite cell1个随体
1 satellite2个随体
2 satellites3个随体
3 satellites观察的有丝分裂中期细胞总数
Number of observed
metaphase cell随体细胞所占比率
Proportion of satellite cell/%合计 Total 47 24 21 2 375 12.53 A组 Group A 17 9 8 0 67 25.37 B组 Group B 30 15 13 2 308 9.74 表 6 不同随体染色体被观察到的次数
Table 6 Number of different satellite chromosomes observed
项目
Item观察到的随体染色体总数
Number of observed satellite chromosome4号染色体
No.4 chromosome8号染色体
No.8 chromosome9号染色体
No.9 chromosome10号染色体
No.10 chromosome合计 Total 72 3 3 32 34 A组 Group A 25 2 2 11 10 B组 Group B 47 1 1 21 24 -
[1] 李嘉珏, 张西方, 赵孝庆, 等. 中国牡丹[M]. 北京: 中国大百科全书出版社, 2011. Li J J, Zhang X F, Zhao X Q, et al. Tree peony of China[M]. Beijing: Encyclopedia of China Publishing House, 2011.
[2] Zhou S L, Zou X H, Zhou Z Q, et al. Multiple species of wild tree peonies gave rise to the ‘king of flowers’, Paeonia suffruticosa Andrews[J]. Proceedings of the Royal Society B: Biological Sciences, 2014, 281: 20141687. doi: 10.1098/rspb.2014.1687
[3] Cheng F Y. Advances in the breeding of tree peonies and a cultivar system for the cultivar group[J]. International Journal of Plant Breeding, 2007, 1(2): 89−104.
[4] Hong D Y. Peonies of the world: taxonomy and phytogeography[M]. London: Kew Publishing, 2010.
[5] 洪德元, 张志宪, 朱相云. 芍药属的研究(1):国产几个野生种核型的报道[J]. 植物分类学报, 1988, 26(1):33−43. Hong D Y, Zhang Z X, Zhu X Y. Studies on the genus Paeonia(1): report of karyotypes of some wild species in China[J]. Acta Phytotaxonomica Sinica, 1988, 26(1): 33−43.
[6] 于兆英, 李思锋, 周俊彦. 珍稀植物—紫斑牡丹和矮牡丹核型分析[J]. 西北植物学报, 1987, 7(1):12−16. doi: 10.3321/j.issn:1000-4025.1987.01.003 Yu Z Y, Li S F, Zhou J Y. Karyotype analysis of Paeonia suffruticosa var. papaveracea and P. suffruticosa var. spontanea[J]. Acta Botanica Boreali-Occidentalia Sinica, 1987, 7(1): 12−16. doi: 10.3321/j.issn:1000-4025.1987.01.003
[7] 裴颜龙. 牡丹复合体的研究[D]. 北京: 中国科学院植物研究所, 1993. Pei Y L. Studies on the Paeonia suffruticosa Andr. complex[D]. Beijing: Institute of Botany, the Chinese Academy of Sciences, 1993.
[8] 张赞平, 侯小改. 杨山牡丹的核型分析[J]. 遗传, 1996, 18(5):3−6. Zhang Z P, Hou X G. Karyotype analysis of Paeonia ostii[J]. Hereditas, 1996, 18(5): 3−6.
[9] 李思锋, 于兆英, 周俊彦. 黄牡丹的核型分析[J]. 武汉植物学研究, 1989, 7(2):107−111. Li S F, Yu Z Y, Zhou J Y. Karyotype analysis of Paeonia delavayi var. lutea[J]. Journal of Wuhan Botanical Research, 1989, 7(2): 107−111.
[10] 肖调江, 龚洵, 夏丽芳, 等. 滇牡丹复合群的Giemsa C-带比较研究[J]. 云南植物研究, 1997, 19(4):67−73. Xiao T J, Gong X, Xia L F, et al. C banding patterns in Paeonia delavayi complex of genus Paeonia[J]. Acta Botanica Yunnanica, 1997, 19(4): 67−73.
[11] 龚洵, 顾志建, 武全安. 黄牡丹七个居群的细胞学研究[J]. 云南植物研究, 1991, 13(4):402−410. Gong X, Gu Z J, Wu Q A. A cytological study of seven populations in Paeonia delavayi var. lutea[J]. Acta Botanica Yunnanica, 1991, 13(4): 402−410.
[12] 杨涤清, 朱燮桴. 草芍药、野牡丹和黄牡丹的核型研究[J]. 云南植物研究, 1989, 11(2):139−144. Yang D Q, Zhu X F. Karyotypic studies of Paeonia obovata, P. delavayi and P. delavayi var. lutea[J]. Acta Botanica Yunnanica, 1989, 11(2): 139−144.
[13] 李懋学, 张赞平. 作物染色体及其研究技术[M]. 北京: 中国农业出版社, 1996. Li M X, Zhang Z P. Crop chromosomes and the research techniques[M]. Beijing: China Agriculture Press, 1996.
[14] 钟原, 杜明杰, 刘羽心, 等. ‘正午’牡丹核型分析及减数分裂的染色体行为观察[J]. 北京林业大学学报, 2019, 41(10):68−73. Zhong Y, Du M J, Liu Y X, et al. The karyotype analysis and meiotic chromosome behavior observation on Paeonia × lemoinei ‘High Noon’[J]. Journal of Beijing Forestry University, 2019, 41(10): 68−73.
[15] 尤瑞麟. 植物学实验技术教程[M]. 北京: 北京大学出版社, 2008. You R L. Textbook of botany experiment[M]. Beijing: Peking University Press, 2008.
[16] 侯小改, 郭大龙, 张亚冰, 等. 部分牡丹品种的染色体核型分析[J]. 河南科技大学学报(自然科学版), 2012, 33(5):83−87. Hou X G, Guo D L, Zhang Y B, et al. Chromosome karyotype analysis of partial cultivars in tree peony[J]. Journal of Henan University of Science and Technology: Natural Science, 2012, 33(5): 83−87.
[17] 李懋学. 对二氯苯在植物染色体预处理中的应用[J]. 遗传, 1980, 2(6):30−32. Li M X. Application of p-dichlorobenzene in pretreatment for plant chromosomes[J]. Hereditas, 1980, 2(6): 30−32.
[18] 王莲英, 刘淑敏, 秦魁杰, 等. 牡丹及其栽培品系种的染色体组型[J]. 北京林学院学报, 1983, 5(1):63−70. Wang L Y, Liu S M, Qin K J, et al. Karyotypes of the tree peony (Paeonia suffruticosa) and its cultivars[J]. Journal of Beijing Forestry College, 1983, 5(1): 63−70.
[19] 张赞平, 张益民. 栽培牡丹的染色体数目和核型变异[J]. 河南农业大学学报, 1989, 23(1):48−52. Zhang Z P, Zhang Y M. The variation of chromosome numbers and karyotypes in cultivated Paeonia suffruticosa[J]. Acta Agriculturae Universitatis Henanensis, 1989, 23(1): 48−52.
[20] 李懋学, 张斅方. 三倍体牡丹的细胞遗传学观察[J]. 遗传, 1982, 4(5):19−21. doi: 10.3321/j.issn:0253-9772.1982.05.009 Li M X, Zhang X F. A cytogenetic observation on triploid Paeonia suffruticosa[J]. Hereditas, 1982, 4(5): 19−21. doi: 10.3321/j.issn:0253-9772.1982.05.009
[21] 刘淑敏, 王莲英, 秦魁杰, 等. 牡丹三倍体品种——首案红[J]. 北京林学院学报, 1983,5(4):62−67. Liu S M, Wang L Y, Qin K J, et al. ‘Shou An Hong’, a triploid cultivar of tree peony (Paeonia suffruticosa)[J]. Journal of Beijing Forestry College, 1983,5(4): 62−67.
[22] 李懋学, 张敩方. 植物染色体研究技术[M]. 哈尔滨: 东北林业大学出版社, 1991. Li M X, Zhang X F. The research technique of plant chromosome[M]. Harbin: Northeast Forestry University Press, 1991.
[23] 李懋学, 陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究, 1985, 3(4):297−302. Li M X, Chen R Y. A suggestion on the standardizaton of karyotype analysis in plants[J]. Journal of Wuhan Botanical Research, 1985, 3(4): 297−302.
[24] 任艳蕊, 刘传斌, 李晓峰. 单瓣和重瓣花中国水仙的核型比较[J]. 河北农业大学学报, 2010, 33(2):9−12. doi: 10.3969/j.issn.1000-1573.2010.02.003 Ren Y R, Liu C B, Li X F. Comparison of karyotype between univalve Chinese narcissus and multiple-valve Chinese narcissus[J]. Journal of Agricultural University of Hebei, 2010, 33(2): 9−12. doi: 10.3969/j.issn.1000-1573.2010.02.003
[25] 刘思汝, 林彦, 罗建中. 不同预处理方法对柠檬桉染色体制片技术的影响[J]. 桉树科技, 2015, 32(4):27−31. doi: 10.3969/j.issn.1674-3172.2015.04.006 Liu S R, Lin Y, Luo J Z. Effect of different pretreatment methods of Corymbia citriodora chromosome technology[J]. Eucalypt Science & Technology, 2015, 32(4): 27−31. doi: 10.3969/j.issn.1674-3172.2015.04.006
[26] 任艳, 王辉, 石延茂, 等. 不同预处理对花生根尖细胞有丝分裂制片的影响[J]. 花生学报, 2008, 37(2):28−31. doi: 10.3969/j.issn.1002-4093.2008.02.007 Ren Y, Wang H, Shi Y M, et al. Effects of pretreatment on mitosis of root tip cells in peanut[J]. Journal of Peanut Science, 2008, 37(2): 28−31. doi: 10.3969/j.issn.1002-4093.2008.02.007
[27] 杨垚, 张艳, 党江波, 等. 以子房为材料制备烟草染色体标本的方法[J]. 中国烟草科学, 2019, 40(4):56−61. Yang Y, Zhang Y, Dang J B, et al. Study on nicotiana chromosome specimen preparation using ovary[J]. Chinese Tobacco Science, 2019, 40(4): 56−61.
[28] 孙静贤, 杨时宇, 杨雪娟, 等. 怒江红山茶(Camellia saluenensis) 3个居群核型分析[J]. 云南大学学报(自然科学版), 2019, 41(6):1246−1253. Sun J X, Yang S Y, Yang X J, et al. Karyotype analysis of 3 populations of Camellia saluenensis[J]. Journal of Yunnan University: Natural Sciences Edition, 2019, 41(6): 1246−1253.
[29] 孙音, 李兆鹏, 房义福, 等. 大叶女贞染色体制片及核型分析[J]. 山东林业科技, 2019, 49(4):1−5. doi: 10.3969/j.issn.1002-2724.2019.04.002 Sun Y, Li Z P, Fang Y F, et al. Chromosome preparation and karyotype analysis of Ligustrum compactum[J]. Shandong Forestry Science and Technology, 2019, 49(4): 1−5. doi: 10.3969/j.issn.1002-2724.2019.04.002
[30] 付文婷, 张爱民, 廖芳芳, 等. 辣椒根尖预处理及植株倍性鉴定[J]. 现代农业科技, 2015,44(18):77−78. doi: 10.3969/j.issn.1007-5739.2015.18.043 Fu W T, Zhang A M, Liao F F, et al. Pretreatment for pepper root tip and plant ploidy identification[J]. Modern Agricultural Science and Technology, 2015,44(18): 77−78. doi: 10.3969/j.issn.1007-5739.2015.18.043
[31] 刘昱希, 韩兰英, 李梦雪, 等. 葫芦科植物幼嫩子房壁制片技术的优化及其染色体倍性鉴定[J]. 西北植物学报, 2020, 40(5):882−887. Liu Y X, Han L Y, Li M X, et al. Optimization of chromosome preparation method using young ovary wall of Cucurbitaceae plants and ploidy identification[J]. Acta Botanica Boreali-Occidentalia Sinica, 2020, 40(5): 882−887.
[32] 陈盈盈, 官锦燕, 谭嘉娜, 等. 辣木的染色体制片优化及核型分析[J]. 热带作物学报, 2020, 41(6):1174−1178. doi: 10.3969/j.issn.1000-2561.2020.06.015 Chen Y Y, Guan J Y, Tan J N, et al. Optimization of chromosome sectioning and karyotype analysis of Moringa oleifera[J]. Chinese Journal of Tropical Crops, 2020, 41(6): 1174−1178. doi: 10.3969/j.issn.1000-2561.2020.06.015
[33] 叶天文, 李艳民, 张健, 等. 普通油茶染色体制片技术优化及核型分析[J]. 南京林业大学学报(自然科学版), 2020, 44(5):93−99. Ye T W, Li Y M, Zhang J, et al. Optimization of chromosome mounting technique and karyotype analysis of Camellia oleifera[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2020, 44(5): 93−99.
[34] 杨玲, 罗梦婷. 不同预处理对长寿沙田柚根尖染色体制片的影响[J]. 南方农业, 2012, 6(6):73−76. Yang L, Luo M T. Effects of pretreatment on chromosome squashing of root tip of Citrus grandis Osbeck cv. Shatianyou Changshou[J]. South China Agriculture, 2012, 6(6): 73−76.
[35] 龙海梅, 张楠卿, 李宗艳, 等. 金盏菊根尖细胞染色体制片与核型分析[J]. 浙江农业学报, 2020, 32(1):86−92. Long H M, Zhang N Q, Li Z Y, et al. Study on chromosome technique of Calendula officinalis and its karyotype[J]. Acta Agriculturae Zhejiangensis, 2020, 32(1): 86−92.
[36] 赵雁, 杜康华, 李宛宣, 等. 两种五加科园林植物染色体制片优化与核型分析[J]. 北方园艺, 2019,43(22):83−89. Zhao Y, Du K H, Li W X, et al. Chromosome preparation optimization and karyotype analysis of two landscape plants in Araliaceae[J]. Northern Horticulture, 2019,43(22): 83−89.
[37] 杨亚飞, 刘沈徽, 黄东益, 等. 适于荧光原位杂交的大薯叶片染色体制片技术[J]. 热带生物学报, 2020, 11(1):100−104. Yang Y F, Liu S H, Huang D Y, et al. Chromosome preparation of leaf cells of Dioscorea alata L. for FISH[J]. Journal of Tropical Blology, 2020, 11(1): 100−104.
[38] 侯小改, 段春燕, 刘素云, 等. 中国牡丹染色体研究进展[J]. 中国农学通报, 2006, 22(2):307−309. doi: 10.3969/j.issn.1000-6850.2006.02.083 Hou X G, Duan C Y, Liu S Y, et al. Advances on chromosome study of Chinese tree peony[J]. Chinese Agricultural Science Bulletin, 2006, 22(2): 307−309. doi: 10.3969/j.issn.1000-6850.2006.02.083
[39] Dong L, Hong M, Li Z H, et al. Karyotypic studies of five Paeonia ludlowii populations from China[J]. Caryologia, 2011, 64(4): 370−376.
-
期刊类型引用(2)
1. 孙榕泽,宋焕芝,蒋珈琦,于晓南. 三倍体芍药品种染色体制片优化和核型分析. 河北农业大学学报. 2024(03): 46-55 .  百度学术
百度学术
2. 段英姿,客绍英,王晓英,张胜珍,马艳芝. 15个油用紫斑牡丹品种核型及亲缘关系分析. 种子. 2023(07): 96-104 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: