Root nitrogen uptake and its relationship with root morphological and chemical traits in Pinus koraiensis at different ages
-
摘要:目的 明确不同年龄红松根系氮素吸收及其与根形态和化学性状的关系,增进对根系资源获取策略与树木个体发育之间联系的理解。方法 本文选取黑龙江省凉水国家级自然保护区阔叶红松林内幼龄((14 ± 1)年)、中龄((48 ± 3)年)和成熟龄((217 ± 4)年)红松为材料,采用稳定性同位素示踪技术研究了各年龄阶段红松根系氮素吸收,同时测定了根系形态和化学性状。结果 随着红松年龄的增大,根系铵态氮、甘氨酸和总吸收速率均逐渐降低,硝态氮吸收速率则无显著变化。红松不同年龄阶段,各形态氮对根系总氮吸收贡献率均表现铵态氮(62% ~ 65%)> 甘氨酸(25% ~ 32%)> 硝态氮(4% ~ 12%),其中硝态氮贡献率随红松年龄的增大而增大,铵态氮和甘氨酸的贡献率则无显著变化。甘氨酸以分子态被幼龄、中龄和成熟龄红松根系吸收的比例非常接近,分别为78%、81%和80%。根系直径随着红松年龄的增大而显著增粗,与根系铵态氮、甘氨酸和总氮吸收速率呈负相关(仅与甘氨酸相关性显著),与硝态氮吸收速率呈正相关;与此相反,比根长和比根表面积则随着红松年龄的增大呈现降低的趋势,均与根系铵态氮、甘氨酸和总氮吸收速率呈正相关(仅甘氨酸相关性显著),与硝态氮吸收速率呈负相关;根系组织密度和化学性状在红松的各年龄阶段均无显著变化,与根系氮吸收的相关性很低。结论 随着红松年龄的增大,根系氮素吸收速率和偏好均发生明显改变,这可能与根系形态性状的变化有关。Abstract:Objective The objective was to determine the root nitrogen uptake and its relationship with root morphological and chemical traits in Korean pine (Pinus koraiensis) at different ages, and to advance our understanding in the linkage between root resource acquisition strategy and tree ontogeny.Method We sampled young ((14 ± 1) years), middle-aged ((48 ± 3) years) and mature ((217 ± 4) years) individuals of Korean pine in a mixed broadleaved Korean pine forest at Liangshui National Nature Reserve, Heilongjiang Province of northeastern China. Root nitrogen uptake was measured in situ with a short-term 15N labeling hydroponic experiment, and root morphological and chemical traits were also determined concurrently.Result Root ammonium, glycine and total nitrogen uptake rate of Korean pine decreased gradually with the increase of age, while no significant change in nitrate uptake rate was found. Across all ages, the contributions of different forms of nitrogen to total uptake ranked in the order of ammonium (62%−65%) > glycine (25%−32%) > nitrate (4%−12%). The contribution of nitrate to total nitrogen uptake increased with the increase of age, but no clear patterns were shown in ammonium and glycine. The percentages of glycine as molecular absorbed by roots were very similar across young, middle-aged and mature individuals, with the corresponding values of 78%, 81% and 80%, respectively. With tree age increased, root diameter increased significantly, showing negative correlations with uptake rates of ammonium, glycine and total nitrogen (significant correlation only found in glycine), but positive correlation with nitrate. By contrast, specific root length and specific root surface area decreased with increasing age, both of them were positively correlated with uptake rates of ammonium, glycine and total nitrogen (significant correlation only found in glycine), but negatively correlated with nitrate. Root tissue density and chemical traits did not show significant changes among tree ages, and exhibited very weak relationships with nitrogen uptake rates.Conclusion With the increase of tree age, root nitrogen uptake rate and preference of P. koraiensis are significantly changed, which may be related to the alternation of root morphological traits.
-
Keywords:
- nitrogen uptake /
- glycine /
- tree age /
- fine root /
- mixed broadleaved Korean pine forest
-
氮素(N)是森林生态系统中限制林木生长发育的重要营养元素之一[1-2],因此,关于N的吸收,转运和代谢长期以来是林学和生态学研究关注的焦点。植物根系N吸收受许多内在和外在因子的影响[3-4]。例如,Liese等[5]证实内生菌根树种无机氮吸收速率显著高于外生菌根树种,而有机氮吸收速率则无显著差异。对青藏高原草地植物的研究发现,根系N吸收速率与细根比根长和比根表面积呈正相关,与细根生物量、体积、表面积和平均直径呈负相关[6]。另一方面,土壤N有效性等外在因子也强烈影响根系N吸收。例如,Song等[7]在青藏高原对草甸植物进行了8年的施肥研究,在铵态氮肥和硝态氮肥共施的条件下,禾本科(Poaceae)牧草类植物N吸收偏好由铵态氮转变为硝态氮。因此,在内在和外在因子的综合影响下,根系N吸收速率和偏好具有复杂性。
伴随树木年龄的增长,影响根系N吸收的内在和外在因子往往也发生改变[8-10],因而会进一步影响根系N吸收。然而,根系N吸收特征如何随林木年龄的变化还了解较少,现有研究结果随研究地点和树种也表现出较大的差异。例如,Liu等[11]发现热带地区7 ~ 49年生(5个年龄序列)橡胶树(Hevea brasiliensis)都表现为偏好吸收铵态氮,但是根系N吸收速率及不同N形态贡献率在不同年龄序列间存在显著差异。李常诚等[12]研究证实,亚热带幼龄与成熟龄杉木(Cunninghamia lanceolata)对铵态氮的吸收速率均显著高于中龄林,而成熟龄杉木对硝态氮的吸收速率显著高于幼龄与中龄林。Zhang等[13]对青藏高原东部20 ~ 70年生(5个年龄序列)云杉(Picea asperata)人工林的研究发现,根系N吸收偏好随林龄的增加发生了变化,由偏好硝态氮转变为偏好铵态氮。因此,考虑到树种N吸收偏好和吸收速率与林龄之间关系的不确定性,通过在不同的地理区域和森林类型中开展研究,将有助于更全面地理解树木年龄与根系N吸收之间的联系。
本研究以我国东北地区小兴安岭原始阔叶红松(Pinus koraiensis)林为研究对象,选择幼龄((14 ± 1)年)、中龄((48 ± 3)年)和成熟龄((217 ± 4)年)红松为研究材料,通过铵态氮、硝态氮和甘氨酸的N同位素标记水培试验测定了各年龄阶段红松根系N吸收速率,同时测定了根系形态和化学性状。研究主要目的是:(1)揭示红松根系N吸收速率和偏好性随树木年龄的变化趋势;(2)明确影响不同年龄红松根系N吸收的形态和化学性状。研究结果有助于增进对林木根系N吸收与年龄的联系与机制的理解,并为原始阔叶红松林生态系统的演替与恢复研究提供理论参考。
1. 研究地概况与研究方法
1.1 研究地概况
研究地点位于黑龙江省伊春市凉水国家级自然保护区(47°10′N、128°53′E),是目前中国保存较为完整的原始阔叶红松混交林分布区之一。该区地形较为复杂,海拔280 ~ 707 m。该区属于温带大陆性季风气候,年平均气温−0.3 ℃,年均最高气温7.5 ℃,年均最低气温−6.6 ℃,≥ 0 ℃积温2 200 ~ 2 600 ℃。年均降水量676 mm,降水集中在6—8月,占全年降水的60%以上,年积雪期130 ~ 150 d,年无霜期100 ~ 120 d。本研究取样林分设置在原始阔叶红松林内,该林分的主要树种有红松、臭冷杉(Abies nephrolepis)、红皮云杉(Picea koraiensis)、色木槭(Acer mono)、花楷槭(Acer ukurunduense)、春榆(Ulmus davidiana var. japonica)、暴马丁香(Syringa reticulata var. amurensis)、辽东桤木(Alnus sibirica)、白桦(Betula platyphylla)、枫桦(Betula costata)等。2019年8月初,在林分内选取健康、没有明显衰退和病害的红松林木进行初步调查,依据树高、胸径、轮枝数量,结合生长锥测定年轮的结果(幼龄林木树干较细未钻取树芯),选取年龄接近和长势一致的幼龄、中龄和成熟龄红松[14]个体各5株,用于后续的根系N吸收速率、形态和化学性状的测定。测定的林分密度为(967 ± 80)株/hm2,其中取样木和取样根系附近(以根系为中心20 cm半径内)周围土壤(0 ~ 10 cm深度)养分概况见表1。
表 1 阔叶红松林取样木和取样根系附近土壤(0 ~ 10 cm深度)养分特征(平均值 ± 标准误差)Table 1. Sample trees and soil characteristics (0 −10 cm depth) around the roots for isotope labeling in a mixed broadleaved Korean pine forest (mean ± SE)发育阶段
Ontogenetic stage年龄/a
Age/year平均树高
Mean tree
height/m平均胸径(地径)
Mean DBH
(ground diameter)/cm土壤全 C
Total soil
carbon/
(g·kg−1)土壤全 N
Total soil
nitrogen/
(g·kg−1)土壤铵态氮
Soil ammonium/
(mg·kg−1)土壤硝态氮
Soil nitrate/
(mg·kg−1)土壤 pH
Soil pH幼龄 Young 14 ± 1 1.5 ± 0.1 2.3 ± 0.1 27.69 ± 4.21a 2.28 ± 0.22a 50.74 ± 5.44a 20.90 ± 2.12a 5.14 ± 0.11a 中龄 Middle-aged 48 ± 3 8.4 ± 0.8 10.2 ± 0.7 24.61 ± 1.34a 2.03 ± 0.09a 57.57 ± 8.27a 24.89 ± 5.39a 5.11 ± 0.06a 成熟龄 Mature 217 ± 4 27.0 ± 0.5 61.1 ± 2.2 30.84 ± 5.20a 2.60 ± 0.27a 54.73 ± 4.07a 17.64 ± 3.16a 5.17 ± 0.08a 注:不同小写字母表示在不同年龄间差异显著(P < 0.05)。Note: different lowercase letters indicate significant differences among varied ages (P < 0.05). 1.2 同位素标记溶液配制
配置含有相同浓度(100 μmol/L)的铵态氮、硝态氮和甘氨酸的混合溶液,使根系在3种N源中能够进行选择[15]。甘氨酸在野外试验中常被用来作为有机N源,是因为甘氨酸在森林土壤中有较高的含量[16]且是微生物利用性差的底物[17]。每种处理标记溶液只含有其中一种同位素标记N源(10atom%15N-KNO3、10atom%(15NH4)2SO4和99atom%2-13C215N-glycine),而其他两种N源不做标记,选用双标记甘氨酸是为了测定甘氨酸以完整分子态被吸收的比例,甘氨酸以完整态被吸收则13C和15N比例为2∶1[18]。此外,配置不含任何同位素标记的混合溶液作为对照。另在溶液中添加10 mg/L的氨苄西林来降低微生物的活性和抑制甘氨酸的分解,并添加0.2 mmol/L的CaCl2来维持根系的功能和完整性。所有溶液用去离子水配置,且存放时间不超过3 d[19]。
1.3 同位素标记水培试验和样品采集
同位素标记水培试验于2019年8月中旬,每天09:00开始。在每个年龄段随机选取5株样木,从树干基部开始,在4个象限上,沿主根伸展方向寻找合适的细根[20-21],使得同年龄段5株样木待测定的细根到样木基部的距离接近。每个方向选取0 ~ 10 cm土层与母根连接完好的1对细根分支,细根直径均 ≤ 1 mm,通常包含了红松的1 ~ 3级根。选择的1对细根分支,试验处理完全相同,目的是二者的生物量之和可以充分满足同位素测定的质量要求(0.10 ~ 0.20 g干质量)。每个方向上的1对细根分支,随机以N同位素标记的铵态氮、硝态氮和甘氨酸的混合溶液,以及未含同位素标记的对照溶液进行水培,共计4个处理。接下来,先用去离子水清洗细根分支上的土壤颗粒,然后将其分别浸入含有3种同位素标记溶液及对照溶液的15 mL离心管中,离心管用铁丝缠紧后固定在土壤中。
细根浸入离心管培养2 h后,考虑到细根吸收后的向上运输[22],在距离培养溶液表面2 cm处,将细根分支从母根上切离。随后,用50 mmol/L的KCL溶液小心冲洗3 min后再用去离子水清洗,去除细根表面残留的15N溶液。另在同位素标记水培取样点附近20 cm范围内,分别用铁锹挖取表层(0 ~ 10 cm)的细根和土壤,根系清洗后放入标记好的封口袋内,用于细根形态性状的测定,土壤也放入标记好的封口袋内用于后续的养分含量分析。
1.4 根系化学性状、N同位素测定和N吸收速率的计算
同位素标记水培试验的细根样品取回后,放入70 ℃烘箱中烘干至恒质量后称质量。随后,使用微量球磨机(Retsch MM400,German)将其研磨至粉末状,后用锡囊进行包样。使用元素分析−同位素比质谱仪(Elementar AnalysenSysteme GmbH,Germany,IsoPrime100,IsoPrime Limited,United Kingdom)测定根系N含量和C含量及15N/14N和13C/12C比值。15N的计算基于15N原子百分超(APE),APE = 15N标记样品与对照样品的差值。N吸收速率计算采用以下公式[11]:
NUR=Nc×APE100×15T×at%15Nt100 式中:NUR为N吸收速率(单位质量根系在单位时间内吸收的N),Nc为细根N含量(µmol/g),15为15N的摩尔质量(g/mol),T为标记时间(h),at%15Nt为标记药品的原子百分数(铵态氮和硝态氮为10%,甘氨酸为99%)。C吸收速率同理计算,并依据13C和15N增量相关性方程斜率计算甘氨酸以完整态被吸收的比例[18]。各N形态的贡献率(%) = (各N形态吸收速率/总吸收速率) × 100%[23]。
1.5 根系形态性状的测定
细根形态分析样品带回实验室后,依据根序分级的方法[24],根系末梢未分支的细根定义为1级根。因为同位素标记根系主要包括前3级根,因此,细根形态分析中,将前3级根整体用数字化扫描仪(EPSON,Expression 10000XL 1.0)扫描,扫描根系图像采用根系形态分析软件(WinRhizo 2004b,Regent instruments Inc,加拿大)进行形态性状分析,获取根系的平均直径、总根长、总表面积、总体积等指标。扫描后的样品在65 ℃下烘干至恒质量(精确到0.0001 g)。计算比根长(单位质量生物量的总根长,m/g)、比根表面积(单位质量生物量的总表面积,cm2/g)和根组织密度 = 细根生物量干质量与细根体积的比值(g/cm3)。
1.6 数据分析
计算各年龄红松根系化学性状、N吸收特征和前3级根形态性状的平均值和标准误(n = 5)。采用一元线性回归分析根系13C和15N增量的线性回归关系(n = 5)。采用单因素方差分析和LSD检验,分析3个年龄阶段根系化学性状、N吸收特征和前3级根形态性状的差异。用Pearson相关分析方法分别检验各样木根系N吸收速率与前3级根形态性状和根系化学性状的相关性(n = 15)。所有统计分析均采用SPSS 19.0 for Windows软件(SPSS公司,美国)完成,并采用Sigmaplot(v.10.0,SYSTAT,美国)制图。
2. 结果与分析
2.1 不同年龄红松根系N吸收特征
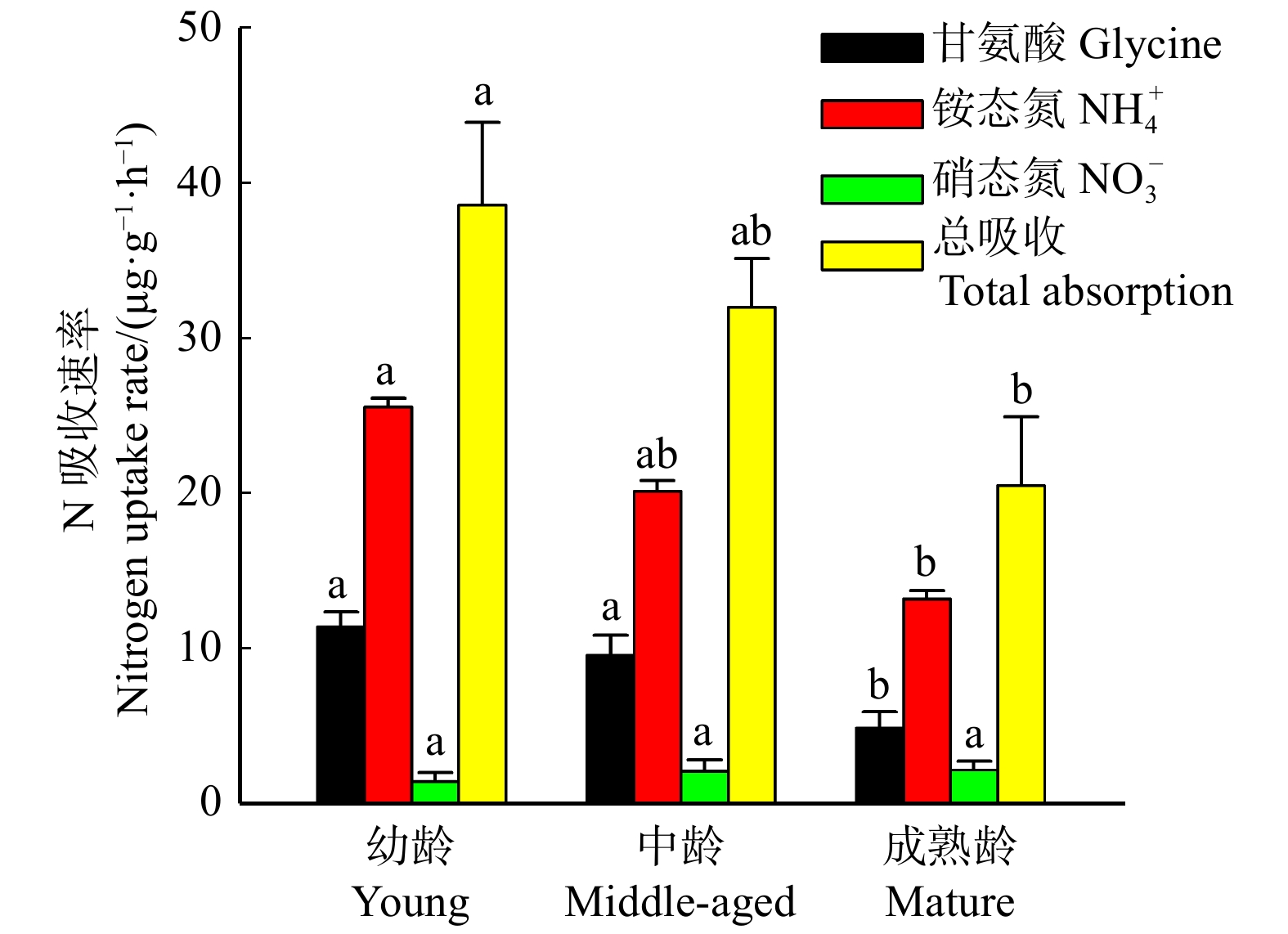
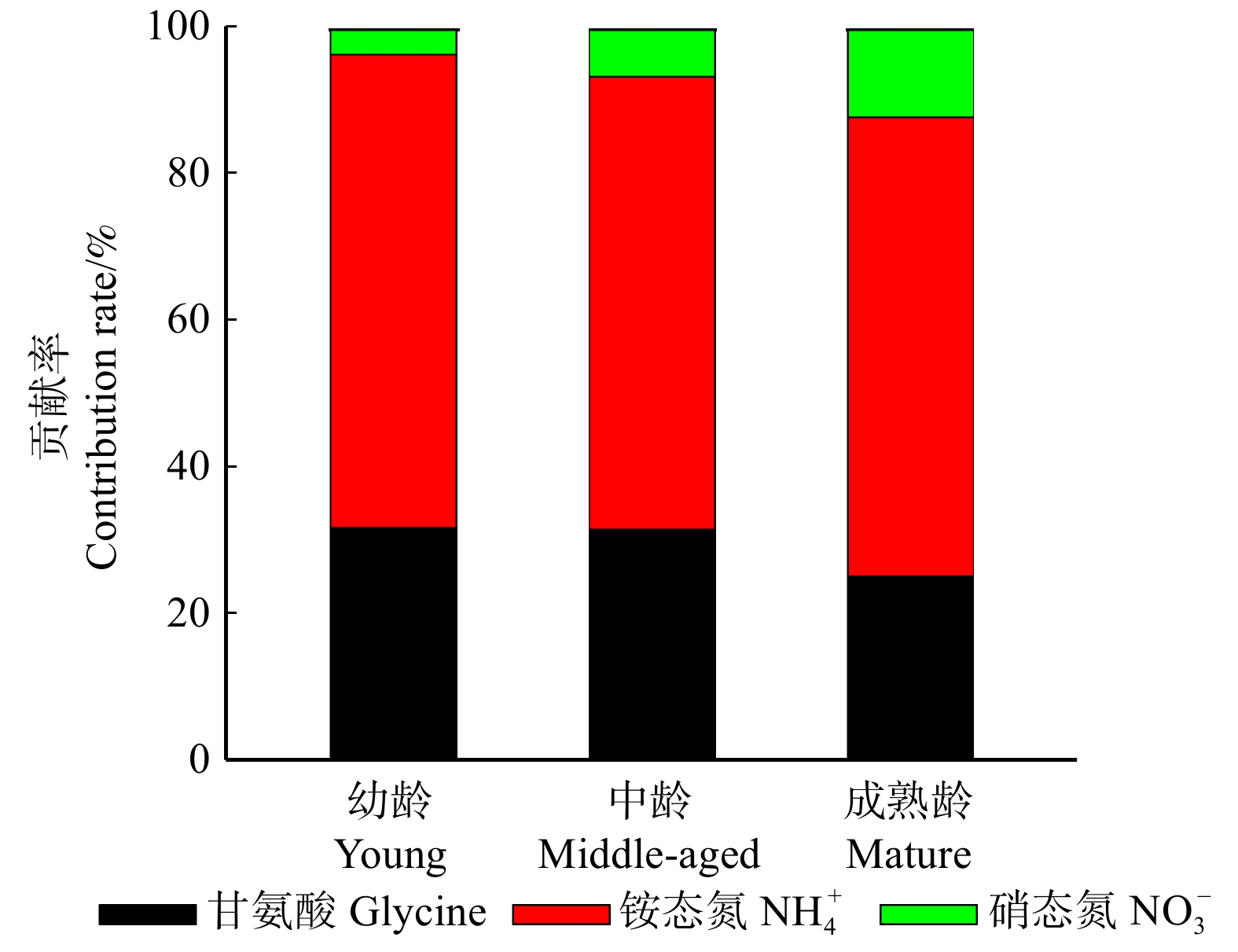
随着红松个体年龄的增大,根系总N吸收速率呈现降低的趋势,特别是幼龄((38.85 ± 5.31) µg/(g·h))与成熟龄((20.69 ± 4.45)µg/(g·h))红松之间差异显著(图1)。其中,根系铵态氮和甘氨酸吸收速率与总N吸收速率变化趋势一致,都表现为随着红松个体年龄的增大而降低,而根系硝态氮吸收速率则无显著变化(图1)。在红松的各年龄阶段,不同形态N吸收对根系总N吸收的贡献率均表现为铵态氮(62% ~ 65%)> 甘氨酸(25% ~ 32%)> 硝态氮(4% ~ 12%)(图2)。随着红松个体年龄的增大,硝态氮贡献率逐渐增大,特别是成熟龄红松硝态氮贡献率显著高于幼龄和中龄红松,而铵态氮和甘氨酸贡献率则在不同年龄阶段间没有显著差异(图2)。此外,各年龄阶段红松根系吸收13C增量与15N增量均呈显著的正相关(图3)。依据回归方程的斜率计算,甘氨酸以分子态被幼龄、中龄和成熟龄红松根系吸收的比例非常接近,分别为78%、81%和80%。
2.2 红松根系形态和化学性状随年龄的变化及对N吸收的影响
根直径随着红松个体年龄的增大而增粗,成熟龄((0.46 ± 0.01)mm)和中龄((0.46 ± 0.02)mm)显著高于幼龄((0.40 ± 0.01)mm)(表2)。与直径的显著变化不同,红松根组织密度、比根长和比根表面积均未随年龄表现出显著的变化,但是比根长和比根表面积呈现随年龄增大而明显降低的趋势(表2)。根系化学性状在各年龄阶段之间均无显著差异,其中根系组织N浓度和C浓度均为中龄最高(表2)。Pearson相关分析表明,红松根系形态和化学性状与不同形态N吸收速率和总N吸收速率存在相关关系,但是仅甘氨酸吸收速率表现出了显著的相关性(表3)。甘氨酸吸收速率与根直径呈显著负相关,而与比根长呈显著正相关(表3)。不考虑显著性水平,根系总N吸收速率与根直径负相关,与比根长正相关,而与根系N浓度呈负相关。
表 2 不同年龄红松根系形态和化学性状(平均值 ± 标准误差)Table 2. Root morphological and chemical traits of Pinus koraiensis at different ages (mean ± SE)根系形态和化学性状 Root morphological and chemical trait 幼龄 Young 中龄 Middle-aged 成熟龄 Mature 根直径 Root diameter/mm 0.40 ± 0.01b 0.46 ± 0.02a 0.46 ± 0.01a 比根长 Specific root length/(m·g−1) 25.06 ± 1.54a 22.29 ± 2.01a 20.47 ± 0.77a 根组织密度 Root tissue density/(g·cm−3) 0.30 ± 0.02a 0.28 ± 0.01a 0.29 ± 0.004a 比根表面积 Specific root surface area/(cm2·g−1) 325.22 ± 16.34a 315.85 ± 18.04a 296.17 ± 4.18a 根组织N浓度 Root tissue N concentration/(mg·g−1) 12.45 ± 0.41a 13.42 ± 0.61a 12.15 ± 0.68a 根组织C浓度 Root tissue C concentration/(mg·g−1) 448.67 ± 7.52a 451.02 ± 6.05a 449.27 ± 2.09a 注:不同小写字母表示在不同年龄间差异显著(P < 0.05)。Note: different lowercase letters indicate significant differences among varied ages (P < 0.05). 表 3 不同年龄红松根系N吸收速率与根系形态和化学性状的Pearson相关性分析Table 3. Pearson’s correlations between root nitrogen uptake rate and morphological and chemical traits of Pinus koraiensis at different ages根系形态和化学性状
Root morphological and chemical traitN吸收速率 Nitrogen uptake rate/(µg·g−1·h−1) 铵态氮 Ammonium 硝态氮 Nitrate 甘氨酸 Glycine 总N吸收 Total absorption 根直径 Root diameter/mm −0.393 0.435 −0.583* −0.443 比根长 Specific root length/(m·g−1) 0.156 −0.435 0.516* 0.233 组织密度 Root tissue density/(g·cm−3) 0.059 0.006 0.183 0.104 比根表面积 Specific root surface area/(cm2·g−1) 0.102 −0.364 0.346 0.146 组织N浓度 Tissue N concentration/(mg·g−1) 0.116 0.139 −0.042 0.096 组织C浓度 Tissue C concentration/(mg·g−1) −0.219 −0.065 −0.291 −0.271 注:表内数值为相关系数,*表示显著相关(P < 0.05)。Notes: values in table are coefficients of correlation, * means significant correlation (P < 0.05). 3. 讨 论
3.1 红松根系N吸收特征随年龄的变化
在阔叶红松林中,随着红松个体年龄的增加,根系铵态氮、甘氨酸和总N吸收速率均逐渐降低,根系硝态氮吸收速率则没有随年龄而显著变化(图1),这与以往的研究有所不同。例如,Liu等[11]通过对热带地区不同年龄橡胶树根系N吸收的研究发现,幼龄橡胶树根系铵态氮和总N吸收速率最高,而中龄橡胶树根系铵态氮、甘氨酸和总N吸收速率最低。不过橡胶树和红松的研究均表明,幼龄个体根系铵态氮和总N吸收速率显著高于成熟龄,根系硝态氮吸收速率随年龄并未表现出明显的变化趋势。李常诚等[12]证实,中龄杉木根系铵态氮和总N吸收速率显著低于幼龄和成熟龄,根系硝态氮吸收速率则表现为成熟龄显著高于幼龄和中龄,而甘氨酸吸收速率没有明显变化。综合来看,不同年龄树木根系N吸收速率的差异,主要体现在对其最为偏好的N形态的吸收速率上,也就是根系吸收最多的N形态,而对于偏好性最低的N形态的吸收则相对稳定。
植物在长期的进化过程中形成了对不同N形态的吸收机制,表现出对N形态的偏好选择性[25]。本研究中各年龄阶段红松根系N吸收速率发生了明显改变,但是根系N吸收偏好均表现为铵态氮 > 甘氨酸 > 硝态氮(图2)。李常诚等[12]证实我国亚热带地区不同年龄杉木人工林根系均表现为偏好吸收铵态氮,与本研究的结果相一致。但是,也有不同的研究结果报道,Zhang等[13]通过对我国青藏高原东部不同年龄云杉人工林根系N吸收进行研究,发现随着年龄的增加,云杉N偏好性由偏好吸收硝态氮转变为偏好吸收铵态氮,并推测这与土壤中占优势的N形态发生了转变有关。其他研究也发现植物通常偏好吸收土壤中占优势的N形态[7]。在本研究中,不同年龄红松均处在同一原始阔叶红松林群落,且土壤中铵态氮占绝对优势(表1),这可能导致不同年龄红松根系均偏好吸收铵态氮。甘氨酸贡献率在各个年龄阶段均高于硝态氮,表明红松根系除对一种无机氮形态(铵态氮)偏好性最强以外,还会吸收有机氮作为其N需求的补充,而不是另一种无机氮形态(硝态氮)。硝态氮必须被还原成铵态氮后才能被进一步同化为有机氮被植物利用[11],所以根系吸收硝态氮相对于其他N形态要消耗更多的能量,这可能导致各年龄阶段红松根系均对硝态氮的吸收偏好性最弱。此外,铵态氮和甘氨酸贡献率均随红松个体年龄的增加而减小,硝态氮贡献率则明显增大(图2)。因为硝态氮的吸收速率在不同年龄红松间没有显著的差异,所以硝态氮贡献率的增加是其他两种N形态吸收速率降低而导致的“被动增加”。总之,随着红松个体年龄的增大,根系N吸收中各形态N贡献率均发生了变化。
回归分析显示,各年龄阶段红松根系吸收13C和15N增量均存在显著的正相关(图3),表明各年龄红松根系均具有吸收分子态甘氨酸的能力。若甘氨酸完全以分子态被吸收,则13C∶15N为2∶1的关系[18]。根据回归方程斜率得知(图3),幼龄、中龄和成熟龄红松根系吸收分子态甘氨酸的比例分别达到了78%、81%和80%,彼此间无明显差异。这表明,红松天然林根系吸收分子态甘氨酸的能力没有随年龄而产生明显变化。不过,Zhu等[26]的研究发现,1年生红松幼苗根系吸收分子态甘氨酸的比例为36%,远远低于本研究的结果,也与其他树种的研究结果存在很大差异。我们的幼龄红松个体的年龄远大于1年,因此,推断红松幼苗在后期的生长过程中,根系吸收分子态甘氨酸的能力可能逐渐增强。不过,这一推论还有待于通过不同地点生长的红松年龄序列个体或林分来验证,而且不同树种根系是否也存在类似的变化规律也有待考察。
3.2 根系形态和化学性状对红松根系N吸收的影响
红松根直径随着个体年龄的增大而增粗,比根长和比根表面积则随着个体年龄的增大而减小,组织密度没有发生明显的变化(表3),这与以往的研究结果相似。例如,Rosenvald等[27]证实欧洲白桦(Betula pendula)随着林龄(3 ~ 60年6个年龄序列)的增加,1级根直径和组织密度逐渐增大,而比根长和比根表面积则逐渐减小;Jagodzinski等[28]通过对不同林龄(6 ~ 20年6个年龄序列)的欧洲赤松(Pinus sylvestris)细根(≤ 2 mm)的研究发现,细根比根长和比根表面积随着林龄的增大而减小,20年林木细根直径显著高于其他林龄。根系组织N浓度与C浓度均为中龄红松最高,但各年龄阶段之间差异并不显著(表2)。这与曾凡鹏等[29]对辽东山区不同林龄兴安落叶松(Larix gmelinii)人工林根系化学特征的研究结果有所不同,该研究中根系组织N浓度随着林龄的增大而显著降低。相对一致的是,该研究中落叶松和本研究中红松各年龄阶段林木根系组织C浓度均无明显变化。
直径、比根长、比根表面积以及组织密度是根系重要的形态指标[30],与其生理功能有密切的联系[20, 31]。本研究中,红松根直径分别与铵态氮、甘氨酸和总N吸收速率呈负相关,而与硝态氮吸收速率呈正相关(但统计上不显著,表3)。一般而言,同一物种的根直径越细,其生理功能越活跃[32-33]。根直径随着红松个体年龄增大而增粗,可能导致铵态氮、甘氨酸和总N吸收速率降低。红松比根长和比根表面积均与铵态氮、甘氨酸和总N吸收速率呈正相关,而与硝态氮吸收速率呈负相关(表3)。比根长和比根表面积常用来指示根系成本−收益之间的权衡[34],较高的比根长和比根表面积,有利于根系对土壤资源的有效探索和利用[35]。红松幼龄林木可能因为新陈代谢作用强烈而有较高的N需求,因此会采取更加经济的策略来构建根系,这有助于提高对铵态氮和甘氨酸的吸收,而对于同化过程中耗能较多的硝态氮则吸收相对较少(见讨论3.1部分)。另外,根系的组织密度与各N形态吸收速率的相关性很弱(表3),这主要与不同年龄红松根系组织密度没有明显变化有关(表2)。类似地,我们发现根系化学性状对各N形态吸收速率的影响很小,也可能是因为不同年龄红松林木根系化学性状缺乏显著变化(表2)。综合来看,根系形态性状随林木年龄的变化可能是导致红松根系N吸收速率和偏好发生改变的重要因子。需要指出,根系N吸收特征还与其他性状如解剖构造或菌根侵染等有关[30-31],因此未来的研究中需要检验更多的根系功能性状,以便全面揭示根系N吸收特征随树木年龄变化的内在机制。
4. 结 论
通过研究阔叶红松林中不同年龄红松根系N吸收及其与根形态和化学性状的关系,证实随着红松年龄的增大,根系铵态氮、甘氨酸和总N吸收速率降低,硝态氮吸收速率没有明显变化;在红松林木的各年龄阶段,N偏好性均表现为铵态氮 > 甘氨酸 > 硝态氮。随着红松年龄的增大,根系吸收铵态氮偏好性保持稳定,吸收硝态氮偏好性则显著增强。红松根系吸收分子态甘氨酸的能力在各年龄阶段则相对稳定。红松根系N吸收速率和偏好随林木年龄的变化与根系形态性状有关,这可能是因为不同年龄红松的N需求有所不同。研究结果增进了对不同年龄阶段红松根系N吸收策略和调节机制的理解。
-
表 1 阔叶红松林取样木和取样根系附近土壤(0 ~ 10 cm深度)养分特征(平均值 ± 标准误差)
Table 1 Sample trees and soil characteristics (0 −10 cm depth) around the roots for isotope labeling in a mixed broadleaved Korean pine forest (mean ± SE)
发育阶段
Ontogenetic stage年龄/a
Age/year平均树高
Mean tree
height/m平均胸径(地径)
Mean DBH
(ground diameter)/cm土壤全 C
Total soil
carbon/
(g·kg−1)土壤全 N
Total soil
nitrogen/
(g·kg−1)土壤铵态氮
Soil ammonium/
(mg·kg−1)土壤硝态氮
Soil nitrate/
(mg·kg−1)土壤 pH
Soil pH幼龄 Young 14 ± 1 1.5 ± 0.1 2.3 ± 0.1 27.69 ± 4.21a 2.28 ± 0.22a 50.74 ± 5.44a 20.90 ± 2.12a 5.14 ± 0.11a 中龄 Middle-aged 48 ± 3 8.4 ± 0.8 10.2 ± 0.7 24.61 ± 1.34a 2.03 ± 0.09a 57.57 ± 8.27a 24.89 ± 5.39a 5.11 ± 0.06a 成熟龄 Mature 217 ± 4 27.0 ± 0.5 61.1 ± 2.2 30.84 ± 5.20a 2.60 ± 0.27a 54.73 ± 4.07a 17.64 ± 3.16a 5.17 ± 0.08a 注:不同小写字母表示在不同年龄间差异显著(P < 0.05)。Note: different lowercase letters indicate significant differences among varied ages (P < 0.05). 表 2 不同年龄红松根系形态和化学性状(平均值 ± 标准误差)
Table 2 Root morphological and chemical traits of Pinus koraiensis at different ages (mean ± SE)
根系形态和化学性状 Root morphological and chemical trait 幼龄 Young 中龄 Middle-aged 成熟龄 Mature 根直径 Root diameter/mm 0.40 ± 0.01b 0.46 ± 0.02a 0.46 ± 0.01a 比根长 Specific root length/(m·g−1) 25.06 ± 1.54a 22.29 ± 2.01a 20.47 ± 0.77a 根组织密度 Root tissue density/(g·cm−3) 0.30 ± 0.02a 0.28 ± 0.01a 0.29 ± 0.004a 比根表面积 Specific root surface area/(cm2·g−1) 325.22 ± 16.34a 315.85 ± 18.04a 296.17 ± 4.18a 根组织N浓度 Root tissue N concentration/(mg·g−1) 12.45 ± 0.41a 13.42 ± 0.61a 12.15 ± 0.68a 根组织C浓度 Root tissue C concentration/(mg·g−1) 448.67 ± 7.52a 451.02 ± 6.05a 449.27 ± 2.09a 注:不同小写字母表示在不同年龄间差异显著(P < 0.05)。Note: different lowercase letters indicate significant differences among varied ages (P < 0.05). 表 3 不同年龄红松根系N吸收速率与根系形态和化学性状的Pearson相关性分析
Table 3 Pearson’s correlations between root nitrogen uptake rate and morphological and chemical traits of Pinus koraiensis at different ages
根系形态和化学性状
Root morphological and chemical traitN吸收速率 Nitrogen uptake rate/(µg·g−1·h−1) 铵态氮 Ammonium 硝态氮 Nitrate 甘氨酸 Glycine 总N吸收 Total absorption 根直径 Root diameter/mm −0.393 0.435 −0.583* −0.443 比根长 Specific root length/(m·g−1) 0.156 −0.435 0.516* 0.233 组织密度 Root tissue density/(g·cm−3) 0.059 0.006 0.183 0.104 比根表面积 Specific root surface area/(cm2·g−1) 0.102 −0.364 0.346 0.146 组织N浓度 Tissue N concentration/(mg·g−1) 0.116 0.139 −0.042 0.096 组织C浓度 Tissue C concentration/(mg·g−1) −0.219 −0.065 −0.291 −0.271 注:表内数值为相关系数,*表示显著相关(P < 0.05)。Notes: values in table are coefficients of correlation, * means significant correlation (P < 0.05). -
[1] Lebauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed[J]. Ecology, 2008, 89(2): 371−379. doi: 10.1890/06-2057.1
[2] 董雯怡, 聂立水, 李吉跃, 等. 应用15N示踪研究毛白杨苗木对不同形态氮素的吸收及分配[J]. 北京林业大学学报, 2009, 31(4):97−101. doi: 10.3321/j.issn:1000-1522.2009.04.017 Dong W Y, Nie L S, Li J Y, et al. Effects of nitrogen forms on the absorption and distribution of nitrogen in Populus tomentosa seedlings using the technique of 15N tracing[J]. Journal of Beijing Forestry University, 2009, 31(4): 97−101. doi: 10.3321/j.issn:1000-1522.2009.04.017
[3] Britto D T, Kronzucker H J. Ecological significance and complexity of N-source preference in plants[J]. Annals of Botany, 2013, 112(6): 957−963. doi: 10.1093/aob/mct157
[4] 霍常富, 孙海龙, 范志强, 等. 根系氮吸收过程及其主要调节因子[J]. 应用生态学报, 2007, 18(6):1356−1364. doi: 10.3321/j.issn:1001-9332.2007.06.032 Huo C F, Sun H L, Fan Z Q, et al. Physiological processes and major regulating factors of nitrogen uptake by plant roots[J]. Chinese Journal of Applied Ecology, 2007, 18(6): 1356−1364. doi: 10.3321/j.issn:1001-9332.2007.06.032
[5] Liese R, Lübbe T, Albers N W, et al. The mycorrhizal type governs root exudation and nitrogen uptake of temperate tree species[J]. Tree Physiology, 2018, 38(1): 83−95. doi: 10.1093/treephys/tpx131
[6] Hong J T, Ma X X, Yan Y, et al. Which root traits determine nitrogen uptake by alpine plant species on the Tibetan Plateau?[J]. Plant and Soil, 2018, 424(1−2): 63−72. doi: 10.1007/s11104-017-3434-3
[7] Song M H, Zheng L L, Suding K N, et al. Plasticity in nitrogen form uptake and preference in response to long-term nitrogen fertilization[J]. Plant and Soil, 2015, 394(1−2): 215−224. doi: 10.1007/s11104-015-2532-3
[8] Leduc S D, Rothstein D E. Plant-available organic and mineral nitrogen shift in dominance with forest stand age[J]. Ecology, 2010, 91(3): 708−720. doi: 10.1890/09-0140.1
[9] Jagodzinski A M, Ziółkowski J, Warnkowska A, et al. Tree age effects on fine root biomass and morphology over chronosequences of Fagus sylvatica, Quercus robur and Alnus glutinosa stands[J/OL]. PLoS One, 2016, 11(2): e148668 [2020−11−16]. https://doi.org/10.1371/journal.pone.0148668.
[10] Hishi T, Tateno R, Fukushima K, et al. Changes in the anatomy, morphology and mycorrhizal infection of fine root systems of Cryptomeria japonica in relation to stand ageing[J]. Tree Physiology, 2016, 37: 61−70.
[11] Liu M, Xu F Z, Xu X L, et al. Age alters uptake pattern of organic and inorganic nitrogen by rubber trees[J]. Tree Physiology, 2018, 38: 1685−1693.
[12] 李常诚, 李倩茹, 徐兴良, 等. 不同林龄杉木氮素的获取策略[J]. 生态学报, 2016, 36(9):2620−2625. Li C C, Li Q R, Xu X L, et al. Nitrogen acquisition strategies of Cunninghamia lanceolate at different ages[J]. Acta Ecologica Sinica, 2016, 36(9): 2620−2625.
[13] Zhang Z L, Li N, Xiao J, et al. Changes in plant nitrogen acquisition strategies during the restoration of spruce plantations on the eastern Tibetan Plateau, China[J]. Soil Biology and Biochemistry, 2018, 119: 50−58. doi: 10.1016/j.soilbio.2018.01.002
[14] 翟明普, 沈国舫. 森林培育学[M]. 3版. 北京: 中国林业出版社, 2016. Zhai M P, Shen G F. Silviculture [M]. 3rd ed. Beijing: China Forestry Publishing House, 2016.
[15] Warren C R, Adams P R. Uptake of nitrate, ammonium and glycine by plants of Tasmanian wet eucalypt forests[J]. Tree Physiology, 2007, 27(3): 413−419. doi: 10.1093/treephys/27.3.413
[16] Liu M, Li C C, Xu X L, et al. Organic and inorganic nitrogen uptake by 21 dominant tree species in temperate and tropical forests[J]. Tree Physiology, 2017, 37(11): 1515−1526. doi: 10.1093/treephys/tpx046
[17] Lipson D, Näsholm T. The unexpected versatility of plants: organic nitrogen use and availability in terrestrial ecosystems[J]. Oecologia, 2001, 128(3): 305−316. doi: 10.1007/s004420100693
[18] Warren C R. Potential organic and inorganic N uptake by six Eucalyptus species[J]. Functional Plant Biology, 2006, 33(7): 653−660. doi: 10.1071/FP06045
[19] Wei L L, Chen C R, Xu Z H, et al. Direct uptake and rapid decrease of organic nitrogen by Wollemia nobilis[J]. Biology and Fertility of Soils, 2013, 49(8): 1247−1252. doi: 10.1007/s00374-013-0818-2
[20] Guo D L, Xia M X, Wei X, et al. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species[J]. New Phytologist, 2008, 180(3): 673−683. doi: 10.1111/j.1469-8137.2008.02573.x
[21] Gu J C, Xu Y, Dong X Y, et al. Root diameter variations explained by anatomy and phylogeny of 50 tropical and temperate tree species[J]. Tree Physiology, 2014, 34(4): 415−425. doi: 10.1093/treephys/tpu019
[22] Geßler A, Kreuzwieser J, Dopatka T, et al. Diurnal courses of ammonium net uptake by the roots of adult beech (Fagus sylvatica) and spruce (Picea abies) trees[J]. Plant and Soil, 2002, 240(1): 23−32. doi: 10.1023/A:1015831304911
[23] Mckane R B, Johnson L C, Shaver G R, et al. Resource-based niches provide a basis for plant species diversity and dominance in arctic tundra[J]. Nature, 2002, 415: 68−71. doi: 10.1038/415068a
[24] Pregitzer K S, Deforest J L, Burton A J, et al. Fine root architecture of nine north American trees[J]. Ecological Monographs, 2002, 72(2): 293−309. doi: 10.1890/0012-9615(2002)072[0293:FRAONN]2.0.CO;2
[25] 张韫, 崔晓阳. 白桦幼苗NH4+/NO3−吸收特征的研究[J]. 北京林业大学学报, 2011, 33(3):26−30. Zhang Y, Cui X Y. NH4+/NO3− absorption characteristics of Betula platyphylla seedlings[J]. Journal of Beijing Forestry University, 2011, 33(3): 26−30.
[26] Zhu F F, Dai L M, Hobbie E A, et al. Uptake patterns of glycine, ammonium, and nitrate differ among four common tree species of northeast China[J]. Frontiers in Plant Science, 2019, 10: 1−11.
[27] Rosenvald K, Ostonen I, Uri V, et al. Tree age effect on fine-root and leaf morphology in a silver birch forest chronosequence[J]. European Journal of Forest Research, 2013, 132(2): 219−230. doi: 10.1007/s10342-012-0669-7
[28] Jagodzinski A M, Kalucka I. Fine roots biomass and morphology in a chronosequence of young Pinus sylvestris stands growing on a reclaimed lignite mine spoil heap[J]. Dendrobiology, 2010, 64: 19−30.
[29] 曾凡鹏, 迟光宇, 陈欣, 等. 辽东山区不同林龄落叶松人工林土壤−根系C∶N∶P生态化学计量特征[J]. 生态学杂志, 2016, 35(7):1819−1825. Zeng F P, Chi G Y, Chen X, et al. The stoichiometric characteristics of C, N and P in soil and root of larch (Larix spp.) plantation at different stand ages in mountainous region of eastern Liaoning Province, China[J]. Chinese Journal of Ecology, 2016, 35(7): 1819−1825.
[30] Robinson D, Hodge A, Fitter A. Constraints on the form and function of root systems[M]//de Kroon H, Visser E J W, ed. Root ecology. Berlin: Springer, 2003: 1−31.
[31] Kong D L, Wang J J, Zeng H, et al. The nutrient absorption-transportation hypothesis: optimizing structural traits in absorptive roots[J]. New Phytologist, 2017, 213(4): 1569−1572. doi: 10.1111/nph.14344
[32] Guo D L, Mitchell R J, Hendricks J J. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia, 2004, 140(3): 450−457. doi: 10.1007/s00442-004-1596-1
[33] Ma Z Q, Guo D L, Xu X L, et al. Evolutionary history resolves global organization of root functional traits[J]. Nature, 2018, 555: 94−97. doi: 10.1038/nature25783
[34] Bowsher A W, Miller B J, Donovan L A. Evolutionary divergences in root system morphology, allocation, and nitrogen uptake in species from high- versus low-fertility soils[J]. Functional Plant Biology, 2016, 43(2): 129−140. doi: 10.1071/FP15162
[35] Comas L H, Eissenstat D M. Patterns in root trait variation among 25 co-existing North American forest species[J]. New Phytologist, 2009, 182(4): 919−928. doi: 10.1111/j.1469-8137.2009.02799.x
-
期刊类型引用(5)
1. 林海,高大中,张童,崔国发. 基于卷积神经网络的无人机遥感影像水鸟自动识别. 动物学杂志. 2024(03): 450-459 .  百度学术
百度学术
2. 齐建东,郑尚姿,陈子仪,马鐘添. 基于ConvNeXt的北京地区红外相机野生动物图像识别改进模型构建. 林业科学. 2024(08): 33-45 .  百度学术
百度学术
3. 贾一鸣,张长春,胡春鹤,张军国. 基于少样本学习的森林火灾烟雾检测方法. 北京林业大学学报. 2023(09): 137-146 .  本站查看
本站查看
4. 齐建东,马鐘添,张德怀,田赟. 基于BS-ResNeXt-50的密云地区野生动物图像识别. 林业科学. 2023(08): 112-122 .  百度学术
百度学术
5. 戎战磊,高雅月,陈生云,张同作. 祁连山国家公园青海片区雪豹栖息地适宜性评价. 兽类学报. 2022(05): 553-562 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: