Populus euphratica PeREM6.5 regulating tolerance mechanism to water stress in Arabidopsis thaliana
-
摘要:目的 Remorin蛋白是广泛存在于苔藓、裸子和被子植物中的蛋白家族,在调控植物生长发育及生物胁迫反应方面具有重要作用,但有关remorin抵御非生物胁迫作用机制的研究较少。前期研究发现抗逆树种胡杨的remorin 6.5(REM6.5)可通过增强质膜质子泵活性提高植物耐盐性,在此基础上,本文研究了胡杨PeREM6.5在植物耐受水分胁迫中的作用,旨在进一步揭示植物抗旱的生理与分子机制。方法 以过表达PeREM6.5拟南芥(OE1和OE2)、野生型(WT)和转空载体对照(VC)拟南芥为试验材料,对各基因型拟南芥进行水分胁迫处理(包括渗透胁迫和土壤干旱)以及复水处理,从生理生化及分子生物学角度研究了胡杨PeREM6.5在拟南芥干旱胁迫中的响应机制。结果 甘露醇处理后,过表达PeREM6.5拟南芥的存活率、根长显著高于WT和VC,并且在渗透胁迫下细胞膜受损程度较小,这些表型差异主要与转基因拟南芥水分吸收、抗氧化防御能力增强有关。甘露醇处理后,过表达PeREM6.5拟南芥水通道基因AtPIP1;2和AtPIP2;1的表达量提高。甘露醇处理诱导WT和VC根细胞积累H2O2,对细胞膜造成氧化伤害。转基因株系在甘露醇处理后过氧化物酶基因POD和过氧化氢酶基因CAT表达量显著上调,能维持较高的POD和CAT酶活性,清除H2O2及其对细胞膜造成的损伤。在土壤干旱处理9 d后,转基因株系的叶绿素含量下降幅度低于WT和VC,复水后叶绿素含量恢复程度较高。另外,PeREM6.5转基因株系在干旱胁迫下维持PSⅡ实际光合量子产量的能力增强。结论 过表达胡杨PeREM6.5基因提高了拟南芥对水分胁迫的耐受性。Abstract:Objective Remorin is a protein family commonly found in bryophytes, gymnosperms and angiosperms, and plays an important role in regulating plant growth, development, and the response to biotic stress. The physiological mechanism of remorin in plant adapting to abiotic stress has rarely been investigated. We have previously shown that PeREM6.5, a remorin protein originated from stress-resistant Populus euphratica, increased salt tolerance through enhancing activity of plasma membrane (PM) H+-ATPase. The role of PeREM6.5
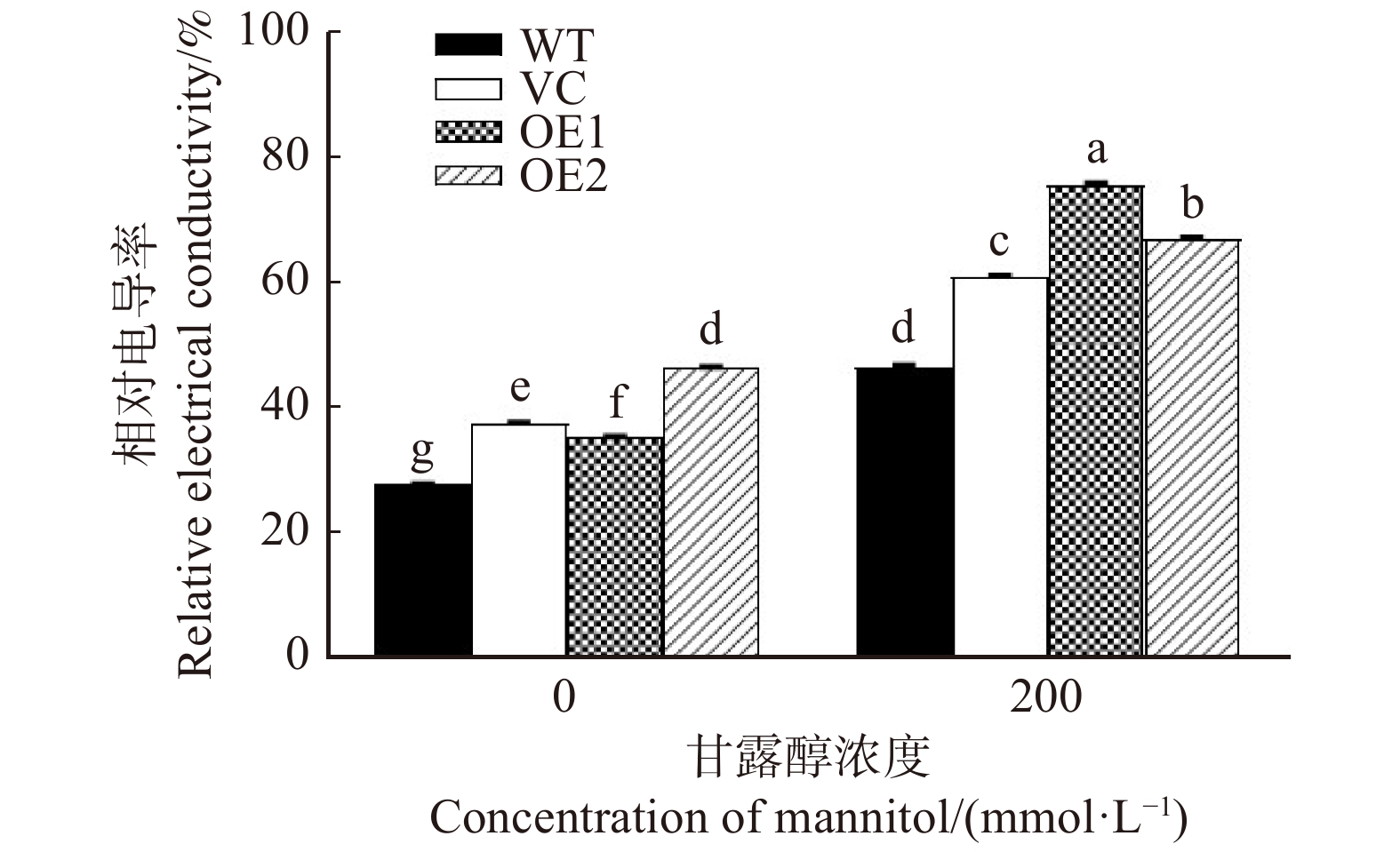
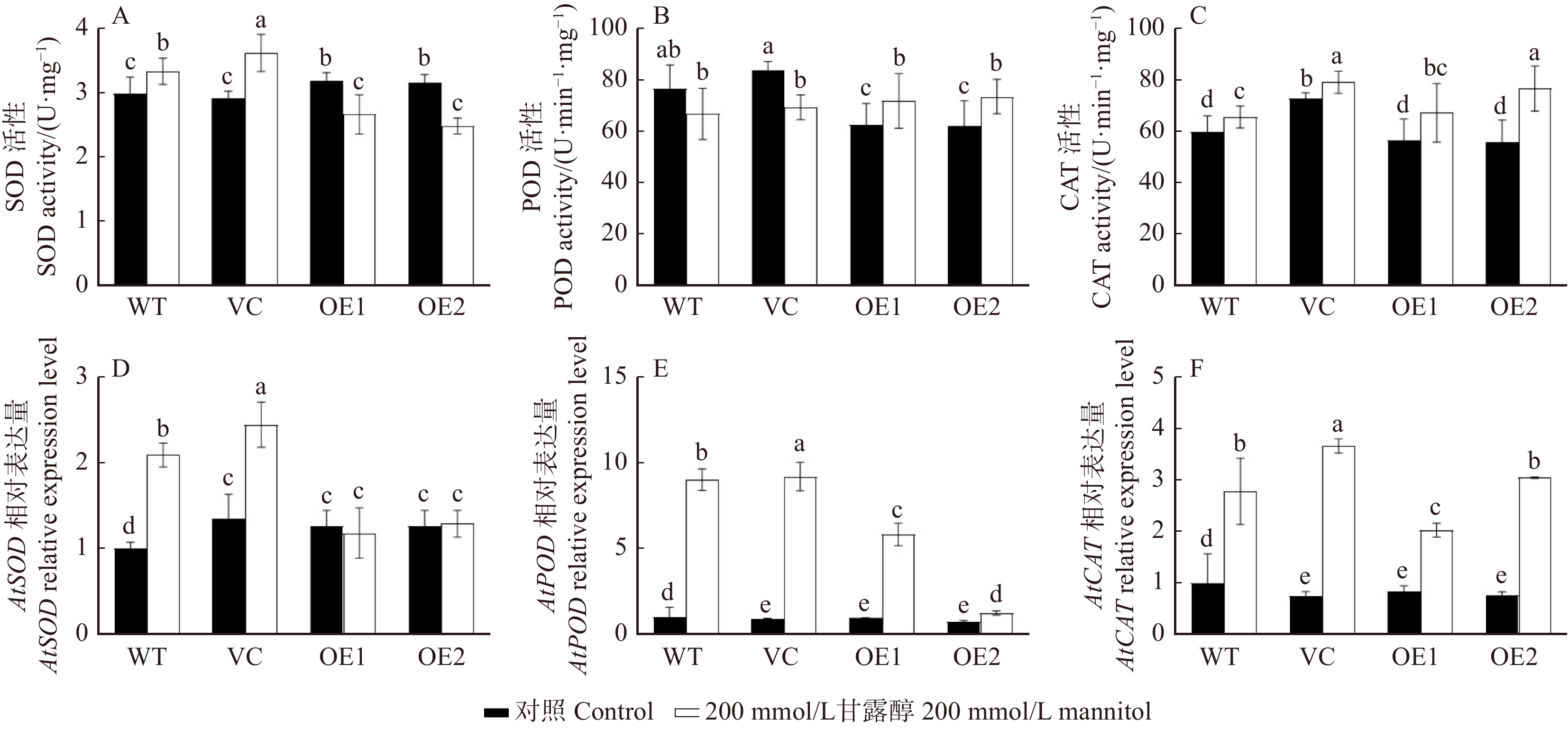
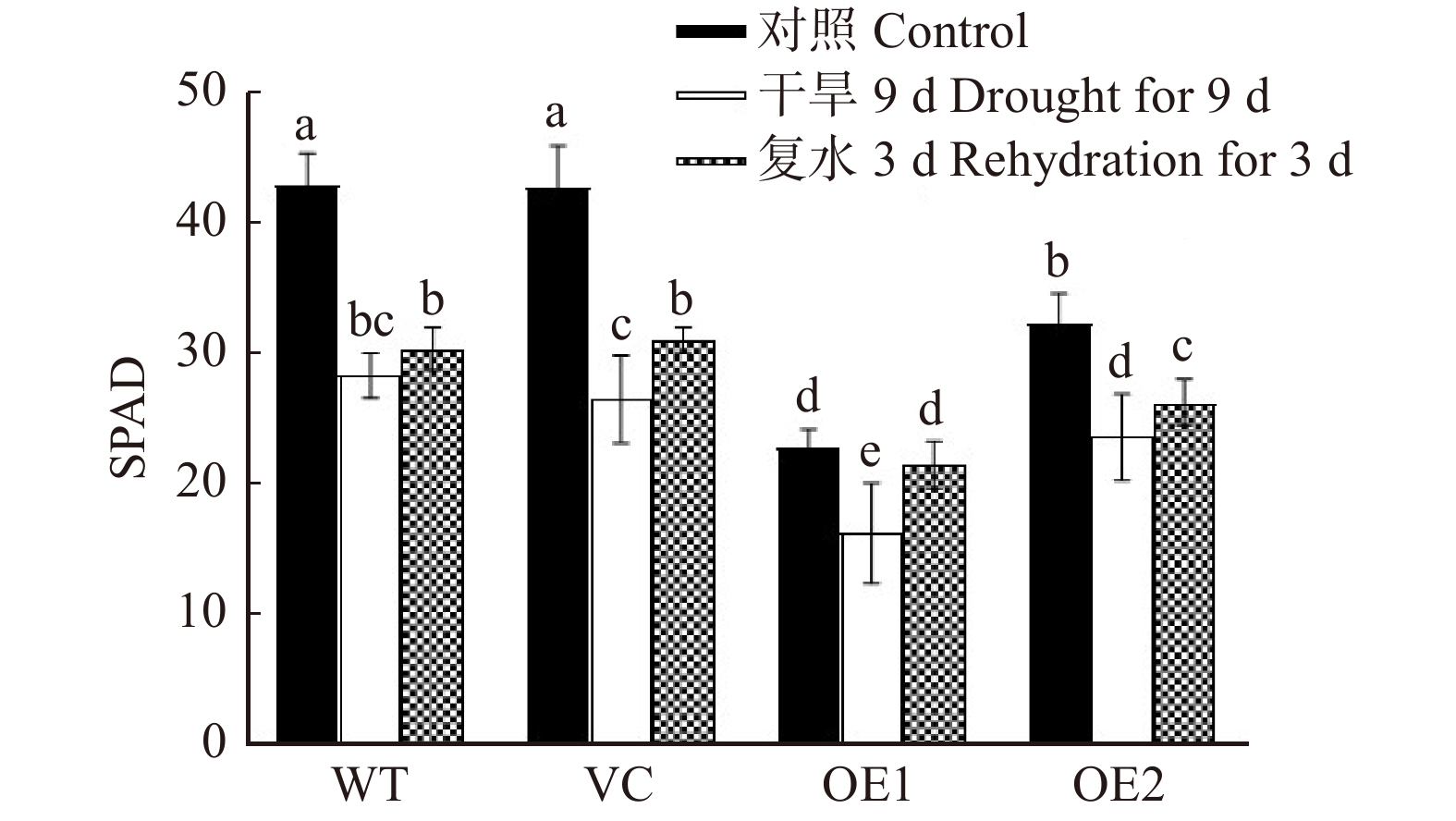
in water stress tolerance was investigated in this study. The aim is to elucidate the physiological and molecular mechanism underlying PeREM6.5 in plant adaptation to drought stress. Method The PeREM6.5-overexpressed Arabidopsis thaliana (OE1 and OE2), wildtype (WT), and vecter control (VC) were used in this study. These four genotypes of A. thaliana were treated with osmotic stress, soil drought and rehydration, respectively. The PeREM6.5-regulated drought response was evaluated at the physiological, biochemical and molecular levels. Result Under mannitol treatment, the seed survival rate and root length of PeREM6.5-overexpressed Arabidopsis thaliana were significantly higher than WT and VC, and the cell membrane was less damaged by osmotic stress. The phenotypic differences were mainly related to the enhanced ability for water uptake and antioxidant defence in the transgenic plants. The expression of water channel genes, AtPIP1;2 and AtPIP2;1 was upregulated by osmotic treatment in PeREM6.5-transgenic lines. Mannitol treatment induced the accumulation of H2O2, causing oxidative damage to the cell membrane in WT and VC. PeREM6.5-transgenic plants up-regulated the transcription of antioxidant enzyme genes, POD and CAT after mannitol treatment. The high activities of POD and CAT could eliminate H2O2, and thus reduce the membrane damage caused by reactive oxygen species. After 9 d of drought treatment, the decrease of chlorophyll content in soil-cultured transgenic lines was lower than that of non-transgenic lines. After rehydration, the recovery of chlorophyll content in transgenic plants was higher than WT and VC. Moreover, PeREM6.5-transgenic plants exhibited a higher ability to maintain PSⅡ actual photosynthetic quantum yield under drought. These results indicated that the overexpression of PeREM6.5 improved the plant capacity to tolerate water stress.Conclusion The above results indicate that the overexpression of PeREM6.5 gene enhances the tolerance to water stress in Arabidopsis thaliana plants.-
Keywords:
- Populus euphratica /
- PeREM6.5 /
- Arabidopsis thaliana /
- osmotic stress /
- drought stress /
- tolerance mechanism
-
樟子松(Pinus sylvestris var. mongolica)隶属于松科(Pinaceae)松属(Pinus),是欧洲赤松(P. sylvestris)的一个变种,该树种抗旱、耐寒、耐瘠薄、防风固沙、适应性强,能够在降水量低、土壤贫瘠的沙土上顽强生长,是我国北方干旱和半干旱沙区防风固沙和水土保持的重要树种[1-4]。自1964年樟子松在陕西榆林红石峡引种栽培成功后[5],经过几十年的推广造林,已成为毛乌素沙区防风固沙造林的常用树种,对陕北沙区生态环境的改善发挥了重要作用[6-8]。营建樟子松种子园的主要目的是为造林绿化和林业生产提供遗传和品质优良的种子[6],随着樟子松母树年龄和树体高度的增加,采种难度也随之增加,树冠中上部的优质种子难以采收,导致种子质量参差不齐,严重影响了种子的产量和质量[9-10]。因此,矮化樟子松母树已成为沙区樟子松种子园亟待解决的技术问题之一,对种子园母树优质高产和科学管理具有重要意义。
关于种子园母树矮化和结实方面的研究,国内外已有大量报道。地中海白松(P. halepensis)[11]、欧洲赤松[12]、火炬松(P. taeda)[13]、辐射松(P. radiate)[14-16]、红松(P. koraiensis)[17-18]、油松(P. tabulaeformis)[19]、长白落叶松(Larix olgensis)[20]、杏仁桉(Eucalyptus regnans)[21]经过修剪、摘心、截冠等矮化处理后,结实量和种子品质均有所提高。洪永辉等[22-23]和谭小梅等[24]对马尾松二代种子园内的61个无性系母树进行截干处理,发现马尾松母树经过处理后分枝角变大,枝下高降低,冠幅增加,侧枝结果率、球果产量和籽粒质量均提高,采种成本大幅度下降。黄开勇等[25]对杉木种子园大龄母树进行截杆矮化处理,发现大多数杉木无性系母树截杆处理后种子产量明显提高,种子质量明显改善。戴俊等[26]研究发现杉木种子园内经截杆处理后的大部分无性系母树种子的发芽率、发芽势和发芽指数明显提高,且用其种子繁殖的子代苗木地径和苗高均显著高于未截杆处理母树种子繁殖的子代苗木。
目前关于樟子松矮化处理方面的研究报道相对较少。王曼[27]研究发现对老龄樟子松母树进行疏枝、截顶、截轮枝3种修剪措施后,樟子松母树结实量下降;王福森等[10]研究发现幼龄樟子松母树截冠矮化处理后,樟子松母树的单果质量和单株结实量分别提高了46.7%和95.5%,种子的质量增加了107%,发芽率和发芽势分别提高了8.1%和3.1%。截冠处理对樟子松壮龄母树结实方面的影响尚未见报道。本试验以榆林市樟子松种子园的壮龄母树为研究对象,对其进行截冠处理,并以相同系号的未截冠樟子松母树作为对照,研究截冠前后球果产量、球果大小、种子产量及质量指标的变化情况,揭示截冠处理对樟子松壮龄母树结实的影响,探索樟子松壮龄母树管理的关键技术,为樟子松种子园壮龄母树的优质高产和科学管理提供基础资料。
1. 材料方法
1.1 试验地概况
研究区设在陕西省榆林市樟子松种子园(109°46′02″ ~ 109°46′30″E、38°09′06″ ~ 38°09′27″N),位于榆林市城南约15.2 km处,地处毛乌素沙地南缘与黄土丘陵区过渡地带,平均海拔1 024 m。该种子园为西北地区最大的樟子松种子园,属温带半干旱大陆性季风气候,园内年平均气温8.1 ~ 10.7 ℃,极端低温− 32.7 ℃,极端高温38.6 ℃,年平均降水量432 mm,降水主要集中于7—9月,蒸发量大于1 900 mm,年平均风速5.1 m/s,最大风速为28.1 m/s。土壤为沙土和盖沙黄土,通透性好,有机质含量低,为0.32% ~ 0.54%,pH值为6.9 ~ 7.6。研究样地内主要植物有角茴香(Hypecoum erectum)、虎尾草(Chloris virgata)、角蒿(Incarvillea sinensis)、沙打旺(Astragalus adsurgens)、醉马草(Achnatherum inebrians)、冰草(Agropyron cristatum)。目前樟子松种子园内有68个无性系母树,主要源自内蒙古红花尔基天然樟子松林和榆林当地。研究区域内有18个樟子松无性系,树龄均为24年,平均胸径17.16 cm,平均冠幅4.69 m,定植密度5.0 m × 5.0 m。
1.2 试验方法
2016年3月8日至3月11日,对研究区内的18个樟子松无性系母树,按照冠幅不超过10 cm、树高不超过20 cm和胸径不超过1.5 cm的标准,每个无性系挑选出6株樟子松母树用于试验,每个无性系随机选取3株母树进行截冠处理,截去顶部3轮枝,余下的轮枝在每枝距离树干2/3处进行拉枝垂吊处理,并以相同无性系未截冠母树作为对照,截冠处理与未截冠处理的母树均采用相同的抚育管理措施,每年进行正常的施肥和人工除草各1次。
2018年11月15日至20日,对樟子松母树所有球果进行采摘,分别装袋标记。对截冠处理和对照组樟子松的单果质量、单株球果质量、单株种子质量、出籽率、球果的长径和短径、种子千粒质量和优良度8个指标进行测定分析,以此研究截冠处理对樟子松壮龄母树结实的影响。
1.3 数据分析
数据采用Excel 2016和DPS 17.1软件进行处理。对截冠处理母树和未截冠处理母树的各项指标进行统计分析,出籽率(SY)、截冠处理母树各指标相对于未截冠处理母树单个无性系的增益值(Gn)及平均增益值(GA)按照如下公式计算。
SY=P/C×100%, (1) 式中:P为单株种子质量,C为单株球果质量。
Gn=(An−Bn)/Bn×100% (2) 式中:An是第n个无性系樟子松母树截冠处理的指标测定值,Bn为第n号无性系母树未截冠处理的指标测定值。
GA=(G1+G2+G3+⋅⋅⋅Gn)/n×100% (3) 式中:G1、G2、G3、···Gn代表第1、2、3···n个无性系的增益值,n为无性系数量。
采用两配对样本t检验法对单果质量、单株球果质量、单株种子质量、出籽率4个产量指标在截冠处理与对照之间的差异进行分析。
2. 结果与分析
2.1 截冠处理对樟子松壮龄母树球果和种子产量的影响
以截冠处理的18个无性系樟子松母树作为一个样本,以未截冠相对应系号樟子松母树作为另一个样本,进行配对t检验,截冠处理母树与未截冠母树各产量指标的t检验结果见表1。从表1可知,截冠处理母树与未截冠处理母树的单果质量和单株球果质量2个产量指标没有显著性差异(P > 0.05),说明截冠处理对单果质量和单株球果质量影响不显著。樟子松母树的单株种子质量和出籽率在截冠处理与对照之间存在显著差异(P < 0.05),说明截冠处理对种子产量具有显著影响。
表 1 截冠处理母树与未截冠母树各产量指标的配对t检验结果Table 1. Comparing sample t-test results on yield index of mother trees under top pruning and non-top pruning产量指标 Yield index 均值 Mean 标准差 Standard deviation t值 t value 自由度 df P值 P value 单果质量 Single cone mass − 1.022 5.286 0.820 17 0.423 3 单株球果质量 Cone mass per tree − 43.41 688.228 0.268 17 0.792 2 单株种子质量 Seed mass per tree − 5.448 10.492 2.203 17 0.041 7 出籽率 Seed-production rate − 0.408 0.595 2.910 17 0.009 8 2.2 截冠处理对樟子松壮龄母树球果产量的增益分析
截冠处理对樟子松壮龄母树的球果产量增益分析见表2。截冠处理后樟子松母树无性系单果质量增益值在− 62.41% ~ 235.04%之间,平均增益值为24.86%。其中10个无性系母树单果质量为正增益(1、6、28、47、29、13、60、46、34、21),其余8个无性系母树单果质量为负增益。樟子松壮龄母树无性系单株球果质量的增益值在− 61.82% ~ 189.47%之间,平均增益值为23.82%。7个无性系母树单株球果质量为正增益(1、6、47、29、60、34、21),11个无性系母树单株球果质量为负增益。从平均增益值来看,截冠后樟子松壮龄母树球果产量呈增长状态,说明截冠在一定程度上能提高樟子松壮龄母树球果产量。
表 2 截冠处理对樟子松壮龄母树的球果产量增益分析Table 2. Gain analysis on cone yield of aged Pinus sylvestris var. mongolica mother trees after top pruning无性系号
Clone No.对照
CK截冠处理
Top pruning treatment单个无性系截冠后球果产量增益值
Gain value of cone yield of single clone after top pruning/%单果质量
Single cone mass/g单株球果质量
Cone mass per tree/g单果质量
Single cone mass/g单株球果质量
Cone mass per tree/g单果质量
Single cone mass单株球果质量
Cone mass per tree51 9.16 541.43 7.88 533.10 − 13.97 − 1.54 11 7.13 374.93 4.53 281.21 − 36.47 − 25.00 5 7.99 1 140.72 7.24 733.75 − 9.39 − 35.68 7 9.28 1 608.56 7.22 1 265.94 − 22.20 − 21.30 1 6.45 1 308.45 21.61 3 527.86 235.04 169.62 53 11.14 1 412.40 7.36 539.27 − 33.93 − 61.82 6 6.09 634.09 9.63 1 085.75 58.13 71.23 28 5.49 693.81 6.31 639.31 14.94 − 7.86 47 5.92 190.58 15.72 456.31 165.54 139.43 29 6.5 1 473.43 10.10 1 750.91 55.38 18.83 13 9.61 1 680.89 11.03 1 659.67 14.78 − 1.26 38 8.61 1 728.75 6.68 1 198.34 − 22.42 − 30.68 60 5.21 585.68 9.10 1 275.45 74.66 117.77 46 6.23 1 508.47 6.32 1 039.56 1.44 − 31.09 30 13.54 1 301.56 5.09 761.10 − 62.41 − 41.52 40 8.29 1 002.52 4.80 526.41 − 42.10 − 47.49 34 9.00 1 560.54 11.47 1 993.02 27.44 27.71 21 4.54 137.91 6.49 399.21 42.95 189.47 平均增益值
Average gain value/ / / / 24.86 23.82 注:“/”代表此项内容不存在。下同。Notes:“/” represents this content non-existents.The same below. 2.3 截冠处理对樟子松壮龄母树种子产量的增益分析
截冠处理对樟子松壮龄母树种子产量的增益分析见表3。截冠处理后樟子松单株种子质量的增益值在− 65.94% ~ 273.26%之间,其中仅有3个樟子松无性系单株种子质量为负增益(28、38、53),其余15个无性系为正增益。种子出籽率也出现了类似的结果,樟子松种子出籽率的增益值在− 39.33% ~191.38%之间,5个无性系母树种子出籽率为负增益(1、30、38、53、60),其余13个无性系为正增益。单株种子质量的平均增益值是81.38%,出籽率的平均增益值是55.94%,说明截冠处理能提高樟子松壮龄母树种子产量。
表 3 截冠处理对樟子松壮龄母树种子产量增益分析Table 3. Gain analysis on seed yield of aged Pinus sylvestris var. mongolica mother trees after top pruning无性系号
Clone No.对照
CK截冠处理
Top pruning treatment单个无性系截冠后种子产量增益值
Gain value of seed yield of single clone after top pruning/%单株种子质量
Seed mass per tree/g出籽率
Seed-production rate/%单株种子质量
Seed mass per tree/g出籽率
Seed-production rate/%单株种子质量
Seed mass per tree出籽率
Seed-production
rate51 5.11 0.94 10.88 2.04 112.92 117.02 11 3.80 1.01 13.14 1.12 245.79 10.89 5 9.19 0.81 16.85 2.30 83.35 183.95 7 22.36 1.39 22.42 1.77 0.27 27.34 1 13.05 1.00 30.61 0.87 134.56 − 13.00 53 15.21 1.08 5.18 0.96 − 65.94 − 11.11 6 4.86 0.77 16.31 1.5 235.6 94.81 28 11.66 1.68 11.04 1.73 − 5.32 2.98 47 4.77 0.6 7.97 1.09 67.09 81.67 29 20.19 1.37 29.48 1.68 46.01 22.63 13 21.36 1.27 33.17 2.00 55.29 57.48 38 41.35 2.39 17.43 1.45 − 57.85 − 39.33 60 8.34 1.42 14.93 1.17 79.02 − 17.61 46 17.26 1.14 19.63 1.89 13.73 65.79 30 16.08 1.24 19.35 1.23 20.34 − 0.81 40 12.98 1.29 19.96 1.89 53.78 46.51 34 9.05 0.58 33.78 1.69 273.26 191.38 21 7.26 0.51 19.82 1.46 173.00 186.27 平均增益值
Average gain value/%/ / / / 81.38 55.94 2.4 截冠处理对樟子松壮龄母树球果大小的影响
截冠处理对樟子松壮龄母树球果大小的影响见表4。从增益值分析可知,截冠后樟子松壮龄母树球果的平均短径增益值在− 29.36% ~ 42.23%之间,平均增益值为− 0.25%,其中有11个无性系为正增益,7个无性系为负增益。截冠后樟子松壮龄母树球果的平均长径增益值在− 31.59% ~ 43.31%之间,平均增益值为1.37%,其中有7个无性系为正增益,11个无性系为负增益。表5为截冠处理与未截冠处理母树的球果大小指标的配对t检验结果,不难看出,截冠处理与对照母树的球果长径和球果短径均无显著差异(P > 0.05),说明截冠对樟子松壮龄母树球果大小的影响不显著。
表 4 截冠处理对樟子松壮龄母树球果大小的影响Table 4. Effects of top pruning on cone size of aged Pinus sylvestris var. mongolica mother trees无性系号
Clone No.对照
CK截冠处理
Top pruning treatment单个无性系截冠后球果大小增益值
Gain value of cone size of single clone after top pruning/%球果短径
Cone short diameter/mm球果长径
Cone long diameter/mm球果短径
Cone short diameter/mm球果长径
Cone long diameter/mm球果短径
Cone short
diameter球果长径
Cone long
diameter51 19.17 ± 0.30 45.77 ± 1.72 19.81 ± 0.39 42.22 ± 1.43 3.34 -7.75 11 18.51 ± 0.16 40.21 ± 1.20 16.10 ± 0.75 35.78 ± 0.30 − 13.00 − 11.02 5 18.69 ± 0.57 42.66 ± 1.42 19.07 ± 0.45 35.84 ± 2.37 2.05 − 15.99 7 20.37 ± 0.62 45.18 ± 1.21 18.44 ± 0.14 43.86 ± 2.65 − 9.46 − 2.92 1 18.51 ± 0.55 35.45 ± 1.23 20.60 ± 0.07 38.31 ± 1.33 11.29 8.07 53 17.34 ± 0.67 47.49 ± 0.12 18.43 ± 0.50 40.58 ± 0.95 6.29 − 14.54 6 20.60 ± 0.07 38.13 ± 1.33 19.73 ± 0.27 45.19 ± 1.61 − 4.22 18.52 28 21.18 ± 0.47 31.94 ± 2.21 17.61 ± 0.22 35.92 ± 1.59 − 16.86 12.45 47 16.28 ± 0.61 40.08 ± 3.85 23.16 ± 0.41 57.44 ± 1.23 42.23 43.31 29 19.02 ± 0.20 35.32 ± 1.49 20.11 ± 0.98 40.80 ± 1.04 5.73 15.53 13 21.91 ± 0.44 43.40 ± 2.69 22.49 ± 0.73 36.11 ± 2.86 2.65 − 16.8 38 23.91 ± 0.46 40.94 ± 1.51 16.89 ± 0.28 34.57 ± 1.73 − 29.36 − 15.56 60 16.58 ± 0.70 29.48 ± 3.56 19.36 ± 0.30 41.77 ± 2.52 16.74 41.71 46 17.33 ± 0.41 40.45 ± 2.75 17.68 ± 0.51 37.08 ± 1.31 2.02 − 8.34 30 16.58 ± 1.21 51.69 ± 2.73 17.66 ± 0.43 35.36 ± 2.29 6.51 − 31.59 40 20.65 ± 0.17 36.50 ± 1.99 16.14 ± 0.88 35.50 ± 0.86 − 21.83 − 2.74 34 20.68 ± 0.29 42.58 ± 1.81 22.60 ± 0.48 52.22 ± 1.77 9.27 22.64 21 21.94 ± 0.39 33.54 ± 2.12 18.01 ± 0.30 32.80 ± 0.50 − 17.9 − 2.22 平均增益值
Average gain value/ / / / − 0.25 1.37 表 5 截冠处理母树与未截冠母树球果大小指标的配对t检验结果Table 5. Comparing sample t-test results on cone size index of mother trees under top pruning and non-top pruning球果大小指标 Cone size index 均值 Mean 标准差 Standard deviation t值 t value 自由度 df P值 P value 球果短径 Cone short diameter 0.297 8 3.201 0.395 17 0.698 0 球果长径 Cone long diameter − 0.030 0 8.227 0.016 17 0.987 8 2.5 截冠处理对樟子松壮龄母树种子质量的影响
截冠处理对樟子松壮龄母树种子质量的影响见表6,对增益值进行分析可知,樟子松母树无性系截冠后种子千粒质量增益值范围为− 41.8% ~ 68.60%,平均增益值为7.43%,其中仅有6个负增益(5、7、11、28、38、51),其余12个都为正增益;单个无性系截冠后种子优良度增益值为6.25% ~ 45.00%之间,平均增益值为24.96%,且优良度增益全为正增益。截冠处理母树与未截冠母树的种子质量指标的配对t检验结果(见表7),截冠处理母树与对照母树种子千粒质量无显著差异(P > 0.05),截冠处理与对照母树种子优良度有显著差异(P < 0.05),截冠处理对种子千粒质量无明显影响,对种子优良度有明显影响。说明截冠处理可以提高樟子松母树种子质量。
表 6 截冠处理对樟子松壮龄母树种子质量的影响Table 6. Effects of top pruning on seed quality of aged Pinus sylvestris var. mongolica mother trees无性系号
Clone No.对照
CK截冠处理
Top pruning treatment单个无性系截冠后种子质量增益值
Gain value of seed quality of single clone after top pruning/%种子千粒质量
Thousand seed mass/g优良度
Seed soundness /%种子千粒质量
Thousand seed mass/g优良度
Seed soundness/%种子千粒质量
Thousand seed
mass优良度
Seed soundness51 10.48 ± 0.02 45 ± 1.28 8.72 ± 0.02 54 ± 1.56 − 16.79 20.00 11 9.45 ± 0.07 48 ± 1.35 7.95 ± 0.04 55 ± 1.78 − 15.87 14.58 5 7.89 ± 0.04 55 ± 1.02 7.04 ± 0.04 62 ± 1.87 − 10.77 12.73 7 8.36 ± 0.06 54 ± 1.32 6.11 ± 0.07 67 ± 1.71 − 26.91 24.07 1 9.10 ± 0.08 44 ± 1.09 13.2 ± 0.03 57 ± 2.43 45.05 29.55 53 7.04 ± 0.08 49 ± 1.43 9.57 ± 0.01 62 ± 2.10 35.94 26.53 6 7.42 ± 0.06 55 ± 1.52 8.50 ± 0.04 61 ± 1.37 14.56 10.91 28 7.56 ± 0.13 47 ± 1.76 4.40 ± 0.04 57 ± 1.56 − 41.80 21.28 47 7.62 ± 0.05 38 ± 1.24 9.86 ± 0.01 53 ± 1.62 29.40 39.47 29 5.86 ± 0.06 40 ± 1.31 9.88 ± 0.02 58 ± 2.02 68.60 45.00 13 8.83 ± 0.03 51 ± 1.27 11.13 ± 0.03 61 ± 1.74 26.05 19.61 38 9.73 ± 0.03 48 ± 1.42 7.39 ± 0.06 51 ± 2.48 − 24.05 6.25 60 7.18 ± 0.08 38 ± 1.24 7.90 ± 0.03 50 ± 1.91 10.03 31.58 46 8.85 ± 0.11 41 ± 1.44 8.96 ± 0.02 53 ± 2.13 1.24 29.27 30 7.96 ± 0.03 39 ± 1.09 8.03 ± 0.02 53 ± 1.53 0.88 35.90 40 7.75 ± 0.03 53 ± 1.53 8.86 ± 0.01 59 ± 1.41 14.32 11.32 34 6.41 ± 0.06 47 ± 1.43 7.69 ± 0.04 66 ± 2.66 19.97 40.43 21 7.84 ± 0.03 52 ± 1.47 8.15 ± 0.03 68 ± 1.73 3.95 30.77 平均增益值
Average gain value/ / / / 7.43 24.96 表 7 截冠处理与未截冠母树种子质量指标的配对t检验结果Table 7. Comparing sample t-test results on seed quality index of mother trees under top pruning and non-top pruning种子质量指标 Seed quality index 均值 Mean 标准差 Standard deviation t值 t value 自由度 df P值 P value 种子千粒质量 Thousand seed mass − 0.445 2.133 0.885 17 0.388 5 种子优良度 Seed soundness − 11.278 4.390 10.900 17 0.000 1 3. 讨 论
樟子松无性系种子园母树的矮化技术,既能降低樟子松母树结实高度便于球果采集,又能促进樟子松结实和提高种子的产量和质量,近年来成为种子园母树科学经营管理的研究热点[10,28-29]。本研究对樟子松种子园18个无性系壮龄母树进行截冠处理,发现截冠处理母树和未截冠处理母树的单果质量和单株球果质量的统计学未达到显著水平,但二者的增益值分别达24.84%和23.82%,说明截冠在一定程度上能提高樟子松壮龄母树球果产量;这和辐射松[14]、油松[19]、大龄杉木[25]的研究结果一致。本研究发现,樟子松壮龄母树截冠处理后单株种子质量和种子出籽率明显提高,平均增益值分别达81.38%、55.94%,配对t检验显示差异显著,说明截冠处理对种子产量有明显促进作用。这和幼龄樟子松[10]、红松[18]、油松[19]、大龄杉木[25]、马尾松[30]的研究结果一致。一般来说,截冠处理消除了顶端优势,营养物质向母树中下部运输,同时冠幅增加,通风透光条件得到改善,树势增强,从而提高了母树的产量。
目前关于樟子松矮化处理和种子结实方面的研究报道不多。王福森等[10]研究发现截冠处理后樟子松母树的单果质量增加了46.7%,单株结实量增加了95.5%,种子产量增加了1.07倍。本研究发现截冠处理后樟子松母树的单果质量、单株结实量和种子的产量增加值均低于王福森等[10]的研究结果。原因可能是前者的试验研究区位于黑龙江省龙江县错海林场,降水量相对较高、蒸发量相对低;而本研究的试验区域位于毛乌素沙地,降雨量少、蒸发量大[31],生长环境较前者相对恶劣;另一个原因可能是,前者在幼龄期对樟子松母树进行截冠处理,而本研究是壮龄期对樟子松母树进行截冠处理,幼龄樟子松的恢复能力比壮龄樟子松的恢复能力强。这和王玉光等[18]的研究结果一致,即红松母树在幼龄截干矮化后结实量比在壮龄期截干矮化结实量大。本研究发现截冠处理后12个无性系母树种子千粒质量增加,全部无性系母树种子优良度提高,说明截冠处理能明显提高樟子松母树的种子优良度和种子质量。这和王福森等[10]对幼龄樟子松母树的研究结果一致。
截冠处理对松科和杉科(Taxodiaceae)树种球果大小的影响的研究报道较少。谭小梅等[24]研究发现马尾松经截冠处理后球果的长径和短径分别增加了8.02%和7.44%。黄开勇等[25]研究发现,截冠处理对杉木球果大小有一定影响,对球果长径和球果短径在同一无性系之间影响一致。本研究发现,截冠处理对樟子松母树球果大小也有一定的影响,但对球果长径和球果短径在同一无性系之间影响不一致。分析原因可能是不同树种的生物学特性导致的差异,或者是截冠处理影响了球果长径和短径的变化,具体原因需进一步研究。
樟子松壮龄母树截干后单果质量、单株球果质量、单株种子质量、出籽率和种子千粒质量5个指标,在不同无性系之间差异较大,不同指标间规律性不强,原因可能是樟子松不同无性系截冠处理后表现不同,也可能是截冠处理选择样本的重复数过少造成的,具体原因尚需进一步探索。本研究还发现7个无性系(1、6、21、28、34、47、60)母树的单果质量和单株球果质量增益值均为正值,8个无性系(5、7、11、28、30、40、51、53)母树的单果质量和单株球果质量增益值均为负值。在今后的研究中,根据本试验的研究结果分别对截冠处理后单果质量和单株球果质量增益值为正值和负值的母树进行挑选,重新配置样地,然后进行截冠处理,同时增加无性系母树的重复株数,以此得到更为科学客观的结果。
值得一提的是,对于樟子松种子园壮龄母树来说,经过多次截冠处理来降低母树高度,不一定符合生产实际,主要原因是多次截干处理会造成樟子松树势衰弱,病虫害频发等问题[6,10],此外也增加了成本。在实际的樟子松种子园经营管理中,最好的方法是对壮龄母树一次截冠使其降低到合理高度,且截冠处理以后要对樟子松母树进行科学和精心的管护。因此,樟子松母树截冠处理后,对其进行4个方向的拉枝垂吊处理,改变枝条的生长方向,缓和枝条长势,建立良好的冠形结构。这样处理会增加樟子松母树的空间利用率,改善母树的光照条件,增加樟子松对病虫害的抵抗能力,也可以促进花芽分化,增加有效结实部位,同时促进营养物质在树体合理分配,提高结实的产量和种子质量。
4. 结 论
对种子园18个无性系樟子松壮龄母树进行截冠处理,对比分析截冠处理和未截冠处理对樟子松壮龄母树球果产量、种子产量、球果大小及种子质量的影响,主要结论如下:
(1)截冠处理对母树单果质量和单株球果质量2个指标影响不显著,其平均增益值分别达24.84%和23.82%;说明截冠处理在一定程度上能提高樟子松壮龄母树球果产量。截冠处理对母树单株种子质量和种子出籽率有明显影响,说明截冠处理能明显提高樟子松壮龄母树种子产量。截冠处理对球果长和短径均无明显影响,截冠处理对樟子松壮龄母树球果大小影响不显著。
(2)截冠处理后大部分无性系母树种子千粒质量为正增益,全部无性系母树种子优良度为正增益。说明截冠处理可以提高樟子松壮龄母树种子质量。总之,本研究证明截冠可以提高樟子松壮龄母树产量和种子质量。
-
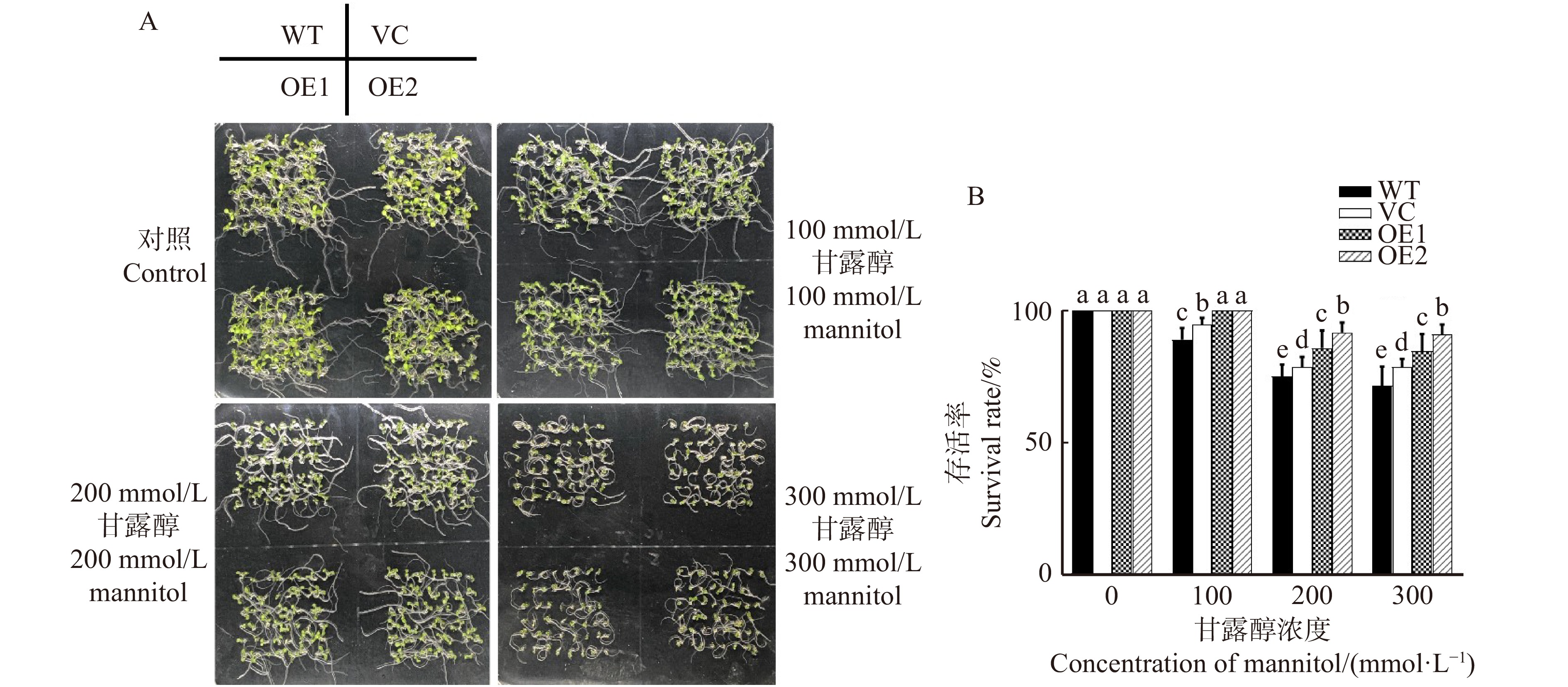
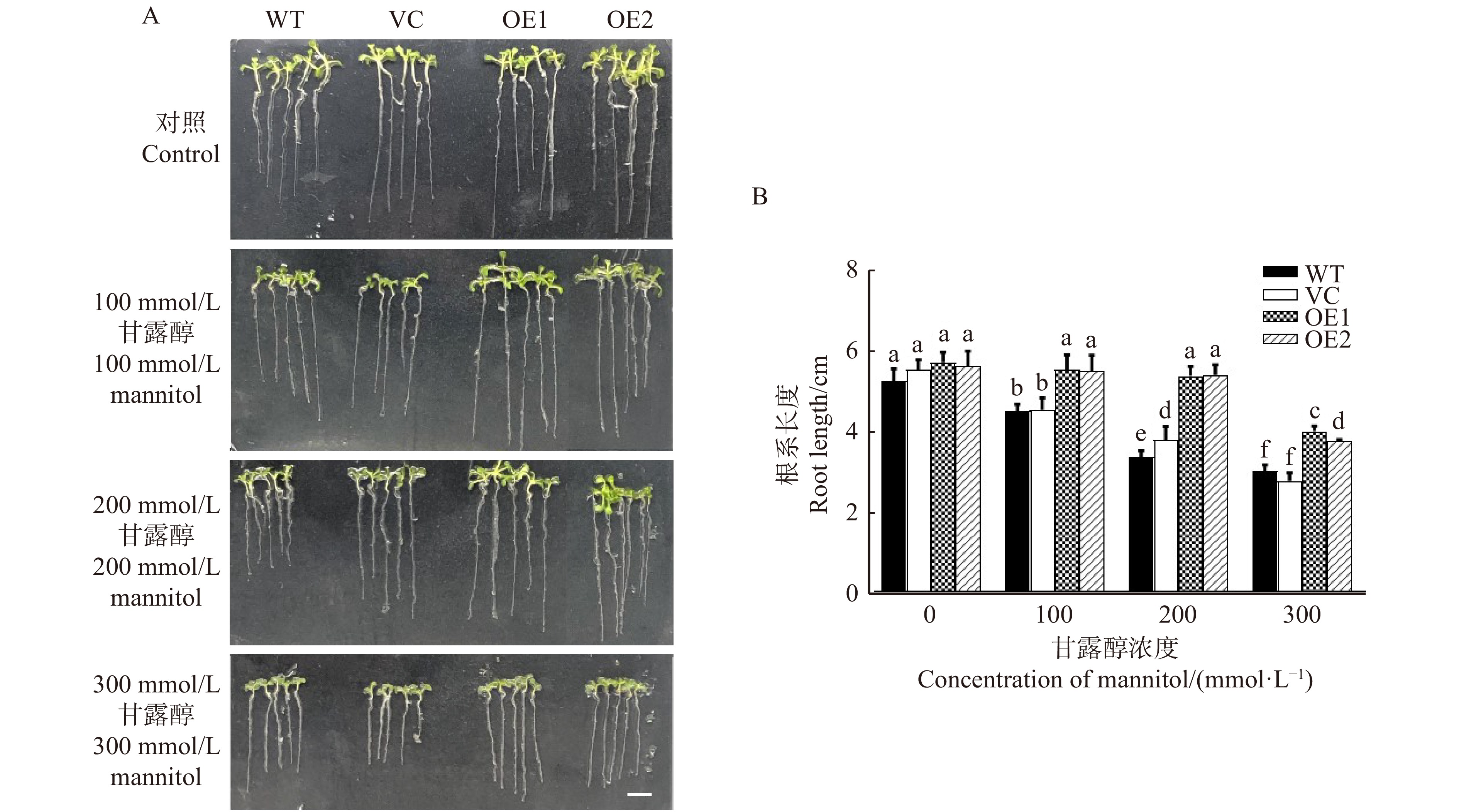
图 1 不同浓度甘露醇对不同拟南芥株系生长表型(A)和存活率(B)的影响
WT. 野生型,VC. 转空载体对照株系,OE1和OE2表示过表达PeREM6.5株系。不同字母表示差异显著P < 0. 05。下同。WT, wild type; VC, empty vector control line; OE1 and OE2 mean PeREM6.5-transgenic Arabidopsis thaliana lines。Different letters in the bar chat denote significant difference (P < 0.05). The same below.
Figure 1. Effects of different concentrations of mannitolon growth phenotype (A) and survival rate (B) on different Arabidopsis thaliana lines
图 4 甘露醇(200 mmol/L)对不同拟南芥株系根细胞H2O2水平变化的影响
A. 根尖细胞H2O2的绿色荧光。B. 根细胞H2O2荧光强度。比例尺 = 100 μm。A, green fluorescence of H2O2 in root cells. B, H2O2 fluorescence intensity in root cells. The scale bar = 100 μm.
Figure 4. Effects of 200 mmol/L mannitol on H2O2 fluorescence intensity in root cells of different Arabidopsis thaliana lines
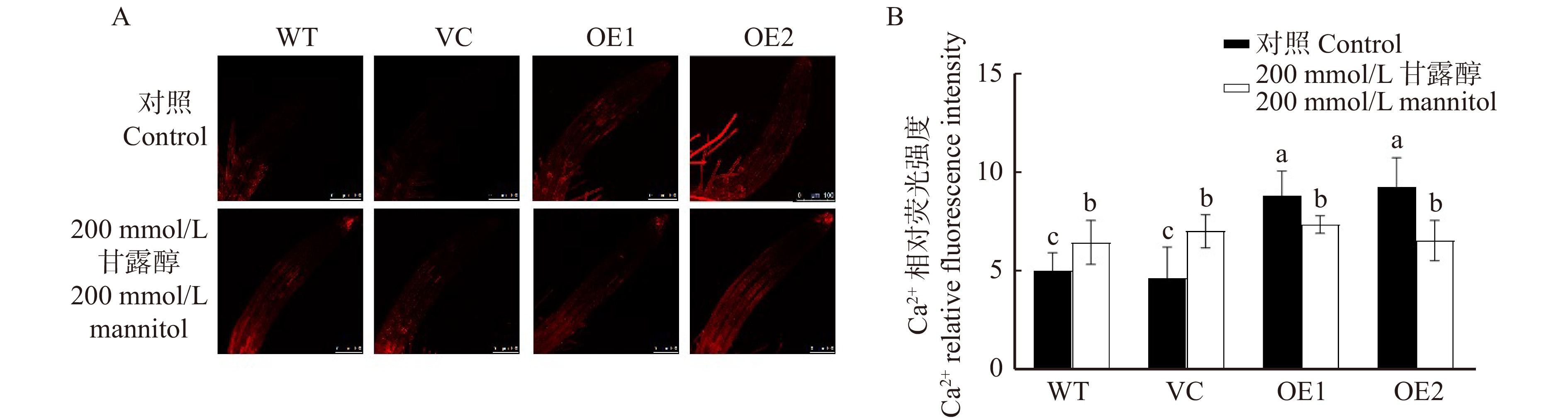
图 5 甘露醇(200 mmol/L)对不同拟南芥株系根细胞Ca2+含量的影响
A. 根尖细胞Ca2+的红色荧光,比例尺= 100 μm;B. 根细胞Ca2+荧光强度。A, red fluorescence of Ca2+ in root cells, scale bar = 100 μm. B, Ca2+ fluorescence intensity in root cells.
Figure 5. Effects of 200 mmol/L mannitol on Ca2+ fluorescence intensity in root cells of different Arabidopsis thaliana lines
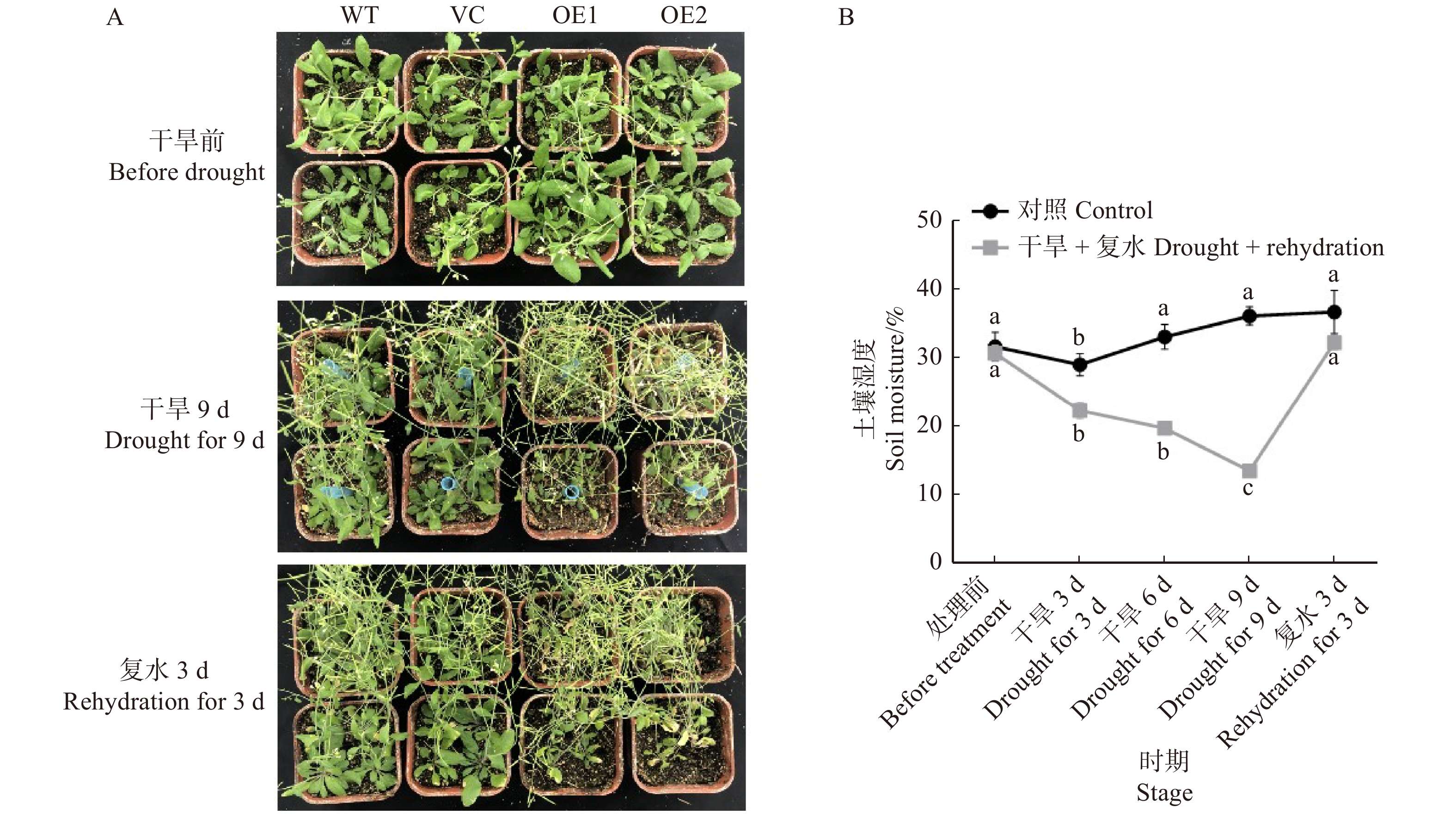
图 8 干旱和复水对不同拟南芥株系生长状况的影响
A. 干旱和复水处理后拟南芥生长状况;B. 干旱和复水处理后土壤湿度的变化。不同字母表示在P < 0.05水平上差异显著。A, plant performance of Arabidopsis thaliana after treatment of drought and rehydration; B, changes of soil moisture after drought and rehydration treatments. Different letters in the bar chat denote significant differences at P < 0.05 level.
Figure 8. Effects of drought and rehydration treatments on plant performance of different Arabidopsis thaliana lines
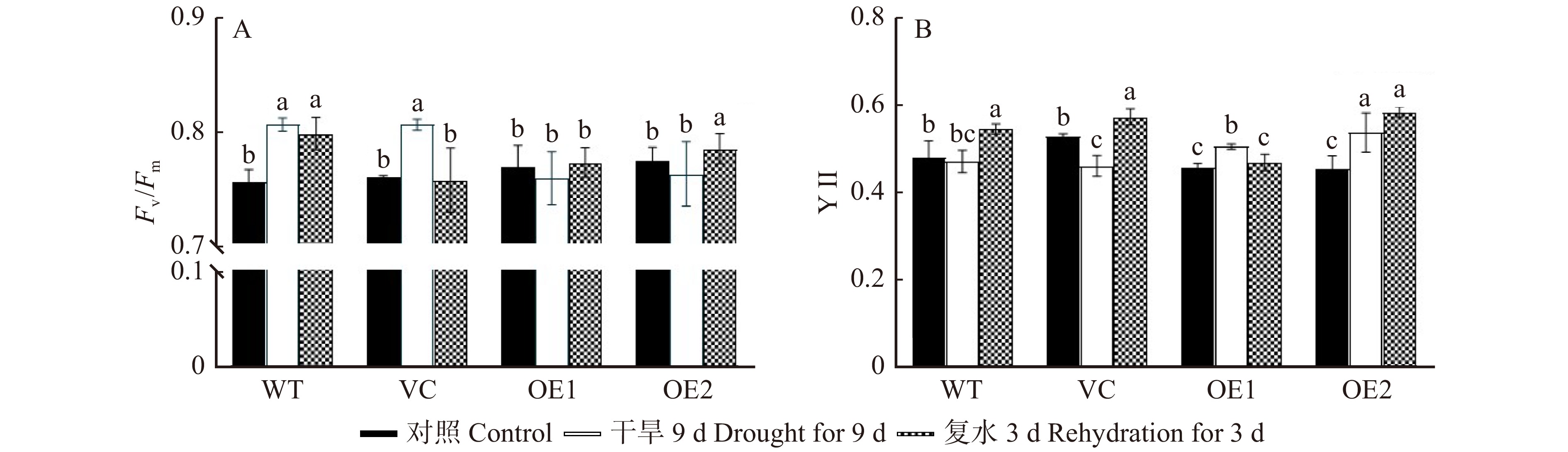
图 10 干旱和复水对不同拟南芥株系叶绿素荧光参数Fv/Fm(A)和YⅡ(B)的影响
Fv/Fm. PSⅡ最大光化学效率;YⅡ. 实际光合量子产量。Fv/Fm, maximum photochemical efficiency of PSⅡ; YⅡ, actual photosynthetic quantum yield.
Figure 10. Effects of drought and rehydration on chlorophyll fluorescence parameters Fv/Fm (A) and YⅡ (B) of different Arabidopsis thaliana lines
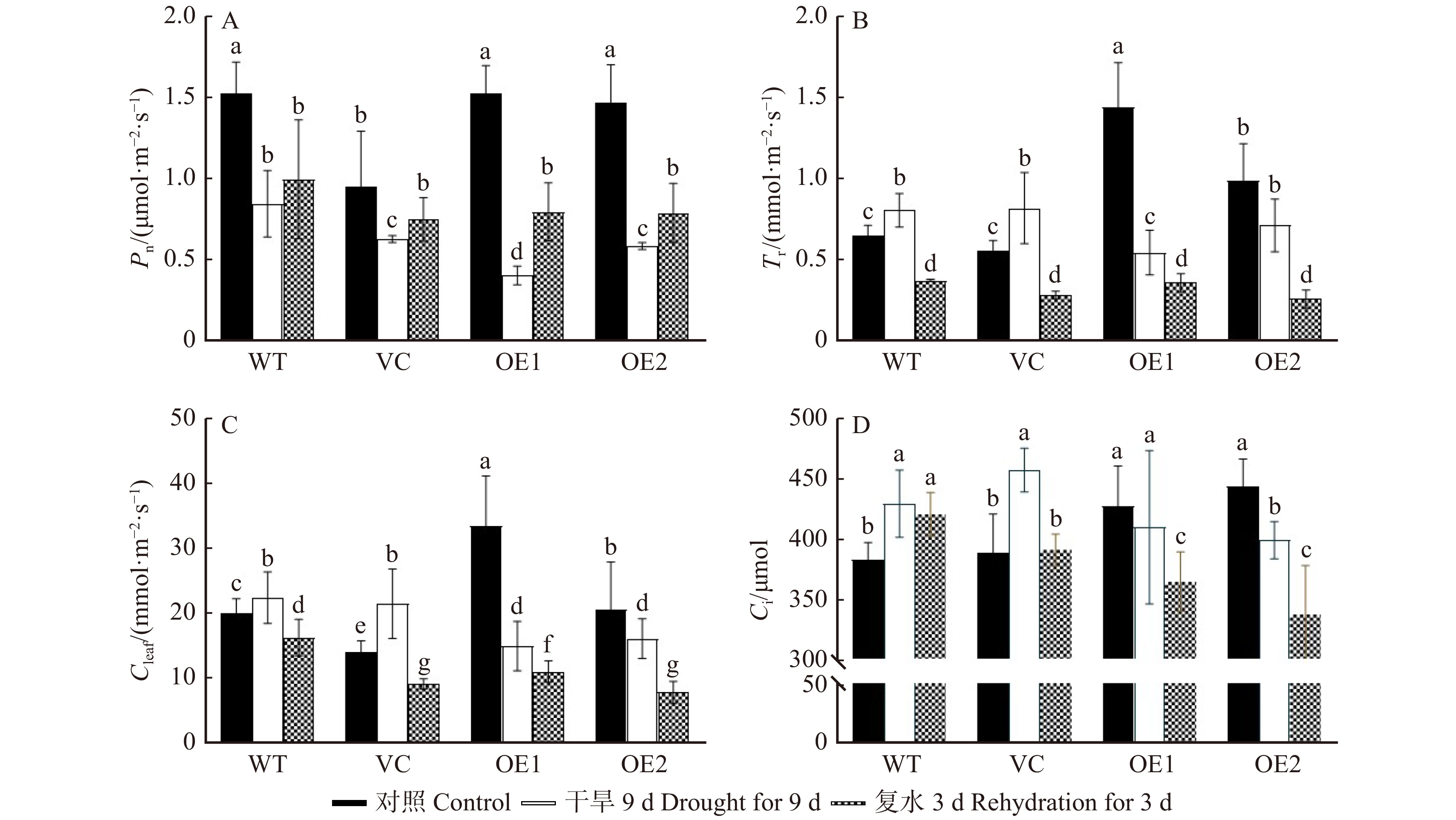
图 11 干旱和复水对不同拟南芥株系光合参数的影响
Pn. 光合速率;Tr.蒸腾速率;Cleaf. 气孔导度;Ci. 胞间二氧化碳浓度。Pn, photosynthetic rate; Tr, transpiration rate; Cleaf, stomatal conductance; Ci, intercellular carbon dioxide concentration.
Figure 11. Effects of drought and rehydration treatments on photosynthetic parameters of different Arabidopsis thaliana lines
表 1 RT-qPCR所用引物序列
Table 1 Sequences of gene-specific primers used for RT-qPCR
基因名称
Gene name正向引物(5′—3′)
Forward primer (5′−3′)反向引物(5′—3′)
Reverse primer (5′−3′)AtACTIN2 GGTAACATTGTGCTCAGTGGTGG AACGACCTTAATCTTCATGCTGC AtSOD AGGAAACATCACTGTTGGAGAT GAGTTTGGTCCAGTAAGAGGAA AtCAT AGGATCAAACTTTGAGGGGTAG CTTGTGGTTCCTGGAATCTACT AtPOD CGTGCCCTTCATATTGTTGG GACGCCATCAACAACGAGTC AtPIP1;2 ACTACCTGTGTGTAACGTGTGT TGCCTGCTTGAGATAAACCCA AtPIP2;1 GCTGCCAACGTCTAAACACA ACACAACGCATAAGAACCTCT -
[1] Caruso A, Chefdor F, Carpin S, et al. Physiological characterization and identification of genes differentially expressed in response to drought induced by PEG 6000 in Populus canadensis leaves[J]. Plant Physiology, 2008, 165: 932−941. doi: 10.1016/j.jplph.2007.04.006
[2] Reymond P, Kunz B, Paul-Pletzer K, et al. Cloning of a cDNA encoding a plasma membrane associated, uronide binding phosphoprotein with physical properties similar to viral movement proteins[J]. The Plant Cell, 1996, 8(12): 2265−2276.
[3] Raffaele S, Mongrand S, Gamas P, et al. Genome-wide annotation of remorins, a plant-specific protein family: evolutionary and functional perspectives[J]. Plant Physiology, 2007, 145(3): 593−600. doi: 10.1104/pp.107.108639
[4] Reymond P, Weber H, Damond M, et al. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis[J]. The Plant Cell, 2000, 12(5): 707−720. doi: 10.1105/tpc.12.5.707
[5] Bray E A. Abscisic acid regulation of gene expression during water-deficit stress in the era of the Arabidopsis genome[J]. Plant Cell and Environment, 2002, 25(2): 153−161. doi: 10.1046/j.1365-3040.2002.00746.x
[6] Reddy A R, Ramakrishna W, Sekhar A C, et al. Novel genes are enriched in normalized cDNA libraries from drought-stressed seedlings of rice (Oryza sativa L. subsp. indica cv. Nagina 22)[J]. Genome, 2002, 45(1): 204−211. doi: 10.1139/g01-114
[7] Checker V G, Khurana P. Molecular and functional characterization of mulberry EST encoding remorin (MiREM) involved in abiotic stress[J]. Plant Cell Reports, 2013, 32(11): 1729−1741. doi: 10.1007/s00299-013-1483-5
[8] Yue J, Cong L, Liu Y, et al. A remorin gene SiREM6, the target gene of SiARDP, from foxtail millet (Setaria italica) promotes high salt tolerance in transgenic Arabidopsis[J]. PLoS One, 2014, 9(6): e100772. doi: 10.1371/journal.pone.0100772
[9] Chen S, Li J, Wang S, et al. Effects of NaCl on shoot growth, transpiration, ion compartmentation, and transport in regenerated plants of Populus euphratica and Populus tomentosa[J]. Canadian Journal of Forest Research, 2003, 33(6): 967−975. doi: 10.1139/x03-066
[10] 张会龙. 胡杨PeREMs和PeJRL调控植物耐盐机制研究[D]. 北京: 北京林业大学, 2019. Zhang H L. The role of Populus euphratica PeREMs and PeJRL in the mediation of salt tolerance in higher plants[D]. Beijing: Beijing Forestry University, 2018.
[11] Abbott A G, Ainsworth C C, Flavell R B. Characterization ofanther differentiation in cytoplasmic male sterile maize using aspecific isozyme system (esterase)[J]. Theoretical and Applied Genetics, 1984, 67: 469−473. doi: 10.1007/BF00263415
[12] Kraus T E, Fletcher R A. Paclobutrazol protects wheat seedlings from heat and paraquat injury is detoxification of active oxygen involved[J]. Plant and Cell Physiology, 1994, 35: 45−52.
[13] Shen Z D, Yao J, Sun J, et al. Populus euphratica HSF binds the promoter of WRKY1 to enhance salt tolerance[J]. Plant Science, 2015, 235: 89−100. doi: 10.1016/j.plantsci.2015.03.006
[14] 武霞, 张一南, 赵楠, 等. 过表达胡杨PeAnn1负调控拟南芥的抗旱性[J]. 北京林业大学学报, 2020, 42(6): 14−25. doi: 10.12171/j.1000-1522.20200031 Wu X, Zhang Y N, Zhao N, et al. Overexpression of PeAnn1 from Populus euphratica negatively regulates drought resistance in transgenic Arabidopsis thaliana[J]. Journal of Beijing Forestry University, 2020, 42(6): 14−25. doi: 10.12171/j.1000-1522.20200031
[15] Lang Y, Wang M, Zhang G C, et al. Experimental and simulated light responses of photosynthesis in leaves of three tree species under different soil water conditions[J]. Photosynthetica, 2013, 51(3): 370−378. doi: 10.1007/s11099-013-0036-z
[16] 魏清江, 冯芳芳, 马张正, 等. 干旱复水对柑橘幼苗叶片光合、叶绿素荧光和根系构型的影响[J]. 应用生态学报, 2018, 29(8): 2485−2492. doi: 10.13287/j.1001-9332.201808.028 Wei Q J, Feng F F, Ma Z Z, et al. Effects of drought rehydration on leaf photosynthesis, chlorophyll fluorescence and root architecture of citrus seedlings[J]. Chinese Journal of Applied Ecology, 2018, 29(8): 2485−2492. doi: 10.13287/j.1001-9332.201808.028
[17] 张永刚, 韩梅, 姜雪, 等. 黄芩对干旱复水的生理生态响应[J]. 中国中药杂志, 2013, 38(22): 3845−3850. Zhang Y G, Han M, Jiang X, et al. Physiological ecology responses of Scutellaria baicalensis to drought rewatering[J]. China Journal of Chinese Materia Medica, 2013, 38(22): 3845−3850.
[18] 程彦伟, 韩建明, 徐晓燕, 等. 植物Remorin蛋白的研究进展[J]. 河南工业大学学报 (自然科学版), 2009, 30(4): 88−93. Cheng Y W, Han J M, Xu X Y, et al. The research progress of Remorin protein of plants[J]. Journal of Henan University of Technology (Natural Science Edition), 2009, 30(4): 88−93.
[19] Vranova E, Inze D, van-Breusegem F. Signal transduction during oxidative stress[J]. Journal of Experimental Botany, 2002, 53(372): 1227−1236. doi: 10.1093/jxb/53.372.1227
[20] Mahdieh M, Mostajeran A, Horie T, et al. Drought stress alters water relations and expression of PIP-type aquaporin genes in Nicotiana tabacum plants[J]. Plant and Cell Physiology, 2008, 49(5): 801−813. doi: 10.1093/pcp/pcn054
[21] Gilroy S, Trewavas A. Signal processing and transduction in plant cells: the end of the beginning[J]. Nature Reviews Molecular Cell Biology, 2001, 2(4): 307−314. doi: 10.1038/35067109
[22] 顾学花, 孙莲强, 高波, 等. 施钙对干旱胁迫下花生生理特性、产量和品质的影响[J]. 应用生态学报, 2015, 26(5): 1433−1439. doi: 10.13287/j.1001-9332.20150319.015 Gu X H, Sun L Q, Gao B, et al. Effects of calcium fertilizer application on peanut growth,physiological characteristics,yield and quality under drought stress[J]. Chinese Journal of Applied Ecology, 2015, 26(5): 1433−1439. doi: 10.13287/j.1001-9332.20150319.015
[23] 王顺喜. 玉米抗逆相关基因Zm-Remorin的克隆和功能分析[D]. 郑州: 河南农业大学, 2014. Wang S X. Cloning and function analysis of maize stress tolerance relate gene Zm-Remorin[D]. Zhengzhou: Henan Agricultural University, 2014.
[24] Zhang H, Deng C, Wu X, et al. Populus euphratica remorin 6.5 activates plasma membrane H+-ATPases to mediate salt Tolerance[J]. Tree Physiolohy, 2020, 6(6): 731−745.
[25] Sun J, Wang M J, Ding M Q, et al. H2O2 and cytosolic Ca2+ signals triggered by the PM H+-coupled transport system mediate K+/Na+ homeostasis in NaCl-stressed Populus euphratica cells[J]. Plant Cell Environment, 2010, 33(6): 943−958. doi: 10.1111/j.1365-3040.2010.02118.x
-
期刊类型引用(1)
1. 柯梦,邓厚银,郭文斌,李艳星,米跃骐,李云,孙宇涵. 银杏小孢子母细胞响应秋水仙碱低频多倍化的细胞学和转录组分析. 核农学报. 2023(08): 1497-1506 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载: