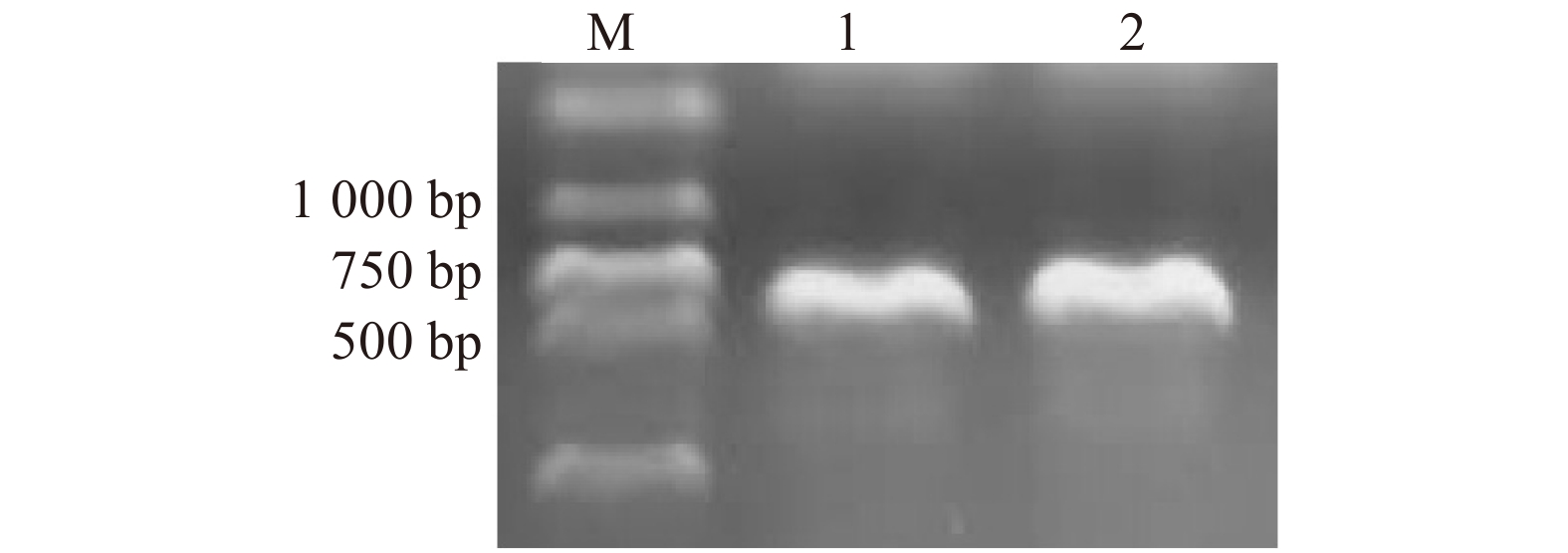
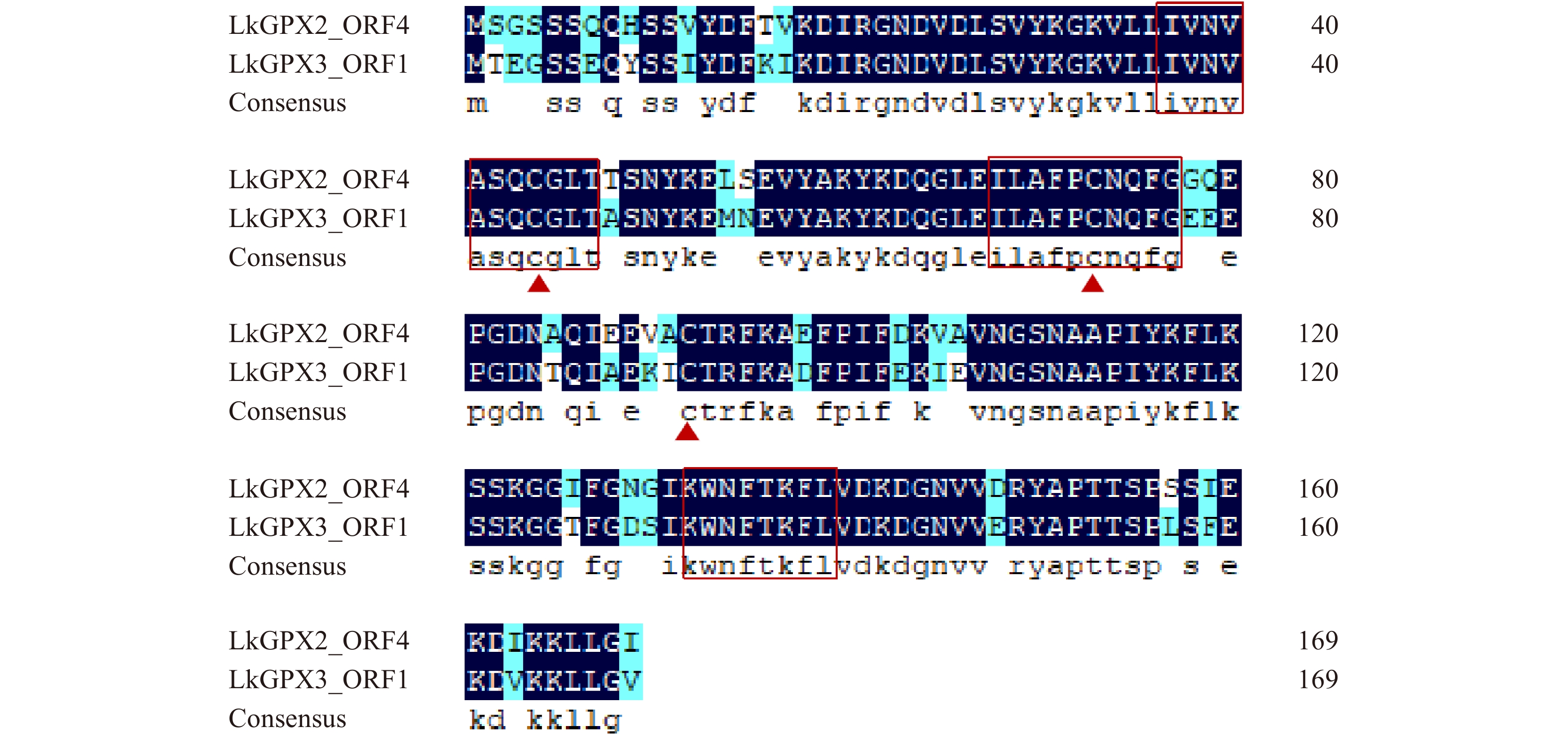
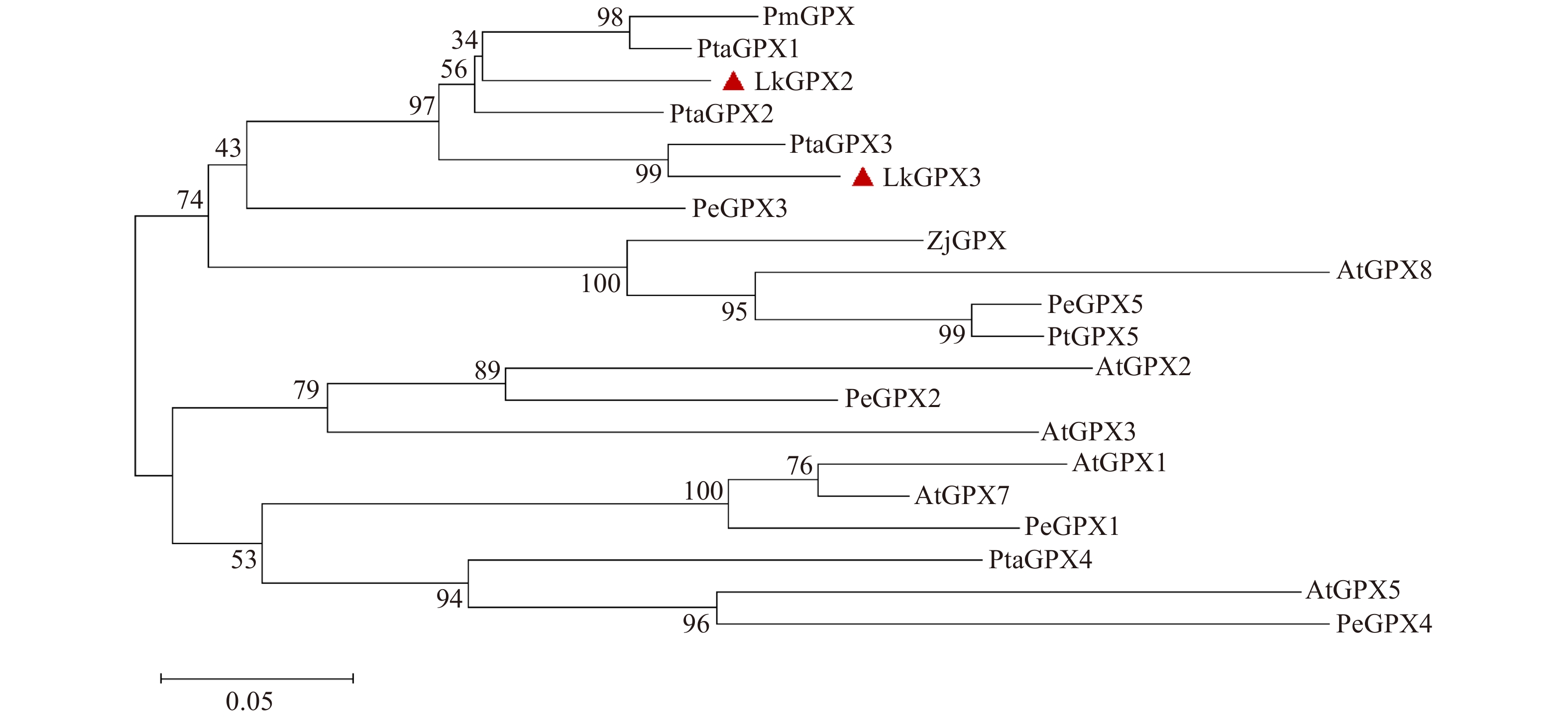
Studies on enzymatic properties and stress resistance of glutathione peroxidase (GPX) from Larix kaempferi
-
摘要:目的 植物谷胱甘肽过氧化物酶(GPX)是酶促活性氧清除机制中的关键酶之一,对日本落叶松GPX开展酶学特性与抗逆性研究,可以补充和完善林木改良基因资源,也为探究谷胱甘肽过氧化物酶抗逆的分子机制提供理论依据。方法 本研究以日本落叶松茎部组织为材料克隆谷胱甘肽过氧化物酶基因,进行生物信息学分析和亚细胞定位研究。诱导、纯化目的蛋白进行体外酶学活性测定,通过点斑试验、生长曲线试验验证GPX抗逆性。结果 从日本落叶松茎中克隆得到了2个GPX基因,分别命名为LkGPX2、LkGPX3,二者都含有完整的特征保守基序。构建系统进化树发现,LkGPXs和具有抗逆功能的PmGPX与PeGPX聚为一支。亚细胞定位显示,LkGPX2和LkGPX3蛋白在细胞核和细胞质中均有表达。以硫氧还蛋白(Trx)为电子供体进行体外酶学活性测定,LkGPX2与LkGPX3对过氧化氢(H2O2)、过氧化氢叔丁醇(t-BHP)和有机氢过氧化物(Cum-OOH)都具有催化活性,LkGPX2对于3种底物的催化活性分别为(0.402 ± 0.037)、(0.424 ± 0.018)、(0.425 ± 0.009) U/mg,LkGPX3对于3种底物的催化活性分别为(0.397 ± 0.027)、(0.449 ± 0.028)、(0.407 ± 0.021) U/mg。大肠杆菌体外逆境处理试验表明,LkGPX2、LkGPX3能够提高大肠杆菌对模拟干旱胁迫和盐胁迫的耐受性。结论 日本落叶松谷胱甘肽过氧化物酶(GPX)既能起到活性氧清除作用,同时具备一定应对非生物胁迫的能力。Abstract:Objective Glutathione peroxidase (GPX) is one of the key enzymes in the plant’s enzymatic active oxygen scavenging mechanism. Conducting enzymatic characteristics and stress resistance research on Larix kaempferi GPX can supply and improve genetic resources and provide theoretical basis for exploring the molecular mechanism of glutathione peroxidase stress resistance.Method The glutathione peroxidase genes were cloned using the stem tissue of Larix kaempferi as a template. In this study, bioinformatics analysis and subcellular localization research were conducted. The GPXs were induced and purified for in vitro enzymatic assays, and verified to have the stress resistance through spotting experiment and growth curve experiment.Result Two GPX genes were cloned from the stem of Larix kaempferi, named LkGPX2 and LkGPX3, both of which contained complete characteristic conserved motifs. LkGPXs were grouped together with the PmGPX and PeGPX in a phylogenetic tree, which were stress-resistant. Subcellular localization showed that both LkGPX2 and LkGPX3 proteins were localized in the nucleus and cytoplasm. Using thioredoxin (Trx) as an electron donor for in vitro enzymatic activity, LkGPX2 and LkGPX3 had catalytic activity on H2O2, t-BHP and Cum-OOH. The catalytic activities of LkGPX2 were (0.402 ± 0.037) U/mg, (0.424 ± 0.018) U/mg, (0.425 ± 0.009) U/mg, and the catalytic activities of LkGPX3 for the three substrates were (0.397 ± 0.027) U/mg, (0.449 ± 0.028) U/mg, and (0.407 ± 0.021) U/mg, respectively. Moreover, the results of stress treatment experiment indicated that LkGPX2 and LkGPX3 could improve the tolerance of Escherichia coli to simulated drought stress and salt stress.Conclusion Larix kaempferi glutathione peroxidase (GPX) is capable of scavenging active oxygen as well as responding to abiotic stresses.
-
丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)属于球囊菌门(Glomeromycata),能够与超过80%的陆地植物形成共生关系[1]。AMF从植物中吸收碳水化合物[2],反过来为植物提供磷酸盐、铵和微量营养素等矿物质[3]。AMF在改善植物生长发育的同时已逐渐应用于经济型农作物害虫的综合防治,并且取得了一定的防治效益[4]。除此之外,AMF定殖是否可以提高林木的抗虫性已成当前研究的热点。
AMF对植食性昆虫的影响存在3种情况,即正效应(约占45%)、负效应(35%)、变化不定和无影响(20%)[5]。例如:Wang等[6]发现摩西管柄囊霉(Glomus mosseae,GM)定殖的长叶车前草(Plantago lanceolata)已被证明可以抑制甜菜夜蛾(Spodoptera exigua)幼虫的相对生长速率,并且通过昆虫的植食作用改变梓醇在环烯醚萜苷水平中所占的比例;而Khaitov等[7]发现GM定殖的菜豆(Phaseolus vulgaris)提高了二斑叶螨(Tetranychus urticae)的繁殖率;Minton等[8]通过研究烟草天蛾(Manduca sexta)取食根内根孢囊霉(Glomus intraradices,GI)定殖的东方龙葵(Solanum ptycanthum)时发现烟草天蛾的体重与对照组无显著差异。菌根定殖对植物抗虫性影响的多态性可能与AMF的种类、昆虫的取食方式、食性广度、寄主植物种类、植物的营养与次生物质代谢等方面有关[9]。此外,昆虫对寄主植物的化学防御具有反防御机制。通常,昆虫在取食植物时会根据食物的质量调节自身的适应能力,尤其在取食一些不利于自身的食物时,其解毒机制被激活[10]。其中,磷酸酯酶可以分为酸性磷酸酯酶(acid phosphatases,ACP)和碱性磷酸酯酶(alkaline phosphatases,AKP),是一种广泛存在于昆虫体内的重要解毒酶,具有代谢一些杀虫剂,解毒部分外源物质的作用[11−12]。
青山杨(Populus pseudo-cathayana × P. deltoides)幼苗−舞毒蛾(Lymantria dispar)幼虫互作系统,由于青山杨幼苗的速生特性[13−14]和舞毒蛾幼虫的发育特性[15−16],是分析木本植物对昆虫抗性的极好模型。本研究以1年生青山杨和舞毒蛾幼虫为研究对象,对青山杨分别接种根内根孢囊霉(GI)和摩西管柄囊霉(GM),通过舞毒蛾幼虫的生长发育、食物利用和解毒酶活性分析GI或GM定殖对青山杨抗虫性的影响,进而为研究AMF对林业害虫的防治提供理论基础。
1. 材料与方法
1.1 试验材料与试剂
供试菌株:根内根孢囊霉(菌株号BJ09)和摩西管柄囊霉(菌株号GZ01A)(由甘肃省农业科学院提供)通过宿主玉米(Zea mays)和三叶草(Trifolium pratense)扩繁完成,菌剂中包含孢子、菌丝、根段和沙子,其中孢子含量15个/g。
供试植物:1年生青山杨扦插苗(为避免自然环境中菌根侵染样本植株干扰试验研究结果,故供试植物选择1年生青山杨扦插苗)。
供试土壤:草炭土、蛭石、沙子体积比为1∶1∶1,混合后在121 ℃下高压灭菌2 h。
供试昆虫:舞毒蛾卵块采自东北林业大学校园,饲料购自中国林业科学院森林生态环境与保护研究所。
供试试剂盒:总蛋白(TP)、酸性磷酸酯酶(ACP)、碱性磷酸酯酶(AKP)测定试剂盒购自南京建成生物工程研究所。
1.2 主要仪器与设备
高压蒸汽灭菌器,普和希株式会社生物医疗公司(MLS-3781L-PC);光照培养箱,东京理化器械株式会社(MTI-202B);电子分析天平,赛多利斯科学仪器有限公司(QYINTIX224-1CN);高速离心机,长沙湘智离心机仪器有限公司(TGL22M);电热恒温水浴锅,上海森信实验仪器有限公司(DK-S26);紫外可见光分光光度计,安玛西亚中国有限公司(ULtrospec5300pro)。
1.3 试验方法
1.3.1 杨树苗的培养及接菌处理
试验前将花盆用0.3%KMnO4溶液浸泡2 h进行消毒处理,每盆装入1.3 kg灭菌土壤,放置于东北林业大学育种苗圃温室。试验设置1个对照(CK)组和2个处理组,处理组分别接入丛枝菌根菌GI和GM,每1.3 kg土壤混入菌剂20 g,CK组不加菌剂。每盆移栽1株青山杨扦插苗,每组300盆,共计900盆,定期浇水除草。在开始饲喂昆虫前(青山杨扦插苗栽植80 d后),从每组随机各选取5株样树,每株至少选取50小段须根根样,根据Phillips等[17]方法测定菌根定殖率。
1.3.2 舞毒蛾幼虫饲养
舞毒蛾卵经10%甲醛溶液浸泡消毒,消除病毒的影响。置于恒温培养箱孵化,温度(25 ± 1) ℃,湿度为(70 ± 1)%,光周期16L∶8D(光照/黑暗时间为8 h/16 h)。待幼虫孵出后用人工饲料喂养至2龄[18]。将刚蜕皮的2龄幼虫分为3组,每组90头,分别摘取栽植80 d后的处理组和对照组叶片进行喂养,每2 d更换一次叶片,观察幼虫的生长发育状况。每组的3、4、5龄幼虫各取30头,测量其体重、体长、头壳宽。用电子分析天平称量每头幼虫体重,将幼虫放在1 mm网格纸上测定幼虫体长和头壳宽,并拍照保存图像。
1.3.3 舞毒蛾幼虫食物利用测定
在幼虫开始进入3龄、4龄、5龄时,分别从3组中各选取蜕皮不超过24 h的幼虫24头,并将每组所选的幼虫分为3个重复,继续用对应组的叶片饲养48 h,测定各重复组取食前鲜叶、取食后残叶和幼虫粪便的质量(湿质量);计算取食量、食物消耗率、转化率和利用率[19]。
I48=(mI−mF)/(1−L/mI) 式中:I48为48 h幼虫取食量,g;mI为取食前叶片鲜质量,g;mF为取食后叶片鲜质量,g; L为对照叶片失水量,g。
EAD=I48/mE×100% 式中:EAD为食物消耗率,%;mE为排粪质量,g。
ECI=(mBF−mBI)/(I48−mE)×100% 式中:ECI为食物转化率,%;mBF为取食后幼虫体重,g;mBI为取食前幼虫体重,g。
ECD=(mBF−mBI)/I48×100% 式中:ECD为食物利用率,%。
1.3.4 解毒酶活力测定
试验期间收集各处理组新蜕皮的4龄和5龄幼虫放置于−40 ℃冰箱备用。取3头相同处理的舞毒蛾同龄幼虫放置于玻璃匀浆器中,加入5 mL预冷的生理盐水(0.90%NaCl),在冰浴条件下充分研磨成匀浆后倒入10 mL离心管中,于4 ℃条件下10 000 r/min下离心10 min,上清液即为酶提取液[20]。采用试剂盒测定解毒酶ACP和AKP活力,每组测3个重复。酶液中组织蛋白含量采用总蛋白测定试剂盒(TP)进行测定。酶活计算公式:酸性磷酸酯酶(U/g) = (测定OD值/标准OD值) × 标准管含酚的量/(待测样本蛋白浓度 × 取样量);碱性磷酸酯酶(金氏单位/g) = (测定OD值/标准OD值) × 标准管含酚的量/(待测样本蛋白浓度 × 取样量)。
1.4 数据处理与分析
各龄期舞毒蛾图像使用Image J-v1.8.0软件测量体长和头壳宽,采用SPSS 19.0对舞毒蛾幼虫体重、体长、头壳宽、取食量、食物消耗率、食物转化率、食物利用率、ACP活性、AKP活性进行单因素方差分析,以LSD法进行多重比较。使用Excel 2016统计数据的平均值和标准误差并做图。
2. 结果与分析
2.1 青山杨根部GI和GM的定殖率
由图1可知AMF在青山杨根系中侵染定殖成功,图中可看到丛枝、泡囊和菌丝结构。在青山杨扦插苗栽植80 d后,其根部GI和GM定殖率如图2所示。GI定殖率为62.1%,GM定殖率为60.8%,未在CK组中检测到菌根定殖。
![]() 图 2 栽植80 d后青山杨扦插苗根部GI、GM的定殖率CK.对照;GI.根内根孢囊霉;GM.摩西管柄囊酶。不同小写字母表示不同处理之间差异显著(P < 0.05)。数据均为平均值 ± 标准差(n = 5)。下同。CK, control; GI, Glomus intraradices; GM, Glomus mosseae. Different lowercase letters indicate significant difference among varied groups (P < 0.05). The data annotation in the picture is average value ± SD (n = 5). The same below.Figure 2. Colonization rate of GI and GM at 80 d after planting
图 2 栽植80 d后青山杨扦插苗根部GI、GM的定殖率CK.对照;GI.根内根孢囊霉;GM.摩西管柄囊酶。不同小写字母表示不同处理之间差异显著(P < 0.05)。数据均为平均值 ± 标准差(n = 5)。下同。CK, control; GI, Glomus intraradices; GM, Glomus mosseae. Different lowercase letters indicate significant difference among varied groups (P < 0.05). The data annotation in the picture is average value ± SD (n = 5). The same below.Figure 2. Colonization rate of GI and GM at 80 d after planting2.2 GI、GM定殖青山杨对舞毒蛾幼虫体重的影响
舞毒蛾幼虫取食GI或GM定殖的青山杨叶片对其体重的影响如图3所示。3龄幼虫体重,GI和GM组均显著高于CK组(P < 0.05),同时GI组显著高于GM组(P < 0.05)。4龄幼虫体重,GI、GM组均显著高于CK组(P < 0.05),但GI组和GM组差异不显著(P > 0.05)。5龄幼虫体重,GI组与CK组差异不显著,GM组显著高于CK组(P < 0.05)。
![]() 图 3 各试验组舞毒蛾幼虫的体重数据均为平均值 ± 标准差(n = 30);不同小写字母表示同一龄期不同组之间差异显著(P < 0.05)。下同。 The data annotation in the picture is average value ± SD (n = 30); different lowercase letters indicate that there is significant difference among different groups at the same age (P < 0.05). The same below.Figure 3. Larvae body mass of spongy moth in each treatment group
图 3 各试验组舞毒蛾幼虫的体重数据均为平均值 ± 标准差(n = 30);不同小写字母表示同一龄期不同组之间差异显著(P < 0.05)。下同。 The data annotation in the picture is average value ± SD (n = 30); different lowercase letters indicate that there is significant difference among different groups at the same age (P < 0.05). The same below.Figure 3. Larvae body mass of spongy moth in each treatment group2.3 GI、GM定殖青山杨对舞毒蛾幼虫体长和头壳宽的影响
舞毒蛾幼虫取食GI或GM定殖的青山杨叶片对其体长和头壳宽的影响分别见图4和图5。3龄幼虫体长,GI组显著高于CK组和GM组(P < 0.05),GM组与CK差异不显著(P > 0.05)。4龄幼虫体长各组之间均不显著(P > 0.05)。5龄幼虫体长,GI组与CK组差异不显著(P > 0.05),GM组显著高于CK组和GI组(P < 0.05)。3龄幼虫头壳宽,GI组显著高于CK组和GM组(P < 0.05),GM组与CK差异不显著(P > 0.05)。4龄GI组与CK组和GM组差异均不显著(P > 0.05),GM组显著高于CK组(P < 0.05),5龄GI组和CK组差异不显著(P > 0.05),GM组显著高于CK组和GI组(P < 0.05)。
2.4 GI、GM定殖青山杨对舞毒蛾幼虫取食量的影响
GI或GM定殖的青山杨叶片对舞毒蛾幼虫取食量的影响如图6所示。3龄幼虫取食量,GI组显著高于CK组(P < 0.05),GM组与CK组和GI组差异均不显著(P > 0.05);4龄幼虫取食量,GI组显著低于CK组和GM组(P < 0.05),GM组与CK组差异不显著(P > 0.05)。5龄幼虫取食量,GI组显著低于CK组和GM组(P < 0.05),GM组显著高于CK组(P < 0.05)。
2.5 GI、GM定殖青山杨对舞毒蛾幼虫食物消耗率的影响
取食GI或GM处理的青山杨叶片对舞毒蛾幼虫食物消耗率的影响如图7所示。3龄幼虫食物消耗率,GI组显著高于GM组和CK组(P < 0.05),GM组与CK组差异不显著(P > 0.05);4龄幼虫食物消耗率,GI组与CK组差异不显著(P > 0.05),GM组显著高于CK组和GI组(P < 0.05);5龄幼虫食物消耗率,各处理组间差异均不显著(P > 0.05)。
2.6 GI、GM定殖青山杨对舞毒蛾幼虫食物转化率的影响
取食GI或GM定殖的青山杨叶片对舞毒蛾幼虫食物转化率的影响如图8所示。3龄幼虫食物转化率,GI组与CK组差异不显著(P > 0.05),GM组显著高于GI组与CK组(P < 0.05);4龄幼虫食物转化率各处理组和对照组差异均不显著(P > 0.05);5龄幼虫食物转化率,GI组与CK组和GM组差异均不显著(P > 0.05),GM组显著高于CK组(P < 0.05)。
2.7 GI、GM定殖青山杨叶片对舞毒蛾幼虫食物利用率的影响
取食GI或GM定殖的青山杨叶片对舞毒蛾幼虫食物利用率的影响如图9所示。GI组食物利用率,3龄时显著高于CK组(P < 0.05),4龄和5龄时GI组和CK组食物利用率差异不显著(P > 0.05)。GM组食物利用率,3龄、4龄显著高于CK组和GI组(P < 0.05),5龄显著高于CK组(P < 0.05),与GI组差异不显著(P > 0.05)。
2.8 GI、GM定殖青山杨对舞毒蛾幼虫ACP和AKP酶活性的影响
舞毒蛾幼虫取食GI或GM定殖的青山杨对其ACP和AKP的影响如图10和图11所示。ACP活性,4龄和5龄幼虫GI组显著低于CK组和GM组(P < 0.05),GM组显著高于CK组(P < 0.05)。AKP活性,4龄幼虫GI组显著高于CK组(P < 0.05),GM组显著高于CK组和GI组(P < 0.05);5龄幼虫GI组显著低于CK组(P < 0.05),GM组显著高于CK组和GI组(P < 0.05)。
3. 结论与讨论
菌根定殖下植物对植食性昆虫的生长影响不尽相同[21−22]。本研究GI定殖的青山杨对舞毒蛾幼虫的生长发育影响呈阶段特异性,表现为:在3、4龄时呈促进作用,5龄呈中性作用。而GM定殖的青山杨对舞毒蛾幼虫的生长发育表现出一种促进效应,表现为:体重、取食量增加,食物转化率、食物利用率提高。这表明植物对昆虫的生长受菌根的种类特异性影响。
食物消耗率、食物转换率、食物利用率是表示植食性昆虫对寄主植物取食利用效率的重要营养参数[23]。菌根定殖可能通过改变植物的物质代谢影响昆虫的食物利用。Selvaraj等[24]发现,接种GI的黑吉豆(Vigna mungo)降低了斜纹夜蛾(Spodoptera litura)的食物转化率与食物利用效率,抑制了幼虫的生长。这与我们的发现不同,本研究中GM组舞毒蛾幼虫食物转化率、食物利用率显著提高,这与其体重增长趋势一致,舞毒蛾幼虫生长受到促进的原因可能是GM提高了青山杨叶片的营养,增强了舞毒蛾幼虫的嗜食性。而在GI定殖下的青山杨对舞毒蛾4、5龄幼虫的食物利用和生长表现出一种中性效应,这就凸显了菌根定殖植物后对植食性昆虫影响的特异性。
目前,大量研究指出,在多种植食性昆虫中,ACP、AKP活性的增强对于提高昆虫应对胁迫压力的能力至关重要[25−26]。姜礅[27]研究发现,在Zn胁迫下,4龄和5龄舞毒蛾幼虫体内的ACP、AKP活性均显著高于对照,发育历期没有被延长,解毒酶ACP和AKP能积极响应舞毒蛾幼虫抵御Zn的胁迫。本研究发现,GI组幼虫ACP活性受到抑制,AKP活性在4龄时高于对照但在5龄时AKP低于对照,这可能是GI组幼虫生长发育在4龄后不再显著增长的原因。GM组幼虫ACP与AKP活性均得到显著促进且幼虫生长发育良好,说明舞毒蛾幼虫体内的解毒酶能积极响应取食接种GM的青山杨后的解毒过程。
同样的菌种对不同树种抗虫性的影响也呈不同的趋势。武帅[28]研究了GI和GM分别定殖银中杨(Populus alba × P. berolinensis)后对舞毒蛾的影响,结果发现:GI和GM均能提高银中杨叶片的防御蛋白活性和次生代谢物含量,但对舞毒蛾的影响却不相同,GI定殖对舞毒蛾的生长发育有促进作用,而GM定殖则抑制了舞毒蛾的生长与取食。而在本研究中,GI定殖对青山杨的抗虫性起中性作用;GM定殖降低了青山杨的抗虫性。表明AMF对植物和植食性昆虫的影响具有种类特异性。本研究结果为今后针对不同树种的AMF菌种选择和植食性昆虫生态防治提供了理论依据。
-
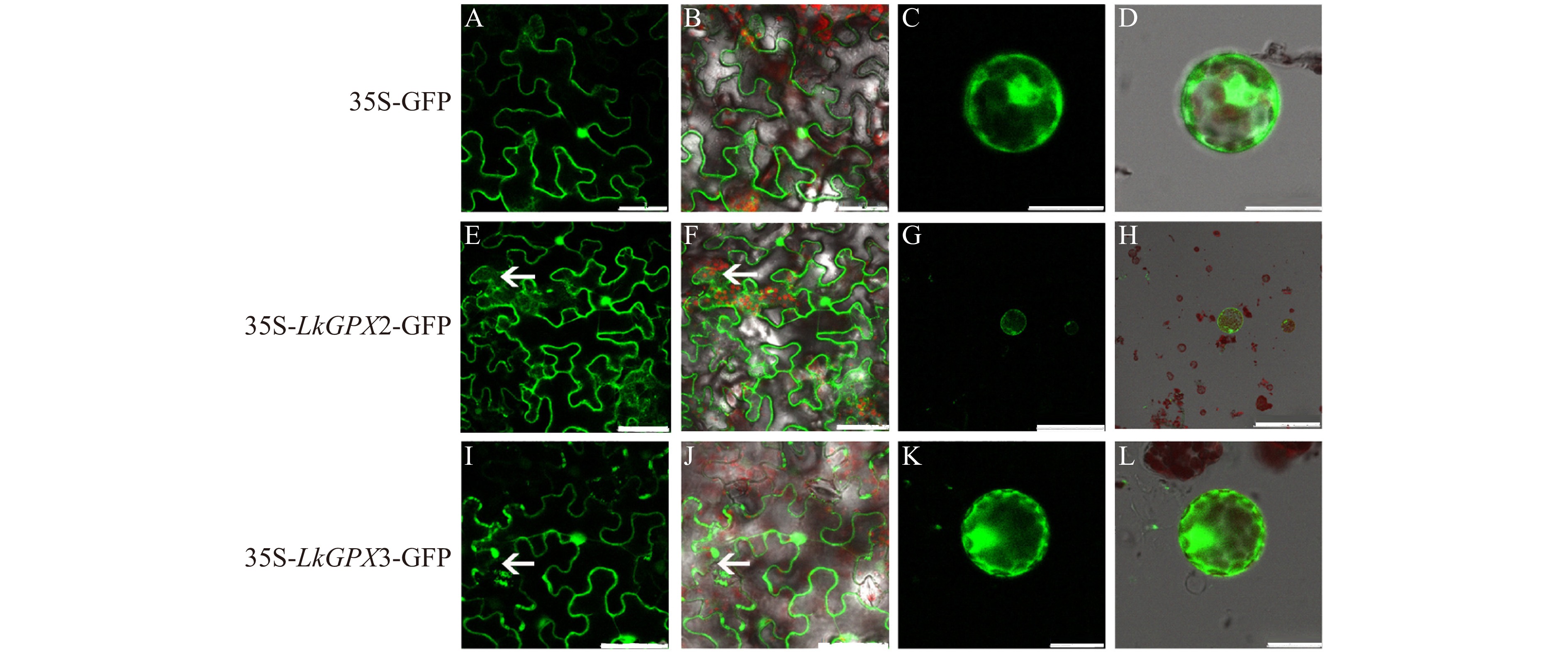
图 4 LkGPX2和LkGPX3亚细胞定位
A、E、I为GFP荧光;B、F、J为荧光叠加;C、G、K为原生质体GFP荧光;D、H、L为原生质体荧光叠加。其中A、B、E、F、I、J标尺为50 μm,C、D、K、L标尺为25 μm,G、H标尺为250 μm。A, E, I are GFP fluorescence; B, F, J are stacked fluorescence; C, G, K are GFP fluorescence of protoplast; D, H, L are stacked fluorescence of protoplast. The ruler of A, B, E, F, I, J is 50 μm; that of C, D, K, L is 25 μm and that of G, H is 250 μm.
Figure 4. Subcellular lolication of LkGPX2 and LkGPX3
图 5 LkGPX2、LkGPX3、Trx、TrxR蛋白纯化
A图中,M为标准蛋白marker,1为未诱导的pET28a空载,2为pET28a空载0.4 mmol/L IPTG诱导3 h,3为LkGPX2未诱导,4为LkGPX2 0.4 mmol/L IPTG诱导3 h,5为超声破碎后的上清液,6为100 mmol/L咪唑洗脱的目的蛋白。B、C、D图中,M为标准蛋白marker,1为未诱导的重组载体,2为0.4 mmol/L IPTG诱导3 h,3为超声破碎后的上清液,4为100 mmol/L咪唑洗脱的目的蛋白。In Fig. A, M is standard protein marker, 1 is uninduced pET28a blank vector, 2 is pET28a blank vector induced by 0.4 mmol/L IPTG for 3 h, 3 is uninduced LkGPX2, 4 is LkGPX2 induced by 0.4 mmol/L IPTG for 3 h, 5 is supernatant after ultrasound crushing, 6 is target protein eluted by 100 mmol/L imidazole. In Fig. B, C and D, M is standard protein marker, 1 is uninduced recombinant vector, 2 is induced by 0.4 mmol/L IPTG for 3 h, 3 is supernatant after ultrasound crushing, 4 is target protein eluted by 100 mmol/L imidazole.
Figure 5. Protein purification of LkGPX2, LkGPX3, Trx and TrxR
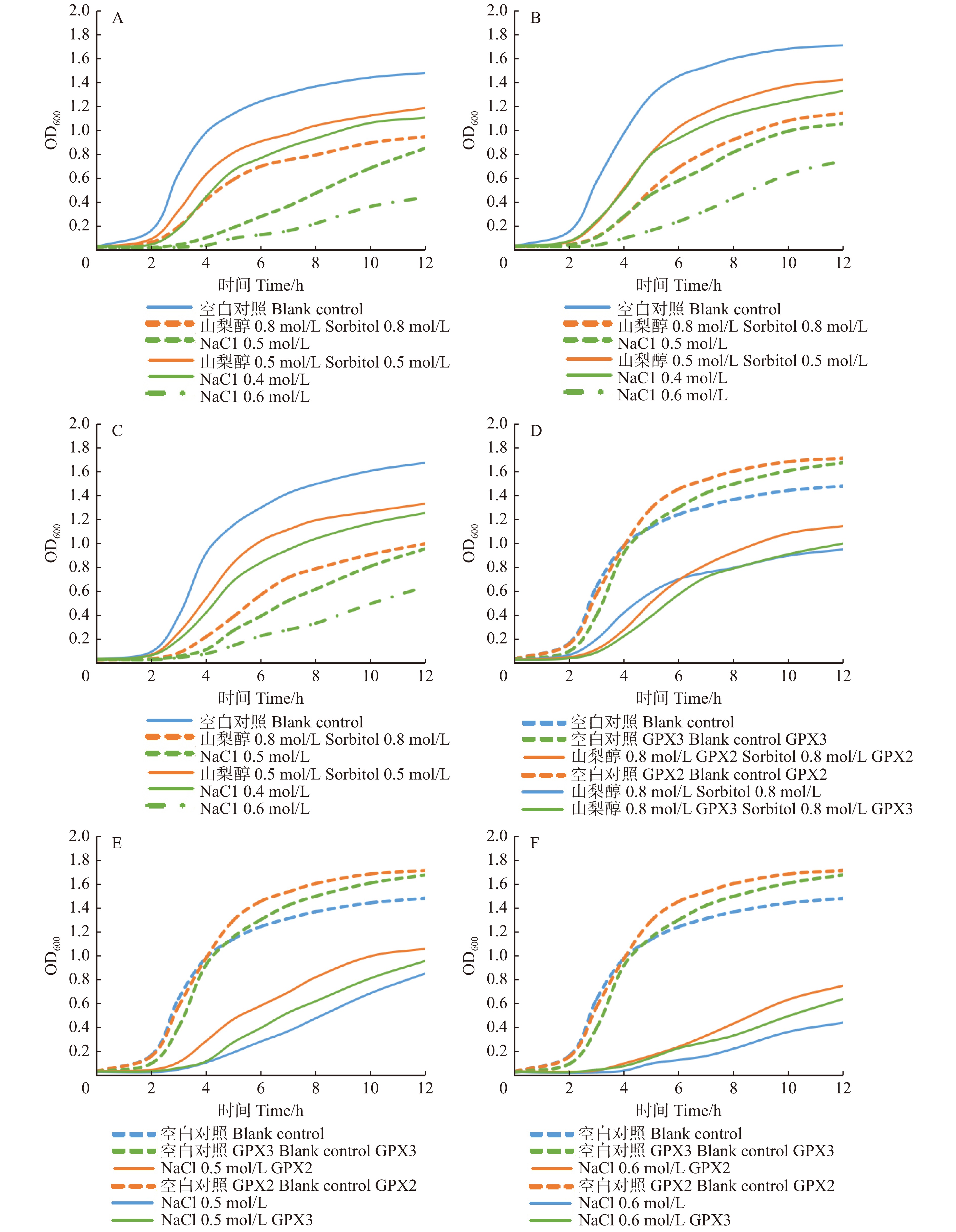
图 7 生长曲线法测定结果
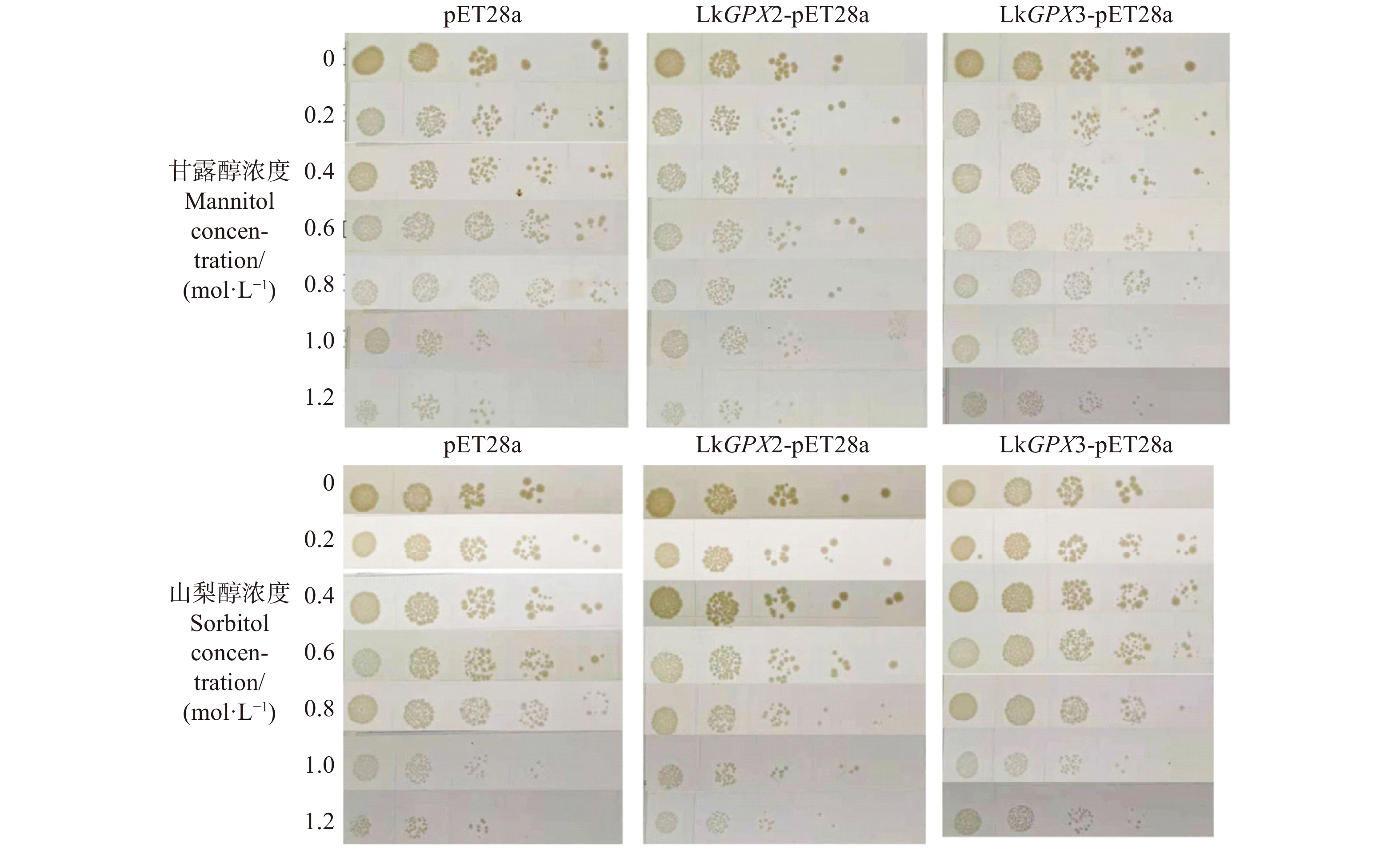
A为pET28a空载不同条件处理;B为LkGPX2-pET28a不同条件处理;C为LkGPX3-pET28a不同条件处理;D为空白对照与0.8 mol/L山梨醇处理对比;E为空白对照与0.5 mol/L NaCl处理对比;F为空白对照与0.6 mol/L NaCl处理。A is different treatments on blank pET28a vector; B is different treatments on LkGPX2-pET28a; C is different treatments on LkGPX3-pET28a; D is comparison of blank control and0.8 mol/L sorbitol treatment; E is comparison of blank control and 0.5 mol/L NaCl treatment; F is comparison of blank control and 0.6 mol/L NaCl treatment.
Figure 7. Test results of growth curve method
表 1 LkGPX2与LkGPX3基因的理化性质分析
Table 1 Physical and chemical property analysis of LkGPX2 and LkGPX3
基因名称
Gene name基因长度
Gene length/bp编码氨基酸个数
Number of coded
amino acids/aa分子量
Molecular
mass/kDa等电点
Isoelectric
pointLkGPX2 513 170 18.6 7.62 LkGPX3 513 170 19.0 5.34 表 2 LkGPX2与LkGPX3亚细胞定位预测
Table 2 Prediction of subcellular localization of LkGPX2 and LkGPX3 protein
亚细胞定位可能性
Possibility of subcellular localizationLkGPX2 LkGPX3 细胞质 Cytoplasm 65.2% 60.9% 细胞核 Nucleus 13.0% 13.0% 线粒体 Mitochondria 8.7% 8.7% 液泡 Vacuole 4.3% 4.3% 分泌小泡 Secretory vesicle 4.3% 4.3% 高尔基体 Golgi apparatus 4.3% 4.3% 细胞骨架 Cytoskeleton 4.3% 表 3 LkGPX2和LkGPX3酶学活性测定
Table 3 Enzymatic activity determination of LkGPX2 and LkGPX3
谷胱甘肽过氧化物酶
Glutathione peroxidase酶学活性 Enzymatic activity/(U·mg−1) 过氧化氢
H2O2叔丁基过氧化氢
t-BHP有机氢过氧化物 Cum-OOH LkGPX2 0.402 ± 0.037 0.419 ± 0.006 0.425 ± 0.009 LkGPX3 0.397 ± 0.027 0.449 ± 0.028 0.413 ± 0.012 -
[1] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology Biochemistry, 2010, 48(12): 909−930. doi: 10.1016/j.plaphy.2010.08.016
[2] Hasanuzzaman M, Bhuyan M H M B, Parvin K, et al. Regulation of ROS metabolism in plants under environmental stress: a review of recent experimental evidence[J]. International Journal of Molecular Science, 2020, 21: 42.
[3] Rio L A. ROS and RNS in plant physiology: an overview[J]. Journal of Experimental Botany, 2015, 66(10): 2827−2837. doi: 10.1093/jxb/erv099
[4] Xia X J, Zhou Y H, Shi K, et al. Interplay between reactive oxygen species and hormones in the control of plant development and stress tolerance[J]. Journal of Experimental Botany, 2015, 66(10): 2839−2856. doi: 10.1093/jxb/erv089
[5] Spruyt L M, Xu E J, Idänheimo N, et al. Spreading the news: subcellular and organellar reactive oxygen species production and signalling[J]. Journal of Experimental Botany, 2016, 67: 14.
[6] Berni R, Luyckx M, Xu X, et al. Reactive oxygen species and heavy metal stress in plants: impact on the cell wall and secondary metabolism[J]. Environmental and Experimental Botany, 2019, 161: 98−106. doi: 10.1016/j.envexpbot.2018.10.017
[7] Jung B G, Lee K O, Lee S S, et al. A Chinese cabbage cDNA with high sequence identity to phospholipid hydroperoxide glutathione peroxidases encodes a novel isoform of thioredoxin-dependent peroxidase[J]. The Journal of Biological Chemistry, 2002, 277(15): 12572−12578. doi: 10.1074/jbc.M110791200
[8] Navrot N, Collin V, Gualberto J, et al. Plant glutathione peroxidases are functional peroxiredoxins distributed in several subcellular compartments and regulated during biotic and abiotic stresses[J]. Plant Physiology, 2006, 142(4): 1364−1379. doi: 10.1104/pp.106.089458
[9] Marchal C, Hinoux V D, Bariat L, et al. NTR/NRX define a new thioredoxin system in the nucleus of Arabidopsis thaliana cells[J]. Molecular Plant Advance Access, 2013, 7(15): 30−44.
[10] Herbette S, Drevet P R, Drevet J R. Seleno-independent glutathione peroxidases: more than simple antioxidant scavengers[J]. FEBS Journal, 2007, 274(9): 2163−2180. doi: 10.1111/j.1742-4658.2007.05774.x
[11] Horta B B, Oliveira M A, Discola K F, et al. Structural and biochemical characterization of peroxiredoxin Qbeta from Xylella fastidiosa: catalytic mechanism and high reactivity[J]. Journal of Biological Chemistry, 2010, 285(21): 16051−16065. doi: 10.1074/jbc.M109.094839
[12] Rouhier N, Jacquot J P. The plant multigenic family of thiol peroxidases[J]. Free Radical Biology and Medicine, 2005, 38(11): 1413−1421. doi: 10.1016/j.freeradbiomed.2004.07.037
[13] Dietz K J. Peroxiredoxins in plants and cyanobacteria[J]. Plant Peroxredoxins, 2011, 15(4): 1129−1159.
[14] 王菲菲, 丁明全, 邓澍荣, 等. 胡杨谷胱甘肽过氧化物酶PeGPX基因的克隆及转化植株耐盐性分析[J]. 基因组学与应用生物学, 2012, 31(3): 231−239. doi: 10.3969/gab.031.000231 Wang F F, Ding M Q, Deng S R, et al. Cloning of glutathione peroxidase gene PeGPX from Populus euphratica and the salt tolerance of the transformed plants[J]. Genomics and Applied Biology, 2012, 31(3): 231−239. doi: 10.3969/gab.031.000231
[15] 蔡琼. 马尾松抗旱相关基因的克隆及表达分析[D]. 贵阳: 贵州大学, 2017. Cai Q. Cloning of the related drought-resistant gene from Pinus massoniana and its expression analysis[D]. Guiyang: Guizhou University, 2017.
[16] Zhai C Z, Zhao L, Yin L J, et al. Two wheat glutathione peroxidase genes whose products are located in chloroplasts improve salt and H2O2 tolerances in Arabidopsis[J]. PLoS One, 2013, 8: 10.
[17] Passaia G, Fonini L S, Caverzan A, et al. The mitochondrial glutathione peroxidase GPX3 is essential for H2O2 homeostasis and root and shoot development in rice[J]. Plant Science, 2013, 208(9): 93−101.
[18] Gaber A, Ogata T, Maruta T, et al. The involvement of Arabidopsis glutathione peroxidase 8 in the suppression of oxidative damage in the nucleus and cytosol[J]. Plant Cell Physiology, 2012, 53(9): 1596−1606. doi: 10.1093/pcp/pcs100
[19] 赵丽. 油松GPX基因家族的分子特性研究[D]. 北京: 北京林业大学, 2014. Zhao L. Molecular properties of glutathione peroxidase family proteins from Pinus tabuliformis[D]. Beijing: Beijing Forestry University, 2014.
[20] 王炜. 小立碗藓GPX基因家族的功能分化与催化特性研究[D]. 北京: 北京林业大学, 2015. Wang W. Functional divergence and catalytic properties of glutathione peroxidase family from Physcomitrella patens[D]. Beijing: Beijing Forestry University, 2015
[21] Chen M Y, Li K, Li H P, et al. The glutathione peroxidase gene family in Gossypium hirsutum: genome-wide identification, classification, gene expression and functional analysis[J]. Scientific Reports, 2017, 7: 44743. doi: 10.1038/srep44743
[22] Kim Y J, Jang M G, Noh H Y, et al. Molecular characterization of two glutathione peroxidase genes of Panax ginseng and their expression analysis against environmental stresses[J]. Gene, 2014, 535(1): 33−41. doi: 10.1016/j.gene.2013.10.071
-
期刊类型引用(10)
1. 王蕾,郭秋菊,艾训儒,姚兰,朱江,刘西尧. 林分空间结构对天然林木本植物多样性的影响. 森林与环境学报. 2024(01): 20-27 .  百度学术
百度学术
2. 朱临渊,曹受金,颜惠芳,彭翠英,廖德志,梁军生,杨鹏华,龚雄夫,王旭军. 杉木凋落物对魔芋的生长及其生理生化影响研究. 湖南林业科技. 2024(01): 1-9 .  百度学术
百度学术
3. 于佳乐,刘志明,王海英. 木醋液对4种蔬菜种子萌发的影响. 中国野生植物资源. 2024(02): 64-72 .  百度学术
百度学术
4. 荆蓉,彭祚登,李云,王少明. 刺槐林下凋落物浸提液对刺槐种子萌发和胚生长的化感作用. 浙江农林大学学报. 2023(01): 97-106 .  百度学术
百度学术
5. 李梦琪,赵冲,罗航,陈杭,刘博,王正宁. 不同凋落物水浸提液对杉木种子萌发和幼苗早期生长的化感作用. 江苏农业科学. 2023(07): 138-146 .  百度学术
百度学术
6. 荆蓉,彭祚登,李云,王少明. 刺槐林下枯落物浸提液对自身幼苗生长的化感效应. 西北林学院学报. 2023(04): 27-33 .  百度学术
百度学术
7. 罗合一,李美玄,贠民强,马印玺,赵萧汀,赵蕾,曲同宝. 四种凋落物对入侵植物火炬树种子萌发和幼苗生长的影响. 山东农业科学. 2023(10): 59-65 .  百度学术
百度学术
8. 马永林,武利玉,张砡嫣,杨玉凤. 兰州主要阔叶造林树种凋落物对火炬树种子萌发的影响. 草原与草坪. 2022(03): 91-99 .  百度学术
百度学术
9. 晋梦然,贾梅花,肖倩茹,刘金福,沈彩霞,施友文,何中声. 林窗凋落物化感作用对格氏栲幼苗生长的影响. 生态学报. 2022(20): 8288-8299 .  百度学术
百度学术
10. 徐来仙,姚兰,周大寨,郭秋菊,朱江,邓楚,艾鑫,夏煜轩. 水杉凋落物水浸提液对其种子萌发和生长的化感作用. 广西植物. 2022(11): 1949-1958 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载: