Functional annotation and analysis of transcriptome of Bombax ceiba with different flower colors
-
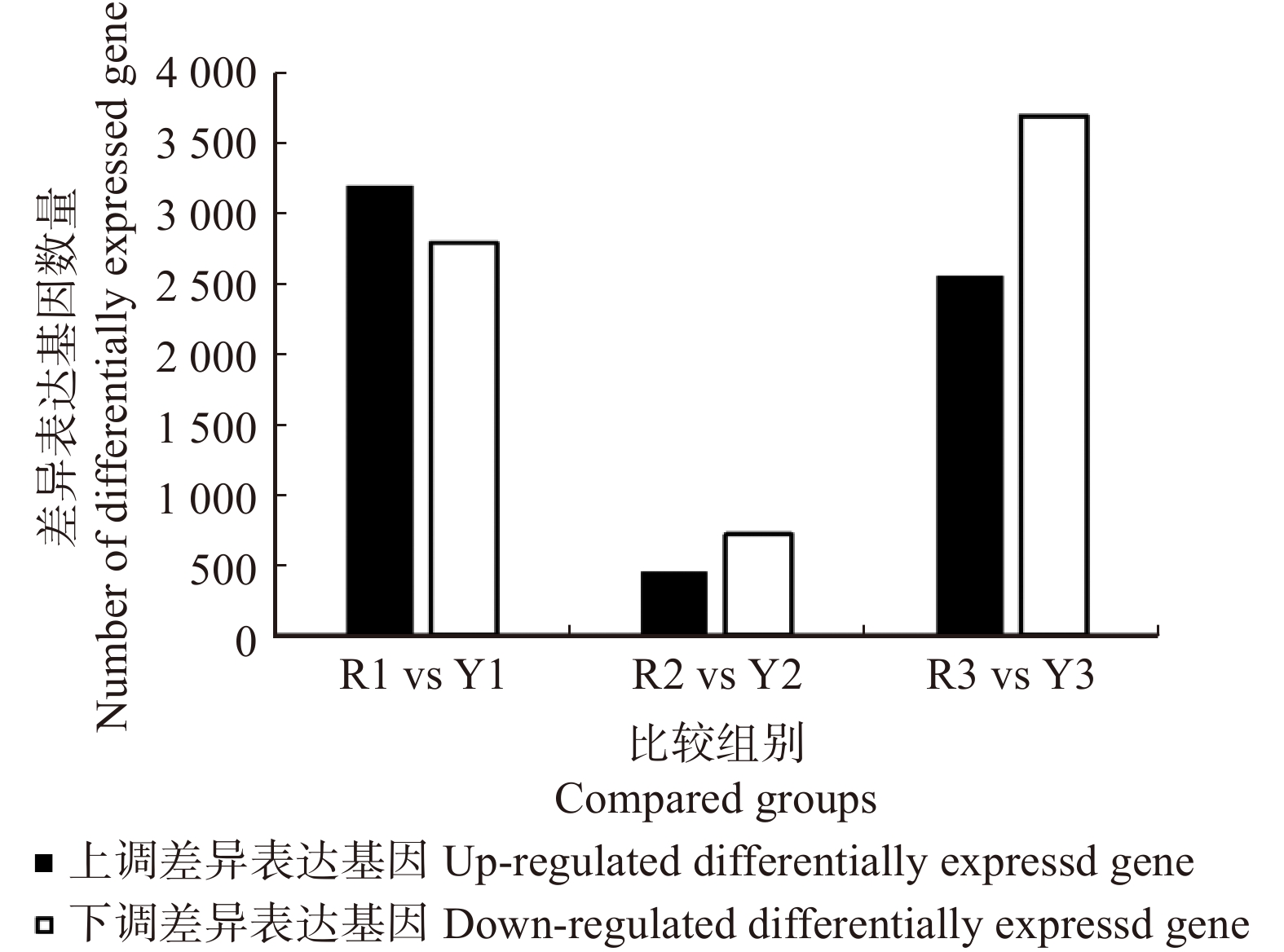
摘要:目的 木棉是我国南方地区重要的观赏植物,研究不同时期花蕾和花朵的花瓣基因表达差异,揭示花色变异的遗传调控机制,为建立花色定向育种技术提供科学依据。方法 以木棉不同发育时期深红色花和黄色花的花瓣为研究对象,利用Illumina HiSeqTM 4000开展转录组测序;分别采用DESeq2和Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库进行差异表达基因鉴定和通路富集分析。结果 测序共获得75 190个单基因,4 772个单基因能被公共数据库注释;基因功能富集分析显示,基因主要富集在基本功能预测、信号转导机制和转录后修饰、蛋白折叠、分子伴侣等通路。共获得不同时期差异表达基因10 397个,显著富集在29个生物学通路,主要包括光合作用、代谢和植物激素信号转导通路等。其中,参与苯丙烷生物合成通路的差异表达基因有72个,参与类胡萝卜素、黄酮类生物合成通路和苯丙氨酸代谢通路的差异表达基因分别为25个,这些通路和基因均与花青素的生物合成相关;另有4个差异表达基因显著富集在甜菜碱的生物合成通路中。qRT-PCR数据验证了转录组数据的可靠性。结论 (1)光合作用、代谢、植物激素信号转导、黄酮类生物合成、苯丙烷生物合成、苯丙氨酸代谢及能量代谢等通路相关基因可能参与花瓣的发育过程。(2)黄酮类生物合成通路相关基因在深红色花发育的花蕾中期与花朵期显著高表达,可能是花色呈现红色的主要原因。(3)类胡萝卜素生物合成通路的关键合成酶基因的部分家族成员在黄色花发育的花蕾期和花蕾中期显著高表达,可能是导致花色呈现黄色的主要原因。Abstract:Objective Bombax ceiba is an important ornamental plant in southern China. The aim of this study on the gene expression differences of flower buds and flowers in different stages was to reveal the genetic regulation mechanism of flower color variation, and provide a scientific basis for the establishment of flower color directional breeding technology.Method Taking the petals of dark-red-line and yellow-line flowers of B. ceiba at different developmental stages as materials, and the Illumina HiSeqTM 4000 was used for transcriptome sequencing. DESeq2 and Kyoto Encyclopedia of Genes and Genomes (KEGG) databases were used to identify differentially expressed genes (DEGs) and enrichment pathways.Result A total of 75 190 unique genes were obtained by sequencing, and 4 772 single genes could be annotated by public databases. Gene function enrichment analysis showed that genes were mainly enriched in basic function prediction, signal transduction mechanism and post transcriptional modification, protein folding, molecular chaperone and other pathways, etc. A total of 10 397 DEGs at different periods were obtained, which were significantly enriched in 29 biological pathways, mainly including photosynthesis, metabolic and plant hormone signal transduction pathways. Among them, there were 72 DEGs involved in the phenylpropanoid biosynthesis pathway, and 25 DEGs involved in carotenoid biosynthesis, flavonoid biosynthesis, phenylalanine metabolism, respectively. These pathways and genes were all related to the biosynthesis of anthocyanins. Another 4 DEGs were significantly enriched in the betalain biosynthesis. The results of qRT-PCR data verified the reliability of the transcriptome data.Conclusion (1) The genes related to photosynthesis, metabolic pathways, plant hormone signal transduction pathways, flavonoid biosynthesis pathways, phenylpropane biosynthesis pathways and energy metabolism pathways may be involved in the development of petals. (2) The genes involved in flavonoid biosynthesis pathway are significantly highly expressed in the middle stage and bloom stage of dark-red line, which may be the main reason for the dark-red flower color. (3) Some family members of the key synthase genes of the carotenoid biosynthesis pathway are highly expressed in the bud and middle stage of yellow-flower line, which may be the main reason for the yellow flower color.
-
Keywords:
- Bombax ceiba /
- flower color /
- transcriptome /
- variation mechanism /
- KEGG analysis
-
从古至今,木材作为一种天然可再生的环保型材料,以其独特的性能和优良的环境学特性深受人们喜爱,并广泛应用于生产生活的各个方面。随着现代科学技术的突飞猛进、人类学理论的不断发展,考古木材作为进行植物考古学和环境考古学研究的一种典型生物材料,正成为专家学者的研究热点,国内外考古作业挖掘出大量的木质文物[1-2],例如:“Riksapplet号”沉船[3]、“小白礁Ⅰ号”沉船[4]、“南海Ⅰ号”船木[5]等为出土考古木材的研究提供了丰富的材料。
Crestini等[6]运用X射线衍射和扫描电镜的方法对埃及古代棺木进行研究,研究发现:考古木材中纤维素、半纤维素、木质素均产生不同程度的降解,小分子化合物发生改变,使考古木材变得脆弱而柔软。Łucejko等[7]运用热裂解气相色谱–质谱联用法对取自比萨圣罗索雷古船的木材样品进行了主成分分析,样品木质素中愈创木基和紫丁香基的去甲基化表明考古木材中多糖产生了流失。卢芸[8]指出大多木质文物纤维素结晶区被严重破坏,葡聚糖侧链的乙酰基消失,多糖类物质遭到严重降解,木质素相对含量明显增加。
考古木材微观结构的变化,将在很大程度上影响其水分吸着行为,因而可利用等温吸附曲线和水分吸着理论对考古木材与吸着水分子的相互作用进行分析,如Guggenheim-Anderson-de Boer模型[9]、Hailwood-Horrobin模型[10]等。Guo等[11]利用Guggenheim-Anderson-de Boer模型计算得到每千克古代润楠木(Machilus pingii Cheng ex Yang)样品的最大单层吸水量为7.388 kg,而相同树种现代木材的最大单层吸水量仅为4.602 kg,考古木材的最大单层吸水量比现代木材增加了61%。
木材的水分吸着过程必然伴随着热量或能量的变化[12],因此基于吸附热力学考察水分吸着机理,有助于从本质上获得考古木材与水分相互作用方面的信息。曹金珍[13]发现西藏云杉(Picea spinulosa)在水分吸着过程中微分吸着热、微分吸着熵值随吸湿过程不断增大。Simón 等[14]研究了在吸湿和解吸平衡态下辐射松(Pinus radiata)的微分吸着熵值随含水率的变化曲线,结果显示在相同平衡含水率下辐射松解吸的微分吸着熵值大于吸湿值。
在以往的研究中,研究者多从成分、结构角度对考古木材水分吸着行为进行研究,且取得了一定进展,而对考古木材的吸附热力学研究较少,而且对各种热力学量变化的系统分析也很欠缺。本研究将聚焦考古木材在吸湿和解吸平衡状态下微分吸着热、自由能变化及微分吸着熵三大热力学量的研究,并分别利用电子显微镜(scanning electron microscope,SEM)、傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析考古木材的细胞壁结构和化学成分变化,从而建立考古木材微观结构与其水分吸着行为间的构效关系,探究考古木材与现代木材在水分吸附热力学方面的差异及其原因,为从能量角度解析考古木材与水分之间的相互作用机制奠定理论基础,同时也可为我国木质文物的保护提供科学依据,以减少出土饱水木质文物与环境中水分的相互作用,提高木质文物的尺寸稳定性。
1. 材料与方法
1.1 材 料
本研究所用考古木材取自成都文物考古研究院发掘出土的南宋木棺残片,由研究院提供的材料和信息确定为考古柏木,并采集四川产柏木(Cupressus sp.)作为现代对照材。
1.2 细胞壁微观形貌表征
利用滑动切片机(REM-710,Yamato Kohki industrial Co.,Ltd,Japan)制得尺寸为1 mm(轴向) × 2 mm(弦向) × 2 mm(径向)的柏木考古木材与现代木材薄片试样(试样重复数为3),用于SEM观察。在80 ℃的鼓风干燥箱中将试样干燥至质量恒定后进行喷金处理,设置SEM(S-3400,Hitachi,日本)加速电压为3 kV,对柏木试样的细胞结构进行观察,初步了解考古木材的降解、腐朽情况。
1.3 化学成分表征
利用研磨机将考古木材与现代木材样品加工成100目以下的木粉,并在80 ℃的真空干燥箱中干燥至质量恒定,之后将木粉与溴化钾充分混合研磨压制成透明薄片,利用红外光谱仪(BRUKER vertex 70 V,德国)对试样进行检测分析,扫描范围设为400 ~ 4 000 cm−1,分辨率为4 cm−1,每个试样扫描次数为32次。重复测试3次,取平均值。
1.4 吸附热力学量测定
将柏木考古木材、现代木材样品加工为20 mg左右木片,并分别置于(103 ± 2)℃下干燥至质量恒定,用于动态水分吸附分析(dynamic vapor sorption,DVS)实验。将各组试样放入DVS中,分别预设恒定温度为25和50 ℃,相对湿度以10%为梯度从0%增加到90%,继续增加至95%,然后降回至90%,再以10%为梯度从90%降低到0%,试样在每个相对湿度下逐渐达到吸湿/解吸平衡后(当样品质量变化速率连续在10 min内小于0.000 1%/min,则认为样品达到吸湿/解吸平衡),仪器自动进入下一个相对湿度梯度。仪器每隔1 min记录样品质量、温度和相对湿度等数据,得到考古木材和现代木材的吸湿和解吸平衡的等温吸附曲线。
利用Hailwood-Horrobin水分吸着理论[10]分析所获得的等温吸附曲线,木材在不同相对湿度条件下达到的平衡含水率可表达为
M=Mh+Md=18m(KhKdH1+KhKdH+KdH1−KdH) (1) 式中:M为试样平衡含水率(%);Mh为水合水质量分数(%);Md为溶解水质量分数(%);m为单位摩尔数吸着位点的绝干木材质量(g/mol);Kh为水合水与溶解水之间的平衡常数;Kd为溶解水与环境温湿度之间的平衡常数;H为相对湿度(%)。
将式(1)整理成多项式,具体为
HM=A+BH−CH2 (2) 式中:A、B、C为多项式的拟合参数,A、B、C与Kh、Kd、m的关系为
A=m18×1Kd(Kh+1) (3) B=m18×Kh−1Kh+1 (4) C=m18×KhKdKh+1 (5) 通过不同相对湿度环境试样的等温吸湿曲线数据分析可得到拟合参数A、B、C的值,进而可以求解m、Kh和Kd的值,公式中
m18 的倒数18m 表示木材中有效吸着基团被水合水饱和时的含水率,间接表达了水分吸着位点的数量。利用各组试样的DVS数据拟合等温吸附曲线,进一步通过Clausius-Clapeyron公式[15]分别计算考古木材与现代木材的微分吸着热QS、自由能变化ΔG和微分吸着熵ΔS,分析考古木材与现代木材在吸附热力学量间的差异,各热力学量的计算公式如下。
QS=0.254d(ln1H)/d(ln1H)d(1T)d(1T) (6) ΔG=−RT18lnH (7) ΔS=QS−ΔG/T (8) 式中:T为温度(K);R为气体常数。
T和H的值均由DVS实验的拟合数据获取,然后分别通过公式(6)、(7)计算得到QS和ΔG的值,进一步计算得到ΔS。
2. 结果与讨论
2.1 细胞壁结构
图1为考古木材与现代木材横切面、纵切面的SEM图片。对比考古木材与现代木材图像,可以发现在经历长时间的饱水腐朽下,考古木材除复合胞间层、细胞角隅保存相对完整外[16-17],其细胞壁结构发生了明显的变化,与现代木材完整有序的细胞排列相比(图1b),考古木材由于长时间遭受微生物降解,细胞结构发生破坏,细胞壁产生腐朽。
具体而言,考古木材细胞壁上出现少量圆形孔洞(图1a),除此之外,从考古木材纵切面可见纹孔膜腐朽细节(图1c),并有菌丝体的存在(图1d),该菌丝体是导致考古木材在所处环境中受到降解的各类真菌的聚集体。Guo等[11]通过氮气吸附法和压汞法对山桐子(Idesia polycarpa)考古木材多孔结构的研究结果表明,考古木材的中孔隙的总孔体积比现代木材样品增加了471%,这也进一步证明了本研究中考古木材孔洞增多的事实。
2.2 化学成分变化
对等量考古木材与现代木材样品的红外光谱进行归一化处理后,可用吸收峰高度半定量表示吸收峰所代表基团的含量[18],通过对比考古木材与现代木材试样红外光谱(图2)的特征吸收峰位置变化及消失情况,结合各特征吸收峰所代表的化学基团,研究得到考古木材3种主要化学成分(纤维素、半纤维素、木质素)的含量变化情况及极性基团−OH、−COOH类型和含量的变化情况。
3 337 ~ 3 401 cm−1范围内的吸收峰代表极性基团−OH(O−H伸缩振动),考古木材在此处的吸收峰高度小于现代木材,证明考古木材中−OH含量减少。选取1 742 cm−1(半纤维素C=O伸缩振动)、1 231 cm−1(半纤维素酰氧键−COO伸缩振动)为半纤维素的代表特征峰,与现代木材相比,柏木考古木材的红外吸收光谱在1 742、1 231 cm−1处吸光度变小,特别是在1 742 cm−1处吸收峰几乎完全消失,证明考古木材细胞壁结构中的半纤维素降解严重;另一方面,1 231 cm−1吸收峰代表半纤维素酰氧键−COO,考古木材在1 231 cm−1处的吸收峰高度明显小于现代木材,证明考古木材半纤维素上的−COOH含量减少。
此外,由于考古木材纤维素结晶区中纤维素链的氢键网络的部分断裂,导致892 cm−1处的峰几乎消失,而该处波峰代表C−H弯曲振动,并且对氢键系统的性质敏感,因此该峰几乎消失表明,在考古木材试样中形成更稳定氢键的羟基数量减少,同时这也表明考古木材中无论是无定形区还是结晶区中的纤维素链都发生部分降解[19]。
指纹区吸收光谱峰数多、较为复杂,包含了更多能反映分子结构细微变化的信息[20]。为了提供更多的信息,将FTIR光谱图分析细化至3个指纹区域(1 550 ~ 1 800 cm−1、1 200 ~ 1 550 cm−1和850 ~ 1 200 cm−1),在这个范围内通过直接的红外光谱分析考古木材和现代木材仍存在一定局限性,因为指纹区往往存在高度重叠的峰,难以分辨和解析。为此,通过对考古木材和现代木材指纹区光谱进行分峰拟合处理,得到分峰拟合曲线,可以更直观地分析考古木材化学成分的变化。
通过对比考古木材和现代木材FTIR在1 550 ~ 1 800 cm−1波数范围内的分峰拟合曲线(图3a)可以发现,考古木材在1 654 cm−1(木质素中共轭C=O伸缩振动)处吸收峰吸光度值较高,这说明考古木材木质素相对含量升高。通过对比考古木材和现代木材FTIR在1 200 ~ 1 550 cm−1波数范围内的分峰拟合曲线(图3b)可以发现,考古木材在1 418 cm−1(木质素甲基中C−H弯曲振动)处吸收峰强度变大,代表考古木材木质素相对含量升高。通过对比分析考古木材和现代木材FTIR在850 ~ 1 200 cm–1波数范围内的分峰拟合曲线(图3c)可以得到:考古木材在892 cm–1(纤维素C−H弯曲振动)处峰几乎消失,这表明在考古木材中形成更稳定氢键的羟基数目减少;1 159 cm–1(综纤维素C−O−C变形振动)处,考古木材吸收峰吸光度值很低,这表明综纤维素也有一定程度的降解。
综上可以发现,考古木材与现代木材相比,半纤维素、纤维素降解严重,纤维素骨架结构受到破坏,因此在SEM下可观察到细胞壁产生腐朽,这种化学成分和化学结构的变化进一步导致了细胞壁孔洞的出现,从化学成分变化角度解释了SEM中观察到考古木材出现孔洞等腐朽现象的原因。通过Xia等[21]的研究,考古木材木质素的化学结构也发生了变化,木质素仍会有降解,但考古木材中多糖类物质(纤维素、半纤维素)比芳环类物质(木质素)降解程度更高,因而木质素相对含量总体有升高趋势[22-23]。除纤维素、半纤维素含量降低及木质素相对含量升高的变化外,考古木材中极性基团−OH、−COOH含量均减少,导致考古木材对水分的吸着减少。
2.3 吸附热力学分析
2.3.1 Hailwood-Horrobin模型拟合
通过Hailwood-Horrobin模型拟合等温吸附曲线,不仅可以得到给定温度下木材吸湿和解吸任意平衡含水率状态下的相对湿度,更可以通过研究考古木材与现代木材的曲线差异,帮助理解考古木材水分吸附行为的差异本质。
根据Hailwood-Horrobin模型分别拟合出在25和50 ℃下考古木材、现代木材的等温吸附曲线(图4)。从中可以看出各等温吸附曲线的拟合度R2值均高于0.99,即Hailwood-Horrobin模型能够较好地描述考古木材及现代木材的等温吸附曲线。所有的等温吸附曲线均呈现“S”形,这说明无论考古木材还是现代木材都属于Ⅱ类等温吸附曲线,具备多孔材料的吸附特征[24-25]。在给定温度的每一个相对湿度条件下,考古木材的平衡含水率均高于现代木材,以温度为50 ℃,相对湿度为0.6时为例,考古木材平衡含水率为7.94%,现代木材为7.46%,考古木材是现代木材的1.1倍。这是因为图1a的 SEM图像显示考古木材物理环境遭到改变,细胞壁孔洞增多,即木材降解程度越大,木材细胞壁内孔隙越多,对水分的容纳空间增加,含水率越高,所以考古木材在经历长时间的降解后平衡含水率高于现代木材。
图5为50 ℃下考古木材吸湿和解吸平衡状态的等温吸附曲线,图5显示考古木材的解吸曲线始终位于吸湿之上,即出现了水分吸湿滞后现象。表1总结了在不同相对湿度条件下,考古木材、现代木材分别在25、50 ℃下的滞后率。从表1可以看出:随着温度或相对湿度的升高,考古木材和现代木材的滞后率均增大,即水分吸湿滞后均减小,这与以往研究结果一致[13];另一方面,考古木材与现代木材的水分吸湿滞后大小差异不大。
2.3.2 吸湿平衡状态下的热力学量分析
2.3.2.1 微分吸着热
图6是吸湿平衡状态下考古木材与现代木材中水分的微分吸着热(QS)随含水率(moisture content,MC)的变化曲线,QS值越大表示木材中水分子与周围分子之间的结合力越强[13]。与以往研究结果略有不同的是,在MC为5%处产生一明显拐点。根据曲线变化趋势,可以将曲线分为两个阶段,当MC小于 5%的低含水率状态下时,QS值逐渐增大直至达到最大值,这表明水分子和木材之间的氢键结合首先表现为单层分子之间的相互结合,且随MC增大,单个水分子和木材中的−OH形成了更多的氢键结合,相互作用更强,形成的键能更高[18]。当含水率大于5%时,QS值随MC的增大而减小,此时单分子层吸着水几乎达到饱和,吸着水分子与木材实质之间形成的氢键结合作用变弱,键能降低[13]。
表 1 考古木材、现代木材在25、50 ℃下不同相对湿度下的吸湿滞后Table 1. Moisture sorption hysteresis of archaeological wood and recent wood under different relative humidities at 25 and 50 ℃相对湿度
Relative humidity滞后率 Hysteresis rate 25 ℃考古木材
25 ℃-archaeological wood50 ℃考古木材
50 ℃-archaeological wood25 ℃现代木材
25 ℃-recent wood50 ℃现代木材
50 ℃-recent wood0.1 0.62 0.74 0.63 0.71 0.2 0.63 0.72 0.64 0.73 0.3 0.64 0.72 0.65 0.74 0.4 0.66 0.73 0.67 0.76 0.5 0.68 0.75 0.70 0.78 0.6 0.71 0.77 0.73 0.81 0.7 0.76 0.81 0.77 0.84 0.8 0.82 0.86 0.84 0.89 0.9 0.91 0.94 0.93 0.95 考古木材与现代木材相比,整体曲线形状基本相同,但考古木材的QS值随MC的变化曲线位于现代木材之下。根据上文FTIR分析,考古木材化学成分中纤维素、半纤维素大量降解,因此外界水分子可结合−OH、−COOH位点数量减少,这种化学环境的改变导致吸着水与木材分子之间的结合减少,QS值降低[26]。
2.3.2.2 自由能变化
水分的自由能变化的物理意义是水分子润胀木材并切断木材分子相互间氢键结合,裸露木材吸着点所需做的功[13]。基于图7所示吸湿平衡状态下考古木材与现代木材中水分的自由能变化ΔG值随MC的变化曲线,可以发现考古木材与现代木材的ΔG值均随MC的增大而减小。ΔG值与MC变化呈负相关可以解释为,MC升高使木材可塑性增大,吸着水分子与木材实质分子的协同运动加剧,因此裸露木材吸着点所需做的功减少。
其次,无论是考古木材或是现代木材,50 ℃相较于25 ℃的ΔG值都有一定程度的减小,这是因为温度升高吸着水分子能量增加,活动加剧,所需做的功减小。
2.3.2.3 微分吸着熵
微分吸着熵(ΔS)体现了木材中吸着的水分子与液态水分子相比排列规则上的差异,ΔS > 0代表木材中水分子排列更有规律[13]。根据吸湿平衡状态下考古木材与现代木材中水分的ΔS值随MC的变化曲线(图8)可知:ΔS值与QS值随MC的变化曲线在MC小于5%呈现相似的变化趋势,都随MC的增大而增大。在MC小于5%的低含水率阶段,ΔS < 0表明木材中吸着的水分子比液态水分子更无序,这是因为此时木材中吸着的水分子主要为单分子层吸着水,它们比处于液体状态的水分子显示出更无序的状态;在经过5%的拐点之后,ΔS值随MC变化不明显。而随着MC的增大,ΔS值经历了由负到正、由无序到有序的变化,这说明吸着在木材中的水分子排列越来越规则。
进一步分析考古木材与现代木材的曲线差异,考古木材ΔS值低于现代木材,这是因为考古木材在经历长期酸碱环境下软腐菌等真菌的降解后[27],细胞壁出现的孔洞分布是随机的,且与水结合的−OH分布也十分不均匀,造成考古木材中吸着的水分子排列更无序。
2.3.3 水分吸湿与解吸的比较
以50 ℃考古木材为例,分别绘制QS、ΔG、ΔS三大热力学量随MC的变化曲线,每张图包含吸湿和解吸平衡态下的两条曲线(图9)。发现吸湿和解吸变化曲线形状基本一致,但解吸的QS、ΔG和ΔS值均大于吸湿的值[14],对应于水分吸湿滞后(图5),这个现象即为“热力学吸湿滞后”,其表征在吸湿与解吸平衡态下,每一个吸着水分子与木材吸着点之间的氢键结合平均数的差异[13]。
热力学吸湿滞后同样可以用水分吸湿滞后的“有效羟基说”[28]解释,即在干燥状态下,部分木材吸着点之间形成氢键结合,当木材从干燥状态开始吸湿时,由于这部分已经形成的氢键结合的影响,处于游离状态能够吸着水分子的吸着点的数量减少,每个吸着水分子与木材吸着点之间的氢键结合平均数减少,从而吸湿的热力学量也低于解吸过程。
3. 结 论
为探究考古木材的水分吸着行为与现代木材的差异机理,本研究从考古木材与现代木材微观结构与吸附热力学两个层面进行了研究。
考古木材三大主要成分(纤维素、半纤维素、木质素)均发生不同程度的降解,且考古木材中极性基团−OH、−COOH含量均减少,导致考古木材对水分的吸着减少。其中半纤维素、纤维素降解程度更大,因此在SEM中可观察到细胞壁产生腐朽,且可见孔洞分布;而考古木材中多糖类物质(纤维素、半纤维素)比芳环类物质(木质素)降解程度更高,因而木质素相对含量升高。
在吸附热力学研究中,通过DVS等温吸附实验并利用Hailwood-Horrobin模型拟合等温吸附曲线,在给定温度条件下考古木材的平衡含水率高于现代木材。结合Clausius-Clapeyron公式计算考古木材与现代木材的QS、ΔG和ΔS三大热力学量。考古木材因纤维素、半纤维素降解导致−OH、−COOH数量减小,QS值低于现代木材;考古木材与现代木材的ΔG值差异不大,且随温度升高而减小;考古木材的细胞壁孔洞、−OH分布不均匀,所以ΔS值低于现代木材;在MC小于5%,考古木材QS值和ΔS值随MC的变化曲线趋势相似,在此范围内木材中吸着的水分子主要为单分子层吸着水,随后在5%处产生一拐点,此时单分子层吸着水达到饱和,此后木材中吸着的水分子以多分子层吸着水占主导。最后,通过对比吸湿和解吸过程的热力学量(吸湿 < 解吸),发现考古木材存在热力学吸湿滞后现象。
基于以上对于考古木材水分吸着行为差异的研究,考古木材的吸湿性在经历长时间的泡水、腐朽下发生了较大变化,因此在出土饱水木质文物的保护工作中,建议采用各种物理、化学手段减少木质文物与环境中水分的相互作用,如涂覆防水涂层、浸渍脱水材料等,从而提高木质文物的尺寸稳定性[29],为我国出土饱水木质文物的保护提供理论支撑。
-
图 1 木棉花蕾和花朵样品图
R1 ~ R3分别对应深红色花的前期花蕾、中期花蕾和花朵;Y1 ~ Y3分别对应黄色花的前期花蕾、中期花蕾和花朵。下同。R1 − R3 correspond to the early buds, middle stage buds and flowers of dark-red flowers, respectively; Y1 − Y3 correspond to the early-stage buds, mid-stage buds and flowers of yellow flowers, respectively. The same below.
Figure 1. Flower buds and flower samples of Bombax ceiba
图 2 木棉转录本注释信息
a. Nr、SwisSProt、COG和KEGG公共数据库对转录本的注释情况;b. 木棉比对到其他物种上的单基因数;c. KOG功能分类分析;d. 包含单基因数量最多的转录因子家族。在图b中:J. 翻译、核糖体结构和生物发生;A. RNA加工和修饰;K. 转录;L. 复制、重组和修复;B. 染色质结构和动力学;D. 细胞周期控制、细胞分裂、染色体分配;Y. 核结构;V. 防御机制;T. 信号转导机制;M. 细胞壁/膜/包膜生物发生;N. 细胞运动;Z. 细胞骨架;W. 细胞外结构;U. 细胞内运输、分泌和囊泡运输;O. 翻译后修饰、蛋白质周转、伴侣;C. 能源生产和转化;G. 碳水化合物运输和代谢;E. 氨基酸转运和代谢;F. 核苷酸转运和代谢;H. 辅酶运输和代谢;I. 脂质运输和代谢;P. 无机离子转运和代谢;Q. 次生代谢物的生物合成、运输和分解代谢;R. 仅通用功能预测;S. 功能未知。在图c中:AA. 榴莲;AB. 可可树;AC. 澳洲棉;AD. 欧洲栓皮栎;AE. 木槿;AF. 虎耳草;AG. 陆地棉;AH. 树棉;AI. 雷蒙德氏棉;AJ. 粳稻。a, annotation of transcripts in public databases of Nr, SwissSProt, COG and KEGG public database; b, number of unigene of Bombax ceiba comparison to other species; c, KOG functional classification analysis; d, transcription factor families containing the most abundant unigenes. In the figure b: J, translation; ribosomal structure and biogenesis;A, RNA processing and modification; K, transcription; L, replication, recombination and repair; B, chromatin structure and dynamics; D, cell cycle control, cell division, chromosome partitioning; Y, nuclear structure; V, defense mechanism; T, signal transduction mechanism; M, cell wall/membrane/envelope biogenesis; N, cell motility; Z, cytoskeleton; W, extracellular structure; U, intracellular trafficking, secretion, and vesicular transport; O, post translational modification, protein turnover, chaperones; C, energy production and conversion; G, carbohydrate transport and metabolism; E, amino acid transport and metabolism; F, nucleotide transport and metabolism; H, coenzyme transport and metabolism; I, lipid transport and metabolism; P, inorganic ion transport and metabolism; Q, secondary metabolite biosynthesis, transport and catabolism; R, general function prediction only; S, function unknown. In the figure c: AA, Durio zibethinus; AB, Theobroma cacao; AC, Gossypium austral; AD, Quercus suber; AE, Hibiscus syriacus; AF, Herrania umbratica; AG, Gossypium hirsutum; AH, Gossypium arboretum; AI, Gossypium raimondii; AJ, Oryza sativa ssp. japonica.
Figure 2. Transcriptome annotation information of Bombax ceiba
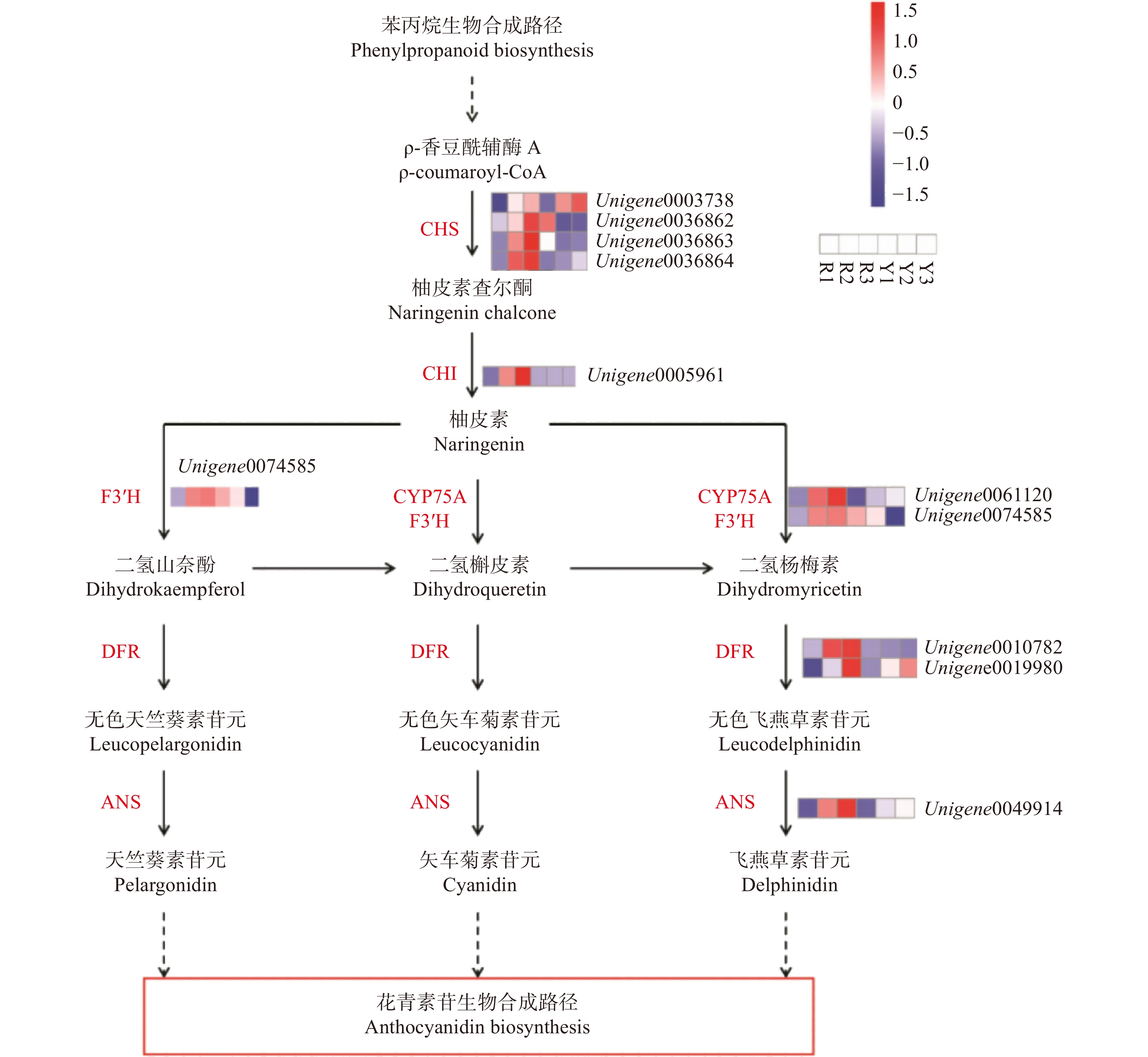
图 4 黄酮类生物合成通路中关键酶合成基因
CHS.查尔酮合成酶;CHI. 查尔酮-黄烷酮异构酶;F3′H. 类黄酮-3′-羟基化酶;DFR. 二氢黄酮醇-4-还原酶;ANS. 花青素苷合成酶;ANR. 花青素还原酶。热图表示不同基因在不同组织中的相对表达情况。下同。CHS, chalcone synthase; CHI, chalcone isomerase; F3′H, flavonoid-3′-hydroxylase; DFR, dihydroflavonol 4-reductase; ANS, anthocyanin synthase; ANR, anthocyanidin reductase. The heatmap shows the relative expression of different genes in varied tissues. The same below.
Figure 4. Expression pattern of key enzyme genes in flavonoid biosynthesis pathway
图 5 类胡萝卜素生物生物合成通路关键酶基因差异表达分析
PSY. 八氢番茄红素合酶2;ZDS. Zeta-胡萝卜素去饱和酶;CRTL-E-1/LUT2. 番茄红素ε-环化酶;CYP97C1. 胡萝卜素ε-单加氧酶;BETA-OHASE. β-羟化酶;CA2. β-胡萝卜素3-羟化酶;ZEP/ABA2. 玉米黄质环氧化酶。PSY, phytoene synthase 2; ZDS, Zeta-carotene desaturase; CRTL-E-1/LUT2, lycopene epsilon-cyclase; CYP97C1, carotene epsilon-monooxygenase; BETA-OHASE, Beta-hydroxylase; CA2, Beta-carotene 3-hydroxylase 1; ZEP/ABA2, zeaxanthin epoxidase.
Figure 5. Expression pattern of key enzyme genes in carotenoid biosynthesis pathway
表 1 qRT-PCR 验证的引物信息
Table 1 Primers for qRT-PCR validation
基因 Gene 引物序列 Primer sequence Unigene0000406 F:TCCGACTTAACTCACGAATA R:GGCAATAGCACCAACAAG Unigene0002371 F:CATTGGTGAGAGCATTGTG R:GCAGACTGAACTTCTTCCT Unigene0005194 F:GACCTCAAGCAGTAGTGTAA R:ACGCATTCAAGCCATTCT Unigene0009590 F:TCTTGATGTCATTGGTCTGT R:TTGCCTCGGAACTATCTTG 18s rRNA F:ACACGGGGAGGTAGTGACAA R:CCTCCAATGGATCCTCGTTA 表 2 木棉测序数据总结
Table 2 Summary of the Bombax ceiba sequencing data
样品
Sample原始数据
Raw data过滤数据
Clean data过滤碱基
Clean base/bpGC含量
GC content/%Q20/% Q30/% R1-1 42 154 112 42 033 474 6 304 737 944 43.70 97.74 93.38 R1-2 38 934 618 38 826 188 5 823 602 214 43.84 97.72 93.31 R1-3 36 405 510 36 298 212 5 444 459 187 43.67 97.78 93.44 R2-1 40 214 258 40 103 306 6 015 171 554 43.71 97.86 93.61 R2-2 43 115 358 42 982 600 6 447 068 673 43.82 97.63 93.16 R2-3 43 554 266 43 424 488 6 513 343 820 43.88 97.68 93.27 R3-1 42 505 058 42 349 994 6 352 219 071 43.48 97.69 93.25 R3-2 43 717 888 43 563 278 6 534 162 689 43.45 97.10 91.94 R3-3 49 106 848 48 960 190 7 343 645 275 43.64 97.76 93.39 Y1-1 40 550 298 40 433 134 6 064 717 455 43.62 97.87 93.57 Y1-2 39 609 714 39 491 164 5 923 413 381 43.63 97.62 93.06 Y1-3 40 911 432 40 791 666 6 118 475 519 43.60 97.75 93.35 Y2-1 43 182 036 43 050 674 6 457 266 450 44.02 97.71 93.28 Y2-2 42 511 828 42 382 872 6 357 097 287 43.89 97.59 93.00 Y2-3 41 619 516 41 498 458 6 224 473 457 43.90 97.78 93.45 Y3-1 49 450 146 49 277 730 7 391 276 334 43.74 97.62 93.07 Y3-2 45 755 168 45 603 158 6 840 142 927 43.73 97.73 93.32 Y3-3 39 178 604 39 057 616 5 858 374 799 43.64 97.83 93.56 注:Q20是指测序碱基质量值达到20以上水平的碱基占总碱基的百分比;Q30是指测序碱基质量值达到30以上水平的碱基占总碱基的百分比。Notes:Q20 refers to the percentage of bases with a mass value above 20 in the total bases; Q30 refers to the percentage of bases with a mass value above 30 in the total bases. 表 3 木棉转录组组装信息汇总
Table 3 Summary of the Bombax ceiba assembled data
基因数量
Gene numberGC含量
GC content/%最大长度
Max. length/bp最小长度
Min. length/bp平均长度
Average length/bp总组装上的碱基
Base on total assembly/bp75 190 39.34 17 316 201 1 103 82 935 086 表 4 参与木棉不同花色不同发育时期差异基因次生代谢通路及信号转导通路的差异表达基因数目
Table 4 Number of differentially expressed genes involved in secondary metabolism pathways and signal transduction pathways at different stages of varied flower lines
通路ID Pathway ID KEGG分类
KEGG classification通路名称 Pathway name 差异表达基因数量
Number of differentially
expressed geneP值
P valueQ值
Q valueko00195 环境信息处理
Environmental information processing光合作用 Photosynthesis 81 < 0.001 < 0.001 ko00196 环境信息处理
Environmental information processing光合作用−天线蛋白
Photosynthesis-antenna protein26 < 0.001 < 0.001 ko01100 遗传信息处理
Genetic information processing代谢通路 Metabolic pathways 1 281 < 0.001 < 0.001 ko04075 代谢 Metabolism 植物激素信号转导
Plant hormone signal transduction152 < 0.001 < 0.001 ko01110 代谢 Metabolism 次生代谢物的生物合成
Biosynthesis of secondary metabolites739 < 0.001 < 0.001 ko03010 代谢 Metabolism 核糖体 Ribosome 329 < 0.001 < 0.001 ko00940 代谢 Metabolism 苯丙烷生物合成
Phenylpropanoid biosynthesis72 < 0.001 < 0.001 ko00906 代谢 Metabolism 类胡萝卜素生物合成
Carotenoid biosynthesis25 < 0.001 < 0.001 ko00062 代谢 Metabolism 脂肪酸延伸 Fatty acid elongation 22 < 0.001 0.003 ko00904 代谢 Metabolism 二萜生物合成 Diterpenoid biosynthesis 14 < 0.001 0.008 ko00950 代谢 Metabolism 异喹啉生物碱生物合成
Isoquinoline alkaloid biosynthesis21 < 0.001 0.008 ko00030 代谢 Metabolism 磷酸戊糖通路 Pentose phosphate pathway 63 < 0.001 0.009 ko00630 代谢 Metabolism 乙醛酸和二羧酸代谢
Glyoxylate and dicarboxylate metabolism80 0.001 0.012 ko04016 代谢 Metabolism MAPK信号通路−植物
MAPK signaling pathway-plant87 0.002 0.016 ko00941 代谢 Metabolism 黄酮类生物合成 Flavonoid biosynthesis 25 0.002 0.016 ko00710 代谢 Metabolism 光合生物中的碳固定
Carbon fixation in photosynthetic organisms76 0.008 0.065 ko00900 代谢 Metabolism 萜类骨架生物合成
Terpenoid backbone biosynthesis38 0.016 0.122 ko00945 代谢 Metabolism 芪类、二芳基庚烷类和姜酚的生物合成
Stilbenoid, diarylheptanoid and gingerol biosynthesis14 0.016 0.122 ko00910 代谢 Metabolism 氮代谢 Nitrogen metabolism 28 0.019 0.133 ko00730 代谢 Metabolism 硫胺代谢 Thiamine metabolism 19 0.020 0.133 ko00360 代谢 Metabolism 苯丙氨酸代谢 Phenylalanine metabolism 25 0.023 0.148 ko00350 代谢 Metabolism 酪氨酸代谢 Tyrosine metabolism 32 0.026 0.160 ko00130 代谢 Metabolism 泛醌和其他萜类−醌生物合成
Ubiquinone and other terpenoid-quinone biosynthesis21 0.028 0.163 ko00960 代谢 Metabolism 托烷、哌啶和吡啶生物碱的生物合成
Tropane, piperidine and pyridine alkaloid biosynthesis18 0.033 0.184 ko00965 代谢 Metabolism 甜菜碱生物合成 Betalain biosynthesis 4 0.034 0.184 ko00860 代谢 Metabolism 卟啉和叶绿素代谢
Porphyrin and chlorophyll metabolism29 0.036 0.186 ko01230 代谢 Metabolism 氨基酸的生物合成 Biosynthesis of amino acid 211 0.038 0.189 ko00603 代谢 Metabolism 鞘糖脂生物合成
Glycosphingolipid biosynthesis-globo and isoglobo series10 0.041 0.196 ko00380 代谢 Metabolism 色氨酸代谢Tryptophan metabolism 36 0.045 0.206 -
[1] 郑万钧. 中国树木志(第3卷)[M]. 北京: 中国林业出版社, 1997. Zheng W J. Trees of China (Volume 3)[M]. Beijing: China Forestry Publishing House, 1997.
[2] 粟娟, 孙冰, 黄家平, 等. 广州市绿地应用树种结构分析[J]. 林业科学研究, 1998, 11(5): 502−507. Su J, Sun B, Huang J P, et al. Analysis on the structure of applied tree species in Guangzhou’s green space[J]. Forest Research, 1998, 11(5): 502−507.
[3] 陆璃, 叶广荣, 胡彦辉, 等. 广州市园林绿地木棉应用现状及种植规划[J]. 福建林业科技, 2013, 40(4): 157−162. doi: 10.3969/j.issn.1002-7351.2013.04.35 Lu L, Ye G R, Hu Y H, et al. Application status of Bombax malabaricum and the planting planning of garden greenland in Guangzhou City[J]. Journal of Fujian Forestry Science and Technology, 2013, 40(4): 157−162. doi: 10.3969/j.issn.1002-7351.2013.04.35
[4] 高柱, 田向楠, 郑元, 等. 云南吉贝种质资源调查及果实性状的相关分析[J]. 经济林研究, 2012, 30(1): 88−94. doi: 10.3969/j.issn.1003-8981.2012.01.017 Gao Z, Tian X N, Zheng Y, et al. Correlation analysis of germplasm resources and fruit characters in Ceiba pentandra in Yunnan[J]. Nonwood Forest Research, 2012, 30(1): 88−94. doi: 10.3969/j.issn.1003-8981.2012.01.017
[5] 张继方, 贺漫媚, 刘文, 等. 广州木棉种质资源调查及其评价[J]. 广东林业科技, 2013, 29(6): 47−53. Zhang J F, He M M, Liu W, et al. The resources surveys and aesthetic evaluation of Bombax ceiba in Guangzhou[J]. Guangdong Forestry Science and Technology, 2013, 29(6): 47−53.
[6] 颜平. 海南钻喙兰种质资源现状调查及其遗传多样性研究[D]. 海口: 海南大学, 2014. Yan P. Investigation on germplasm resources and genetic diversity of Rhynchostylis gigantea (Lindl.) Ridl in Hainan[D]. Haikou: Hainan University, 2014.
[7] 姬慧娟, 李大明, 肖恩, 等. 攀枝花地区木棉种质资源调查与保存初探[J]. 四川林业科技, 2017, 38(1): 51−53. Ji H J, Li D M, Xiao E, et al. A preliminary study of germplasm investigation and conservation of Bombax malabaricum in Panzhihua[J]. Journal of Sichuan Forestry Science and Technology, 2017, 38(1): 51−53.
[8] 王丕振, 潘林义. 海南岛木棉种质资源调查分析[J]. 热带林业, 2018, 46(3): 47−50. doi: 10.3969/j.issn.1672-0938.2018.03.011 Wang P Z, Pan L Y. Investigation and analysis of germplasm resources of Bombax ceiba in Hainan Island[J]. Tropical Forestry, 2018, 46(3): 47−50. doi: 10.3969/j.issn.1672-0938.2018.03.011
[9] 朱报著, 张方秋, 潘文, 等. 木棉花形态结构特征和观赏类型划分[J]. 中国野生植物资源, 2016, 35(6): 42−46. doi: 10.3969/j.issn.1006-9690.2016.06.011 Zhu B Z, Zhang F Q, Pan W, et al. Characteristics of the flower morphological structure of Bombax ceiba and the classification of their ornamental types[J]. Chinese Wild Plant Resources, 2016, 35(6): 42−46. doi: 10.3969/j.issn.1006-9690.2016.06.011
[10] Jeknić Z, Jeknić S, Jevremović S, et al. Alteration of flower color in Iris germanica L. ‘Fire Bride’ through ectopic expression of phytoene synthase gene (crtB) from Pantoea agglomerans[J]. Plant Cell Reports, 2014, 33(8): 1307−1321. doi: 10.1007/s00299-014-1617-4
[11] Nishihara M, Nakatsuka T. Genetic engineering of flavonoid pigments to modify flower color in floricultural plants[J]. Biotechnology Letters, 2011, 33(3): 433−441. doi: 10.1007/s10529-010-0461-z
[12] Brouillard R. The in vivo expression of anthocyanin colour in plants[J]. Pergamon, 1983, 22(6): 1311−1323.
[13] Liu X, Zhang B, Wu J, et al. Pigment variation and transcriptional response of the pigment synthesis pathway in the S2309 triple-color ornamental kale (Brassica oleracea L. var. acephala) line[J]. Genomics, 2020, 112(3): 2658−2665. doi: 10.1016/j.ygeno.2020.02.019
[14] Jin S, Rahim M A, Afrin K S, et al. Transcriptome profiling of two contrasting ornamental cabbage (Brassica oleracea var. acephala) lines provides insights into purple and white inner leaf pigmentation[J/OL]. BMC Genomics, 2018, 19(1): 797[2021−05−01]. https://doi.org/10.1186/s12864-018-5199-3.
[15] Zhang J, Sui C, Wang Y, et al. Transcriptome-wide analysis reveals key DEGs in flower color regulation of Hosta plantaginea (Lam.) aschers[J/OL]. Genes, 2020, 11(1): 31[2021−05−05]. https://doi.org/10.3390/genes11010031.
[16] Zhuang H, Lou Q, Liu H, et al. Differential regulation of anthocyanins in green and purple turnips revealed by combined de novo transcriptome and metabolome analysis[J/OL]. International Journal of Molecular Sciences, 2019, 20(18): 4387[2021−04−01]. https://doi.org/10.3390/ijms20184387.
[17] Zhou C, Mei X, Rothenberg D O N, et al. Metabolome and transcriptome analysis reveals putative genes involved in anthocyanin accumulation and coloration in white and pink tea (Camellia sinensis) flower[J/OL]. Molecules, 2020, 25(1): 190[2021−03−01]. https://doi.org/10.3390/molecules25010190.
[18] Aida R, Yoshida K, Kondo T, et al. Copigmentation gives bluer flowers on transgenic torenia plants with the antisense dihydroflavonol-4-reductase gene[J]. Plant Science (Limerick), 2000, 160(1): 49−56. doi: 10.1016/S0168-9452(00)00364-2
[19] Forkmann G M O B. Flavonoids as flower pigments: the formation of the natural spectrum and its extension by genetic engineering[J]. Plant Breeding, 1991, 106(1): 1−26. doi: 10.1111/j.1439-0523.1991.tb00474.x
[20] Yoshikazu T, Akemi O. Seeing is believing: engineering anthocyanin and carotenoid biosynthetic pathways[J]. Current Opinion in Biotechnology, 2008, 19(2): 190−197. doi: 10.1016/j.copbio.2008.02.015
[21] Zhu C, Bai C, Sanahuja G, et al. The regulation of carotenoid pigmentation in flowers[J]. Archives of Biochemistry and Biophysics, 2010, 504(1): 132−141. doi: 10.1016/j.abb.2010.07.028
[22] Katsumoto Y, Fukuchi-Mizutani M, Fukui Y, et al. Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers Accumulating delphinidin[J]. Narnia, 2007, 48(11): 1589−1600.
[23] Grotewold E. The genetics and biochemistry of floral pigments[J]. Annual Review of Plant Biology, 2006, 57: 761−780. doi: 10.1146/annurev.arplant.57.032905.105248
[24] 戴思兰, 洪艳. 基于花青素苷合成和呈色机理的观赏植物花色改良分子育种[J]. 中国农业科学, 2016, 49(3): 529−542. Dai S L, Hong Y. Molecular breeding of ornamental plant color improvement based on anthocyanin synthesis and coloration mechanism[J]. Scientia Agricultura Sinica, 2016, 49(3): 529−542.
[25] 赵历强, 单春苗, 张声祥, 等. 基于转录组测序的细风轮花青素合成通路及关键酶基因分析[J]. 植物研究, 2020, 40(6): 886−896. Zhao L Q, Shan C M, Zhang S X, et al. Identification of key enzyme genes involved in anthocyanin synthesis pathway inClinopodium gracile by transcriptome analysis[J]. Bulletin of Botanical Research, 2020, 40(6): 886−896.
[26] Peer W A, Murphy A S. Flavonoids and auxin transport: modulators or regulators?[J]. Trends in Plant Science, 2007, 12(12): 556−563. doi: 10.1016/j.tplants.2007.10.003
[27] Zhang H, Liang W, Yang X, et al. Carbon starved anther encodes a MYB domain protein that regulates sugar partitioning required for rice pollen development[J]. The Plant Cell, 2010, 22(3): 672−689. doi: 10.1105/tpc.109.073668
[28] Weiss D. Regulation of flower pigmentation and growth: multiple signaling pathways control anthocyanin synthesis in expanding petals[J]. Physiologia Plantarum, 2000, 110(2): 152−157. doi: 10.1034/j.1399-3054.2000.110202.x
[29] Ruan Y, Jin Y, Yang Y, et al. Sugar input, metabolism, and signaling mediated by invertase: roles in development, yield potential, and response to drought and heat[J]. Molecular Plant, 2010, 3(6): 942−955. doi: 10.1093/mp/ssq044
-
期刊类型引用(6)
1. 冯林艳,周火艳,赵晓迪. 乌兰布和沙漠两种植物的分布格局及其变化. 南京林业大学学报(自然科学版). 2024(01): 155-160 .  百度学术
百度学术
2. 曾红,徐永艳,邵琳亚,闻永慧,夏小丽,汪琼. 4种植物叶片浸提液成分分析及其对珊瑚樱种子萌发的影响. 西南林业大学学报(自然科学). 2023(04): 39-46 .  百度学术
百度学术
3. 马光宗,徐高峰,杨韶松,杨云海,张付斗,温丽娜,陶琼,申时才,叶敏. 甘薯提取物对3种杂草种子萌发和幼苗生长的化感作用. 西南农业学报. 2022(06): 1295-1302 .  百度学术
百度学术
4. 路文杰,佛芒芒,肖毅,王永新,杜利霞,钟华,赵祥,董宽虎. 草地植物凋落物浸提液对根际微生物碳源利用的影响. 中国草地学报. 2021(06): 35-42 .  百度学术
百度学术
5. 张林媚,刘姝玲,郭彩云. 立地条件对榆林沙区樟子松嫁接红松生长的影响. 林业科技通讯. 2021(11): 32-37 .  百度学术
百度学术
6. 王方琳,尉秋实,柴成武,王理德,张德魁,王昱淇,王飞,胡小柯. 沙蒿(Artemisia desertorum)浸提液对自身种子萌发与幼苗生长的化感作用. 中国沙漠. 2021(06): 21-28 .  百度学术
百度学术
其他类型引用(3)














 下载:
下载: