Construction of a yeast hybrid cDNA library during seed dormancy release of Paeonia lactiflora
-
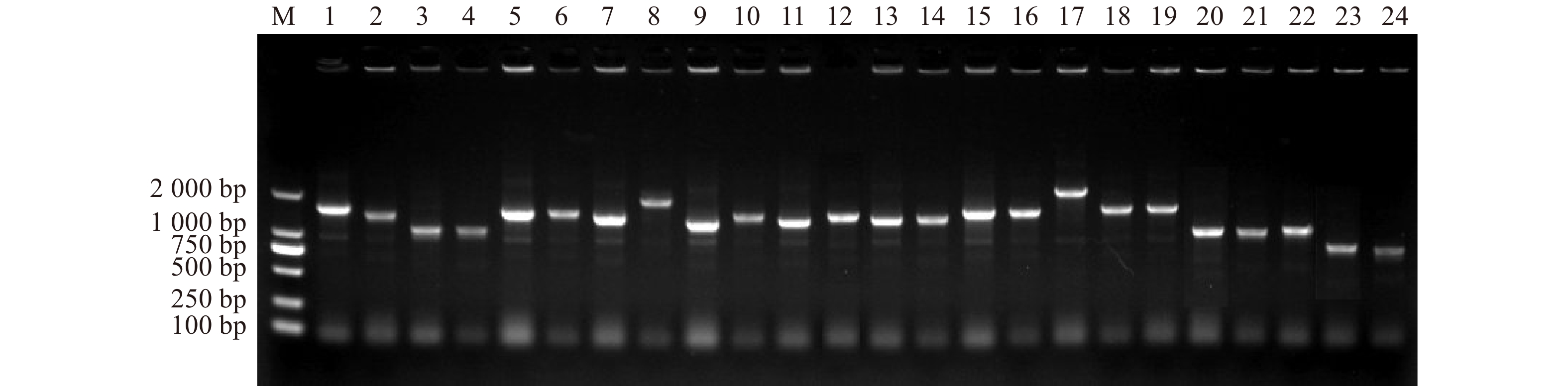
摘要:目的 芍药具有极佳的观赏价值,但其种子的双重休眠难以解除,严重阻碍芍药的育种进程。本研究利用gateway技术构建芍药种子休眠解除关键时期的酵母杂交cDNA文库,可用于筛选调控芍药种子休眠解除相关基因的转录因子及互作蛋白。本文库的构建可为丰富芍药种子休眠调控研究提供科学支撑,能为芍药栽培育种和野生资源保护及利用奠定分子理论基础。方法 本研究以休眠解除过程中5个关键时期的芍药种子为试验材料,进行总RNA的提取和mRNA的分离,使用gateway方法构建cDNA初级文库,再通过LR重组,将初级文库重组到pGADT7-DEST次级文库载体上,构建出次级文库,最后经过酵母转化试验,将次级文库质粒转化到酵母Y187感受态细胞中,构建出芍药种子休眠解除过程的酵母文库。结果 经鉴定,cDNA初级文库库容量为1.28 × 107 CFU,平均插入片段长度在1 000 bp以上,重组率为100%;cDNA次级文库库容量为1.12 × 107 CFU,平均插入片段长度在1 000 bp以上,重组率为100%;酵母文库滴度为7.0 × 107 CFU/mL,平均插入片段长度在1 000 bp以上,重组率为96%。23个阳性克隆测序结果经NCBI比对后,按照功能将20个已知蛋白序列划分为8类,其中7个序列已被报道参与种子的休眠与萌发。结论 芍药种子休眠解除过程的酵母杂交cDNA文库构建的质量较高,具有较完整的基因信息,符合酵母文库筛选试验所需的标准,为构建芍药种子休眠解除过程的分子调控网络提供基础。Abstract:Objective Paeonia lactiflora has high ornamental value, but the double dormancy of the P. lactiflora seeds is difficult to release, and severely hinders the breeding process. We used gateway technique to construct the yeast hybrid cDNA library of the P. lactiflora seeds, which are in critical dormancy release periods. It can be used to screen transcription factors and interact proteins that regulates seed dormancy release of P. lactiflora. The construction of this library not only provides scientific support for enriching the P. lactiflora seed dormancy release regulation research, but also establish the foundation of molecular theory for P. lactiflora cultivation breeding and the protection and utilization of wild resources.Method The P. lactiflora seeds in five critical dormancy release stages were used as samples to extract total RNA and isolate mRNA. The gateway method was used to construct cDNA primary library. Then, the primary library was recombined into pGADT7-DEST, a secondary library vector, by LR recombination to build a secondary library. Finally, the secondary library plasmid was transformed into yeast Y187 strains by transformation test, the construction of a yeast hybrid cDNA library during seed dormancy release of the P. lactiflora was completed.Result After identification, the cDNA primary library capacity was 1.28 × 107 CFU, the average insert fragment length was more than 1 000 bp, and the recombination rate was 100%; the cDNA secondary library capacity was 1.12 × 107 CFU, the average insert fragment length was more than 1 000 bp, and the recombination rate was 100%; the yeast library titer was 7.0 × 107 CFU/mL, the average insert fragment length was more than 1 000 bp, and the recombination rate was 96%. Using NCBI to compare the sequencing results of 23 positive clones, we found 20 known protein sequences and divided them into 8 categories according to their functions. 7 sequences had been reported to be involved in seed dormancy and germination in these categories.Conclusion We successfully construct a yeast hybrid cDNA library during seed dormancy release of P. lactiflora. This library has a high quality and a complete genetic information, which conforms to the yeast library screen test standard. It provides basis for revealing molecular regulatory networks of P. lactiflora seeds in the process of dormancy release.
-
Keywords:
- Paeonia lactiflora /
- seed dormancy and germination /
- yeast hybrid /
- cDNA library /
- gateway technique
-
热激蛋白(Heat stress proteins, Hsp)主要参与生物体内新生肽的运输、折叠、组装、定位以及变性蛋白的复性和降解,具有分子伴侣作用[1],广泛存在于自然界原核与真核细胞中,在生物体内具有多种复杂的功能。当受到环境胁迫时,生物体就会开启该类应激基因的迅速表达,产生结构上非常保守的特殊蛋白质,使生物体快速调整细胞的存活机制,促进细胞恢复正常的结构和机能[2]。热激蛋白按照蛋白分子质量大小和同源性分为5类:Hsp100(80~110 kDa)、Hsp90(82~96 kDa)、Hsp70(67~76 kDa)、Hsp60(58~65 kDa)和小分子热激蛋白(40 kDa以下)[3]。除昆虫小分子热激蛋白(smHsp)外,其余4类热激蛋白均比较保守,但smHsp在结构和功能上具有共同特征,分子质量范围12~43 kDa,所有小分子热激蛋白含有保守的80~100个氨基酸组成的α晶体结构域(α-crystallin domain,ACD),可产生数量较多的低聚体,能被胁迫因子诱导并具有分子伴侣活性[4-9]。Hsp70和Hsp40分子伴侣活性需要ATP能量,主动介导底物结合/释放循环,但smHsp的分子伴侣活性不同,其本身具有和同等质量变性底物结合的能力,而不需要直接重新折叠热诱导的非折叠变性蛋白,从而形成稳定的复合体,并且防止不可逆的非特异性聚集的发生[10]。smHsp能够与其他热激蛋白互作阻止靶蛋白的聚合,并在靶蛋白的重折叠过程中发挥重要作用[11-12]。许多研究表明smHsp参与生物体的生长发育和氧化还原代谢、维持细胞完整性以及增强对环境胁迫能力等重要生理功能[9-10]。目前,研究证实昆虫smHsp在生长发育、生殖调节以及滞育和休眠中均发挥着重要作用[11],而对杀虫剂胁迫响应方面研究甚少。
舞毒蛾(Lymantria dispar)是一种周期性发生的世界性林业食叶害虫,国内报道取食杨树(Populus spp.)、马尾松(Pinus massoniana)、栎(Quercus spp.)、红松(Pinus koraiensis)等500多种植物,主要分布于东北、华北、华中和西北地区,其传播和蔓延的速度快[12],给农林业生产带来了巨大损失,化学防治仍是目前有效控制舞毒蛾危害的主要防治措施之一。本文从舞毒蛾转录本文库中获得了舞毒蛾Hsp家族中6个smHsp基因的全长cDNA序列,分析该基因生物学特性,在此基础上进一步采用实时荧光定量RT-PCR技术,探讨了smHsp对杀虫剂甲萘威胁迫的响应,为进一步研究smHsp应对外源杀虫剂响应作用机制提供依据。
1. 材料与方法
1.1 供试昆虫
舞毒蛾卵块和人工饲料购自中国林业科学研究院森林生态环境与保护研究所,幼虫置于温度(25±1) ℃,光照14 L:10 D,相对湿度75%的条件下的培养箱内,人工饲料饲养,取健康、大小一致的2龄幼虫进行试验。
1.2 smHsp基因克隆与分析
从1~6龄的舞毒蛾幼虫中,分别随机挑选活泼、健康、大小一致的幼虫各10头,采用RNeasy Mini动物组织总RNA提取试剂盒(Qiagen),分别提取舞毒蛾幼虫各龄期的总RNA,然后将各龄幼虫提取的总RNA等比例混匀,20 μg总RNA用于转录组文库构建,用Illumina HiSeqTM 2000对建好的测序文库进行测序(深圳华大基因科技有限公司)[13-14]。对转录组文库中Unigenes在NCBI上进行Blastx和Blastn分析,根据功能注释结果,查找并获得smHsp基因序列,然后设计引物进行RT-PCR验证,通过测序确定所获得的smHsp基因全长序列。用ORF founder(http://www.ncbi.nlm.nih.gov/gorf.html)程序来确定其开放读码框。用ProtParam(http://au.expasy.org/tools/protparam.html)软件计算推导蛋白质的分子质量及理论等电点。在NCBI上用Conserved Domains程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)来预测蛋白的保守区。利用Blast程序(http://www.ncbi.nlm.nih.gov/BLAST/)来进行序列同源性搜索,选择与其相似程度高的鳞翅目昆虫的smHsp蛋白氨基酸序列,用ClustalW多序列联配程序进行多序列比对。应用Clustalx 1.83和MEGA 5.1,采用邻接法(Neighbor-Joining, N-J)构建系统发育树[15]。
1.3 实时荧光定量RT-PCR
采用含有LC5(0.031 mg/g)、LC10(0.041 mg/g)和LC30(0.075 mg/g)剂量的甲萘威人工饲料毒饵饲喂舞毒蛾2龄幼虫,以不含甲萘威的人工饲料作为对照组,分别于饲喂舞毒蛾幼虫6、12、24、48和72 h后,随机挑取活泼幼虫提取其总RNA,用DNase I(Promega)消化总RNA中的DNA,测定其质量浓度,采用PrimeScriptTM RT reagent Kit(TaKaRa)合成cDNA,将合成cDNA稀释10倍,作为模板备用,使用试剂盒SYBR Green Real-time PCR Master mix(Toyobo)进行实时荧光定量PCR。内参基因(Actin、EF1α和TUB)和smHsp基因引物序列见表 1。实时荧光定量PCR反应体系为:10 μL 2×SYBR premix Ex Taq酶、正向和反向引物(10 μmol/L)各1、2 μL稀释的cDNA模板,加去离子水补足20 μL;反应条件:94 ℃预变性30 s,94 ℃变性12 s,60 ℃退火45 s,72 ℃延伸45 s,81 ℃读板1 s,45个循环,每样品和每处理各重复3次,用2-△△Ct方法进行基因相对表达量分析[16]。
表 1 实时荧光定量RT-PCR引物序列Table 1. Primer sequences of real-time RT-PCR基因
Gene正向引物序列(5′-3′)
Forward primer sequence (5′-3′)反向引物序列(5′-3′)
Reverse primer sequence (5′-3′)LdHsp20.3 AGACGTCGGCTCTACTATCA CATCACGGAATCGGCATCTA LdHsp18.7 GACTCCACAGCATCAGGATTAG GGATGCCGGATCTTCAATCA LdHsp21.4 CTCTGCTCTCCGATGACTACTA CGAACTGTCGACTGATGTATCC LdHsp19.1 CTCCGTACTGGATGCGTTATC CACCTTCTTCCCGTCGATTT LdHsp17.0 GGAGCGTGACAAGTACGAAA CCGAGGTACGGTGATAACTAGA LdHsp21.3 GGGTGTACTGGCTAACATCAA CCGAAATGAGGAAGATGGAAGA Actin AGAAGCACTTGCGGTGGACAAT ACCTGTACGCCAACACTGTCAT EF1α TTTGCCTTCCTTGCGCTCAACA TGTAAAGCAGCTGATCGTGGGT TUB AATGCAAGAAAGCCTTGCGCCT ATGAAGGAGGTCGACGAGCAAA 1.4 数据统计与分析
采用SPSS 17.0(SPSS Inc., USA)统计软件进行单因素方差分析(One-way ANOVA,Duncan)检测同一基因在同一浓度的甲萘威胁迫下,不同时间点表达量差异的显著性(P<0.05)。采用OriginPro 8.5软件,进行数据统计和绘图。
2. 结果与分析
2.1 smHsp基因全长克隆与分析
通过舞毒蛾转录组文库分析和RT-PCR验证获得6个舞毒蛾smHsp家族全长基因,开放阅读框大小为444~567 bp;编码147~188个氨基酸;理论等电点为5.58~6.17,均为酸性蛋白(表 2)。BLASTP对6个舞毒蛾smHsp保守区的预测结果表明,该类蛋白属于alpha-crystallin-Hsps-p23-like超级家族蛋白(图 1)。
表 2 舞毒蛾smHsp基因特性Table 2. Characteristics of smHsp genes in L. dispar基因
Gene开放阅读框
Open reading frame/bp编码氨基酸
Encoding amino acids分子质量
Molecular weight/kDa理论等电点
Theoretical pI含量最多的氨基酸
The most abundant amino acids/%LdHsp17.0 444 147 17.00 6.15 Lys(9.5%) LdHsp18.7 501 166 18.79 5.58 Val(9.6%) LdHsp19.1 495 164 19.10 6.13 Glu(11.0%) LdHsp20.3 534 177 20.30 5.76 Glu(8.5%) LdHsp21.4 567 188 21.42 6.17 Leu(9.0%) LdHsp21.3 564 187 21.37 5.79 Ser(11.8%) 舞毒蛾smHsp蛋白的系统进化树分析表明,6个smHsp蛋白分为二大类,LdHsp20.3、LdHsp21.4、LdHsp18.7和LdHsp17.0聚为一大类,其中LdHsp20.3、LdHsp21.4和LdHsp18.7分别与甘蓝夜蛾(Mamestra brassicae)、印度谷斑螟(Plodia interpunctella)和大红斑蝶(Danaus plexippus)亲缘关系最近而聚为一类。舞毒蛾LdHsp21.3和LdHsp19.1与艺神袖蝶(Heliconius erato)、斜纹夜蛾(Spodoptera litura)、棉铃虫(Helicoverpa armigera)和柑橘凤蝶(Papilio xuthus)聚为一大类(图 2)。
2.2 甲萘威胁迫对smHsp基因表达量的影响
为了探讨杀虫剂甲萘威对舞毒蛾smHsp基因表达的影响,运用实时荧光定量RT-PCR技术分析了亚致死剂量(LC5、LC10和LC30)的甲萘威对舞毒蛾2龄幼虫6个smHsp基因表达量的影响(图 3)。亚致死剂量甲萘威对舞毒蛾smHsp表达量的影响结果分为两类:一类是对LdHsp20.3、LdHsp19.1和LdHsp17.0主要表现为诱导上调;另一类是对LdHsp21.4、LdHsp21.3和LdHsp18.7主要表现为抑制其表达。
![]() 图 3 甲萘威胁迫对舞毒蛾smHsp基因表达量的影响A.亚致死剂量LC5处理组smHsp基因表达量;B.亚致死剂量LC10处理组smHsp基因表达量;C.亚致死剂量LC30处理组smHsp基因表达量。不同小写字母表示同一基因不同处理间的表达量差异显著(P<0.05)。Figure 3. Effects of carbaryl on smHsp gene expressions in L. dispar larvaeA, smHsp gene expression under LC5 of sublethal dose stress; B, smHsp gene expression under LC10 of sublethal dose stress; C, smHsp gene expression under LC30 of sublethal dose stress. Different lowercase letters show significant differences between treatment groups for the same gene at P < 0.05 level.
图 3 甲萘威胁迫对舞毒蛾smHsp基因表达量的影响A.亚致死剂量LC5处理组smHsp基因表达量;B.亚致死剂量LC10处理组smHsp基因表达量;C.亚致死剂量LC30处理组smHsp基因表达量。不同小写字母表示同一基因不同处理间的表达量差异显著(P<0.05)。Figure 3. Effects of carbaryl on smHsp gene expressions in L. dispar larvaeA, smHsp gene expression under LC5 of sublethal dose stress; B, smHsp gene expression under LC10 of sublethal dose stress; C, smHsp gene expression under LC30 of sublethal dose stress. Different lowercase letters show significant differences between treatment groups for the same gene at P < 0.05 level.LC5和LC10甲萘威胁迫处理后,舞毒蛾LdHsp20.3基因的表达量在6~72 h均表现为显著上调,且LC10胁迫诱导作用高于LC5;LC10胁迫6 h时诱导作用最大,为对照的28.08倍;而LC30处理24 h和48 h时LdHsp20.3的表达量分别下降为对照的84%和50%。与对照相比,LC5、LC10和LC30甲萘威胁迫对舞毒蛾LdHsp19.1的表达均表现为显著的诱导作用,表达量为对照的1.42~12.46倍,其中胁迫24 h是表达量最高。LC5和LC10甲萘威对LdHsp17.0主要表现为诱导作用,LC5胁迫6 h其表达量为对照的3.34倍;但LC30甲萘威在处理的72 h内(除6 h)主要表现为抑制作用,表达量为对照的39%~86%。
亚致死剂量甲萘威对舞毒蛾LdHsp21.3和LdHsp18.7的表达主要表现为显著的抑制作用。与对照相比,LC5、LC10和LC30甲萘威处理72 h(除LC5胁迫6 h)均显著抑制了LdHsp21.3的表达,表达量为对照的28%~86%,其中LC30甲萘威胁迫48 h抑制作用最大,抑制率为72%。甲萘威处理24~72 h均显著抑制了LdHsp18.7的表达,表达量为对照的13%~55%。对于LdHsp21.4,除了甲萘威胁迫6 h表现为诱导作用外,随着作用时间的延长均表现为显著的抑制作用,表达量为对照的5%~98%,其中LC5甲萘威处理48 h抑制作用最大,抑制率达95%。
3. 讨论与结论
热激蛋白是生物体细胞在一些应激源(如:高温、缺氧、重金属、氧化应激、饥饿、代谢毒物等)诱导下,激活Hsp基因从而高效表达的一组进化上高度保守的蛋白质。其中,smHsp在N端和C端氨基酸序列和长度差异较大,但它们的中段α晶体序列长度和结构上比较相似,都具有“三明治”的β折叠[17]。昆虫体内有众多smHsps,每种昆虫体内所含有的种类和功能各不相同。本文获得舞毒蛾6个含有1个α晶体结构域smHsp蛋白,系统进化树分析表明舞毒蛾smHsp蛋白序列差异性大,同源性小,LdHsp20.3、LdHsp21.4、LdHsp18.7和LdHsp17.0亲缘关系较近而聚为一大类,LdHsp19.1和LdHsp21.3聚为另一类。
热激蛋白是有机体在压力胁迫下诱导表达的参与自身保护反应的一类特殊蛋白,在陆地和水生系统,其化学物质胁迫响应机制已成为主要研究方向之一[18-19]。在外源有毒物质对生物体毒性作用的研究中,不仅大分子Hsps基因作为生物标志基因被广泛研究,而且smHsp基因在生物体应对外源化合物胁迫响应中所起的重要作用也有所报道。有研究发现黑腹果蝇(Drosophila melanogaster)3龄幼虫暴露于0.02~2.00 μg/mL的硫丹12~48 h,Hsp83、Hsp70、Hsp60和Hsp26与对照组相比没有显著表达差异,但发现Hsp23和Hsp22的表达量随处理质量浓度和时间的增加而增加,并且在48 h后,Hsp23表达量高于Hsp22,推测Hsp22和Hsp23在果蝇应对硫丹介导的细胞压力中担当重要的保护角色[20]。王瑞娴等采用双跟踪标定定量分析法测定表明家蚕(Bombyx mori)取食蜕皮激素(2×10-3 μg/μL)和芸香苷(5×10-2 ng/μL)溶液浸泡的桑叶2 h后,BmHsp19.9基因在中肠、脂肪体和马氏管组织中的转录水平均有上升[21]。王利华等报道在毒死蜱长期筛选的灰飞虱(Laodelpphax striatellus)种群中LsHsp70-2、LsHsp90-1和LsHsp90-2的表达量分别上升2.32、1.53和2.28倍;且高温(42 ℃)热激后毒死蜱抗性品系的存活率比敏感品系高23.58%[22]。寇利花等发现Cd急性诱导下中华稻蝗(Oxya chinensis)OcsHSPs(OcHsp19.1、OcHsp19.8、OcHsp20.4、OcHsp20.7、OcHsp21.1)基因在精巢和卵巢的表达模式不同,其表达量与Cd质量浓度和作用时间有关[23]。本文研究结果表明3个亚致死剂量的甲萘威胁迫舞毒蛾2龄幼虫后,其smHsp基因呈现不同的表达模式。甲萘威处理对舞毒蛾LdHsp20.3和LdHsp19.1表现出高的诱导表达效应,但对LdHsp17.0诱导效果较小,在高质量浓度(LC30)下则表现为抑制作用。这些舞毒蛾smHsps基因的上调表达使得细胞内smHsp蛋白增多,进而及时与变性蛋白结合,形成稳定的复合体,防止不可逆的非特异性聚集,可能为DnaK/Hsp70蛋白争取更多机会与变性蛋白结合,进而增强害虫应对外界胁迫时产生的蛋白修复能力。然而,舞毒蛾LdHsp21.4、LdHsp21.3和LdHsp18.7对甲萘威胁迫的响应则主要表现为下调表达,虽然在胁迫初期表现出一定诱导作用,这表明3个smHsp基因在低质量浓度短时间胁迫下具有迅速应激响应来保护自身免受损伤的能力,但随着质量浓度和时间的延长胁迫压力增大而丧失。随着全球气候变暖和害虫抗药性日益严重,害虫对生境适应能力增强,对热激蛋白的深入研究可为探讨害虫抗逆机制以及害虫综合治理提供一定的理论基础。
-
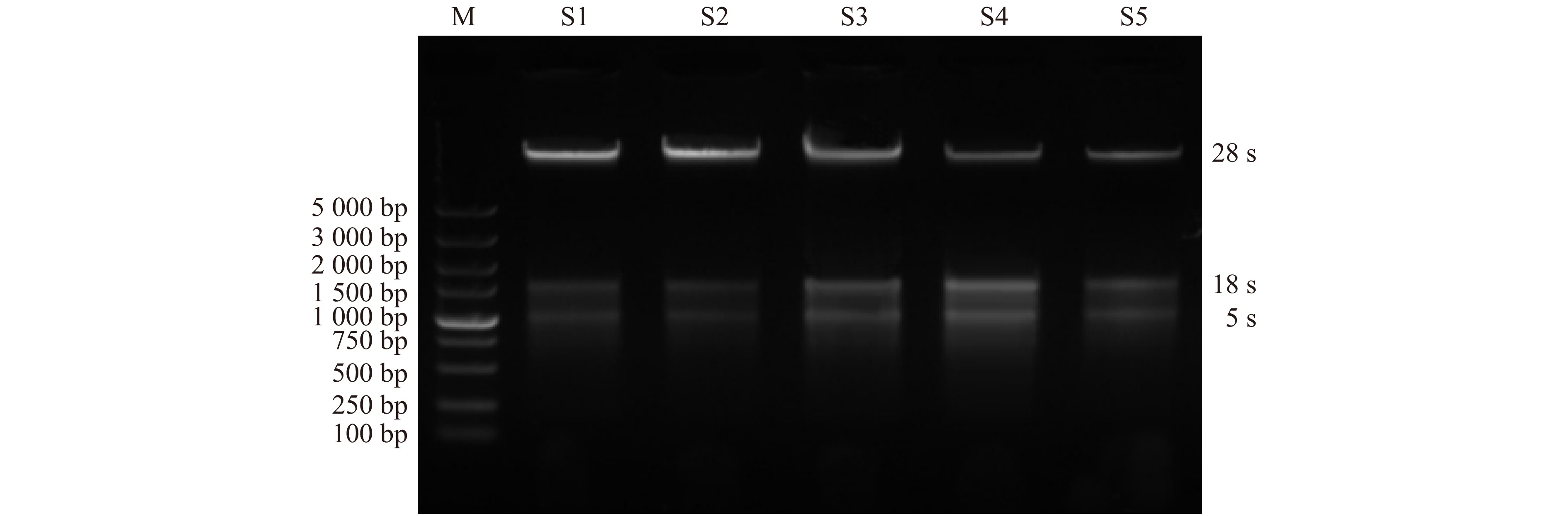
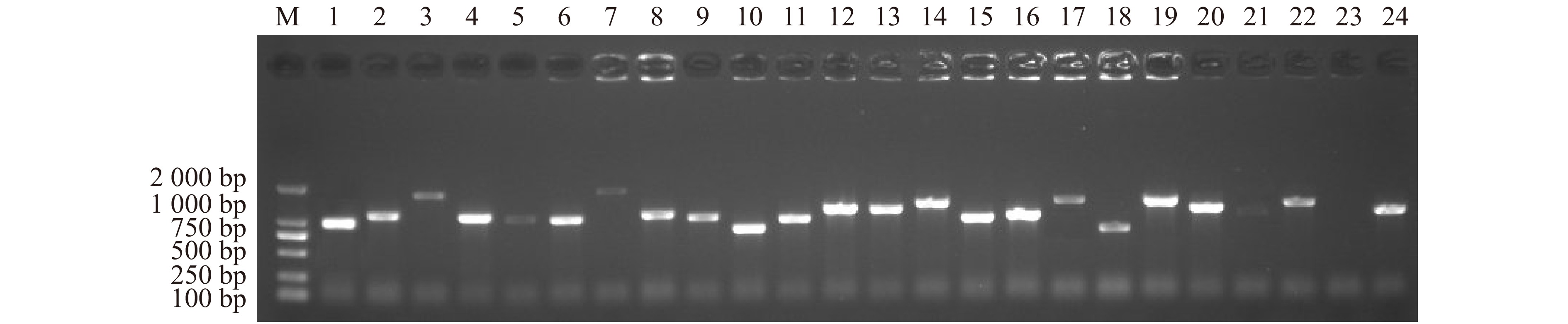
图 1 芍药种子休眠解除5个关键时期的总RNA电泳图
M. DL2000 Plus DNA Marker;S1. 吸涨后的种子;S2. 露白的种子;S3. 根长3 ~ 4 cm的种子;S4. 根茎变红的种子;S5. 长芽的种子。下同。M, DL2000 Plus DNA Marker; S1, the imbibition seed; S2, the radicle breakthrough seed coat; S3, seed root length is 3−4 cm; S4, the basal part of seed root turns to red; S5, sprouting seeds. The same below.
Figure 1. Total RNA electrophoretogram of the P. lactiflora seeds at five critical dormancy release periods
表 1 芍药种子休眠解除5个关键时期的总RNA质量
Table 1 Total RNA quality of the P. lactiflora seeds at five critical dormancy release periods
种子休眠解除时期
Seed dormancy release stage质量浓度
Mass concentration/(μg·μL−1)A260/A280 S1 1.297 2 2.01 S2 1.165 0 2.00 S3 1.010 1 2.03 S4 1.155 5 2.03 S5 1.753 8 2.02 表 2 酵母文库中cDNA插入片段的序列分析
Table 2 Sequence analysis of the inserted cDNA fragments in yeast cDNA library
阳性克隆编号
Positive clone No.同源基因登录号
Accession No. of the homologous gene功能注释
Functional annotation1 XP_020677857.1 赤霉素 3-beta-氧化酶1 Gibberellin 3-beta-dioxygenase 1(GA3ox) 2 XP_034227399.1 半胱氨酸蛋白酶RD19A-like Cysteine protease RD19A-like 3 XP_034690410.1 UDP-葡萄糖醛酸脱羧酶2-like UDP-glucuronic acid decarboxylase 2-like 4 XP_010266166.1 线粒体解偶联蛋白5-like Mitochondrial uncoupling protein 5-like 5 XP_038999384.1 延伸因子1-delta-like Elongation factor 1-delta-like(eEF) 6 RVX14141.1 假定蛋白 Hypothetical protein 7 XP_007203178.1 WUSCHEL蛋白 Protein WUSCHEL 8 XP_018164540.1 类硫氧还蛋白结构域蛋白 DSBA-like thioredoxin domain-containing protein 9 XP_038974828.1 生长素响应因子17-like X1亚型
Auxin response factor 17-like isoform X1(ARF)10 XP_040992987.1 渗调-like蛋白 Osmotin-like protein 11 MBA0678152.1 假定蛋白 Hypothetical protein 12 XP_022760600.1 乙烯响应转录因子RAP2-3-like X2亚型
Ethylene-responsive transcription factor RAP2-3-like isoform X213 KAB1216993.1 E3泛素蛋白连接酶RBBP6 E3 ubiquitin-protein ligase RBBP6 14 XP_015623076.1 鳞状细胞启动子结合样蛋白4 X2亚型
Squamosa promoter-binding-like protein 4 isoform X2(SPL)15 WP_166488593.1 假定蛋白 Hypothetical protein 16 KAB1205953.1 D-半乳糖醛酸酯还原酶 D-galacturonate reductase 17 XP_038701416.1 水通道蛋白PIP2-2-like Aquaporin PIP2-2-like 18 XP_034675176.1 14-3-3-like蛋白 14-3-3-like protein 19 XP_010278122.1 组蛋白H1-like Histone H1-like 20 XP_002323024.1 脱落酸受体 PYL4 Abscisic acid receptor PYL4 21 XP_015576211.1 蛋白GID8同源亚型 X1 Protein GID8 homolog isoform X1 22 XP_024041837.1 CTD小磷酸酶样蛋白2亚型X2
CTD small phosphatase-like protein 2 isoform X223 XP_010243544.1 叶绿体一类过氧化物酶-2E-1 Peroxiredoxin-2E-1, chloroplastic -
[1] 王莲英, 袁涛. 中国牡丹与芍药[M]. 北京: 金盾出版社, 1999: 1−3. Wang L Y, Yuan T. Chinese tree peony and herbaceous peony[M]. Beijing: Jin Dun Press, 1999: 1−3.
[2] 李嘉珏. 中国牡丹与芍药[M]. 北京: 中国林业出版社, 1999: 153−155. Li J Y. Chinese tree peony and herbaceous peony[M]. Beijing: China Forestry Publishing House, 1999: 153−155.
[3] 张萍. ‘凤丹’种子发育过程中脱落酸表达机制的初步研究[D]. 北京: 中囯农业科学院, 2014. Zhang P. Preliminary study on the mechanisms of abscisic acid regulation in Paeonia ostii ‘Fengdan’ seed development[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014.
[4] Ma Y L, Cui J Q, Lu X J, et al. Transcriptome analysis of two different developmental stages of Paeonia lactiflora seeds[J/OL]. International Journal of Plant Genomics, 2017, 8027626[2021−04−16]. https://doi.org/10.1155/2017/8027626.
[5] 李雪婷. 基于转录组分析的芍药种子休眠解除相关基因PlCYP707As的功能分析[D]. 沈阳: 沈阳农业大学, 2020. Li X T. Functional analysis of PlCYP707As related to dormancy release in Paeonia lactiflora seed based on transcriptome analysis[D]. Shenyang: Shenyang Agricultural University, 2020.
[6] 麻永磊. 芍药种子休眠与萌发相关基因PlPP2C的克隆及遗传转化[D]. 沈阳: 沈阳农业大学, 2018. Ma Y L. Cloning and genetic transformation of PlPP2C gene related to dormancy and germination of Paeonia lactiflora seeds[D]. Shenyang: Shenyang Agricultural University, 2018.
[7] 崔金秋. 芍药种子下胚轴休眠与萌发相关调控基因PlGAI1的克隆及功能分析[D]. 沈阳: 沈阳农业大学, 2016. Cui J Q. Cloning and functional analysis of the PlGAI1 gene related to the dormancy and germination of the seeds in Paeonia lactiflora Pall.[D]. Shenyang: Shenyang Agricultural University, 2016.
[8] 费日雯. 芍药PlSAURs基因的克隆及对拟南芥的遗传转化[D]. 沈阳: 沈阳农业大学, 2018. Fei R W. Cloning of the PlSAURs genes from Paeonia lactiflora Pall. and transformation of Arabidopsis thaliana[D]. Shenyang: Shenyang Agricultural University, 2018.
[9] 王琪, 朱延明, 王冬冬. 酵母单杂交系统在植物基因工程研究中的应用[J]. 北京林业大学学报, 2008, 30(1): 141−147. Wang Q, Zhu Y M, Wang D D. Application of yeast one-hybrid system in plant genetic engineering[J]. Journal of Beijing Forestry University, 2008, 30(1): 141−147.
[10] 娄鸿飞, 张志文, 林桂亭. 酵母双杂交系统研究进展[J]. 生物学通报, 2001, 36(11): 1−2. Lou H F, Zhang Z W, Lin G T. Advances in yeast two-hybrid system[J]. Bulletin of Biology, 2001, 36(11): 1−2.
[11] 晏慧君, 黄兴奇, 程在全. cDNA文库构建策略及其分析研究进展[J]. 云南农业大学学报, 2006, 21(1): 1−6. Yan H J, Huang X Q, Cheng Z Q. Advances of the studies on construction strategy and analysis of cDNA library[J]. Journal of Yunnan Agricultural University, 2006, 21(1): 1−6.
[12] 胡陶, 姚娜, 杨学文, 等. 毛竹萌发种子全长cDNA文库的构建[J]. 安徽农业科学, 2012, 40(35): 17007−17010, 17028. Hu T, Yao N, Yang X W, et al. Construction of full-length cDNA library for germinating seeds of Phyllostachys heterocycla[J]. Journal of Anhui Agricultural Sciences, 2012, 40(35): 17007−17010, 17028.
[13] 覃怀德. 水稻种子休眠期cDNA文库构建与筛选及基因表达谱分析[D]. 南京: 南京农业大学, 2020. Qin H D. Seed dormancy cDNA library construct and selection and gene expression profiling analysis in rice (Oryza sativa L.)[D]. Nanjing: Nanjing Agricultural University, 2020.
[14] Liu X, Yi X, Yang Y R, et al. A rice geranylgeranyl reductase is essential for chloroplast development[J]. Journal of Integrative Agriculture, 2021, 20(10): 2592−2600. doi: 10.1016/S2095-3119(20)63324-X
[15] Zhang L F, Zhou H, Wei F J, et al. Construction of yeast two-hybrid cDNA libraries for wheat near-isogenic line TcLr19 under the stress of Puccinia recondita and its preliminary appreciation[J]. Frontiers of Agriculture in China, 2011, 5: 450−455. doi: 10.1007/s11703-011-1123-1
[16] 苏玲, 李彬, 王青, 等. 金柑花蕾酵母双杂交cDNA文库构建及评价[J]. 基因组学与应用生物学, 2019, 38(7): 3169−3173. Su L, Li B, Wang Q, et al. Construction and evaluation of yeast two hybrid cDNA library of floral buds from Rongan kumquat[J]. Genomics and Applied Biology, 2019, 38(7): 3169−3173.
[17] 刘婕仪, 苏小慧, 全芮萍, 等. 苎麻酵母cDNA文库的构建与分析[J]. 分子植物育种, 2021, 21(13):4295−4300. Liu J Y, Su X H, Quan R B, et al. Construction and analysis of cDNA library of ramie yeast[J]. Molecular Plant Breeding, 2021, 21(13):4295−4300.
[18] 邱爱连, 刘林林, 蔡汉阳, 等. Gateway技术构建酵母双杂分析用辣椒cDNA文库[J]. 江西农业大学学报, 2010, 32(4): 791−796. Qiu A L, Liu L L, Cai H Y, et al. Construction of a cDNA library of pepper for yeast two-hybrid analysis using gateway technology[J]. Journal of Jiangxi Agricultural University, 2010, 32(4): 791−796.
[19] Cao S H, Siriwardana C L, Kumimoto R W, et al. Construction of high quality Gateway™ entry libraries and their application to yeast two-hybrid for the monocot model plant Brachypodium distachyon[J]. BMC Biotechnology, 2011, 11: 53. doi: 10.1186/1472-6750-11-53
[20] 陶烨. 大麦黄矮病毒GAV与二穗短柄草互作蛋白的筛选鉴定研究[D]. 杨凌: 西北农林科技大学, 2016. Tao Y. Screening and characterization of proteins interacted with barley yellow dwarf virus-GAV in brachypodium distachyon[D]. Yangling: Northwest Agricultural and Forestry University, 2016.
[21] 费日雯, 孙晓梅, 杨盼盼, 等. 芍药种子变温层积过程中的解剖结构观察[J]. 沈阳农业大学学报, 2017, 48(3): 354−359. Fei R W, Sun X M, Yang P P, et al. Anatomical observation of Paeonia lactiflora seeds during stratification process[J]. Journal of Shenyang Agricultural University, 2017, 48(3): 354−359.
[22] Li X T, Fei R W, Chen Z J, et al. Plant hormonal changes and differential expression profiling reveal seed dormancy removal process in double dormant plant-herbaceous peony[J]. PLoS ONE, 2020, 15(4): e0231117.
[23] 朱佳慧, 徐秋芳, 袁平平, 等. 水稻幼苗酵母双杂交cDNA文库的构建及鉴定[J]. 江苏农业科学, 2018, 46(9): 47−50. Zhu J H, Xu Q F, Yuan P P, et al. Construction and identification of yeast two-hybrid cDNA library of rice seedling[J]. Jiangsu Agricultural Sciences, 2018, 46(9): 47−50.
[24] 周莹, 王楠, 尹俊琦, 等. 大豆幼荚全长cDNA文库的构建及鉴定分析[J]. 大豆科学, 2013, 32(4): 455−458. Zhou Y, Wang N, Yin J Q, et al. Construction and indentification of full-length cDNA library from young pod of soybean[J]. Soybean Science, 2013, 32(4): 455−458.
[25] Ohara O, Temple G. Directional cDNA library construction assisted by the in vitro recombination reaction[J]. Nucleic Acids Research, 2001, 29(4): e22. doi: 10.1093/nar/29.4.e22
[26] 王丽娟, 金治平, 王能飞, 等. 羊草叶片cDNA文库的构建及部分表达序列标签的分析[J]. 草业学报, 2009, 18(1): 65−71. doi: 10.11686/cyxb20090110 Wang L J, Jin Z P, Wang N F, et al. Construction of cDNA library of Leymus chinensis leaves and analysis of partial expression sequence tags[J]. Acta Prataculture Sinica, 2009, 18(1): 65−71. doi: 10.11686/cyxb20090110
[27] 王舟, 宗俊勤, 郭海林, 等. Gateway技术构建结缕草低温和干旱诱导cDNA文库及其质量鉴定[J]. 草业科学, 2012, 29(6): 911−917. Wang Z, Zong J Q, Guo H L, et al. Construction of low temperature and drought induction in Zoysia japonica by gateway technique cDNA library and its quality identification[J]. Pratacultural Science, 2012, 29(6): 911−917.
[28] 李慧. 云斑天牛触角cDNA文库的构建及相关嗅觉蛋白的表达及功能分析[D]. 武汉: 华中农业大学, 2012. Li H. Construction and analysis of cDNA libraries from the antenna of the Batocera horsfieldi (Hope) and cloning, expression and functional analysis of olfactory related proteins[D]. Wuhan: Huazhong Agricultural University, 2012.
[29] 赵志辉, 李宁. EST序列测定时cDNA文库的构建和参数评估[J]. 农业生物技术学报, 2003, 11(4): 422−425. Zhao Z H, Li N. Construction of cDNA library and its parameter evaluating on EST sequencing[J]. Journal of Agricultural Biotechnology, 2003, 11(4): 422−425.
[30] 张萌萌. 芍药种子休眠机理及萌发技术的研究[D]. 沈阳: 沈阳农业大学, 2012. Zhang M M. Studies on seed dormant mechanism and germination technique of Paeonia lactiflora[D]. Shenyang: Shenyang Agricultural University, 2012.
[31] Hao Z, Zhang Z, Xiang D, et al. Conserved, divergent and heterochronic gene expression during Brachypodium and Arabidopsis embryo development[J]. Plant Reproduction, 2021, 34(3): 207−224. doi: 10.1007/s00497-021-00413-4
[32] Sun M, Tuan P A, Izydorczyk M S, et al. Ethylene regulates post-germination seedling growth in wheat through spatial and temporal modulation of ABA/GA balance[J]. Journal of Experimental Botany, 2020, 71(6): 1985−2004. doi: 10.1093/jxb/erz566
[33] Ge W J, Steber C M. Positive and negative regulation of seed germination by the Arabidopsis GA hormone receptors, GID1a, b, and c[J]. Plant Direct, 2018, 2(9): e00083. doi: 10.1002/pld3.83
[34] Liu X D, Zhang H, Zhao Y C, et al. Auxin controls seed dormancy through stimulation of abscisic acid signaling by inducing ARF-mediated ABI3 activation in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(38): 15485−15490. doi: 10.1073/pnas.1304651110
[35] 秦苗苗. 水稻SPL家族基因SPL12调控种子休眠及作用机理研究[D]. 杭州: 浙江农林大学, 2020. Qin M M. Study on a member SPL12 of SQUAMOSA Promoter Binding Protein-Like gene family in regulating seed dormancy in rice[D]. Hangzhou: Zhejiang Agricultural and Forestry University, 2020.
[36] Jahn T, Fuglsang A T, Olsson A, et al. The 14-3-3 protein interacts directly with the C-terminal region of the plant plasma membrane H (+)-ATPase[J]. Plant Cell, 1997, 9(10): 1805−1814.
[37] 覃迎姿, 黄先益, 叶兴枝, 等. 植物延伸因子eEF1A研究进展[J]. 广西农业科学, 2009, 40(5): 472−477. Qin Y Z, Huang X Y, Ye X Z, et al. Advance in eukaryotic elongation factor eEF1A in plant[J]. Guangxi Agricultural Sciences, 2009, 40(5): 472−477.
[38] Yang W, Burkhart W, Cavallius J, et al. Purification and characterization of a phosphatidylinositol 4-kinase activator in carrot cells[J]. Journal of Biological Chemistry, 1993, 268(1): 392−398. doi: 10.1016/S0021-9258(18)54163-6
-
期刊类型引用(7)
1. 于秋莹,郭苗苗,许岢昕,刘建斌,王聪,郑健,张克中,张炎. 欧洲丁香品种‘Downfield’花序和花序轴愈伤组织诱导和悬浮培养. 东北林业大学学报. 2023(03): 47-53 .  百度学术
百度学术
2. 胡家锋,代鲁鲁,戴瑜,姚芳,姜韬,谈家金. 常熟市枫香刺小蠹野外危害调查及防治效果评价. 天津农业科学. 2023(06): 56-61 .  百度学术
百度学术
3. 韩娟,李亚鹏,田彦挺,郭琪,李云,孙宇涵,邓永平,牛东升,苏立琢,李秀宇,彭祚登. 刺槐离体叶片高效再生体系的优化. 林业科学. 2023(04): 68-78 .  百度学术
百度学术
4. 胡家锋,谈家金,姚芳,戴瑜,姜韬,代鲁鲁. 6种药剂对枫香刺小蠹幼虫及成虫的室内毒力测定. 东北林业大学学报. 2023(11): 157-161 .  百度学术
百度学术
5. 王玉娟,罗成凤,幸伟年,李进,占志勇,何小三. 中国枫香×北美枫香杂交子代生长表现及初步评价. 南方林业科学. 2022(06): 15-18 .  百度学术
百度学术
6. 李亦轩,江帅菲,董明亮,齐帅征,张金凤,Lisheng Kong. 油松胚性愈伤组织成熟培养的影响因素. 东北林业大学学报. 2020(04): 20-23+49 .  百度学术
百度学术
7. 高磊,王建国,王章训,李猷,鞠瑞亭. 危险性害虫枫香刺小蠹的形态特征及发生现状. 林业科学. 2020(03): 193-198 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: