Response of growth and metabolism of Artemisia scoparia to precipitation change in desert steppe
-
摘要:目的 研究荒漠草原猪毛蒿生长和代谢特征对降水变化的响应,可为荒漠草原植被恢复与重建提供参考。方法 本文采用野外增减降水试验,于2017—2020年研究了降水改变(增水30%、对照和减水30%)条件下猪毛蒿生长特征及其代谢产物,旨在探讨猪毛蒿生长代谢对降水改变的响应机制。结果 在降水量较多的2018年(385.6 mm),降水改变对猪毛蒿生长影响较小,而在降水较少的2020年(205.8 mm)猪毛蒿的地上生物量、密度、株高和冠幅对降水变化响应显著。在猪毛蒿茎叶中检测出772种代谢物,主要包括黄酮、酚酸类、脂质等。3种降水处理间具有显著差异的43种代谢物主要是黄酮、酚酸类、有机酸、脂质、氨基酸及其衍生物等。增加和减少降水处理间出现差异的代谢物为52种,差异代谢物以上调为主,上调数量占到了差异代谢物数量的76.07%,而增减水和对照处理三者间共同的差异代谢物仅为2种,说明水分可显著影响猪毛蒿生长代谢。在代谢通路方面,降水量改变主要影响了猪毛蒿茎叶的花青素生物合成通路、精氨酸生物合成与淀粉和蔗糖代谢通路。结论 荒漠草原猪毛蒿通过增强地上生物量、密度、株高和冠幅等表型可塑性来适应降水的变化,降水偏枯年份的表型可塑性变异比丰水年更明显,而且降水变化可显著改变猪毛蒿茎叶代谢物,这可能是干旱环境下猪毛蒿生理可塑性的表现。虽然本研究发现了猪毛蒿在不同降水处理下差异明显的KEGG代谢通路,但差异通路上具体的调控机制还需要进一步深入探究。Abstract:Objective Studying the response of growth and metabolic characteristics of Artemisia scoparia to precipitation changes can provide reference for vegetation restoration and reconstruction in desert steppe.Method Test method of precipitation control was adopted and the growth characteristics of A. scoparia under the condition of precipitation change (30% water increase treatments, IT; check treatments, CK; 30% water decrease treatments, DT) were continuously observed from 2017 to 2020, and its metabolites were determined to explore the response mechanism of growth response and metabolic adaptation of A. scoparia to precipitation change.Result The results showed that precipitation changes had little effect on the growth characteristics of A. scoparia in the year with more precipitation (2018), while the aboveground biomass, density, plant height and crown width of A. scoparia had significant response to precipitation changes in the dry year (2020). Seven hundreds and seventy two metabolites were detected in the stem and leaf mixture of A. scoparia, including flavonoids, phenolic acids, lipids, etc. The 43 metabolites with significant differences among different precipitation treatments were mainly flavonoids, phenolic acids, organic acids, lipids, amino acids and their derivatives. There were 52 individual differential metabolites in the increased and decreased water treatment, and the differential metabolites were mainly up-regulated, which accounted for 76.07% of differential metabolites, while there were only 2 common differential metabolites in common among the three treatments. The results indicated that the precipitation change in desert steppe was an important factor affecting the growth and metabolism characteristics of A. scoparia. In metabolic pathway, precipitation changes mainly affected anthocyanin biosynthesis, arginine biosynthesis and starch and sucrose metabolism in stem and leaf mixture of A. scoparia.Conclusion A. scoparia in desert steppe adapted to the change of precipitation by enhancing the phenotypic plasticity of aboveground biomass, density, plant height and crown width. The phenotypic plasticity variation in dry years of precipitation was more obvious than that in wet years. Precipitation can significantly change the metabolites of stem and leaf of A. scoparia, which may be the expression of physiological plasticity of A. scoparia under drought environment. Although the KEGG metabolic pathway of A. scoparia under different precipitation treatments was found, the specific regulation mechanism of the differential pathway needs to be further explored.
-
水分是土壤−植物−微生物及其所在环境作用的必需物质,是养分转换、物质循环及能量交换的关键因素,也是生物代谢所需的基本物质。全球气候变化导致极端降水事件(干旱或者洪涝)频发,对荒漠草原生态系统产生较大影响[1],加之荒漠草原的脆弱性,使得其对气候的波动更为敏感[2]。因此,研究降水变化对植物的影响对荒漠草原的适应性管理具有重要意义[3]。
植物在受到刺激或扰动后,会产生一系列的响应,其中代谢物可以直观反映植物对所处环境变化的响应[4]。代谢组学是系统生物学的一个分支,通过高通量检测和大数据量的处理手段,开展系统整合的代谢物组群指标分析,可以反映外界刺激的细胞或组织代谢应答变化[5],这为从整体上全面、多维理解植物响应环境变化提供了可能[6]。Carmo-Silva等[7]研究了3种C4草本植物对干旱胁迫应答的代谢指纹图谱,发现5-hydroxynorvaline这种特殊的非蛋白质氨基酸与植物的抗旱能力密切相关。Foito等[8]研究发现两种不同基因型的黑麦草在干旱胁迫下叶片中的代谢产物发生明显的变化,而丹参在干旱模式下的应激也不完全相同[9],说明土壤水分的变化会影响植物代谢通路及最终的代谢产物。因此,代谢组学可以反映植物对复杂生物或非生物因素的响应及其应答机制[10-11],已经被应用于植物学研究的各个领域[12]。
猪毛蒿(Artemisia scoparia)广泛分布在欧亚大陆的温带到亚热带地区,在中国大部分地区均有分布,极易形成覆盖度50%以上的单优种群[13]。因具有极强的适应恶劣环境能力,而且在与其他植物伴生过程中往往具有较强的竞争能力,也具有较高的扩散性[14]。有学者研究发现黄土丘陵沟壑区阳坡幼苗密度较小而存活率较高,在与其他伴生种的竞争中是以“量”取胜[15]。还有研究发现,荒漠草原猪毛蒿的生长与降水密切相关,受降水影响较大[16]。但目前运用代谢组学的方法研究降水变化对猪毛蒿代谢物影响的相关报道尚少,因此本研究以荒漠草原猪毛蒿为研究对象,采用植物代谢组学的方法和技术,探讨猪毛蒿生长表型对降水变化的响应,以及不同降水处理下猪毛蒿代谢物差异及其主要代谢途径,可为理解猪毛蒿如何应对气候变化和深入挖掘猪毛蒿药用价值奠定理论基础。
1. 研究区概况与研究方法
1.1 样地概况
研究区在宁夏回族自治区吴忠市盐池县皖记沟行政村(37°47′30″ ~ 37°57′00″ N,107°22′30″ ~ 107°33′45″ E),位于盐池县城东北方向,地势南部高、北部低,植被类型属于典型的荒漠草原。具有典型的过渡性(鄂尔多斯台地向黄土高原的过渡,干旱荒漠向半干旱草原区的过渡)[17]。气候特点为干旱少雨,蒸发量大,冬春两季风大沙多,年降水量小、时空分布不匀,年际变率大[18],多年平均蒸发量可达2710 mm,属典型的中温带大陆性气候[19]。所选样地土壤类型以风沙土为主,植物群落物种多样性低、群落结构简单,优势种为猪毛蒿,伴生种主要有牛枝子(Lespedeza potaninii)、虫实(Corispermum mongolicum)、蒺藜(Tribulus terrester)、糙隐子草(Cleistogenes squarrosa)等。
1.2 试验设计
野外开展的降水改变试验是根据本团队的相关专利布设[20],其中减水处理是通过截雨槽将降水截留,以减少降水量来控制减水,同时将截留的降水在重力作用下流进下端的增水槽内(分布有漏水眼),达到增水处理同步增水的目的,对照处理则为天然降水。每个处理小区面积为2 m × 2 m,3个重复。为了避免边缘效应对试验结果的影响,在每个小区内又分别设置3个50 cm × 50 cm的样方开展监测和调查,即每个处理监测和调查样方共9个重复。参考同地区研究设定的降水量处理设计[21],于2017年4月在宁夏大学生态学教学科研基地的荒漠草原野外监测试验站布设降水增加30%、天然降水和降水减少30% 3个降水控制试验,定期清除试验小区内的其他植物。
1.3 测定指标与计算方法
1.3.1 环境指标
降水量和降水天数等数据来源于中国气象数据网(http://data.cma.cn/)的盐池站点数据。
1.3.2 生长指标
为了减少刈割对次年种群生长的影响,只开展2次(2018年和2020年生育期末)地上生物量的测定。密度、株高、冠幅、盖度、地上生物量具体测定方法见文献[17]。考虑到2020年各处理下猪毛蒿表型的差异明显,特选择生长旺盛期(8月10日)进行代谢组学的采样和测定。可塑性指数:参照Valladares等[22]的方法计算不同降水处理下猪毛蒿密度、株高、冠幅、盖度和地上生物量的可塑性指数。
1.3.3 代谢产物
样品提取:选取不同处理下生长状况良好且无病虫害的猪毛蒿茎叶,各设3个生物学重复。将获得的样品置于冻干机(Scientz-100F)中真空冷冻干燥后,研磨至粉末状;称取100 mg的粉末,溶解于1.2 mL 70% 甲醇提取液中;每30 min涡旋一次,每次持续30 s,共涡旋6次,样本置于4 ℃冰箱过夜;12000 rpm离心10 min,将上层清液过0.22 μm滤膜后保存于进样瓶中,用于后续测定。
检测分析:主要包括超高效液相色谱和串联质谱,其中液相条件:(1)色谱柱:Agilent SB-C18 1.8 µm,2.1 mm × 100 mm;(2)流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸);(3)洗脱梯度:0.00 min B相比例为5%,9.00 min内B相比例线性增加到95%,并维持在95% 1.00 min,10.00 ~ 11.10 min,B相比例降为5%,并以5%平衡至14.00 min;(4)流速0.35 mL/min;柱温40 ℃;进样量4 μL。
质谱条件:采用三重四极杆线性离子阱质谱仪(QTRAP)进行线性离子阱(LIT)和三重四极杆(QQQ)扫描。电喷雾离子源(ESI)操作参数如下:离子源,涡轮喷雾;源温度550 ℃;离子喷雾电压(IS)5500 V(正离子模式)/−4500 V(负离子模式);离子源气体I(GSI),气体II和帘气分别设置为50.0、60.0和25.0 psi,碰撞诱导电离参数设置为高。在QQQ和LIT模式下分别用10和100 μmol/ L聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用多反应检测扫描(MRM)模式,并将碰撞气体(氮气)设置为中等。
定性定量:利用二级谱信息定性物质,分析时去除含K +、Na + 、NH4 + 等杂质信号。定量则是利用四级杆筛选目标物质的前体离子,排除掉其他分子量物质对应的离子;碎片离子通过三重四级杆过滤选择出所需要的特征碎片离子。最后对其中同一代谢物在不同样本中的质谱出峰进行积分校正。
基于超高效液相色谱串联质谱检测平台(UPLC-MS/MS)和自建数据库(metware database)对代谢物进行鉴定。
1.4 数据处理
利用Analyst 1.6.1软件进行质谱定性定量分析。采用多维统计分析,建立可靠的数学模型对代谢物进行分析。差异代谢物的筛选采取将差异倍数值、偏最小二乘法判别模型的变量重要性投影值相结合的方法。筛选标准为:(1)选取差异倍数(fold change)≤ 0.5和 ≥ 2的代谢物;(2)选取变量重要性投影(variable importance projection, VIP) ≥ 1代谢物,一般认为VIP ≥ 1的代谢物则为差异显著。根据差异代谢物结果,进行KEGG通路富集,其中富集因子(rich factor)为差异表达的代谢物在对应通路中的个数与该通路检测注释到的代谢物总数的比值,通过超几何检验的P值确定其显著性。
2. 结果与分析
2.1 环境因子特征
从各月平均降水量分布来看(表1),不同月份降水分配不均,1—3月和11—12月降水量较低,平均月降水量 < 10 mm,降水主要发生在4—10月,占全年降水量的93.34%,而且较大的有效降水事件发生频次也较高,同时,这一时期气温相对较高,雨热同期有利于植物生长。
表 1 2017—2020年各月降水情况Table 1. Monthly precipitation condition from 2017 to 2020月份 Month 2017 2018 2019 2020 月平均降水量
Monthly average
precipitation/mm降水量
Precipitation/
mm降水天数
Precipitation
day number降水量
Precipitation/
mm降水天数
Precipitation
day number降水量
Precipitation/
mm降水天数
Precipitation
day number降水量
Precipitation/
mm降水天数
Precipitation
day number1月 January 0.0 0 3.9 4 2.2 1 7.3 9 3.4 2月 February 21.6 4 0.0 0 2.5 3 0.3 1 6.1 3月 March 11.0 4 2.5 1 2.7 2 0.0 0 4.1 4月 April 25.6 5 18.4 3 20.1 6 1.8 1 16.5 5月 May 17.6 4 68.5 5 14.7 5 11.9 4 28.2 6月 June 55.6 9 63.4 7 57.3 9 10.8 6 46.8 7月 July 78.0 10 63.3 10 55.5 8 15.7 7 53.1 8月 August 122.5 11 112.5 13 85.0 10 98.9 12 104.7 9月 September 18.6 7 29.1 7 40.1 7 37.3 9 31.3 10月 October 41.7 10 19.5 4 37.1 8 0.2 2 24.6 11月 November 0.0 0 3.8 2 5.9 3 17.4 5 6.8 12月 December 1.1 1 0.7 3 0.1 1 4.2 7 1.5 合计 Total 393.3 65 385.6 59 323.2 63 205.8 63 327.0 研究区1956—2020年的年平均降水量为292.3 mm,丰水年降水临界值319.0 mm,枯水年临界值261.8 mm。从降水年型来看,2017年和2018年为丰水年,2019年也为丰水年(但仅比丰水年临界值多4.2 mm),2020年为枯水年,较多年平均降水量少了86.5 mm。从所设置的增减水处理来看,2017年减水处理理论值为275.3 mm,增水处理理论值为511.3 mm;2018年减水处理理论值为269.9 mm,增水处理理论值为501.3 mm;2019年减水处理理论值为226.2 mm,增水处理理论值为420.2 mm;2020年减水处理理论值为144.1 mm,增水处理理论值为267.5 mm(仅比枯水年临界值多5.7 mm)。
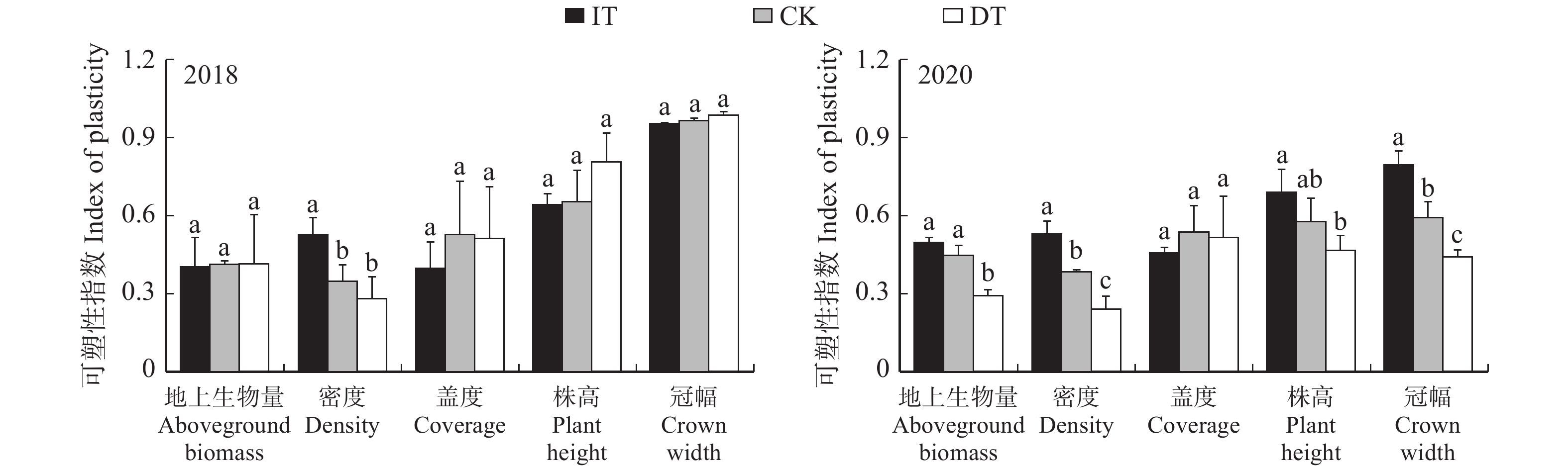
2.2 降水变化对猪毛蒿生长的影响
2018年猪毛蒿生长指标的可塑性指数中,仅增水处理下种群密度的可塑性指数显著高于其他两个处理,其他生长指标的可塑性指数均无显著差异;而2020年,降水处理对猪毛蒿地上生物量、密度、株高和冠幅的可塑性指数均产生了显著影响,随着水分的减少,这些指数呈降低的趋势,但盖度无显著差异(图1)。这可能是由于2018年降水充足,猪毛蒿未受到水分胁迫,因此降水改变对猪毛蒿生长的影响不大,而2020年为枯水年,特别是1—7月的降水量仅为47.8 mm,生长季前期的干旱对猪毛蒿生长产生了较大的影响,水分导致不同处理间猪毛蒿种群特征(地上生物量、密度、株高和冠幅)发生了显著差异。因此,我们选取2020年各处理下猪毛蒿茎叶进行后续的代谢特征分析。
2.3 差异代谢物分析和筛选
对不同处理下猪毛蒿地上部分代谢物进行检测,共分析鉴定出772种代谢物。其中主要包括了216种黄酮、129种酚酸类、106种脂质、72种氨基酸及其衍生物、68种有机酸、46种核苷酸及其衍生物、36种木脂素和香豆素、34种生物碱、15种萜类、2种醌类、2种鞣质以及其他46种。
2.3.1 差异代谢物分析
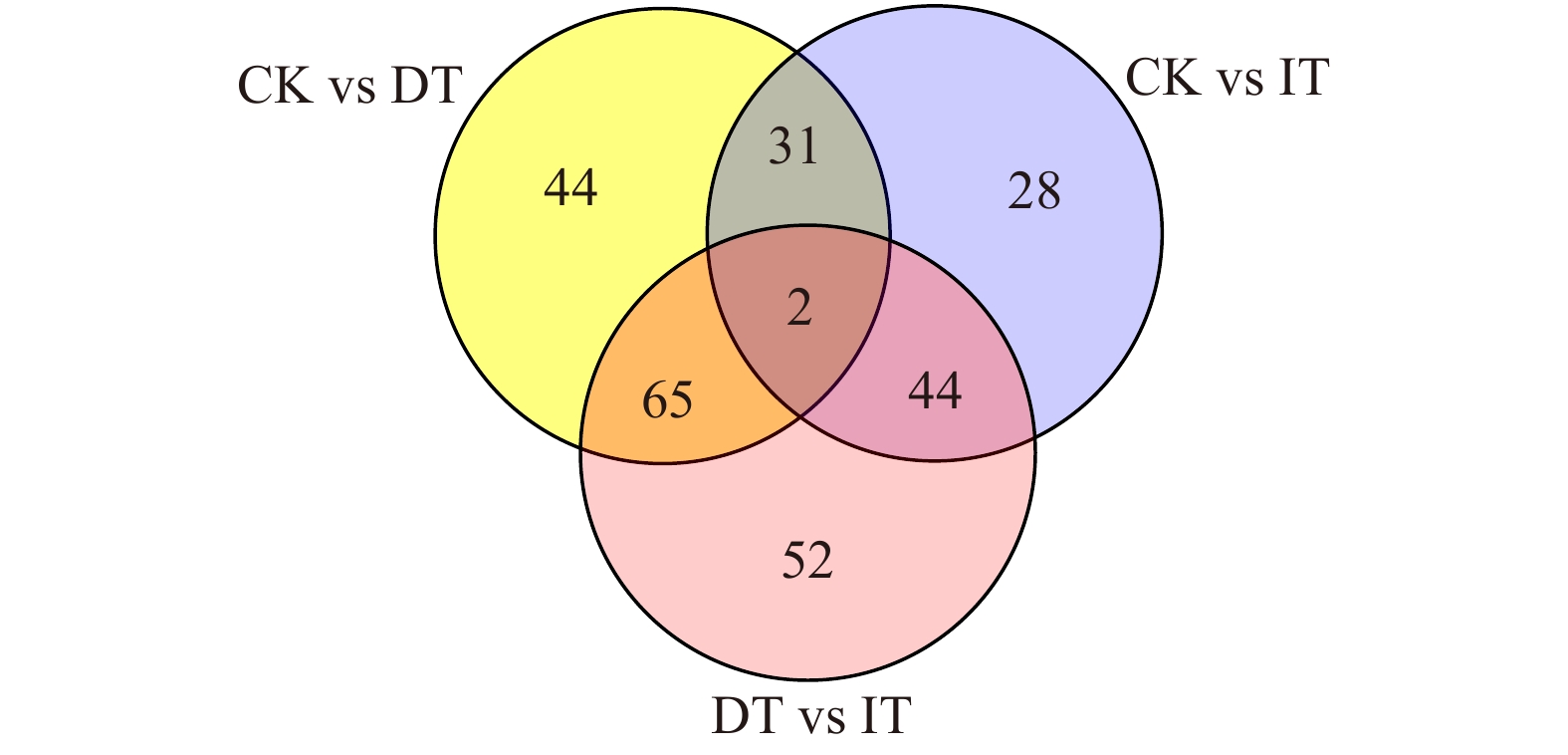
从表2可以看出,与对照处理相比,增水处理上调的代谢物有63个,下调的有42个;减水处理相比对照处理,下调的代谢物数量(100个)较上调的(42个)多;增水处理和减水处理相比,发生显著差异的代谢物数量共有163个,增水处理比减水处理有124个上调,39个下调。说明水分对猪毛蒿代谢物的影响较大,特别是减水处理下调的差异代谢物数量较多,而相对于增水处理,差异代谢物主要以上调为主,占到了两者间差异代谢物数量的76.07%。此外,从韦恩图(图2)也可以看出,增减水处理间出现的单独差异代谢物最多,达到了52种;减水处理和对照处理间有44种单独差异代谢物;增水处理和对照处理间独有的差异代谢物最少,为28种。而增减水和对照处理三者间共同的差异代谢物仅为2种。
表 2 不同处理猪毛蒿差异代谢物的数量Table 2. Number of differentially metabolites in A. scoparia under different treatments比较组
Comparison
group差异代谢物
数量
Number of differential metabolites
下调差异
代谢物数量
Down-regulate
the number of
differential
metabolites上调差异
代谢物数量
Up-regulate
the number of
differential
metabolitesCK vs DT 142 100 42 CK vs IT 105 42 63 DT vs IT 163 39 124 ![]() 图 2 CK与DT组、CK与IT组、DT与IT组差异代谢物韦恩图每个圈代表两两处理的比较组,圈重叠部分的数字是比较组共同差异代谢物个数,没有重叠部分的数字是比较组特有差异代谢物个数。Each circle represents the comparison group treated in pairs. The number of overlapping circles is the number of common differential metabolites in the comparison group, and the number without overlapping parts is the number of unique differential metabolites in the comparison group.Figure 2. Venn diagram illustrate numbers of common and uniquely significantly changing variables in different treatments of CK group vs DT group, CK group vs IT group, DT group vs IT group
图 2 CK与DT组、CK与IT组、DT与IT组差异代谢物韦恩图每个圈代表两两处理的比较组,圈重叠部分的数字是比较组共同差异代谢物个数,没有重叠部分的数字是比较组特有差异代谢物个数。Each circle represents the comparison group treated in pairs. The number of overlapping circles is the number of common differential metabolites in the comparison group, and the number without overlapping parts is the number of unique differential metabolites in the comparison group.Figure 2. Venn diagram illustrate numbers of common and uniquely significantly changing variables in different treatments of CK group vs DT group, CK group vs IT group, DT group vs IT group2.3.2 差异代谢物筛选
对检测到的代谢物进行log2处理后,对照和减水处理、对照和增水处理、增减水处理间差异倍数排在前20(上调和下调)的代谢物见图3,结果表明降水变化对猪毛蒿代谢物产生了较大的影响,与对照处理相比,减水处理中有机酸类的3,4-二甲氧基苯乙酸显著上调了10.88倍,酚酸类中的3-羟基-4-异丙基苯甲醇-3-O-葡萄糖苷显著下调了14.68倍;增水处理中黄酮类的槲皮素-3-O-鼠李糖基(1→2)阿拉伯糖苷较对照下调高达20.38倍;增减水处理间一种酚酸类上调倍数最大的达到了16.46倍(3-羟基-4-异丙基苯甲醇-3-O-葡萄糖苷),有一种黄酮类的下调最大为17.36倍(槲皮素-3-O-鼠李糖基(1→2)阿拉伯糖苷),这些差异倍数较大的代谢物可能是影响不同处理间猪毛蒿表型和光合特性差异的主要原因。
![]() 图 3 各组代谢物差异倍数图FC为差异代谢物的差异倍数。FC is difference multiple of differential metabolites. HJAP011. 金圣草黄素-8-C-葡萄糖苷 (金雀花素) Chrysoeriol-8-C-glucoside (Scoparin);Hmbp002498.东莨菪内酯-7-O-木糖基(1→6)葡糖苷 Scopoletin-7-O-xylosyl(1→6)glucoside;Hmcp001769.槲皮素-3-O-鼠李糖基(1→2)阿拉伯糖苷 Quercetin-3-O-rhamnosyl(1→2)arabinoside;Lmgp004474.5,7,4′-三羟基异黄酮-7-O-半乳糖苷-鼠李糖 5,7,4′-trihydroxyisoflavone-7-O-galactoside-rhamnose;Lmhn002683.对香豆酰咖啡酰酒石酸 p-coumaroylcaffeoyltartaric acid;Lmhp008763.溶血磷脂酰乙醇胺 16∶1(2n异构)* LysoPE 16∶1(2n isomer)*;Lmjn004991.二氢青蒿素 D3 Dihydro artemisinin-D3;Lmjp002718.青蒿素A Artemisinin A;Lmjp002764. 5,6-二甲氧基-7-羟基香豆素 5,6- dimethoxy -7- hydroxycoumarin;Lmyp004318.山奈酚-3-O-(6″-对香豆酰)半乳糖苷 Kaempferol-3-O-(6''-p-coumaroyl)galactoside;mws0129. 5,4′-二羟基-7-甲氧基黄酮5,4′- dihydroxy -7- methoxyflavone;mws0219. L-天冬氨酸 L-aspartic acid;mws0260. L-精氨酸 L-Arginine;mws0346. 3-(3-羟基苯基)丙酸 3-(3-hydroxyphenyl)-propionate acid;mws0572. 5-甲基胞嘧啶 5-methylcytosine;mws0612. 3,4-二甲氧基苯乙酸 3,4-dimethoxyphenyl acetic acid;mws1505. 咖啡酸苯乙酯 Phenethyl caffeate;mws1661. 香叶木苷 Vanillin;mws4177. 邻氨基苯甲酸甲酯 Methyl anthranilate;pma1840. 对香豆酰胆碱 P-coumaric choline;pmb0069. 苯甲酰胺 Benzamide;pmb0554. 天竺葵素-3-O-(6″'-O-丙二酰)葡萄糖苷 Pelargonidin-3-O-(6″'-O-malonyl)glucoside;pmb0566.木犀草素-7-O-葡萄糖苷-5-O-阿拉伯糖苷 Luteolin-7-O-glucoside-5-O-arabinoside;pmb0608.金圣草黄素-7-O-(6″'-丙二酰)葡萄糖苷 Chrysoeriol-7-O-(6″'-malonyl)glucoside;pmb2165.溶血磷脂酰胆碱 Lysophospholipidylcholine;pmb2922.尿苷 5′-二磷酸-D-葡萄糖 Uridine 5′-diphospho-D-glucose;pme0014. L-谷氨酸 L-glutamic acid;pme0368. 阿皮根素-7-O-芦丁(异罗非林) Apigenin-7-O-rutinoside (Isorhoifolin);pme1194. 2′-脱氧胞苷 2′-deoxycytidine;pme3207.己二烯二酸 Muconic acid;pme3381. 3-羟基苯基乙酸甲酯 3-hydroxyphenylacetic acid methyl ester;pme3388. 高精氨酸 Homoarginine;pme3443. 芥子醛 Sinapinaldehyde;pmn001521. 3-羟基-5-甲基苯酚-1-氧-(6′-没食子酰)葡萄糖苷 3-hydroxy-5-methylphenol-1-O-(6′-galloyl)glucoside;pmn001690. 3-羟基-4-异丙基苯甲醇-3-O-葡萄糖苷 3-hydroxy-4-isopropylbenzylalcohol-3-O-glucoside;pmp000575. 金合欢素-7-O-葡萄糖苷 (煅树素) Acacetin-7-O-glucoside (Tilianin);pmp000581. 芹菜素-7-O-(6″-乙酰)葡萄糖苷 Apigenin-7-O-(6″-acetyl)glucoside;pmp000585. 芹菜素-7-O-(6″-丙二酰)葡萄糖苷 Apigenin-7-O-(6″-malonyl)glucoside;Zmap010051. 布卢米恩C Blumeaene C;Zmhn002227. 4-O-葡萄糖基芥子酸 4-O-glucosyl-sinapate;Zmhn002508. 4-对香豆酰鼠李糖基-(1→6)-D-葡萄糖 4-p-cumaroyl-rhamnosyl-(1→6)-D-glucose;Zmjp000182. N-单甲基-L-精氨酸 N-monomethyl-L-arginine;Zmlp003063.木犀草素-7-O-(2″-O-鼠李糖基)芸香糖苷 Luteolin-7-O-(2″-O-rhamnosyl)rutinoside;Zmzn000113. L-苏式-3-甲基天冬氨酸 L-threo-3-methylaspartateFigure 3. Multiple diagram of metabolite difference in each group
图 3 各组代谢物差异倍数图FC为差异代谢物的差异倍数。FC is difference multiple of differential metabolites. HJAP011. 金圣草黄素-8-C-葡萄糖苷 (金雀花素) Chrysoeriol-8-C-glucoside (Scoparin);Hmbp002498.东莨菪内酯-7-O-木糖基(1→6)葡糖苷 Scopoletin-7-O-xylosyl(1→6)glucoside;Hmcp001769.槲皮素-3-O-鼠李糖基(1→2)阿拉伯糖苷 Quercetin-3-O-rhamnosyl(1→2)arabinoside;Lmgp004474.5,7,4′-三羟基异黄酮-7-O-半乳糖苷-鼠李糖 5,7,4′-trihydroxyisoflavone-7-O-galactoside-rhamnose;Lmhn002683.对香豆酰咖啡酰酒石酸 p-coumaroylcaffeoyltartaric acid;Lmhp008763.溶血磷脂酰乙醇胺 16∶1(2n异构)* LysoPE 16∶1(2n isomer)*;Lmjn004991.二氢青蒿素 D3 Dihydro artemisinin-D3;Lmjp002718.青蒿素A Artemisinin A;Lmjp002764. 5,6-二甲氧基-7-羟基香豆素 5,6- dimethoxy -7- hydroxycoumarin;Lmyp004318.山奈酚-3-O-(6″-对香豆酰)半乳糖苷 Kaempferol-3-O-(6''-p-coumaroyl)galactoside;mws0129. 5,4′-二羟基-7-甲氧基黄酮5,4′- dihydroxy -7- methoxyflavone;mws0219. L-天冬氨酸 L-aspartic acid;mws0260. L-精氨酸 L-Arginine;mws0346. 3-(3-羟基苯基)丙酸 3-(3-hydroxyphenyl)-propionate acid;mws0572. 5-甲基胞嘧啶 5-methylcytosine;mws0612. 3,4-二甲氧基苯乙酸 3,4-dimethoxyphenyl acetic acid;mws1505. 咖啡酸苯乙酯 Phenethyl caffeate;mws1661. 香叶木苷 Vanillin;mws4177. 邻氨基苯甲酸甲酯 Methyl anthranilate;pma1840. 对香豆酰胆碱 P-coumaric choline;pmb0069. 苯甲酰胺 Benzamide;pmb0554. 天竺葵素-3-O-(6″'-O-丙二酰)葡萄糖苷 Pelargonidin-3-O-(6″'-O-malonyl)glucoside;pmb0566.木犀草素-7-O-葡萄糖苷-5-O-阿拉伯糖苷 Luteolin-7-O-glucoside-5-O-arabinoside;pmb0608.金圣草黄素-7-O-(6″'-丙二酰)葡萄糖苷 Chrysoeriol-7-O-(6″'-malonyl)glucoside;pmb2165.溶血磷脂酰胆碱 Lysophospholipidylcholine;pmb2922.尿苷 5′-二磷酸-D-葡萄糖 Uridine 5′-diphospho-D-glucose;pme0014. L-谷氨酸 L-glutamic acid;pme0368. 阿皮根素-7-O-芦丁(异罗非林) Apigenin-7-O-rutinoside (Isorhoifolin);pme1194. 2′-脱氧胞苷 2′-deoxycytidine;pme3207.己二烯二酸 Muconic acid;pme3381. 3-羟基苯基乙酸甲酯 3-hydroxyphenylacetic acid methyl ester;pme3388. 高精氨酸 Homoarginine;pme3443. 芥子醛 Sinapinaldehyde;pmn001521. 3-羟基-5-甲基苯酚-1-氧-(6′-没食子酰)葡萄糖苷 3-hydroxy-5-methylphenol-1-O-(6′-galloyl)glucoside;pmn001690. 3-羟基-4-异丙基苯甲醇-3-O-葡萄糖苷 3-hydroxy-4-isopropylbenzylalcohol-3-O-glucoside;pmp000575. 金合欢素-7-O-葡萄糖苷 (煅树素) Acacetin-7-O-glucoside (Tilianin);pmp000581. 芹菜素-7-O-(6″-乙酰)葡萄糖苷 Apigenin-7-O-(6″-acetyl)glucoside;pmp000585. 芹菜素-7-O-(6″-丙二酰)葡萄糖苷 Apigenin-7-O-(6″-malonyl)glucoside;Zmap010051. 布卢米恩C Blumeaene C;Zmhn002227. 4-O-葡萄糖基芥子酸 4-O-glucosyl-sinapate;Zmhn002508. 4-对香豆酰鼠李糖基-(1→6)-D-葡萄糖 4-p-cumaroyl-rhamnosyl-(1→6)-D-glucose;Zmjp000182. N-单甲基-L-精氨酸 N-monomethyl-L-arginine;Zmlp003063.木犀草素-7-O-(2″-O-鼠李糖基)芸香糖苷 Luteolin-7-O-(2″-O-rhamnosyl)rutinoside;Zmzn000113. L-苏式-3-甲基天冬氨酸 L-threo-3-methylaspartateFigure 3. Multiple diagram of metabolite difference in each group为了获得更可靠的差异代谢物结果,结合偏最小二乘法判别方法的变量重要性投影值(VIP≥1)和单变量统计分析T检验P值(P < 0.05)来筛选3种处理间的显著差异代谢物。具有显著差异的43种代谢物中(表3),有机酸7种、脂质3种、酚酸类3种、氨基酸及其衍生物7种、生物碱6种、木脂素和香豆素2种、黄酮5种、核苷酸及其衍生物6种、其他类的为4种。
表 3 3种处理猪毛蒿具有显著差异的代谢物Table 3. Metabolites with significant differences in A. scoparia among three treatments序号
No.物质
Compounds物质一级分类
Primary classification of
substances (class Ⅰ)物质二级分类
Secondary classification of
substances (class Ⅱ)变量重要性投影
Variable importance projectionP 1 β-羟基异戊酸 β-hydroxyisovaleric acid 有机酸 Organic acid(OA) OA 2.079 0.019 2 精氨基琥珀酸 Argininosuccinic acid OA OA 1.928 0.018 3 α-酮戊二酸 α-ketoglutaric acid OA OA 1.815 0.015 4 2-吡啶甲酸 2-picolinic acid OA OA 1.758 0.003 5 异烟酸 Isonicotinic acid OA OA 1.552 0.015 6 γ-氨基丁酸 γ-aminobutyric acid OA OA 1.439 0.030 7 3-(3-羟基苯基)丙酸
3-(3-hydroxyphenyl)-propionate acidOA OA 1.263 0.039 8 顺-10-十七碳烯酸
cis-10-heptadecenoic acid脂质 Lipid 游离脂肪酸
Free fatty acid(FFA)2.262 0.042 9 二十碳二烯酸 Eicosadienoic acid 脂质 Lipid FFA 1.849 0.016 10 肉豆蔻酸 Myristic acid 脂质 Lipid FFA 1.270 0.022 11 秦皮乙素 Esculetin 木脂素和香豆素 Lignas and Coumarin 香豆素 Coumarin 2.274 0.020 12 茵芋苷 7-hydroxycoumarin-7-O-glucoside
(Skimmin)木脂素和香豆素
Lignan and Coumarin香豆素 Coumarin 1.700 0.001 13 D-苏糖酸 D-threonic acid 其他类 Others 糖及醇类
Saccharides and
alcohols (SA)2.098 0.022 14 D-阿拉伯糖醇 D-arabitol 其他类 Others SA 1.800 0.007 15 D-潘糖 D-panose 其他类 Others SA 1.546 0.005 16 1-甲基组胺 1-methylhistamine 其他类 Others 其他 Others 1.214 0.042 17 3-吲哚丙酸 3-indolepropionic acid 生物碱 Alkaloid 吲哚类生物碱 Plumerane 1.004 0.033 18 胆碱 Choline 生物碱 Alkaloid 生物碱 Alkaloid 2.163 0.023 19 N-苯亚甲基异甲胺
N-benzylmethylene isomethylamine生物碱 Alkaloid 生物碱 Alkaloid 1.984 0.039 20 甜菜碱 Betaine 生物碱 Alkaloid 生物碱 Alkaloid 1.858 0.021 21 二对香豆酰精胺
N1,N5-bis (p-coumaroyl) spermine生物碱 Alkaloid 酚胺 Phenolamine 1.872 0.035 22 N-对香豆酰精胺 N-p-coumaroylspermine 生物碱 Alkaloid 酚胺 Phenolamine 1.838 0.020 23 槲皮素-7-O-葡萄糖苷 Quercetin-7-O-glucoside 黄酮 Flavonoid 黄酮醇 Flavonol 2.241 0.010 24 槲皮素-3-O-葡萄糖苷(异槲皮苷)
Quercetin-3-O-glucoside (Isoquercitrin)黄酮 Flavonoid 黄酮醇 Flavonol 2.234 0.019 25 槲皮素-3-O-半乳糖苷 (金丝桃苷)
Quercetin-3-O-galactoside (Hyperin)黄酮 Flavonoid 黄酮醇 Flavonol 2.144 0.006 26 6-甲基山奈酚-3-O-葡萄糖苷
6-methyl kaempferol-3-O-glucoside黄酮 Flavonoid 黄酮 Flavonoid 1.436 0.009 27 香叶木素-7-O-半乳糖苷
Diosmetin-7-O-galactoside黄酮 Flavonoid 黄酮 Flavonoid 1.284 0.025 28 5-脱氧-5-甲硫腺苷
5′-deoxy-5′-(methylthio) adenosine核苷酸及其衍生物
Nucleotide and derivative (ND)ND 1.995 0.005 29 1-甲基腺嘌呤 1-methyladenine ND ND 1.963 0.047 30 2-(二甲基氨基)鸟苷
2-(Dimethylamino) guanosineND ND 1.933 0.013 31 鸟苷 Guanosine ND ND 1.838 0.028 32 2′-脱氧尿苷 2′-deoxyuridine ND ND 1.617 0.047 33 黄嘌呤 Xanthine ND ND 1.587 0.037 34 1′-O-(3,4-二羟基苯乙基)-O-咖啡酰基-葡萄糖苷
1′-O-(3,4-dihydroxyphenethyl)-O-caffeoyl-glucoside酚酸类
Phenolic acid (PA)PA 1.994 0.029 35 4-O-(6′-O-葡萄糖基咖啡酰)-3,4-二羟基苯甲酸
4-O-(6′-O-glucosylcaffeoyl)-3,4-dihydroxybenzoic acidPA PA 1.610 0.014 36 5-O-咖啡酰莽草酸 5-O-caffeoylshikimic acid PA PA 1.064 0.010 37 2-氨基异丁酸 2-aminoisobutyric acid 氨基酸及其衍生物 Amino acids and derivatives (ACD) ACD 2.137 0.025 38 L-脯氨酰-L-亮氨酸 L-prolyl-L-leucine ACD ACD 2.006 0.020 39 L-苯丙氨酸 L-phenylalanine ACD ACD 1.963 0.049 40 L-谷氨酸 L-glutamic acid ACD ACD 1.718 0.019 41 N,N-二甲基甘氨酸 N,N-dimethylglycine ACD ACD 1.644 0.016 42 L-苏式-3-甲基天冬氨酸
L-threo-3-methylaspartateACD ACD 1.521 0.000 43 5-羟基-L-色氨酸 5-hydroxy-L-tryptophan ACD ACD 1.158 0.014 2.4 差异代谢物KEGG富集分析
通过对改变降水条件下猪毛蒿的差异代谢物所参与的主要代谢通路进行富集和拓扑分析,可以筛选出关键代谢通路(图4)。减水处理与对照处理比较分析发现,减水处理对猪毛蒿的花青素生物合成、精氨酸生物合成、异黄酮类生物合成等代谢通路影响比较明显,且富集到对应通路上的差异显著代谢物数量较多,而富集到氨基酸的生物合成和2-氧代羧酸代谢通路上的差异代谢物数量虽然较多,但其富集不显著;增水处理与对照处理比较,对猪毛蒿的代谢途径、次级代谢物的生物合成、精氨酸生物合成、淀粉和蔗糖代谢等代谢通路影响明显,其中差异显著代谢物数量达到了近30种;增水处理与减水处理相比,代谢途径、淀粉和蔗糖代谢、嘧啶代谢、丙氨酸、天冬氨酸和谷氨酸代谢等代谢通路影响明显,同样是以富集到代谢途径通路上的差异显著代谢物数量最多。
![]() 图 4 3个对比组中差异代谢物排名前20的KEGG富集图横坐标表示富集因子;纵坐标为通路名称;点的颜色表示P值,越红表示富集越显著;点的大小代表富集到的差异代谢物数量。Abscissa represents the enrichment factor; ordinate represents the path name; color of the point represents the P value; size of the point represents the number of different metabolites enriched. A1. 维他命B6代谢 Vitamin B6 metabolism;A2. 酪氨酸代谢 Tyrosine metabolism;A3. 萜类化合物生物合成 Terpenoid backbone biosynthesis;A4. 丙酮酸代谢 Pyruvate metabolism ;A5. 嘧啶代谢 Pyrimidine metabolism;A6. 嘌呤代谢 Purine metabolism;A7. 单体生物合成 Monobactam biosynthesis;A8. 异黄酮生物合成 Isoflavonoid biosynthesis;A9. 谷胱甘肽代谢 Glutathione metabolism;A10. 果糖和甘露糖代谢 Fructose and mannose metabolism;A11. 叶酸生物合成 Folate biosynthesis;A12. 黄酮和黄酮醇的生物合成 Flavone and flavonol biosynthesis;A13. 脂肪酸生物合成 Fatty acid biosynthesis;A14. D-精氨酸和D-鸟氨酸代谢 D-arginine and D-ornithine metabolism;A15. 光合生物的固碳作用 Carbon fixation in photosynthetic organisms;A16. 氨基酸生物合成 Biosynthesis of amino acids;A17. 精氨酸生物合成 Arginine biosynthesis;A18. 花青素生物合成 Anthocyanin biosynthesis;A19. ABC转运蛋白 ABC transporters;A20. 2-氧代羧酸代谢 2-oxocarboxylic acid metabolism. B1. 牛磺酸和低牛磺酸代谢 Taurine and hypotaurine metabolism;B2. 淀粉和蔗糖代谢 Starch and sucrose metabolism;B3. 戊糖和葡糖醛酸相互转化 Pentose and glucuronate interconversions;B4. 氮代谢 Nitrogen metabolism;B5. 代谢路径 Metabolic pathways;B6. 赖氨酸生物合成 Lysine biosynthesis;B7. 组氨酸代谢 Histidine metabolism;B8. 乙醛酸和二羧酸代谢 Glyoxylate and dicarboxylate metabolism;B9. 甘油脂代谢 Glycerolipid metabolism;B10. 半乳糖代谢 Galactose metabolism;B11. 类黄酮生物合成 Flavonoid biosynthesis;B12. D-精氨酸和D-鸟氨酸代谢 D-arginine and D-ornithine metabolism;B13. C5-支链二元酸代谢 C5-branched dibasic acid metabolism;B14. 丁酸代谢 Butanoate metabolism;B15. 次级代谢物的生物合成 Biosynthesis of secondary metabolites;B16. 氨基酸的生物合成 Biosynthesis of amino acids;B17. 精氨酸生物合成 Arginine biosynthesis;B18. 精氨酸和脯氨酸代谢 Arginine and proline metabolism;B19. 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism;B20. 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine, aspartate and glutamate metabolism. C1. 牛磺酸和低牛磺酸代谢 Taurine and hypotaurine metabolism;C2. 淀粉和蔗糖代谢 Starch and sucrose metabolism;C3. 嘧啶代谢 Pyrimidine metabolism;C4. 嘌呤代谢 Purine metabolism;C5. 代谢路径 Metabolic pathways;C6. 赖氨酸生物合成 Lysine biosynthesis;C7. 组氨酸代谢 Histidine metabolism;C8. 甘油脂代谢 Glycerolipid metabolism;C9. 半乳糖代谢 Galactose metabolism;C10. 类黄酮生物合成 Flavonoid biosynthesis;C11. 碳代谢 Carbon metabolism;C12. 光合生物的固碳作用 Carbon fixation in photosynthetic organisms;C13. 咖啡因代谢 Caffeine metabolism;C14. C5-支链二元酸代谢 C5-branched dibasic acid metabolism;C15. 丁酸代谢 Butanoate metabolism;C16. β-丙氨酸代谢 β-alanine metabolism;C17. 精氨酸生物合成 Arginine biosynthesis;C18. 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism;C19. 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine,aspartate and glutamate metabolism;C20. ABC转运蛋白 ABC transportersFigure 4. Top 20 KEGG enrichment map of different metabolites in three groups
图 4 3个对比组中差异代谢物排名前20的KEGG富集图横坐标表示富集因子;纵坐标为通路名称;点的颜色表示P值,越红表示富集越显著;点的大小代表富集到的差异代谢物数量。Abscissa represents the enrichment factor; ordinate represents the path name; color of the point represents the P value; size of the point represents the number of different metabolites enriched. A1. 维他命B6代谢 Vitamin B6 metabolism;A2. 酪氨酸代谢 Tyrosine metabolism;A3. 萜类化合物生物合成 Terpenoid backbone biosynthesis;A4. 丙酮酸代谢 Pyruvate metabolism ;A5. 嘧啶代谢 Pyrimidine metabolism;A6. 嘌呤代谢 Purine metabolism;A7. 单体生物合成 Monobactam biosynthesis;A8. 异黄酮生物合成 Isoflavonoid biosynthesis;A9. 谷胱甘肽代谢 Glutathione metabolism;A10. 果糖和甘露糖代谢 Fructose and mannose metabolism;A11. 叶酸生物合成 Folate biosynthesis;A12. 黄酮和黄酮醇的生物合成 Flavone and flavonol biosynthesis;A13. 脂肪酸生物合成 Fatty acid biosynthesis;A14. D-精氨酸和D-鸟氨酸代谢 D-arginine and D-ornithine metabolism;A15. 光合生物的固碳作用 Carbon fixation in photosynthetic organisms;A16. 氨基酸生物合成 Biosynthesis of amino acids;A17. 精氨酸生物合成 Arginine biosynthesis;A18. 花青素生物合成 Anthocyanin biosynthesis;A19. ABC转运蛋白 ABC transporters;A20. 2-氧代羧酸代谢 2-oxocarboxylic acid metabolism. B1. 牛磺酸和低牛磺酸代谢 Taurine and hypotaurine metabolism;B2. 淀粉和蔗糖代谢 Starch and sucrose metabolism;B3. 戊糖和葡糖醛酸相互转化 Pentose and glucuronate interconversions;B4. 氮代谢 Nitrogen metabolism;B5. 代谢路径 Metabolic pathways;B6. 赖氨酸生物合成 Lysine biosynthesis;B7. 组氨酸代谢 Histidine metabolism;B8. 乙醛酸和二羧酸代谢 Glyoxylate and dicarboxylate metabolism;B9. 甘油脂代谢 Glycerolipid metabolism;B10. 半乳糖代谢 Galactose metabolism;B11. 类黄酮生物合成 Flavonoid biosynthesis;B12. D-精氨酸和D-鸟氨酸代谢 D-arginine and D-ornithine metabolism;B13. C5-支链二元酸代谢 C5-branched dibasic acid metabolism;B14. 丁酸代谢 Butanoate metabolism;B15. 次级代谢物的生物合成 Biosynthesis of secondary metabolites;B16. 氨基酸的生物合成 Biosynthesis of amino acids;B17. 精氨酸生物合成 Arginine biosynthesis;B18. 精氨酸和脯氨酸代谢 Arginine and proline metabolism;B19. 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism;B20. 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine, aspartate and glutamate metabolism. C1. 牛磺酸和低牛磺酸代谢 Taurine and hypotaurine metabolism;C2. 淀粉和蔗糖代谢 Starch and sucrose metabolism;C3. 嘧啶代谢 Pyrimidine metabolism;C4. 嘌呤代谢 Purine metabolism;C5. 代谢路径 Metabolic pathways;C6. 赖氨酸生物合成 Lysine biosynthesis;C7. 组氨酸代谢 Histidine metabolism;C8. 甘油脂代谢 Glycerolipid metabolism;C9. 半乳糖代谢 Galactose metabolism;C10. 类黄酮生物合成 Flavonoid biosynthesis;C11. 碳代谢 Carbon metabolism;C12. 光合生物的固碳作用 Carbon fixation in photosynthetic organisms;C13. 咖啡因代谢 Caffeine metabolism;C14. C5-支链二元酸代谢 C5-branched dibasic acid metabolism;C15. 丁酸代谢 Butanoate metabolism;C16. β-丙氨酸代谢 β-alanine metabolism;C17. 精氨酸生物合成 Arginine biosynthesis;C18. 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism;C19. 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine,aspartate and glutamate metabolism;C20. ABC转运蛋白 ABC transportersFigure 4. Top 20 KEGG enrichment map of different metabolites in three groupsKEGG通路富集分析是了解与生物学过程最相关代谢通路的主要方法,但是,筛选出来的差异代谢物只有部分能够在KEGG数据库中进行通路分析[23]。以P < 0.01为阈值筛选显著富集通路,分析了富集极显著的KEGG路径(表4)。在减水处理和对照处理对比中,花青素生物合成通路具有显著富集,主要包括飞燕草素-3-O-(3'',6''-O-二丙二酰)葡萄糖苷、矢车菊素-3-O-(6''-O-丙二酰)葡萄糖苷、矢车菊素-3-O-葡萄糖苷、天竺葵素-3-O-(6''-O-丙二酰)葡萄糖苷等成分。在增水处理和对照处理中,差异代谢物在精氨酸生物合成与淀粉和蔗糖代谢通路上富集显著,精氨酸生物合成途径主要包括L-谷氨酰胺、α-酮戊二酸、L-瓜氨酸、L-谷氨酸、L-精氨酸、精氨基琥珀酸;淀粉和蔗糖代谢通路上主要包括尿苷5'-二磷酸-D-葡萄糖、葡萄糖-1-磷酸、D-葡萄糖-6-磷酸、D-果糖-6-磷酸。
表 4 3种处理猪毛蒿差异代谢物显著富集通路Table 4. Significant enrichment pathway of different metabolites in A. scoparia under three treatments组别
GroupKEGG通路
KEGG pathway通路号
Ko-IDP 百分比
Percent/%化合物
CompoundCK vs DT 花青素生物合成
Anthocyanin biosynthesisko00942 0.008 12.50 飞燕草素-3-O-(3″,6″-O-二丙二酰)葡萄糖苷Delphinidin-3-O-(3″,6″-O-dimalonyl) glucoside、矢车菊素-3-O-(6″-O-丙二酰)葡萄糖苷Cyanidin-3-O-(6″-O-malonyl) glucoside-5-O-glucoside、矢车菊素-3-O-葡萄糖苷Cyanidin-3-O-glucoside (Kuromanin)、天竺葵素-3-O-(6″-O-丙二酰)葡萄糖苷Pelargonidin-3-O-(6″-O-malonyl)glucoside CK vs IT 精氨酸生物合成
Arginine biosynthesisko00220 0.000 15.79 L-谷氨酰胺L-glutamine、α-酮戊二酸α-ketoglutaric acid、L-瓜氨酸L-citrulline、L-谷氨酸L-glutamic acid、L-精氨酸L-arginine、精氨基琥珀酸Argininosuccinic acid CK vs IT 淀粉和蔗糖代谢
Starch and sucrose metabolismko00500 0.004 10.53 尿苷5′-二磷酸-D-葡萄糖Uridine 5′-diphospho-D-glucose、葡萄糖-1-磷酸Glucose-1-phosphate、D-葡萄糖-6-磷酸D-glucose 6-phosphate、D-果糖-6-磷酸D-fructose 6-phosphate 这些显著富集的代谢通路可能是猪毛蒿应对水分变化而提高适应性的主要原因。通过对代谢物在显著富集通路上的分析,可以进一步掌握猪毛蒿关键代谢物、代谢途径上目标基因的功能和生物合成等,为深入研究其生物学特征奠定基础。
3. 讨 论
植物的生长发育依赖于水分运输和平衡,因此水分是限制干旱半干旱地区植物生长的一个普遍因素,已有较多的研究[2-3, 7, 17]发现改变降水会对植物表型可塑性产生较大影响,但针对植物代谢物水平对降水改变的响应则相对较少。植物激素的合成会受到干旱胁迫的干扰,在长期的适应过程中已经进化出了复杂的代谢调节机制,其对胁迫的代谢响应可能是迅速和多样的,甚至会动员多个或全部代谢途径[24]。代谢组学可以反映植物对复杂生境的响应及其应答机制,有助于理解植物生态学功能与代谢响应间的关系[10-11]。Carmo-Silva[7]研究了3种C4草本植物对干旱胁迫应答的代谢指纹图谱,发现了5-hydroxynorvaline这种特殊的非蛋白质氨基酸与植物的抗旱能力密切相关。Foito[8]研究发现两种不同基因型的黑麦草在干旱胁迫下叶片中的代谢产物发生明显的变化,而丹参在干旱模式下的应激也不完全相同[9],说明土壤水分的变化会影响植物代谢通路及最终的代谢产物。此外,还有学者将代谢物变化及转化数据叠加分析,建立生物个体代谢物组的响应动态模型[25]。本研究结果表明,降水改变除了引起猪毛蒿种群地上生物量、密度、株高和冠幅的变化外,同样改变了猪毛蒿代谢特征,差异代谢物主要有黄酮、酚酸类、有机酸等,其中3,4-二甲氧基苯乙酸、3-羟基-4-异丙基苯甲醇-3-O-葡萄糖苷上调倍数较大,槲皮素-3-O-鼠李糖基(1→2)阿拉伯糖苷下调倍数较大,而这几种代谢物的差异反映了猪毛蒿应对水分变化的生理代谢响应,但后期还需开展进一步验证。
在代谢通路方面,降水改变主要影响了花青素生物合成通路、精氨酸生物合成与淀粉和蔗糖代谢通路。花青素是植物的一种黄酮类物质,具有较强的生物活性,花青素的生物合成途径是植物次生代谢产物研究最广泛的途径之一,在植物中,花青素衍生自黄烷酮,例如柚皮素和圣草酚,它们本身衍生自苯丙烷途径[26]。精氨酸则是植物体内重要的氮素储藏营养物质,是主要的氮储存和运输分子,参与植物的众多生理过程[27],在植物中的积极作用是参与其分解代谢的发生并促进多胺、一氧化氮等的生物合成。在温度胁迫下,精氨酸分解代谢关键酶,如精氨酸酶、精氨酸脱羧酶和一氧化氮合酶得到活化,进而提高了果实中多胺和一氧化氮水平[28]。对于高等植物而言,蔗糖是光合产物的主要运输和贮存形式,也是高等植物可溶性糖的主要“源”和“库”,为植物生长、繁殖提供能量[29],因此蔗糖代谢水平的高低直接关系到植物种子产量[30],这可能是猪毛蒿在应对干旱环境中仍然可以快速繁殖后代、保证种群存活的机制之一。当然,本研究虽然发现了猪毛蒿在不同降水处理下差异明显的KEGG代谢通路,但每条通路应答环境胁迫及其主动调控机制尚需深入探究。
4. 结 论
在荒漠草原带,猪毛蒿通过增强地上生物量、密度、株高和冠幅等表型可塑性来适应降水的变化,降水偏枯(205.8 mm)年份的表型可塑性变异比较丰水年(385.6 mm)更明显。
荒漠草原带降水变化可显著改变猪毛蒿茎叶代谢物,如黄酮、酚酸类、有机酸含量,而且对花青素生物合成、精氨酸生物合成、淀粉和蔗糖代谢都有显著影响,这可能是干旱环境下猪毛蒿生理可塑性的表现。
-
图 2 CK与DT组、CK与IT组、DT与IT组差异代谢物韦恩图
每个圈代表两两处理的比较组,圈重叠部分的数字是比较组共同差异代谢物个数,没有重叠部分的数字是比较组特有差异代谢物个数。Each circle represents the comparison group treated in pairs. The number of overlapping circles is the number of common differential metabolites in the comparison group, and the number without overlapping parts is the number of unique differential metabolites in the comparison group.
Figure 2. Venn diagram illustrate numbers of common and uniquely significantly changing variables in different treatments of CK group vs DT group, CK group vs IT group, DT group vs IT group
图 3 各组代谢物差异倍数图
FC为差异代谢物的差异倍数。FC is difference multiple of differential metabolites. HJAP011. 金圣草黄素-8-C-葡萄糖苷 (金雀花素) Chrysoeriol-8-C-glucoside (Scoparin);Hmbp002498.东莨菪内酯-7-O-木糖基(1→6)葡糖苷 Scopoletin-7-O-xylosyl(1→6)glucoside;Hmcp001769.槲皮素-3-O-鼠李糖基(1→2)阿拉伯糖苷 Quercetin-3-O-rhamnosyl(1→2)arabinoside;Lmgp004474.5,7,4′-三羟基异黄酮-7-O-半乳糖苷-鼠李糖 5,7,4′-trihydroxyisoflavone-7-O-galactoside-rhamnose;Lmhn002683.对香豆酰咖啡酰酒石酸 p-coumaroylcaffeoyltartaric acid;Lmhp008763.溶血磷脂酰乙醇胺 16∶1(2n异构)* LysoPE 16∶1(2n isomer)*;Lmjn004991.二氢青蒿素 D3 Dihydro artemisinin-D3;Lmjp002718.青蒿素A Artemisinin A;Lmjp002764. 5,6-二甲氧基-7-羟基香豆素 5,6- dimethoxy -7- hydroxycoumarin;Lmyp004318.山奈酚-3-O-(6″-对香豆酰)半乳糖苷 Kaempferol-3-O-(6''-p-coumaroyl)galactoside;mws0129. 5,4′-二羟基-7-甲氧基黄酮5,4′- dihydroxy -7- methoxyflavone;mws0219. L-天冬氨酸 L-aspartic acid;mws0260. L-精氨酸 L-Arginine;mws0346. 3-(3-羟基苯基)丙酸 3-(3-hydroxyphenyl)-propionate acid;mws0572. 5-甲基胞嘧啶 5-methylcytosine;mws0612. 3,4-二甲氧基苯乙酸 3,4-dimethoxyphenyl acetic acid;mws1505. 咖啡酸苯乙酯 Phenethyl caffeate;mws1661. 香叶木苷 Vanillin;mws4177. 邻氨基苯甲酸甲酯 Methyl anthranilate;pma1840. 对香豆酰胆碱 P-coumaric choline;pmb0069. 苯甲酰胺 Benzamide;pmb0554. 天竺葵素-3-O-(6″'-O-丙二酰)葡萄糖苷 Pelargonidin-3-O-(6″'-O-malonyl)glucoside;pmb0566.木犀草素-7-O-葡萄糖苷-5-O-阿拉伯糖苷 Luteolin-7-O-glucoside-5-O-arabinoside;pmb0608.金圣草黄素-7-O-(6″'-丙二酰)葡萄糖苷 Chrysoeriol-7-O-(6″'-malonyl)glucoside;pmb2165.溶血磷脂酰胆碱 Lysophospholipidylcholine;pmb2922.尿苷 5′-二磷酸-D-葡萄糖 Uridine 5′-diphospho-D-glucose;pme0014. L-谷氨酸 L-glutamic acid;pme0368. 阿皮根素-7-O-芦丁(异罗非林) Apigenin-7-O-rutinoside (Isorhoifolin);pme1194. 2′-脱氧胞苷 2′-deoxycytidine;pme3207.己二烯二酸 Muconic acid;pme3381. 3-羟基苯基乙酸甲酯 3-hydroxyphenylacetic acid methyl ester;pme3388. 高精氨酸 Homoarginine;pme3443. 芥子醛 Sinapinaldehyde;pmn001521. 3-羟基-5-甲基苯酚-1-氧-(6′-没食子酰)葡萄糖苷 3-hydroxy-5-methylphenol-1-O-(6′-galloyl)glucoside;pmn001690. 3-羟基-4-异丙基苯甲醇-3-O-葡萄糖苷 3-hydroxy-4-isopropylbenzylalcohol-3-O-glucoside;pmp000575. 金合欢素-7-O-葡萄糖苷 (煅树素) Acacetin-7-O-glucoside (Tilianin);pmp000581. 芹菜素-7-O-(6″-乙酰)葡萄糖苷 Apigenin-7-O-(6″-acetyl)glucoside;pmp000585. 芹菜素-7-O-(6″-丙二酰)葡萄糖苷 Apigenin-7-O-(6″-malonyl)glucoside;Zmap010051. 布卢米恩C Blumeaene C;Zmhn002227. 4-O-葡萄糖基芥子酸 4-O-glucosyl-sinapate;Zmhn002508. 4-对香豆酰鼠李糖基-(1→6)-D-葡萄糖 4-p-cumaroyl-rhamnosyl-(1→6)-D-glucose;Zmjp000182. N-单甲基-L-精氨酸 N-monomethyl-L-arginine;Zmlp003063.木犀草素-7-O-(2″-O-鼠李糖基)芸香糖苷 Luteolin-7-O-(2″-O-rhamnosyl)rutinoside;Zmzn000113. L-苏式-3-甲基天冬氨酸 L-threo-3-methylaspartate
Figure 3. Multiple diagram of metabolite difference in each group
图 4 3个对比组中差异代谢物排名前20的KEGG富集图
横坐标表示富集因子;纵坐标为通路名称;点的颜色表示P值,越红表示富集越显著;点的大小代表富集到的差异代谢物数量。Abscissa represents the enrichment factor; ordinate represents the path name; color of the point represents the P value; size of the point represents the number of different metabolites enriched. A1. 维他命B6代谢 Vitamin B6 metabolism;A2. 酪氨酸代谢 Tyrosine metabolism;A3. 萜类化合物生物合成 Terpenoid backbone biosynthesis;A4. 丙酮酸代谢 Pyruvate metabolism ;A5. 嘧啶代谢 Pyrimidine metabolism;A6. 嘌呤代谢 Purine metabolism;A7. 单体生物合成 Monobactam biosynthesis;A8. 异黄酮生物合成 Isoflavonoid biosynthesis;A9. 谷胱甘肽代谢 Glutathione metabolism;A10. 果糖和甘露糖代谢 Fructose and mannose metabolism;A11. 叶酸生物合成 Folate biosynthesis;A12. 黄酮和黄酮醇的生物合成 Flavone and flavonol biosynthesis;A13. 脂肪酸生物合成 Fatty acid biosynthesis;A14. D-精氨酸和D-鸟氨酸代谢 D-arginine and D-ornithine metabolism;A15. 光合生物的固碳作用 Carbon fixation in photosynthetic organisms;A16. 氨基酸生物合成 Biosynthesis of amino acids;A17. 精氨酸生物合成 Arginine biosynthesis;A18. 花青素生物合成 Anthocyanin biosynthesis;A19. ABC转运蛋白 ABC transporters;A20. 2-氧代羧酸代谢 2-oxocarboxylic acid metabolism. B1. 牛磺酸和低牛磺酸代谢 Taurine and hypotaurine metabolism;B2. 淀粉和蔗糖代谢 Starch and sucrose metabolism;B3. 戊糖和葡糖醛酸相互转化 Pentose and glucuronate interconversions;B4. 氮代谢 Nitrogen metabolism;B5. 代谢路径 Metabolic pathways;B6. 赖氨酸生物合成 Lysine biosynthesis;B7. 组氨酸代谢 Histidine metabolism;B8. 乙醛酸和二羧酸代谢 Glyoxylate and dicarboxylate metabolism;B9. 甘油脂代谢 Glycerolipid metabolism;B10. 半乳糖代谢 Galactose metabolism;B11. 类黄酮生物合成 Flavonoid biosynthesis;B12. D-精氨酸和D-鸟氨酸代谢 D-arginine and D-ornithine metabolism;B13. C5-支链二元酸代谢 C5-branched dibasic acid metabolism;B14. 丁酸代谢 Butanoate metabolism;B15. 次级代谢物的生物合成 Biosynthesis of secondary metabolites;B16. 氨基酸的生物合成 Biosynthesis of amino acids;B17. 精氨酸生物合成 Arginine biosynthesis;B18. 精氨酸和脯氨酸代谢 Arginine and proline metabolism;B19. 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism;B20. 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine, aspartate and glutamate metabolism. C1. 牛磺酸和低牛磺酸代谢 Taurine and hypotaurine metabolism;C2. 淀粉和蔗糖代谢 Starch and sucrose metabolism;C3. 嘧啶代谢 Pyrimidine metabolism;C4. 嘌呤代谢 Purine metabolism;C5. 代谢路径 Metabolic pathways;C6. 赖氨酸生物合成 Lysine biosynthesis;C7. 组氨酸代谢 Histidine metabolism;C8. 甘油脂代谢 Glycerolipid metabolism;C9. 半乳糖代谢 Galactose metabolism;C10. 类黄酮生物合成 Flavonoid biosynthesis;C11. 碳代谢 Carbon metabolism;C12. 光合生物的固碳作用 Carbon fixation in photosynthetic organisms;C13. 咖啡因代谢 Caffeine metabolism;C14. C5-支链二元酸代谢 C5-branched dibasic acid metabolism;C15. 丁酸代谢 Butanoate metabolism;C16. β-丙氨酸代谢 β-alanine metabolism;C17. 精氨酸生物合成 Arginine biosynthesis;C18. 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism;C19. 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine,aspartate and glutamate metabolism;C20. ABC转运蛋白 ABC transporters
Figure 4. Top 20 KEGG enrichment map of different metabolites in three groups
表 1 2017—2020年各月降水情况
Table 1 Monthly precipitation condition from 2017 to 2020
月份 Month 2017 2018 2019 2020 月平均降水量
Monthly average
precipitation/mm降水量
Precipitation/
mm降水天数
Precipitation
day number降水量
Precipitation/
mm降水天数
Precipitation
day number降水量
Precipitation/
mm降水天数
Precipitation
day number降水量
Precipitation/
mm降水天数
Precipitation
day number1月 January 0.0 0 3.9 4 2.2 1 7.3 9 3.4 2月 February 21.6 4 0.0 0 2.5 3 0.3 1 6.1 3月 March 11.0 4 2.5 1 2.7 2 0.0 0 4.1 4月 April 25.6 5 18.4 3 20.1 6 1.8 1 16.5 5月 May 17.6 4 68.5 5 14.7 5 11.9 4 28.2 6月 June 55.6 9 63.4 7 57.3 9 10.8 6 46.8 7月 July 78.0 10 63.3 10 55.5 8 15.7 7 53.1 8月 August 122.5 11 112.5 13 85.0 10 98.9 12 104.7 9月 September 18.6 7 29.1 7 40.1 7 37.3 9 31.3 10月 October 41.7 10 19.5 4 37.1 8 0.2 2 24.6 11月 November 0.0 0 3.8 2 5.9 3 17.4 5 6.8 12月 December 1.1 1 0.7 3 0.1 1 4.2 7 1.5 合计 Total 393.3 65 385.6 59 323.2 63 205.8 63 327.0 表 2 不同处理猪毛蒿差异代谢物的数量
Table 2 Number of differentially metabolites in A. scoparia under different treatments
比较组
Comparison
group差异代谢物
数量
Number of differential metabolites
下调差异
代谢物数量
Down-regulate
the number of
differential
metabolites上调差异
代谢物数量
Up-regulate
the number of
differential
metabolitesCK vs DT 142 100 42 CK vs IT 105 42 63 DT vs IT 163 39 124 表 3 3种处理猪毛蒿具有显著差异的代谢物
Table 3 Metabolites with significant differences in A. scoparia among three treatments
序号
No.物质
Compounds物质一级分类
Primary classification of
substances (class Ⅰ)物质二级分类
Secondary classification of
substances (class Ⅱ)变量重要性投影
Variable importance projectionP 1 β-羟基异戊酸 β-hydroxyisovaleric acid 有机酸 Organic acid(OA) OA 2.079 0.019 2 精氨基琥珀酸 Argininosuccinic acid OA OA 1.928 0.018 3 α-酮戊二酸 α-ketoglutaric acid OA OA 1.815 0.015 4 2-吡啶甲酸 2-picolinic acid OA OA 1.758 0.003 5 异烟酸 Isonicotinic acid OA OA 1.552 0.015 6 γ-氨基丁酸 γ-aminobutyric acid OA OA 1.439 0.030 7 3-(3-羟基苯基)丙酸
3-(3-hydroxyphenyl)-propionate acidOA OA 1.263 0.039 8 顺-10-十七碳烯酸
cis-10-heptadecenoic acid脂质 Lipid 游离脂肪酸
Free fatty acid(FFA)2.262 0.042 9 二十碳二烯酸 Eicosadienoic acid 脂质 Lipid FFA 1.849 0.016 10 肉豆蔻酸 Myristic acid 脂质 Lipid FFA 1.270 0.022 11 秦皮乙素 Esculetin 木脂素和香豆素 Lignas and Coumarin 香豆素 Coumarin 2.274 0.020 12 茵芋苷 7-hydroxycoumarin-7-O-glucoside
(Skimmin)木脂素和香豆素
Lignan and Coumarin香豆素 Coumarin 1.700 0.001 13 D-苏糖酸 D-threonic acid 其他类 Others 糖及醇类
Saccharides and
alcohols (SA)2.098 0.022 14 D-阿拉伯糖醇 D-arabitol 其他类 Others SA 1.800 0.007 15 D-潘糖 D-panose 其他类 Others SA 1.546 0.005 16 1-甲基组胺 1-methylhistamine 其他类 Others 其他 Others 1.214 0.042 17 3-吲哚丙酸 3-indolepropionic acid 生物碱 Alkaloid 吲哚类生物碱 Plumerane 1.004 0.033 18 胆碱 Choline 生物碱 Alkaloid 生物碱 Alkaloid 2.163 0.023 19 N-苯亚甲基异甲胺
N-benzylmethylene isomethylamine生物碱 Alkaloid 生物碱 Alkaloid 1.984 0.039 20 甜菜碱 Betaine 生物碱 Alkaloid 生物碱 Alkaloid 1.858 0.021 21 二对香豆酰精胺
N1,N5-bis (p-coumaroyl) spermine生物碱 Alkaloid 酚胺 Phenolamine 1.872 0.035 22 N-对香豆酰精胺 N-p-coumaroylspermine 生物碱 Alkaloid 酚胺 Phenolamine 1.838 0.020 23 槲皮素-7-O-葡萄糖苷 Quercetin-7-O-glucoside 黄酮 Flavonoid 黄酮醇 Flavonol 2.241 0.010 24 槲皮素-3-O-葡萄糖苷(异槲皮苷)
Quercetin-3-O-glucoside (Isoquercitrin)黄酮 Flavonoid 黄酮醇 Flavonol 2.234 0.019 25 槲皮素-3-O-半乳糖苷 (金丝桃苷)
Quercetin-3-O-galactoside (Hyperin)黄酮 Flavonoid 黄酮醇 Flavonol 2.144 0.006 26 6-甲基山奈酚-3-O-葡萄糖苷
6-methyl kaempferol-3-O-glucoside黄酮 Flavonoid 黄酮 Flavonoid 1.436 0.009 27 香叶木素-7-O-半乳糖苷
Diosmetin-7-O-galactoside黄酮 Flavonoid 黄酮 Flavonoid 1.284 0.025 28 5-脱氧-5-甲硫腺苷
5′-deoxy-5′-(methylthio) adenosine核苷酸及其衍生物
Nucleotide and derivative (ND)ND 1.995 0.005 29 1-甲基腺嘌呤 1-methyladenine ND ND 1.963 0.047 30 2-(二甲基氨基)鸟苷
2-(Dimethylamino) guanosineND ND 1.933 0.013 31 鸟苷 Guanosine ND ND 1.838 0.028 32 2′-脱氧尿苷 2′-deoxyuridine ND ND 1.617 0.047 33 黄嘌呤 Xanthine ND ND 1.587 0.037 34 1′-O-(3,4-二羟基苯乙基)-O-咖啡酰基-葡萄糖苷
1′-O-(3,4-dihydroxyphenethyl)-O-caffeoyl-glucoside酚酸类
Phenolic acid (PA)PA 1.994 0.029 35 4-O-(6′-O-葡萄糖基咖啡酰)-3,4-二羟基苯甲酸
4-O-(6′-O-glucosylcaffeoyl)-3,4-dihydroxybenzoic acidPA PA 1.610 0.014 36 5-O-咖啡酰莽草酸 5-O-caffeoylshikimic acid PA PA 1.064 0.010 37 2-氨基异丁酸 2-aminoisobutyric acid 氨基酸及其衍生物 Amino acids and derivatives (ACD) ACD 2.137 0.025 38 L-脯氨酰-L-亮氨酸 L-prolyl-L-leucine ACD ACD 2.006 0.020 39 L-苯丙氨酸 L-phenylalanine ACD ACD 1.963 0.049 40 L-谷氨酸 L-glutamic acid ACD ACD 1.718 0.019 41 N,N-二甲基甘氨酸 N,N-dimethylglycine ACD ACD 1.644 0.016 42 L-苏式-3-甲基天冬氨酸
L-threo-3-methylaspartateACD ACD 1.521 0.000 43 5-羟基-L-色氨酸 5-hydroxy-L-tryptophan ACD ACD 1.158 0.014 表 4 3种处理猪毛蒿差异代谢物显著富集通路
Table 4 Significant enrichment pathway of different metabolites in A. scoparia under three treatments
组别
GroupKEGG通路
KEGG pathway通路号
Ko-IDP 百分比
Percent/%化合物
CompoundCK vs DT 花青素生物合成
Anthocyanin biosynthesisko00942 0.008 12.50 飞燕草素-3-O-(3″,6″-O-二丙二酰)葡萄糖苷Delphinidin-3-O-(3″,6″-O-dimalonyl) glucoside、矢车菊素-3-O-(6″-O-丙二酰)葡萄糖苷Cyanidin-3-O-(6″-O-malonyl) glucoside-5-O-glucoside、矢车菊素-3-O-葡萄糖苷Cyanidin-3-O-glucoside (Kuromanin)、天竺葵素-3-O-(6″-O-丙二酰)葡萄糖苷Pelargonidin-3-O-(6″-O-malonyl)glucoside CK vs IT 精氨酸生物合成
Arginine biosynthesisko00220 0.000 15.79 L-谷氨酰胺L-glutamine、α-酮戊二酸α-ketoglutaric acid、L-瓜氨酸L-citrulline、L-谷氨酸L-glutamic acid、L-精氨酸L-arginine、精氨基琥珀酸Argininosuccinic acid CK vs IT 淀粉和蔗糖代谢
Starch and sucrose metabolismko00500 0.004 10.53 尿苷5′-二磷酸-D-葡萄糖Uridine 5′-diphospho-D-glucose、葡萄糖-1-磷酸Glucose-1-phosphate、D-葡萄糖-6-磷酸D-glucose 6-phosphate、D-果糖-6-磷酸D-fructose 6-phosphate -
[1] Gherardi L A, Sala O E. Enhanced precipitation variability decreases grass- and increases shrub-productivity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(41): 12735−12740.
[2] Selene B, Collins S L, Pockman W T, et al. Effects of experimental rainfall manipulations on Chihuahuan Desert Grassland and shrubland plant communities[J]. Oecologia, 2013, 172(4): 1117−1127.
[3] 孙岩, 何明珠, 王立. 降水控制对荒漠植物群落物种多样性和生物量的影响[J]. 生态学报, 2018, 38(7): 2425−2433. Sun Y, He M Z, Wang L. Effects of precipitation control on plant diversity and biomass in a desert region[J]. Acta Ecologica Sinica, 2018, 38(7): 2425−2433.
[4] 赵丹, 刘鹏飞, 潘超, 等. 生态代谢组学研究进展[J]. 生态学报, 2015, 35(15): 4958−4967. Zhao D, Liu P F, Pan C, et al. Advances in ecometabolomics[J]. Acta Ecologica Sinica, 2015, 35(15): 4958−4967.
[5] Nicholson J K, Lindon J C, Holmes E, et al. ‘Metabonomics’: understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181−1189.
[6] 滕中秋, 付卉青, 贾少华, 等. 植物应答非生物胁迫的代谢组学研究进展[J]. 植物生态学报, 2011, 35(1): 110−118. Teng Z Q, Fu H Q, Jia S H, et al. Review of current progress in the metabolomics for plant response to abiotic stress[J]. Chinese Journal of Plant Ecology, 2011, 35(1): 110−118.
[7] Carmo-Silva A E, Beale M H, Baker J M, et al. Drought stress increases the production of 5-hydroxynorvaline in two C4 grasses[J]. Phytochemistry, 2009, 70(5): 664−671.
[8] Foito A, Byrne S L, Shepherd T, et al. Transcriptional and metabolic profiles of lolium perenne(l): genotypes in response to a peg-induced water stress[J]. Plant Biotechnology Journal, 2010, 7(8): 719−732.
[9] Dai H, Xiao C N, Liu H B, et al. Combined NMR and LC-MS analysis reveals the metabonomic changes in Salvia miltiorrhiza Bunge induced by water depletion[J]. Journal of Proteome Research, 2010, 9(3): 1460−1475.
[10] Gehlenborg N, O’donoghue S I, Baliga N S, et al. Visualization of omics data for systems biology[J]. Nature Methods, 2010, 7(3): 56−68.
[11] Dam N M, Bouwmeester H J. Metabolomics in the rhizosphere: tapping into belowground chemical communication[J]. Trends in Plant Science, 2016, 21(3): 256−265.
[12] 刘鹏飞, 胡志宏, 代探, 等. 代谢组学: 植物病理学研究有力的生物分析工具[J]. 植物病理学报, 2018, 48(4): 433−444. Liu P F, Hu Z H, Dai T, et al. Metabolomics-a robust bioanalytical approach for phytopathology[J]. Acta Phytopathologica Sinica, 2018, 48(4): 433−444.
[13] 焦菊英, 张振国, 贾燕锋, 等. 陕北丘陵沟壑区撂荒地自然恢复植被的组成结构与数量分类[J]. 生态学报, 2008, 28(7): 2981−2997. Jiao J Y, Zhang Z G, Jia Y F, et al. Species composition and classification of natural vegetation in the abandoned lands of the hilly-gullied region of North Shaanxi Province[J]. Acta Ecologica Sinica, 2008, 28(7): 2981−2997.
[14] 杜峰, 山仑, 梁宗锁, 等. 陕北黄土丘陵区撂荒演替生态位研究[J]. 草业学报, 2006, 15(3): 27−35. doi: 10.3321/j.issn:1004-5759.2006.03.004 Du F, Shan L, Liang Z S, et al. Studies on the succession niche of abandoned arable land in a hilly Loess region of northern Shaanxi Province[J]. Acta Prataculturae Sinica, 2006, 15(3): 27−35. doi: 10.3321/j.issn:1004-5759.2006.03.004
[15] 苏嫄, 焦菊英, 王志杰. 陕北黄土丘陵沟壑区坡沟立地环境下幼苗的存活特征[J]. 植物生态学报, 2014, 38(7): 694−709. Su Y, Jiao J Y, Wang Z J. Characteristics of seedling survival in habitats of hill and gully slopes in hill-gully Loess Plateau region of northern Shaanxi[J]. Chinese Journal of Plant Ecology, 2014, 38(7): 694−709.
[16] 周娟. 基于GF-1/WFV时间序列的荒漠草原猪毛蒿群落提取及时空特征研究[D]. 银川: 宁夏大学, 2017. Zhou J. Research on spatio-temporal characteristics and information extraction of Artemisia scoparia in desert steppe based on GF-1/WFV time series [D]. Yinchuan: Ningxia University, 2017.
[17] 陈林. 荒漠草原猪毛蒿的生态适应对策[D]. 银川: 宁夏大学, 2019. Chen L. Ecological adaptive strategies of Artemisia scoparia in desert steppe [D]. Yinchuan: Ningxia University, 2019.
[18] 陈林, 杨新国, 翟德苹, 等. 柠条秸秆和地膜覆盖对土壤水分和玉米产量的影响[J]. 农业工程学报, 2015, 31(2): 108−116. doi: 10.3969/j.issn.1002-6819.2015.02.016 Chen L, Yang X G, Zhai D P, et al. Effects of mulching with Caragana korshinskii powder and plastic film on soil water and maize yield[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(2): 108−116. doi: 10.3969/j.issn.1002-6819.2015.02.016
[19] 宋乃平, 王兴, 陈林, 等. 荒漠草原“土岛”生境群落物种共存机制[J]. 生物多样性, 2018, 26(7): 667−677. Song N P, Wang X, Chen L, et al. Co-existence mechanisms of plant species within “soil islands” habitat of desert steppe[J]. Biodiversity Science, 2018, 26(7): 667−677.
[20] 陈林, 宋乃平, 杨新国, 等. 具有野外增减雨和活动围栏作用的组合试验装置: ZL201621029398.2[P]. 2017−12−19. Chen L, Song N P, Yang X G, et al. Combined test device with functions of increasing or decreasing rain in the field and movable fence: ZL201621029398.2[P]. 2017−12−19.
[21] 黄菊莹, 余海龙, 刘吉利, 等. 控雨对荒漠草原植物、微生物和土壤C、N、P化学计量特征的影响[J]. 生态学报, 2018, 38(15): 5362−5373. Huang J Y, Yu H L, Liu J L, et al. Effects of precipitation levels on the C:N:P stoichiometry in plants, microbes, and soils in a desert steppe in China[J]. Acta Ecologica Sinica, 2018, 38(15): 5362−5373.
[22] Valladares F, Wright S J, Lasso E, et al. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest[J]. Ecology, 2000, 81(7): 1925−1936.
[23] 徐洪雨, 李向林. 控水处理对紫花苜蓿抗寒性影响的代谢组学分析[J]. 草业学报, 2020, 29(174): 109−119. Xu H Y, Li X L. A metabolomics analysis of the effect of water deficit on the freezing tolerance of alfalfa (Medicago sativa)[J]. Acta Prataculturae Sinica, 2020, 29(174): 109−119.
[24] 郭瑞, 周际, 杨帆, 等. 拔节孕穗期小麦干旱胁迫下生长代谢变化规律[J]. 植物生态学报, 2016, 40(12): 1319−1327. doi: 10.17521/cjpe.2016.0107 Guo R, Zhou J, Yang F, et al. Growth metabolism of wheat under drought stress at the jointing-booting stage[J]. Chinese Journal of Plant Ecology, 2016, 40(12): 1319−1327. doi: 10.17521/cjpe.2016.0107
[25] Josep P, Jordi S. Ecology: elementary factors[J]. Nature, 2009, 460: 803−804.
[26] 许倩, 张晨, 吴嘉维, 等. 花青素的生物合成研究进展[J]. 林产化学与工业, 2020, 40(3): 1−11. doi: 10.3969/j.issn.0253-2417.2020.03.001 Xu Q, Zhang C, Wu J W, et al. Research progress in biosynthesis of anthocyanins[J]. Chemistry and Industry of Forest Products, 2020, 40(3): 1−11. doi: 10.3969/j.issn.0253-2417.2020.03.001
[27] 杨洪强, 高华君. 植物精氨酸及其代谢产物的生理功能[J]. 植物生理与分子生物学学报, 2007, 33(1): 1−8. Yang H Q, Gao H J. Physiological function of arginine and its metabolites in plants[J]. Journal of Plant Physiology and Molecular Biology, 2007, 33(1): 1−8.
[28] 苏金龙, 王小璐, 李素方, 等. 水杨酸延缓猕猴桃果实采后衰老与精氨酸分解代谢的关系[J]. 西北植物学报, 2020, 40(10): 94−101. Su J L, Wang X L, Li S F, et al. Relationship between salicylic acid delaying postharvest senescence and arginine catabolism in kiwifruit[J]. Acta Botanica Boreali-Occidentalia Sinica, 2020, 40(10): 94−101.
[29] 潘庆民, 韩兴国, 白永飞, 等. 植物非结构性贮藏碳水化合物的生理生态学研究进展[J]. 植物学通报, 2002, 19(1): 30−38. Pan Q M, Han X G, Bai Y F, et al. Advances in physiology and ecology studies on stored non-structure carbohydrates in plants[J]. Chinese Bulletin of Botany, 2002, 19(1): 30−38.
[30] 崔光军, 刘风珍, 万勇善. 花生荚果干物质积累与蔗糖代谢的相关性研究[J]. 中国农业科学, 2010, 43(19): 3965−3973. doi: 10.3864/j.issn.0578-1752.2010.19.008 Cui G J, Liu F Z, Wan Y S. Relationship between dry matter accumulation and sucrose metabolism during pod development in peanut (Arachis hypogaea L.)[J]. Scientia Agricultura Sinica, 2010, 43(19): 3965−3973. doi: 10.3864/j.issn.0578-1752.2010.19.008
-
期刊类型引用(14)
1. 王洪胜,吴思平,杨贤洪,朱熙隆,洪瑞成,许师瑛,马诚,王秋华. 栎类林燃烧性研究进展. 山东林业科技. 2025(01): 84-91 .  百度学术
百度学术
2. 魏云敏,孙家宝,李丹丹. 黑龙江省草原草本燃烧性分析. 林业科技. 2023(02): 57-62 .  百度学术
百度学术
3. 王博,杨雪清,蒋春颖,刘冬,陈锋,白夜,刘晓东. 基于GIS的北京市延庆区森林火灾蔓延风险. 林业科学. 2023(08): 90-101 .  百度学术
百度学术
4. 高敏,任云卯,周晓东,陈思帆,高钰,王会娟,顾泽,刘晓东. 抚育间伐对西山林场侧柏林冠层可燃物特征及潜在火行为的影响. 北京林业大学学报. 2022(08): 56-65 .  本站查看
本站查看
5. 王立轩,杨光,高佳琪,郑鑫,李兆国,瓮岳太,邸雪颖,于宏洲. 兴安落叶松林火烧迹地地表枯落物燃烧性变化. 林业科学. 2022(06): 110-121 .  百度学术
百度学术
6. 孟维英,尹汉臣,王学勇,宋红霞,刘峰. 太行山低丘陵区薪柴类能源林树种选择. 河北林业科技. 2022(03): 1-6 .  百度学术
百度学术
7. 张状,宗树琴,闫星蓉,张浩,黄宏超,翟跃琴,符利勇. 林分和地形因子对崇礼冬奥核心区森林地表可燃物载量的影响. 林业科学. 2022(10): 59-66 .  百度学术
百度学术
8. 苗杰,路兆军,王淑惠,李保进,张专文,张声凯,王益星,张靖川,孙太元. 烟台市赤松-黑松林林分结构因子对地表可燃物载量的影响. 安徽农业科学. 2021(09): 109-112 .  百度学术
百度学术
9. 吕沣桐,周雪,丁佳欣,单延龙,尹赛男,刘泓禹,高博,韩喜越. 兴安落叶松人工林潜在地表火行为特征的影响因素. 东北林业大学学报. 2021(07): 83-90 .  百度学术
百度学术
10. 王秋华,闫想想,龙腾腾,许若水,叶彪,陈启良,李晓娜. 昆明地区华山松纯林枯枝的燃烧性研究. 江西农业大学学报. 2020(01): 66-73 .  百度学术
百度学术
11. 龙腾腾,向临川,闫想想,高磊,王秋华,叶彪,陈启良. 华山松林地表可燃物着火及蔓延特征研究. 消防科学与技术. 2020(05): 590-592 .  百度学术
百度学术
12. 闫想想,王秋华,李晓娜,龙腾腾,叶彪,陈启良,张文文. 昆明周边主要林型地表可燃物的燃烧特性研究. 西南林业大学学报(自然科学). 2020(05): 135-142 .  百度学术
百度学术
13. 詹航,牛树奎,王博. 北京地区8种树种枯死可燃物含水率预测模型及变化规律. 北京林业大学学报. 2020(06): 80-90 .  本站查看
本站查看
14. 高仲亮,魏建珩,龙腾腾,王秋华,周汝良,舒立福. 安宁市计划烧除点烧区域遴选研究. 消防科学与技术. 2020(09): 1285-1290 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载: