Soil organic carbon stabilization and formation: mechanism and model
-
摘要: 土壤有机碳对自然气候解决方案的贡献可以达到25%,提高土壤碳储量是实现“碳中和”的重要途径。合理的土壤有机碳管理和精准的模型预测依赖于对土壤碳循环过程的清晰认识。然而,土壤有机碳的长期保存机制、来源和环境调控作用还不清楚。本文系统评述了土壤有机碳稳定(生化难分解性、矿物保护和团聚体保护)和形成(腐质化、微生物效率−基质稳定框架和微生物碳泵理论)的前沿理论和机制,在此基础上分析了目前土壤碳循环模型的发展(Century模型、微生物模型和微生物−矿物模型),并提出了未来试验和模型研究中亟需解决的关键科学问题。Abstract: Soil organic carbon (SOC) represents 25% of the potential of natural climate solutions, improvement of SOC storage is a critical pathway to realize “carbon neutralization”. Reasonable SOC management and accurate model prediction require deep understanding of soil carbon cycling processes. However, the persistence mechanism of SOC, pathways controlling SOC formation, and their environmental regulations are not clear. Here, we first synthesized the frontier theories and mechanisms of SOC stabilization (biochemical recalcitrance, mineral protection, and aggregation protection) and formation (humification, microbial efficiency-matrix stabilization framework, and microbial carbon pump theory); we then reviewed the development of soil carbon cycling models (Century model, microbial model, and microbial-mineral model); we finally proposed the urgent scientific question for future experimental and modelling studies.
-
森林碳汇是指森林植物通过光合作用吸收并固定CO2以减少大气CO2浓度,是森林生态系统服务功能的重要体现。2020年9月,习近平主席在第七十五届联合国大会上宣布“中国二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”(简称“双碳”目标),将其纳入我国生态文明建设整体布局。2021年9月,在《中共中央国务院关于完整准确全面贯彻新发展理念做好碳达峰碳中和工作的意见》中对增加森林蓄积量提出了明确要求,指出森林在我国生态增汇体系里具有举足轻重的作用。有效提升森林碳汇功能是落实“双碳”目标重要生态途径之一,亦是林业产业绿色发展的时代使命。
全球陆地生态系统森林面积为40.6亿hm2,占全球陆域面积的1/3,是陆地生态系统最大的碳库,森林碳库对全球变化的负面响应会引起大气CO2浓度显著变化,加速全球气候变暖进程[1]。在全球陆地生态系统中,森林与草地、湿地和农田等生态系统类型相比具有更强的碳汇功能和增汇潜力。通过有效提升全球森林生态系统固碳能力能够抵消来自于化石燃料燃烧释放的CO2,减缓全球变暖进程,因此被认为是实现“双碳”目标最为经济、安全、有效的途径之一[2-3]。基于森林碳汇功能的重要性,本文从森林碳汇评估方法、全球森林碳汇格局及其驱动因素、森林增汇途径及其未来发展趋势简要阐述,浅析森林碳汇功能对我国落实“双碳”目标的贡献,以及存在的相关理论与应用瓶颈。
1. 森林碳汇评估方法
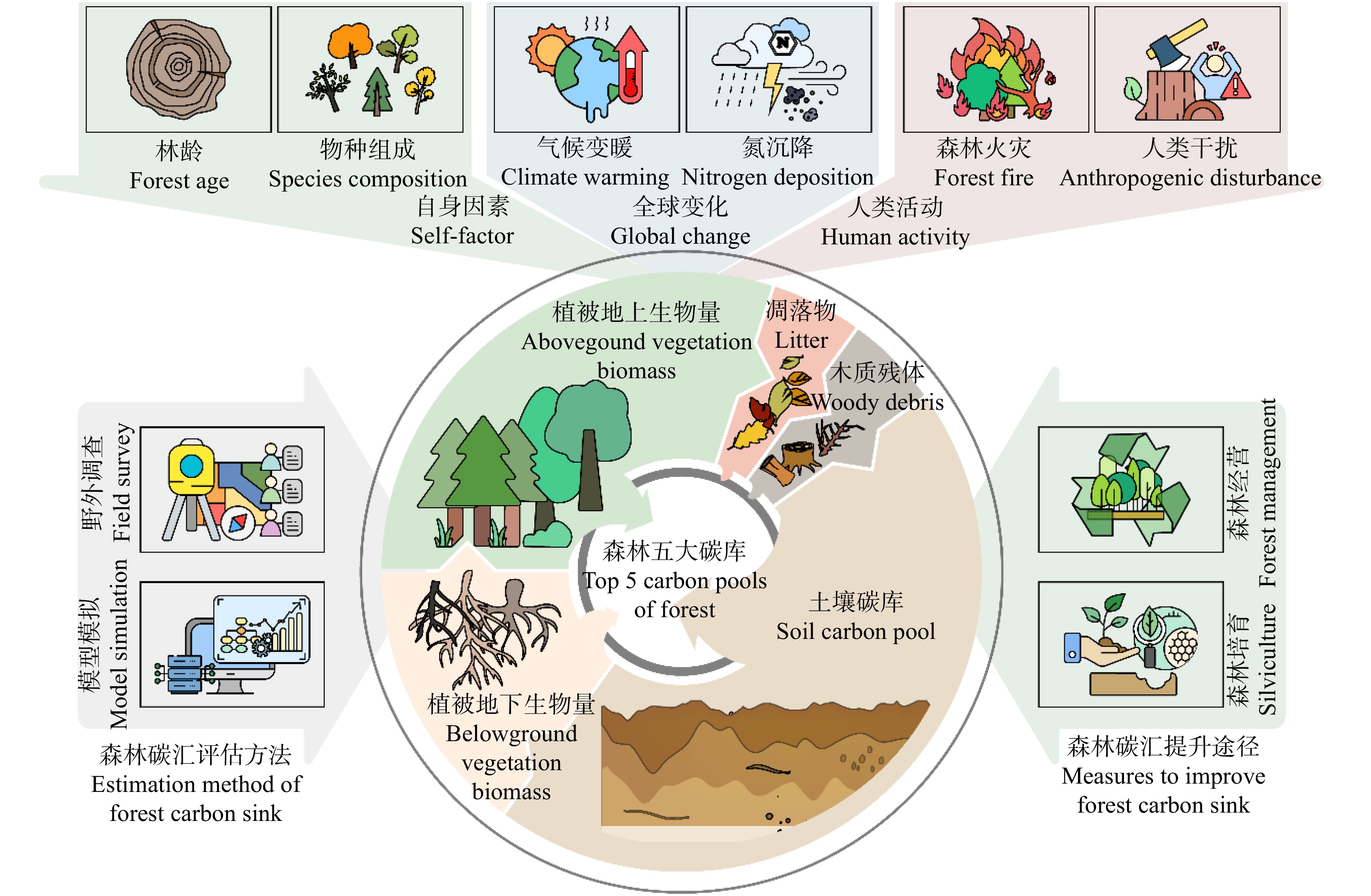
制定森林增汇相关决策的基础是对森林碳汇功能进行准确的评估 (图1)。在“双碳”背景下,国内外已经发展了大量森林碳汇的评估方法,包括基于野外调查数据的森林碳储量变化方法和基于模型模拟的方法等。其中,储量变化方法通过大量的地面调查来获得包括森林蓄积量在内的主要基础数据,进而利用已建立的生物量模型估算生态系统各碳库储量,分析碳储量的年变化量[4]。储量变化法具有精度高、可靠性强的优势,但工作量大,通常只能在抽样总体中保证精度。而模型模拟方法往往用于大尺度生态系统碳循环研究。模型模拟方法既包括基于统计的经验模型,建立胸径、树高、蓄积量等变量与生物量之间的回归关系,描述森林生长速度[5],如生物量模型[6-7]以及全碳库模型[8-9];又包括基于生态系统物质转化的过程模型,通过描述生态系统中生物量与土壤、温度、降水等环境因素之间的关系模拟生态系统中的碳分配过程[10],如假设植被类型和环境组成不变的静态植被模型[11-12]等以及考虑全球变化情景下的动态植被模型[13-14]等。模型模拟中统计经验模型的参数本地化过程以及过程模型的参数往往是模型使用的关键和难点。随着森林碳汇评估方法和技术的发展,更多的研究开始着眼于评估过程中不同估算方法的综合使用,不同时空尺度的转化,多源数据的有机融合以及不确定性来源的分析等方面,从不同角度提高森林碳汇评估精度和森林固碳潜力预测能力[15]。
2. 森林碳汇格局及其影响因素
森林碳汇功能是森林五大碳库固碳能力的综合体现,包括森林植被地上和地下生物量、木质残体、凋落物和土壤碳库(图1)。森林植被和土壤碳库是全球森林碳储量的主要部分,分别占森林总碳储量的44%和45%;森林木质残体碳储量占4%,凋落物碳储量占6%[1,16]。与森林植被相比,森林土壤碳库具有更高的稳定性,在提升森林碳汇功能,应对全球气候变化上具有重要作用[17-18]。由于森林生态系统的复杂性和相关研究数据的不确定性,全球学者对于森林土壤的碳汇估算结果差异较大。早期估算的全球森林土壤碳储量占森林生态系统碳储量的近70%[19],而2020年联合国粮农组织的《全球森林资源评估报告》给出的估算数据为45%。1990年以来,全球森林碳储量持续下降,2020年全球森林碳储量有662 Pg(以C计,下同),1990年有668 Pg,30年间下降了6 Pg[1]。尽管全球森林碳储量表现为持续下降趋势,中国陆地生态系统仍旧表现出较强的增汇能力。目前,中国陆地生态系统的碳汇强度在0.17 ~ 0.35 Pg/a之间,平均为0.24 Pg/a[20]。中国森林碳汇强度为1.22 Mg/(hm2·a)[16],略高于美国森林碳汇强度,但由于沙漠和裸地在中国陆域面积的占比较高,导致我国总的陆地生态系统碳汇强度仅有美国的一半[20]。因此,现阶段提升我国陆地生态系统综合碳汇能力仍旧面临挑战。
全球森林碳汇存在明显的地理分布格局[1]。1990—2020年期间的统计数据结果显示:对全球森林固碳增汇有贡献的区域主要是欧洲、亚洲东部、北美洲、亚洲西部和中部的森林生态系统;而南美、非洲和亚洲南部、东南部的森林碳储量年增长量则为负值,是拖慢全球森林增汇减排进程的主要区域(表1)[1]。南美、非洲和东南亚热带雨林分布区受到人为干扰严重,其中亚马孙热带雨林、巴西季雨林和东南亚热带雨林等区域森林碳汇功能持续下降,目前全球四大主要热带雨林区域中,仅非洲的刚果盆地发挥碳汇的作用[21-22]。以巴西热带季雨林为例,从1987—2020年期间,年均碳排放量增加3.4%,森林碳汇强度下降0.13 Mg/(hm2·a),局部区域已从原来的碳汇变为碳源[22]。与之相反,位于东亚季风区域的亚热带森林生态系统固碳能力不仅高于北方温带森林生态系统,同时也高于同纬度欧美和非洲地区的森林固碳能力,能够解释全球森林净初级生产力的8%[23]。中国森林碳汇的空间分布呈现南多北少的格局,尤其是东南和西南亚热带以及热带森林分布区域,相较于北方温带与寒温带具有更高的固碳增汇能力[24]。
表 1 全球森林生态系统碳汇分布格局 106 t/aTable 1. Carbon sink distribution pattern of global forest ecosystem106 t/year 区域 Region 1990—2000 2000—2010 2010—2020 欧洲 Europe 243.4 365.7 333.3 东亚 East Asia 127.3 135.4 205.1 北美洲 North America 106.1 61.6 78.8 西亚和中亚
Western Asia and Central Asia17.2 29.3 17.2 加勒比地区 Caribbean Region 6.1 4.0 3.0 大洋洲 Oceania −7.1 −3.0 2.0 北非 North Africa −4.0 −4.0 −6.1 中美洲 Central America −16.2 −15.2 −9.1 南亚和东南亚
South Asia and Southeast Asia−44.4 −58.6 −83.8 东非和南非
East Africa and South Africa−67.7 −80.8 −89.9 南美洲 South America −411.1 −416.2 −188.9 西非和中非
West Africa and Central Africa−174.7 −171.7 −223.2 注:此表引自文献[1]。Note: the table is cited from reference [1]. 全球森林土壤碳储量同样呈现明显的地理分布格局。全球寒带森林土壤碳储量占陆地生态系统碳储量的23%,高于热带和亚热带森林土壤碳储量之和[25]。在中国,森林土壤碳储量约为170 ~ 350 Pg[26]。尽管由于估算模型、采样的土层深度以及所在区域气候特征、森林植被类型和林龄等因素造成估算结果具有较大的不确定性,但森林土壤有机碳库随着时间的推移而增加的总体趋势是相对明确的[27]。以中国热带常绿阔叶林为例,基于其土壤有机碳的长期监测数据发现土壤0 ~ 20 cm土层有机碳持续增加[28]。对不同演替序列的落叶林0 ~ 60 cm土壤碳储量的研究发现,森林土壤碳汇功能增强这一趋势可能会在更大时间和空间跨度表现出来[29]。由此可见,森林土壤碳库作为全球森林核心碳库,在未来提升森林总体碳汇功能、维持全球碳平衡、调节全球气候方面将仍旧起到重要作用。
森林碳汇受其林龄、树种组成等自身因素的影响,同时与生境和气候条件密切相关[2](图1)。一般认为,生长旺盛的幼龄林和中龄林具有较强的固碳能力,而老龄林和退化森林的增汇潜力则相对较低[23]。然而,已有研究发现老龄林可能同样具有较强的碳汇功能,表现在具有较强的土壤碳固持能力[28]和较高的木质残体碳库[30]。其中木质残体碳库在森林碳汇研究过程中往往被忽视,因此要全面理解森林碳汇功能有必要开展森林全组分碳库的长期监测与评估。在全球变化背景下,森林生境条件发生了极大的改变,并成为影响其碳汇功能的主要方面。全球气候变暖往往能够促进中高纬度区域森林植被的生长,从而提升森林碳汇功能[31-32]。同时,全球氮沉降增加能够提升森林植被的固碳能力,尤其是对分布在中高纬度地区的温带森林植被,因其光合固碳能力相比于低纬度森林生态系统受到氮限制的程度更为严重[32]。与之相反,森林火灾、土地利用变化等人类活动均会增加森林碳释放,加剧全球森林的碳汇功能的降低[16,21]。据报道,森林火灾导致亚马孙热带雨林大面积受损,这将造成大量热带生物栖居地的丧失,并极大消减热带雨林的碳汇功能 [1,33]。土地利用变化导致热带森林每年释放到大气中的碳约有2.9 Pg,而每年森林通过生长固定的碳仅有1.6 Pg,使全球热带森林成为一个巨大的碳源[16]。以亚马孙热带雨林为例,2001—2015年,毁林导致其碳排放量增加2 592 Tg,其中边缘效应引发的碳排放量占三分之一[21]。可以看出,人类活动导致的全球变化仍是当前影响森林碳汇功能的主要驱动因素。而对于不同区域而言,影响森林碳汇的主要驱动因素可能会存在较大不同,中国森林碳汇能力的增加源于人工林建设、生态工程(如“三北”防护林工程)、生态恢复等因素;而欧美国家森林碳汇更多是受到全球气候变化的影响[3]。
3. 提升森林碳汇功能的途径
3.1 基于森林经营的方法与途径
维持与提升森林碳汇功能,抓好森林经营是必要条件。森林是生命系统,自然演替与人为干扰,如死亡分解、不当采伐、火灾等,均可将已固持的碳释放回大气,进而提升温室气体浓度,为全球变暖推波助澜。森林既是碳汇,也是碳源,因此必须发挥森林经营的杠杆作用,确保碳汇功能、巩固碳汇能力[16]。森林经营是具有积极作用的人为活动,是一系列贯穿森林生长周期的保育措施。森林经营以运筹学为基础,以建立稳定健康、优质高效的森林生态系统为规划目标,通过构建具体营林措施的优化“组合拳”提高森林质量,从而修复与强化森林的供给、调节、服务与支持功能[34]。森林经营是抵消二氧化碳排放的一种独特方式,通过推动森林经营方案的科学编制、以择伐作业为核心的近自然营林模式、以珍贵树种为核心的人工林经营模式等途径实现(图1)。
推动科学编制森林经营方案,精准提升森林质量。充分利用运筹学原理如线性规划科学制定优化后的营林措施(如施肥、造林密度调整、轮伐期、采伐方式调整、采伐剩余物管理等),可有效提升森林碳汇功能、巩固碳汇能力。由于不同树种的生产力存在差异,通过选用高生产力造林树种改善林分结构,将纯林改造为混交林,可在增强森林固碳能力的同时,生产高价值木材[35-36]。推动以择伐作业为核心的近自然营林模式,发展多种形式的择伐与渐伐作业法[37]。抚育性择伐取代传统皆伐的营林作业模式转变是以永续利用为原则的近自然经营的重要内容[38],而构建森林生态系统多功能碳汇林的营林技术体系要求完善多种形式的择伐与渐伐营林作业法,从而维持与恢复森林生态系统健康,发挥森林生态系统多功能作用,贯彻“人与自然和谐共生”的生态文明建设理念。推动以珍贵树种为核心的人工林经营模式,发展现代多功能林业,提高森林生态系统生产力。森林生态系统的主体是高大乔木层,决定系统的结构、功能与质量。高大乔木层可利用珍贵树种发挥建群和用材功能,如栓皮栎(Quercus variabilis)、麻栎(Quercus acutissima)、红锥(Castanopsis hystrix)、含笑(Michelia figo)、合欢(Albizia julibrissin)、格木(Erythrophleum fordii)、黄檀(Dalbergia hupeana)、香樟(Cinnamomum camphora)、楠木(Phoebe zhennan)等。由于人工林营建普遍追求“速生”,珍贵树种在人工林经营中处于缺失状态[39]。因此,构建以珍贵树种为主体的多树种混交林经营模式是恢复与提升人工林生态系统功能的有效途径之一。森林经营是系统工程,要求在加强科学抚育的同时,搞好病虫害防治,保护生物多样性,提升森林生态系统碳汇潜力,为实现“双碳”愿景贡献力量。
3.2 基于森林培育的方法与途径
森林培育技术的发展是促进我国林业可持续发展的关键因素[40],能够有效推动我国生态文明建设迈上新台阶(图1)。为实现“碳达峰”和“碳中和”目标,林业碳汇备受关注。通过各项森林培育技术增加林业碳汇以减缓和适应气候变化,正成为越来越重要的发展议题[41]。虽然我国森林培育技术的起步时间较晚,但随着国家林业、环保以及国土等部门对森林培育工作的高度重视与积极配合,近年来我国森林培育技术已有较大幅度的提升[42]。目前,森林培育的方法主要包括育种技术、育苗技术、森林营造技术、森林抚育技术、森林主伐与更新技术等[43]。
森林育种技术主要包括人工授粉技术、诱导技术、生物工程技术、组织培养技术等,通过采取上述技术选育出性状稳定的优良品种,可为后续的森林育苗工作奠定良好基础[44]。育种栽培技术是人工林营造中的关键环节,同时也是我国常用的森林培育技术,易受林地基础条件、密度以及后续生产管理等因素的影响[42]。种子育苗技术是指在育苗之前,根据当地的气候条件和地理环境,选择适宜的种子类型,通过研究种子采集、储藏、萌发、加工、播种以及发育等相关过程的处理技术,以提高种子的萌发率以及成活率[45]。但是采用种子育苗的工序较为繁琐,出苗率低,且生长较慢,种子在越冬时存在被鸟兽采食的风险[46],而扦插育苗的方法较为简便,耗时短且成本低,但易受扦插苗床基质的种类和配比、外源植物激素浓度和配比、枝条木质化程度、扦插时间等因素的多重影响[47],在实际应用中,尤其是人工林苗木培育,仍需要开展进一步的研究来确定合适的扦插方式。此外,体胚苗生产技术是近年来我国重点研究的育苗技术之一,即通过选择优良的种子,利用体胚苗生产技术让体胚在温室中发育,当体胚生长到一定阶段后再对其进行严格筛选,采用包衣技术,将发育成熟的体胚苗制作成规格统一和质量合格的人工种子,进而开展后续的播种育苗工作[48-49]。但是由于我国体胚苗生产技术的研究时间较短,大多数树种的体胚苗育苗系统正在建设中,还存在许多优化与改进之处,尚缺乏相对成熟的生产技术体系[50]。
人工造林可增加森林覆盖面积,从而提高森林碳汇能力[51]。目前,西欧、北美各发达国家和澳大利亚、新西兰等国家都在加大对造林碳吸收、碳有效储存时间和碳增汇对策技术的研究力度[52]。英国科学家提出的保护现有森林、共同参与、通过生物多样性实现多功能、选择合适的造林地、尽可能利用天然更新、营造混交林、采用适应气候变化的韧性树种、规划先行等“十大造林黄金法则”对于提高碳汇功能同样具有重要意义[53]。前人研究发现退耕农田和牧场上造林可以显著提高碳储量[54-56],但造林后植被碳储量随林分年龄增加而增加,直到森林成熟后,不再明显地积累碳[57]。森林生物量在枝、叶、干和根间的分配在不同年龄的树木和不同的生境条件下存在差异[58],也会影响到造林植被碳增汇作用的实现。另外,包括造林树种、气候、土壤、地形以及人类活动等因素也会影响人工林的植被碳密度和碳储量。
森林抚育是指为提高幼林的存活率和成林的生产率、促进林木生长、优化林木组成、改善林木品质所采取的森林经营活动,具体措施包括松土、除草、灌溉、施肥、修枝去藤、间伐等[59]。以施肥与灌溉为例,目前苗木施肥技术的研究主要集中在分析苗木生长状况与养分供应之间的内在关系,由此掌握苗木在不同阶段的生长规律,进而确定合适的施肥方式、施肥种类以及施肥数量等,提升苗木施肥的科学性[60]。苗木灌溉技术则侧重于灌溉水质量的控制,通过定期测定灌溉水的pH、金属离子含量和杂草种子等情况,精准化监测灌溉水的水质,进而建立科学化和规范化的森林育苗程序[61]。为实现低碳林业,可通过采取透光抚育、生长抚育、综合抚育等方式来充分保证林分抚育的生态效益、经济效益和社会效益[62]。但在开展森林抚育工作的过程中,思想认识、工作规划、经营管理、技术研究以及理论与实践的结合等方面仍存在一些不足之处[63]。未来应当制定合理的效益评价指标并完善抚育技术的工作体系,综合评价森林抚育的成效,加强对森林抚育技术方法的研究与学习,进一步提升森林抚育工作的实践功能[64]。此外,还应该强化群众的保护意识,加强抚育管理,避免破坏森林资源行为的发生[65]。
从国际上来看,美国和日本在森林育种、森林育苗、森林栽培以及林分管理等各方面均处于领先水平。虽然我国的森林培育技术已取得较大进步,但与其他国家相比,我国人工林培育技术仍然相对落后,存在较大的发展空间,还需要积极学习发达国家先进的森林培育技术与理念,因地制宜地发展符合我国国情的森林培育技术。因此,为强化森林培育,首先应该树立科学的森林培育理念,从根本上强化传统的森林育种育苗技术,发展分子育种、无性繁殖和杂交育种等新技术,并建立规范化的森林培育程序[66]。其次,开展森林培育的分类经营,即对森林资源实行精细化管理,针对林地的生长特点和净化能力,将森林划分为若干类型,如生态森林区、林木绿化地区和重要森林的天然生态圈等,而后根据不同的森林资源类型进行科学的森林培育和经营管理[67-68],尤其是在后期管理中做好防火管理与病虫害防治[69]。再次,注重提升技术人员的专业能力和管理人员的综合素质,以此带动森林培育技术的创新与优化,确保森林培育工作的有效落实[36]。最后,还应增加政府投资,完善资金的使用制度,建立综合的森林培育技术推广计划,为提升森林培育水平创造良好条件[70-71]。
4. 森林碳汇研究的未来发展趋势
尽管国内外针对森林碳汇开展了大量研究,然而在评估森林碳储量、碳汇分布格局和动态变化等过程中往往简化了复杂的生态过程,导致评估结果仍存在很大不确定性,缺乏森林全组分碳库驱动因素和机制的综合解析,以及森林生态系统生态增汇如何纳入现有碳金融体系等方面仍存在诸多问题。
4.1 建立多尺度、全方位森林碳汇评估体系
随着多尺度、全方位生态系统监测网络的建立和大量生态参数与观测数据的积累,我国森林碳汇功能监测技术已有较大提升,森林碳汇监测与评估正向着多方法综合和多尺度兼容的方向发展。然而,为了进一步提升森林碳汇评估精度和森林固碳潜力预测能力,仍需要加强如下几个方面。
(1)构建森林碳汇评估方法体系。目前存在的森林碳汇评估方法各有优点与不足,随着多尺度、全方位生态系统监测网络的建立和大量生态参数与观测数据的积累,森林碳汇监测与评估正向着多方法综合和多尺度兼容的方向发展,融合多源数据,构建森林碳汇评估方法体系。
(2)优化全国森林生态系统观测网络,提升森林生产力和碳汇功能监测能力。考虑到森林生态系统的复杂性、观测数据的空间异质性和时间连续性会给森林碳汇评估和固碳能力预测带来不确定性,因而优化全国森林生态系统观测网络建设,合理布设观测站点对于有效提高森林碳汇功能的评估和监测能力则至关重要。
(3)开发森林生态碳循环模拟系统,提升森林生态系统碳汇和生态系统服务功能的评估、预测能力。从2020—2050年的30年间,是全球主要区域实现“双碳”目标的重要窗口期,提升森林碳汇预测能力是落实和调整相关政策的重要基础。因此,基于生态系统观测网络数据和森林碳汇评估方法体系,有必要开发森林生态碳循环模拟系统,进一步提升森林生态系统碳汇和生态系统服务功能的评估、预测能力。
4.2 构建森林全组分碳库综合分析框架
构建森林全组分碳库综合分析体系是森林碳汇评估、预测及其驱动因素分析的重要基础,也是未来全球森林碳汇研究的总体趋势。森林碳汇评估往往通过调查数据的碳储量变化或是基于模型模拟进行评估;然而无论通过何种方法,森林碳汇研究大多是基于对森林植被碳库的评估。对于森林植被地上和地下碳库以外的土壤、木质残体和凋落物碳库空间分布、时间变化和驱动机制等研究的关注程度则远远低于前者。近些年,人们逐渐认识到森林土壤碳库、木质残体和凋落物碳库对森林碳汇的重要性,基于局域水平的研究发现老龄林土壤碳库和木质残体碳库是其碳汇功能的重要组分[28,30]。然而,在区域尺度或全球范围内,仍旧缺乏对森林全组分碳库的长期监测和综合评估,很难掌握全球森林碳汇体量、动态及其驱动机制的准确数据,这就增加了全球森林碳汇强度和动态估算的不确定性。
考虑到全组分碳库综合分析的重要性,在开展森林碳汇评估的过程中应作出如下考虑:首先,基于多尺度、全方位生态系统监测网络,整合多组分碳库储量和动态的监测,对森林植被地上、地下碳库、粗木质残体碳库、凋落物碳库和土壤碳库进行监测,并明晰各组分指标测定标准、规范以获取翔实、准确的数据;其次,基于资源清查、动态观测、过程模拟、大气反演和经济统计的多层次方法,综合分析森林各组分碳的固定速率,估算森林碳汇功能和预测未来森林固碳空间与潜力。再次,针对森林全组分碳库固存机制开展综合性研究,推进森林生态系统碳循环生物学调控机制研究,发展新理论、新方法以助力森林碳汇能力提升。
4.3 建立可持续的林业碳金融市场
面对日益恶化的全球气候变化,减缓气候变化和改善生活环境已成为全世界的基本共识。各国正在共同努力,通过包括增加森林覆盖率等一系列措施来减少碳排放。在这个过程中,大量的金融需求正在出现,碳金融的重要作用也越来越明显[72]。世界上不同经济体的能源需求不同,碳排放也有很大差异。其中,美国、欧盟、日本等发达国家已经达到碳排放的峰值,碳排放呈现下降趋势,而中国、印度等发展中国家的能源需求仍然很高,碳排放尚未达到峰值。随着中国经济的快速发展,碳排放急剧增加,引发了气候环境问题,同时也改变了经济发展理念,经济发展逐渐向低碳经济转变,因此由金融工具、金融市场和金融政策构成的碳金融至关重要[73]。一方面,碳金融也可以通过支持碳汇有效地促进碳中和,通过制定限额与交易计划、建立全国性市场机制,有效凸显森林价值、提高林地所有者和碳排放者的参与积极性,充分利用大自然的清洁能力,通过扩大森林碳汇来有效中和碳排放,这不仅为碳交易市场提供了更多的供应,也大大推进了碳中和的进程[74];另一方面,碳金融可以控制现有的以及新的碳排放,既可以通过利用碳基金、碳保险、碳信托、绿色债券以及绿色信贷等碳金融工具,支持碳减排,赋能绿色发展,也可以通过规范林地所有者的行为,对违规行为进行制裁,如制定环境法规或征收林业碳税,对市场机制未能解决的环境外部性问题进行调节,以实现经济与自然的和谐发展[75]。
目前碳金融市场仍处于快速发展阶段,尤其是林业碳金融,但是仍旧需要进一步提质增效。而要加强碳金融市场的调控作用,就需要加强如下几个方面的工作:(1)政府要加大对林业碳金融的政策支持,一方面,需完善相关法律法规,保证碳金融政策的有效推进,另一方面要充分利用市场的力量配置碳排放权,提高金融市场流动性,建立有效的碳定价机制等,持续发展碳金融市场,从而促进碳经济绿色转型与高质量发展;(2)传统林农人才往往只熟悉林业生产方面的知识,对金融行业了解甚少,因此要大力培养具备金融、环境、林业等专业知识的复合性人才,才能更好地胜任碳金融战略决策、资源管理和研究开发等方面的重要职务;(3)在国内外合作方面,要借鉴国内碳金融发展领先的经验,开展“城市—林区”帮扶合作,从而促进林业碳金融的发展,并通过强化林业领域的国际合作,吸收碳金融发展领先的国家的经验和技术,提高碳金融的资源配置效率,更高质量地支持“双碳”目标的实现。
-
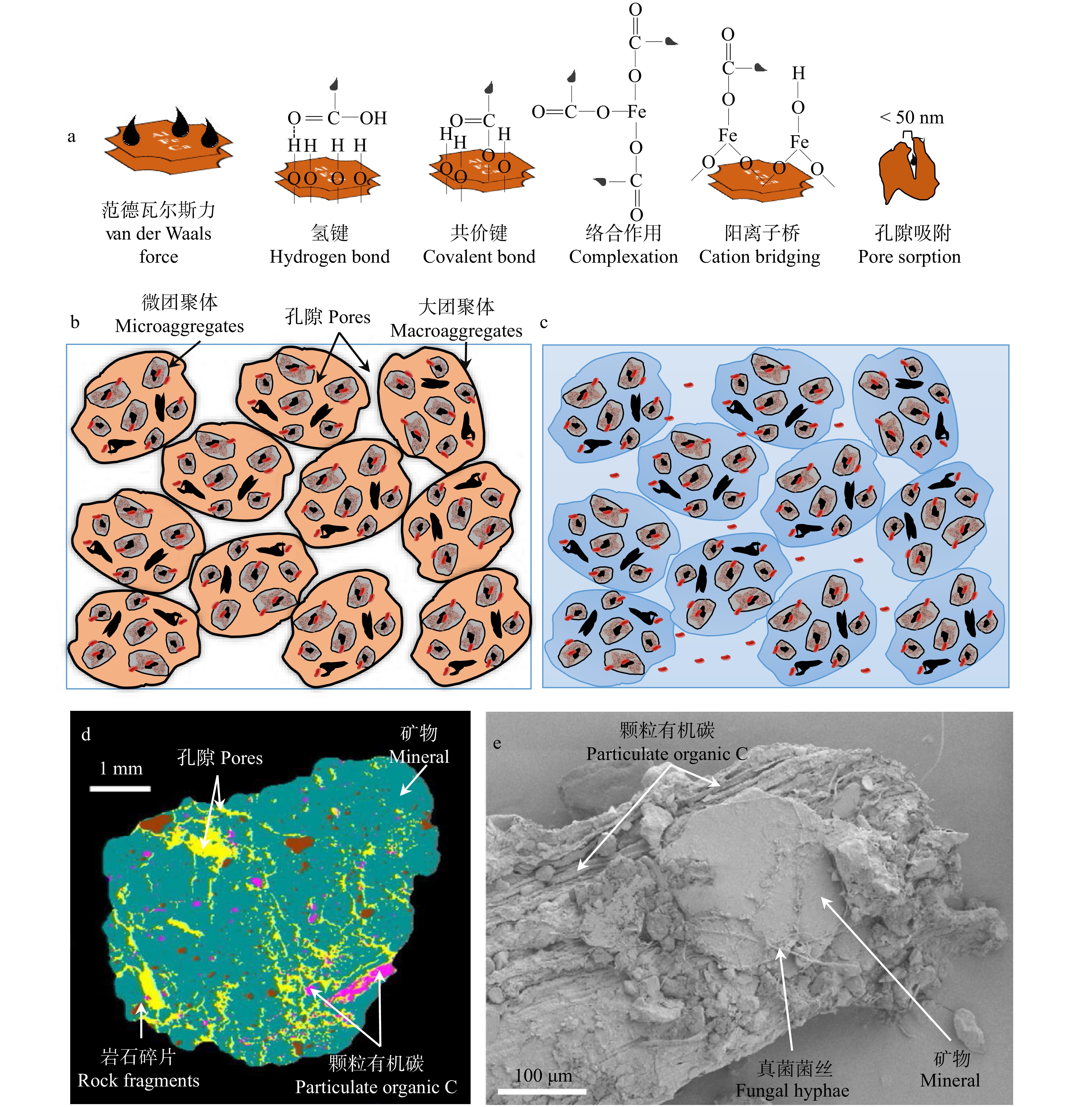
图 1 土壤有机碳的矿物保护和团聚体保护
a. 矿物保护机制;b,c. 干旱和湿润条件下土壤团聚体间的隔离情况,参考Wilpiszeski等[34]绘制;d. 团聚体孔隙对有机碳的闭蓄保护作用(图片来源于Schlüter等[35]);e. 新鲜凋落物−矿物界面(电镜扫描照片来源于Witzgall等[36])。a, mechanisms of mineral protection; b and c, the isolation of soil aggregates under dry and wet conditions, referring to Wilpiszeski, et al.[34]; d, occlusion of soil organic carbon by aggregation (image from Schlüter, et al.[35]); e, scanning electron microscopy image of the interface of plant litter and soil minerals (image from Witzgall, et al.[36]).
Figure 1. Mineral and aggregate protection of soil organic carbon
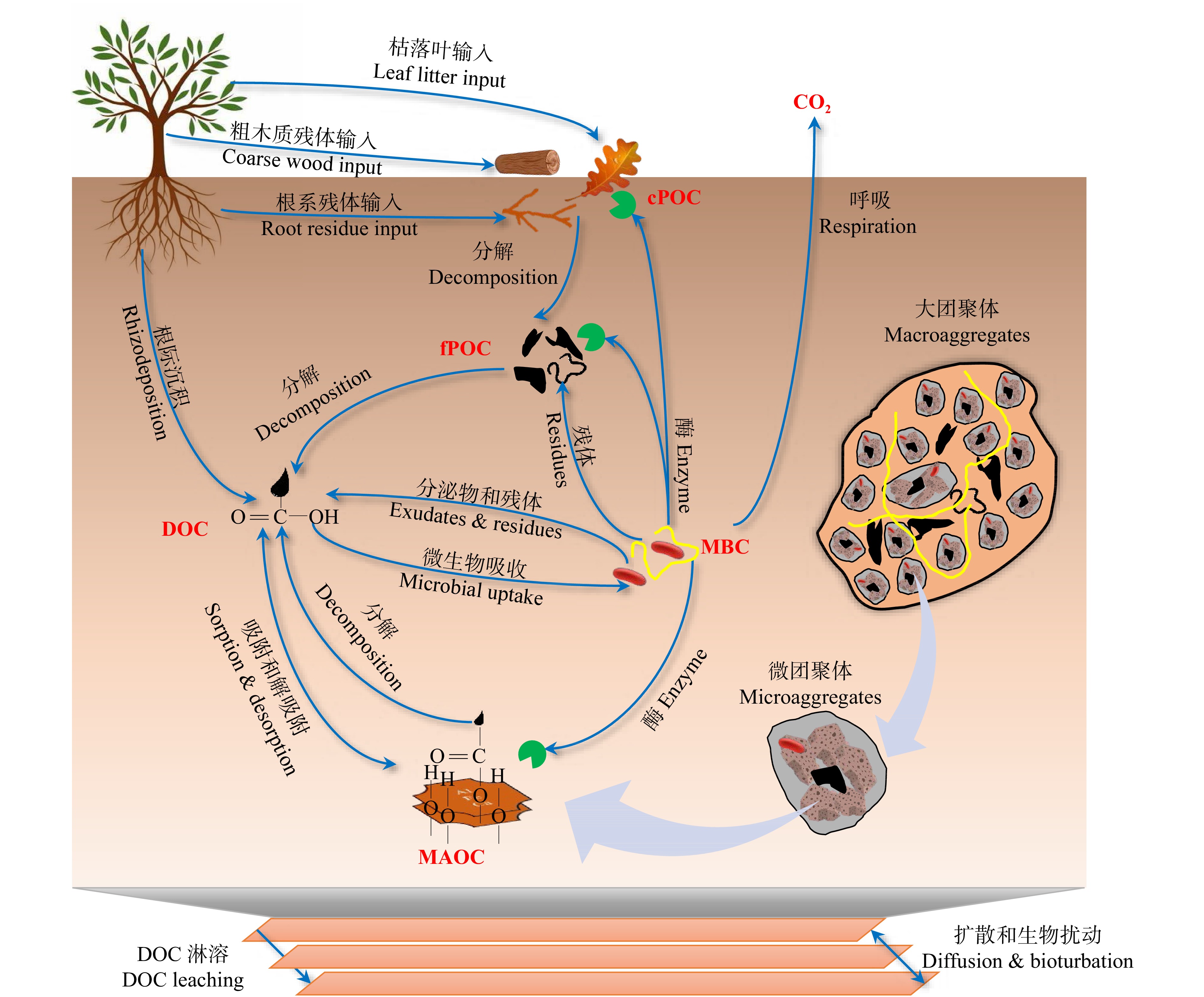
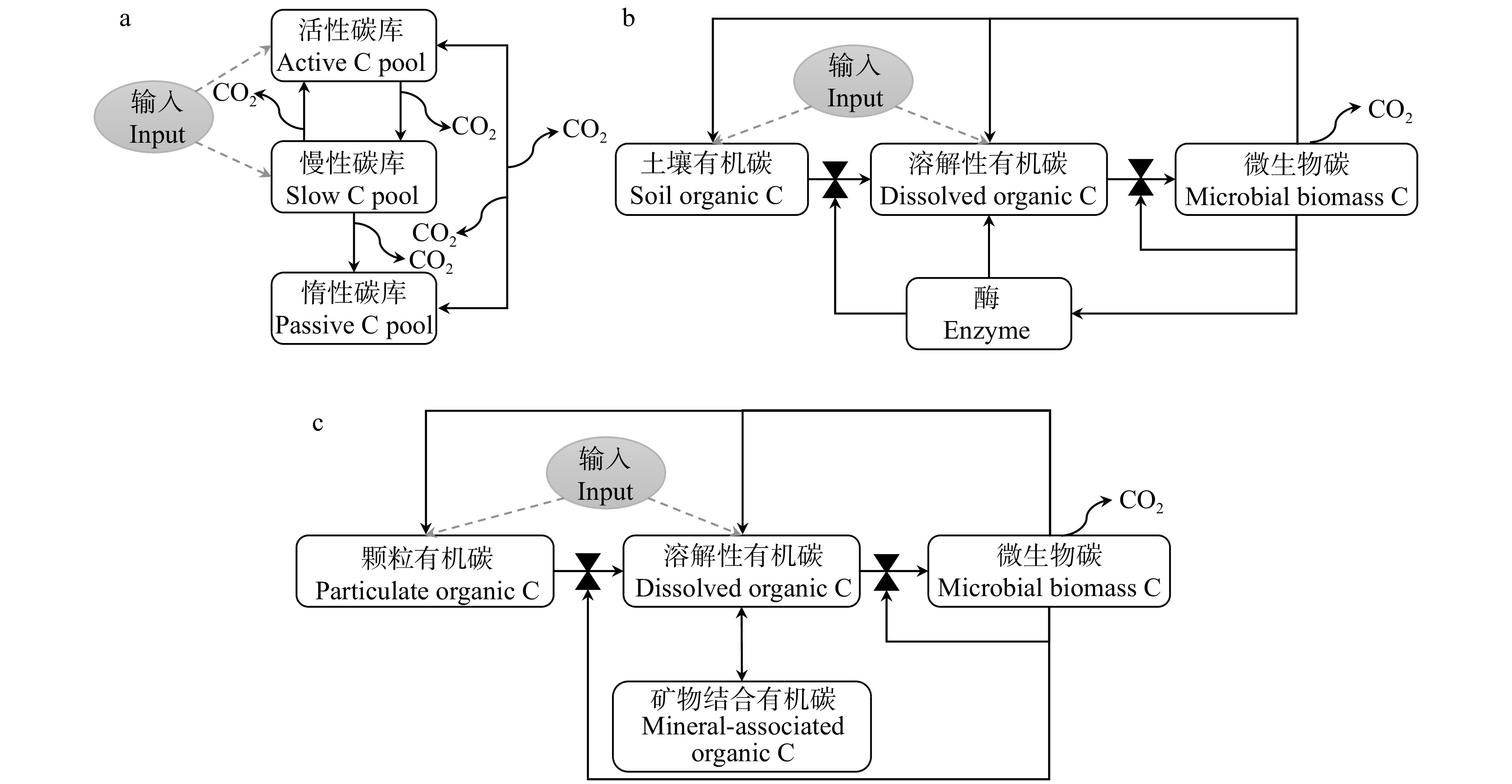
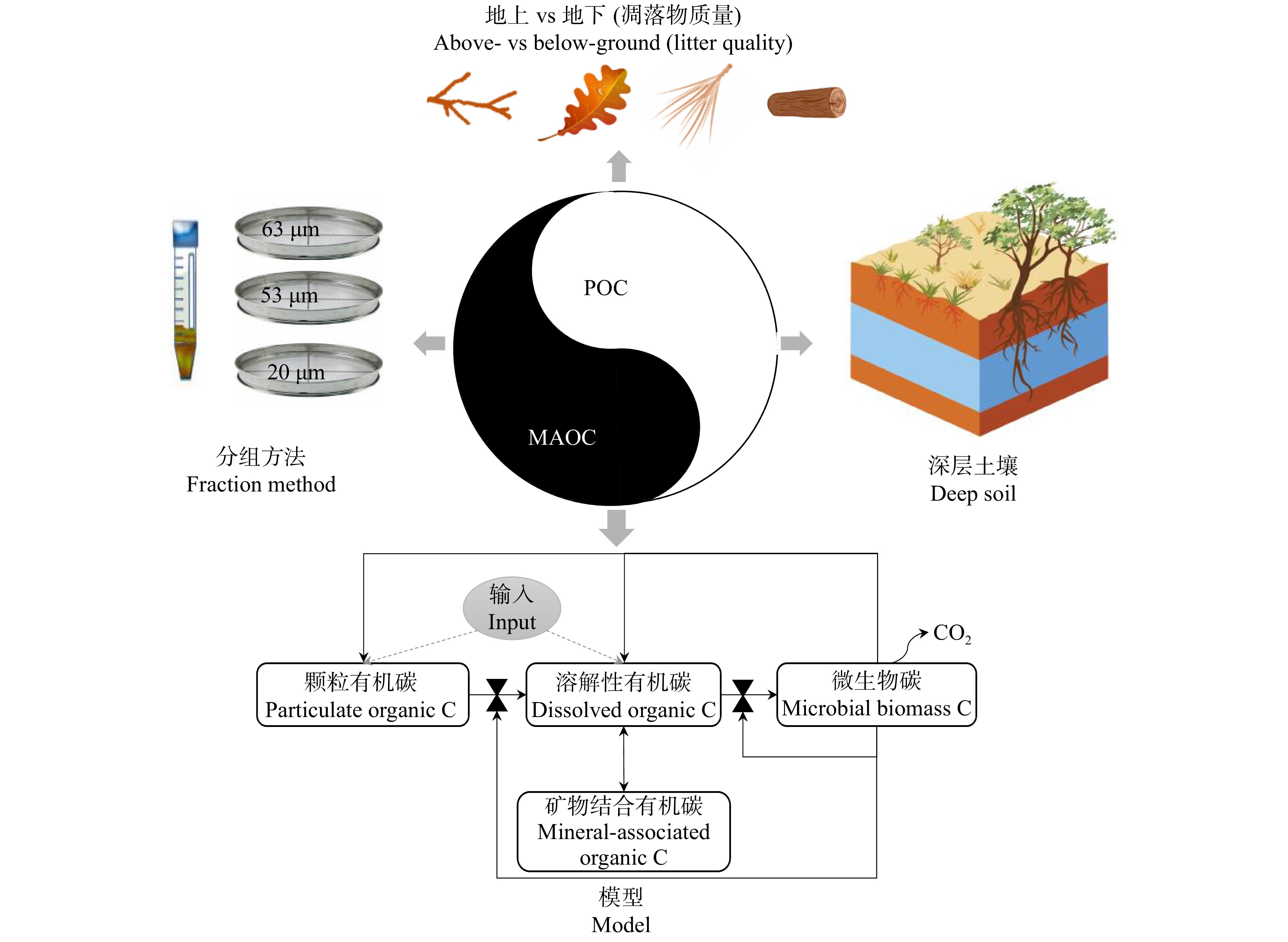
图 2 土壤有机碳的形成和稳定机制
cPOC. 粗颗粒有机碳;fPOC. 细颗粒有机碳;DOC. 溶解性有机碳;MBC. 微生物生物量碳;MAOC. 矿物结合有机碳。下同。cPOC, coarse particulate organic carbon; fPOC, fine particulate organic carbon; DOC, dissolved organic carbon; MBC, microbial biomass carbon; MAOC, mineral-associated organic carbon. The same below.
Figure 2. Mechanisms of soil organic carbon formation and stabilization
表 1 颗粒有机碳和矿物结合有机碳功能特性
Table 1 Functional traits of particulate organic carbon and mineral-associated organic carbon
项目
Item颗粒有机碳
Particulate organic carbon矿物结合有机碳
Mineral-associated organic carbon主要来源
Main source植物残体和真菌菌丝
Plant residues and fungal hyphae植物和微生物残体
Plant and microbial residues分子量 Molecular mass/Da > 600 ~ 1 000 < 600 ~ 1 000 密度 Density 低 Low 高 High 碳库上限 Upper limit of C pool 无 No 有 Yes 主要稳定机制
Main stabilization mechanism生化难分解性和团聚体保护
Biochemical recalcitrance and aggregate protection矿物保护和团聚体保护
Mineral and aggregate protection温度敏感性 Temperature sensitivity 高 High 低 Low 周转时间 Turnover time < 10年 ~ 数十年 < ten years – decades 数十年 ~ 数百年 Decades – centuries -
[1] Wiesmeier M, Urbanski L, Hobley E, et al. Soil organic carbon storage as a key function of soils-a review of drivers and indicators at various scales[J]. Geoderma, 2019, 333: 149−162. doi: 10.1016/j.geoderma.2018.07.026
[2] Wall D H, Nielsen U N, Six J. Soil biodiversity and human health[J]. Nature, 2015, 528: 69−76. doi: 10.1038/nature15744
[3] Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478: 49−56. doi: 10.1038/nature10386
[4] Li X G, Li F M, Zed R, et al. Soil physical properties and their relations to organic carbon pools as affected by land use in an alpine pastureland[J]. Geoderma, 2007, 139(1−2): 98−105.
[5] Tiessen H, Cuevas E, Chacon P. The role of soil organic matter in sustaining soil fertility[J]. Nature, 1994, 371: 783−785. doi: 10.1038/371783a0
[6] O’rourke S M, Angers D A, Holden N M, et al. Soil organic carbon across scales[J]. Global Change Biology, 2015, 21(10): 3561−3574. doi: 10.1111/gcb.12959
[7] Laban P, Metternicht G, Davies J. Soil biodiversity and soil organic carbon: keeping drylands alive[M]. Gland: IUCN, 2018.
[8] Batjes N H. Harmonized soil property values for broad-scale modelling (WISE30sec) with estimates of global soil carbon stocks[J]. Geoderma, 2016, 269: 61−68. doi: 10.1016/j.geoderma.2016.01.034
[9] Bossio D A, Cook-Patton S C, Ellis P W, et al. The role of soil carbon in natural climate solutions[J]. Nature Sustainability, 2020, 3(5): 391−398. doi: 10.1038/s41893-020-0491-z
[10] Beillouin D, Cardinael R, Berre D, et al. A global overview of studies about land management, land-use change, and climate change effects on soil organic carbon[J]. Global Change Biology, 2022, 28(4): 1690−1702. doi: 10.1111/gcb.15998
[11] Sollins P, Homann P, Caldwell B A. Stabilization and destabilization of soil organic matter: mechanisms and controls[J]. Geoderma, 1996, 74(1−2): 65−105. doi: 10.1016/S0016-7061(96)00036-5
[12] Grigatti M, Perez M D, Blok W J, et al. A standardized method for the determination of the intrinsic carbon and nitrogen mineralization capacity of natural organic matter sources[J]. Soil Biology and Biochemistry, 2007, 39(7): 1493−1503. doi: 10.1016/j.soilbio.2006.12.035
[13] Feng W T, Shi Z, Jiang J, et al. Methodological uncertainty in estimating carbon turnover times of soil fractions[J]. Soil Biology and Biochemistry, 2016, 100: 118−124. doi: 10.1016/j.soilbio.2016.06.003
[14] von Lützow M, Kogel-Knabner I, Ekschmitt K, et al. Stabilization of organic matter in temperate soils: mechanisms and their relevance under different soil conditions: a review[J]. European Journal of Soil Science, 2006, 57(4): 426−445. doi: 10.1111/j.1365-2389.2006.00809.x
[15] Mayer L M. The inertness of being organic[J]. Marine Chemistry, 2004, 92(1−4): 135−140. doi: 10.1016/j.marchem.2004.06.022
[16] Sokol N W, Sanderman J, Bradford M A. Pathways of mineral-associated soil organic matter formation: integrating the role of plant carbon source, chemistry, and point of entry[J]. Global Change Biology, 2019, 25(1): 12−24. doi: 10.1111/gcb.14482
[17] Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261−273. doi: 10.1111/gcb.14859
[18] Lugato E, Lavallee J M, Haddix M L, et al. Different climate sensitivity of particulate and mineral-associated soil organic matter[J]. Nature Geoscience, 2021, 14(5): 295−300. doi: 10.1038/s41561-021-00744-x
[19] Angst G, Mueller K E, Nierop K G J, et al. Plant- or microbial-derived? a review on the molecular composition of stabilized soil organic matter[J]. Soil Biology and Biochemistry, 2021, 156: 108189. doi: 10.1016/j.soilbio.2021.108189
[20] Lehmann J, Hansel C M, Kaiser C, et al. Persistence of soil organic carbon caused by functional complexity[J]. Nature Geoscience, 2020, 13(8): 529−534. doi: 10.1038/s41561-020-0612-3
[21] Han L F, Sun K, Jin J, et al. Some concepts of soil organic carbon characteristics and mineral interaction from a review of literature[J]. Soil Biology and Biochemistry, 2016, 94: 107−121. doi: 10.1016/j.soilbio.2015.11.023
[22] Feng X J, Simpson M J. The distribution and degradation of biomarkers in Alberta grassland soil profiles[J]. Organic Geochemistry, 2007, 38(9): 1558−1570. doi: 10.1016/j.orggeochem.2007.05.001
[23] Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528: 60−68. doi: 10.1038/nature16069
[24] Melillo J M, Aber J D, Muratore J F. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics[J]. Ecology, 1982, 63(3): 621−626. doi: 10.2307/1936780
[25] Otto A, Simpson M J. Degradation and preservation of vascular plant–derived biomarkers in grassland and forest soils from Western Canada[J]. Biogeochemistry, 2005, 74(3): 377−409. doi: 10.1007/s10533-004-5834-8
[26] Otto A, Simpson M J. Sources and composition of hydrolysable aliphatic lipids and phenols in soils from western Canada[J]. Organic Geochemistry, 2006, 37(4): 385−407. doi: 10.1016/j.orggeochem.2005.12.011
[27] Amelung W. Methods using amino sugars as markers for microbial residues in soil[M]//Assessment methods for soil carbon. Boca Raton: Lewis Publishers, 2001.
[28] Gunina A, Kuzyakov Y. From energy to (soil organic) matter[J]. Global Change Biology, 2022, 28(7): 2169−2182. doi: 10.1111/gcb.16071
[29] Wattel-Koekkoek E J W, Buurman P, van der Plicht J, et al. Mean residence time of soil organic matter associated with kaolinite and smectite[J]. European Journal of Soil Science, 2003, 54(2): 269−278. doi: 10.1046/j.1365-2389.2003.00512.x
[30] Kleber M, Bourg I C, Coward E K, et al. Dynamic interactions at the mineral-organic matter interface[J]. Nature Reviews Earth and Environment, 2021, 2(6): 402−421. doi: 10.1038/s43017-021-00162-y
[31] del Nero M, Galindo C, Bucher G, et al. Speciation of oxalate at corundum colloid-solution interfaces and its effect on colloid aggregation under conditions relevant to freshwaters[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 418: 165−173.
[32] Kunhi M Y, Kučerík J, Diehl D, et al. Cation-mediated cross-linking in natural organic matter: a review[J]. Reviews in Environmental Science and Bio/technology, 2012, 11(1): 41−54. doi: 10.1007/s11157-011-9258-3
[33] Keiluweit M, Kleber M. Molecular-level interactions in soils and sediments: the role of aromatic π-systems[J]. Environmental Science and Technology, 2009, 43(10): 3421−3429. doi: 10.1021/es8033044
[34] Wilpiszeski R L, Aufrecht J A, Retterer S T, et al. Soil aggregate microbial communities: towards understanding microbiome interactions at biologically relevant scales[J]. Applied and Environmental Microbiology, 2019, 85(14): e00324−19.
[35] Schlüter S, Leuther F, Albrecht L, et al. Microscale carbon distribution around pores and particulate organic matter varies with soil moisture regime[J]. Nature Communications, 2022, 13(1): 1−14. doi: 10.1038/s41467-021-27699-2
[36] Witzgall K, Vidal A, Schubert D I, et al. Particulate organic matter as a functional soil component for persistent soil organic carbon[J]. Nature Communications, 2021, 12(1): 4115. doi: 10.1038/s41467-021-24192-8
[37] Ni J, Pignatello J J. Charge-assisted hydrogen bonding as a cohesive force in soil organic matter: water solubility enhancement by addition of simple carboxylic acids[J]. Environmental Science: Processes and Impacts, 2018, 20(9): 1225−1233. doi: 10.1039/C8EM00255J
[38] Rowley M C, Grand S, Verrecchia É P. Calcium-mediated stabilisation of soil organic carbon[J]. Biogeochemistry, 2018, 137(1): 27−49.
[39] Totsche K U, Amelung W, Gerzabek M H, et al. Microaggregates in soils[J]. Journal of Plant Nutrition and Soil Science, 2018, 181(1): 104−136. doi: 10.1002/jpln.201600451
[40] Kaiser K, Guggenberger G. Sorptive stabilization of organic matter by microporous goethite: sorption into small pores vs. surface complexation[J]. European Journal of Soil Science, 2007, 58(1): 45−59. doi: 10.1111/j.1365-2389.2006.00799.x
[41] Mayer L M, Schick L L, Hardy K R, et al. Organic matter in small mesopores in sediments and soils[J]. Geochimica et Cosmochimica Acta, 2004, 68(19): 3863−3872. doi: 10.1016/j.gca.2004.03.019
[42] Mayer L M. Surface area control of organic carbon accumulation in continental shelf sediments[J]. Geochimica et Cosmochimica Acta, 1994, 58(4): 1271−1284. doi: 10.1016/0016-7037(94)90381-6
[43] 刘红梅, 李睿颖, 高晶晶, 等. 保护性耕作对土壤团聚体及微生物学特性的影响研究进展[J]. 生态环境学报, 2020, 29(6): 1277−1284. doi: 10.16258/j.cnki.1674-5906.2020.06.025 Liu H M, Li R Y, Gao J J, et al. Research progress on the effects of conservation tillage on soil aggregates and microbiological characteristics[J]. Ecology and Environmental Sciences, 2020, 29(6): 1277−1284. doi: 10.16258/j.cnki.1674-5906.2020.06.025
[44] Ranjard L, Poly F, Combrisson J, et al. Heterogeneous cell density and genetic structure of bacterial pools associated with various soil microenvironments as determined by enumeration and DNA fingerprinting approach (RISA)[J]. Microbial Ecology, 2000, 39(4): 263−272.
[45] Young I M, Crawford J W. Interactions and self-organization in the soil-microbe complex[J]. Science, 2004, 304: 1634−1637. doi: 10.1126/science.1097394
[46] Barreto R C, Madari B E, Maddock J E L, et al. The impact of soil management on aggregation, carbon stabilization and carbon loss as CO2 in the surface layer of a Rhodic Ferralsol in Southern Brazil[J]. Agriculture, Ecosystems and Environment, 2009, 132(3−4): 243−251. doi: 10.1016/j.agee.2009.04.008
[47] Sexstone A J, Revsbech N P, Parkin T B, et al. Direct measurement of oxygen profiles and denitrification rates in soil aggregates[J]. Soil Science Society of America Journal, 1985, 49(3): 645−651. doi: 10.2136/sssaj1985.03615995004900030024x
[48] Wang B, An S, Liang C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems[J]. Soil Biology and Biochemistry, 2021, 162: 108422. doi: 10.1016/j.soilbio.2021.108422
[49] Cotrufo M F, Wallenstein M D, Boot C M, et al. The microbial efficiency-matrix stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988−995. doi: 10.1111/gcb.12113
[50] Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105. doi: 10.1038/nmicrobiol.2017.105
[51] Castellano M J, Mueller K E, Olk D C, et al. Integrating plant litter quality, soil organic matter stabilization, and the carbon saturation concept[J]. Global Change Biology, 2015, 21(9): 3200−3209. doi: 10.1111/gcb.12982
[52] Hedges J I, Oades J M. Comparative organic geochemistries of soils and marine sediments[J]. Organic Geochemistry, 1997, 27(7−8): 319−361. doi: 10.1016/S0146-6380(97)00056-9
[53] Fan X, Gao D, Zhao C, et al. Improved model simulation of soil carbon cycling by representing the microbially derived organic carbon pool[J]. The ISME Journal, 2021, 15(8): 2248−2263. doi: 10.1038/s41396-021-00914-0
[54] Schimel J P, Weintraub M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: a theoretical model[J]. Soil Biology and Biochemistry, 2003, 35(4): 549−563. doi: 10.1016/S0038-0717(03)00015-4
[55] Jiao N, Herndl G J, Hansell D A, et al. Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean[J]. Nature Reviews Microbiology, 2010, 8: 593−599. doi: 10.1038/nrmicro2386
[56] Jiao N, Herndl G J, Hansell D A, et al. The microbial carbon pump and the oceanic recalcitrant dissolved organic matter pool[J]. Nature Reviews Microbiology, 2011, 9: 555.
[57] Lu W, Luo Y, Yan X, et al. Modeling the contribution of the microbial carbon pump to carbon sequestration in the South China Sea[J]. Science China Earth Sciences, 2018, 61(11): 1594−1604. doi: 10.1007/s11430-017-9180-y
[58] 梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论[J]. 中国科学: 地球科学, 2021, 51(5): 680−695. Liang C, Zhu X F. The soil microbial carbon pump as a new concept for terrestrial carbon sequestration[J]. Science China Earth Sciences, 2021, 51(5): 680−695.
[59] 胡慧蓉, 马焕成, 罗承德, 等. 森林土壤有机碳分组及其测定方法[J]. 土壤通报, 2010, 41(4): 1018−1024. doi: 10.19336/j.cnki.trtb.2010.04.049 Hu H R, Ma H C, Luo C D, et al. Forest soil organic carbon fraction and its measure methods[J]. Chinese Journal of Soil Science, 2010, 41(4): 1018−1024. doi: 10.19336/j.cnki.trtb.2010.04.049
[60] Bailey V L, Bond-Lamberty B, de Angelis K, et al. Soil carbon cycling proxies: understanding their critical role in predicting climate change feedbacks[J]. Global Change Biology, 2018, 24(3): 895−905. doi: 10.1111/gcb.13926
[61] 张丽敏, 徐明岗, 娄翼来, 等. 土壤有机碳分组方法概述[J]. 中国土壤与肥料, 2014(4): 1−6. doi: 10.11838/sfsc.20140401 Zhang L M, Xu M G, Lou Y L, et al. Soil organic carbon fractionation methods[J]. Soil and Fertilizer Sciences in China, 2014(4): 1−6. doi: 10.11838/sfsc.20140401
[62] 张国, 曹志平, 胡婵娟. 土壤有机碳分组方法及其在农田生态系统研究中的应用[J]. 应用生态学报, 2011, 22(7): 1921−1930. doi: 10.13287/j.1001-9332.2011.0264 Zhang G, Cao Z P, Hu C J. Soil organic carbon fractionation methods and their applications in farmland ecosystem research: a review[J]. Chinese Journal of Applied Ecology, 2011, 22(7): 1921−1930. doi: 10.13287/j.1001-9332.2011.0264
[63] Cotrufo M F, Ranalli M G, Haddix M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience, 2019, 12: 989−994. doi: 10.1038/s41561-019-0484-6
[64] Sokol N W, Whalen E D, Jilling A, et al. Global distribution, formation and fate of mineral-associated soil organic matter under a changing climate: a trait-based perspective[J]. Functional Ecology, 2022, 36(6): 1411−1429. doi: 10.1111/1365-2435.14040
[65] Luo Y, Schuur E A G. Model parameterization to represent processes at unresolved scales and changing properties of evolving systems[J]. Global Change Biology, 2020, 26(3): 1109−1117. doi: 10.1111/gcb.14939
[66] Todd-Brown K E O, Randerson J T, Post W M, et al. Causes of variation in soil carbon simulations from CMIP5 earth system models and comparison with observations[J]. Biogeosciences, 2013, 10(3): 1717−1736. doi: 10.5194/bg-10-1717-2013
[67] Todd-Brown K E O, Randerson J T, Hopkins F, et al. Changes in soil organic carbon storage predicted by earth system models during the 21st century[J]. Biogeosciences, 2014, 11(8): 2341−2356. doi: 10.5194/bg-11-2341-2014
[68] Shi Z, Crowell S, Luo Y, et al. Model structures amplify uncertainty in predicted soil carbon responses to climate change[J]. Nature Communications, 2018, 9(1): 2171. doi: 10.1038/s41467-018-04526-9
[69] Parton W J, Schimel D S, Cole C V, et al. Analysis of factors controlling soil organic matter levels in Great Plains grasslands[J]. Soil Science Society of America Journal, 1987, 51(5): 1173−1179. doi: 10.2136/sssaj1987.03615995005100050015x
[70] Lawrence D M, Fisher R A, Koven C D, et al. The community land model version 5: description of new features, benchmarking, and impact of forcing uncertainty[J]. Journal of Advances in Modeling Earth Systems, 2019, 11(12): 4245−4287. doi: 10.1029/2018MS001583
[71] Liang J, Xia J, Shi Z, et al. Biotic responses buffer warming-induced soil organic carbon loss in Arctic tundra[J]. Global Change Biology, 2018, 24(10): 4946−4959. doi: 10.1111/gcb.14325
[72] Wang Y P, Law R M, Pak B. A global model of carbon, nitrogen and phosphorus cycles for the terrestrial biosphere[J]. Biogeosciences, 2010, 7(7): 2261−2282. doi: 10.5194/bg-7-2261-2010
[73] Wieder W R, Bonan G B, Allison S D. Global soil carbon projections are improved by modelling microbial processes[J]. Nature Climate Change, 2013, 3(10): 909−912. doi: 10.1038/nclimate1951
[74] Allison S D, Wallenstein M D, Bradford M A. Soil-carbon response to warming dependent on microbial physiology[J]. Nature Geoscience, 2010, 3(5): 336−340. doi: 10.1038/ngeo846
[75] Abramoff R Z, Guenet B, Zhang H, et al. Improved global-scale predictions of soil carbon stocks with Millennial Version 2[J]. Soil Biology and Biochemistry, 2022, 164: 108466. doi: 10.1016/j.soilbio.2021.108466
[76] Six J, Guggenberger G, Paustian K, et al. Sources and composition of soil organic matter fractions between and within soil aggregates[J]. European Journal of Soil Science, 2001, 52(4): 607−618. doi: 10.1046/j.1365-2389.2001.00406.x
[77] Ahrens B, Braakhekke M C, Guggenberger G, et al. Contribution of sorption, DOC transport and microbial interactions to the 14C age of a soil organic carbon profile: insights from a calibrated process model[J]. Soil Biology and Biochemistry, 2015, 88: 390−402. doi: 10.1016/j.soilbio.2015.06.008
[78] Benbi D K, Boparai A K, Brar K. Decomposition of particulate organic matter is more sensitive to temperature than the mineral associated organic matter[J]. Soil Biology and Biochemistry, 2014, 70: 183−192. doi: 10.1016/j.soilbio.2013.12.032
[79] Jobbágy E G, Jackson R B. The vertical distribution of soil organic carbon and its relation to climate and vegetation[J]. Ecological Applications, 2000, 10(2): 423−436. doi: 10.1890/1051-0761(2000)010[0423:TVDOSO]2.0.CO;2
[80] Koven C D, Riley W J, Subin Z M, et al. The effect of vertically resolved soil biogeochemistry and alternate soil C and N models on C dynamics of CLM4[J]. Biogeosciences, 2013, 10(11): 7109−7131. doi: 10.5194/bg-10-7109-2013
[81] Wieder W R, Grandy A S, Kallenbach C M, et al. Representing life in the earth system with soil microbial functional traits in the MIMICS model[J]. Geoscientific Model Development, 2015, 8(6): 1789−1808. doi: 10.5194/gmd-8-1789-2015
[82] Huang Y, Lu X, Shi Z, et al. Matrix approach to land carbon cycle modeling: a case study with the Community Land Model[J]. Global Change Biology, 2018, 24(3): 1394−1404. doi: 10.1111/gcb.13948
[83] Angst G, Mueller K E, Eissenstat D M, et al. Soil organic carbon stability in forests: distinct effects of tree species identity and traits[J]. Global Change Biology, 2019, 25(4): 1529−1546. doi: 10.1111/gcb.14548
[84] Samson M É, Chantigny M H, Vanasse A, et al. Coarse mineral-associated organic matter is a pivotal fraction for SOM formation and is sensitive to the quality of organic inputs[J]. Soil Biology and Biochemistry, 2020, 149: 107935. doi: 10.1016/j.soilbio.2020.107935
[85] Wiseman C L S, Püttmann W. Interactions between mineral phases in the preservation of soil organic matter[J]. Geoderma, 2006, 134(1−2): 109−118. doi: 10.1016/j.geoderma.2005.09.001
[86] Stewart C E, Plante A F, Paustian K, et al. Soil carbon saturation: linking concept and measurable carbon pools[J]. Soil Science Society of America Journal, 2008, 72(2): 379−392. doi: 10.2136/sssaj2007.0104
[87] Stewart C E, Paustian K, Conant R T, et al. Soil carbon saturation: implications for measurable carbon pool dynamics in long-term incubations[J]. Soil Biology and Biochemistry, 2009, 41(2): 357−366. doi: 10.1016/j.soilbio.2008.11.011
[88] Xia M, Talhelm A F, Pregitzer K S. Fine roots are the dominant source of recalcitrant plant litter in sugar maple-dominated northern hardwood forests[J]. New Phytologist, 2015, 208(3): 715−726. doi: 10.1111/nph.13494
[89] Farrar J, Hawes M, Jones D, et al. How roots control the flux of carbon to the rhizosphere[J]. Ecology, 2003, 84(4): 827−837. doi: 10.1890/0012-9658(2003)084[0827:HRCTFO]2.0.CO;2
[90] Toljander J F, Lindahl B D, Paul L R, et al. Influence of arbuscular mycorrhizal mycelial exudates on soil bacterial growth and community structure[J]. FEMS Microbiology Ecology, 2007, 61(2): 295−304. doi: 10.1111/j.1574-6941.2007.00337.x
[91] Frey S D. Mycorrhizal fungi as mediators of soil organic matter dynamics[J]. Annual Review of Ecology, Evolution, and Systematics, 2019, 50: 237−259. doi: 10.1146/annurev-ecolsys-110617-062331
[92] Vranova V, Rejsek K, Skene K R, et al. Methods of collection of plant root exudates in relation to plant metabolism and purpose: a review[J]. Journal of Plant Nutrition and Soil Science, 2013, 176(2): 175−199. doi: 10.1002/jpln.201000360
[93] Sokol N W, Kuebbing S E, Karlsen-Ayala E, et al. Evidence for the primacy of living root inputs, not root or shoot litter, in forming soil organic carbon[J]. New Phytologist, 2019, 221(1): 233−246. doi: 10.1111/nph.15361
[94] Dijkstra F A, Zhu B, Cheng W. Root effects on soil organic carbon: a double-edged sword[J]. New Phytologist, 2021, 230(1): 60−65. doi: 10.1111/nph.17082
[95] Calvo O C, Franzaring J, Schmid I, et al. Atmospheric CO2 enrichment and drought stress modify root exudation of barley[J]. Global Change Biology, 2017, 23(3): 1292−1304. doi: 10.1111/gcb.13503
[96] Song J, Wan S, Piao S, et al. A meta-analysis of 1, 119 manipulative experiments on terrestrial carbon-cycling responses to global change[J]. Nature Ecology and Evolution, 2019, 3(9): 1309−1320. doi: 10.1038/s41559-019-0958-3
[97] 周艳翔, 吕茂奎, 谢锦升, 等. 深层土壤有机碳的来源、特征与稳定性[J]. 亚热带资源与环境学报, 2013, 8(1): 48−55. doi: 10.3969/j.issn.1673-7105.2013.01.009 Zhou Y X, Lü M K, Xie J S, et al. Sources, characteristics and stability of organic carbon in deep soil[J]. Journal of Subtropical Resources and Environment, 2013, 8(1): 48−55. doi: 10.3969/j.issn.1673-7105.2013.01.009
[98] Soong J L, Castanha C, Hicks P C E, et al. Five years of whole-soil warming led to loss of subsoil carbon stocks and increased CO2 efflux[J]. Science Advances, 2021, 7(21): eabd1343. doi: 10.1126/sciadv.abd1343
[99] Li J, Pei J, Pendall E, et al. Rising temperature may trigger deep soil carbon loss across forest ecosystems[J]. Advanced Science, 2020, 7(19): 2001242. doi: 10.1002/advs.202001242
[100] Kramer M G, Chadwick O A. Climate-driven thresholds in reactive mineral retention of soil carbon at the global scale[J]. Nature Climate Change, 2018, 8(12): 1104−1108. doi: 10.1038/s41558-018-0341-4
[101] Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450: 277−280. doi: 10.1038/nature06275
[102] Tang J, Riley W J. Weaker soil carbon-climate feedbacks resulting from microbial and abiotic interactions[J]. Nature Climate Change, 2015, 5(1): 56−60. doi: 10.1038/nclimate2438
[103] Opfergelt S. The next generation of climate model should account for the evolution of mineral-organic interactions with permafrost thaw[J]. Environmental Research Letters, 2020, 15(9): 091003. doi: 10.1088/1748-9326/ab9a6d
-
期刊类型引用(23)
1. 栗世博,赖巧巧,屈峰. 森林“四库”研究的热点、前沿和动态. 林业经济问题. 2025(01): 41-51 .  百度学术
百度学术
2. 李子辉,张亚,巴永,陈伟志,董春凤,杨梦娇,文方平. 云南省植被固碳能力与产水、土壤保持服务冷热点识别. 中国环境科学. 2024(02): 1007-1019 .  百度学术
百度学术
3. 傅乐乐,苏建兰,张凯迪. 云南省经济林碳汇测算及其产品开发探析. 现代农业研究. 2024(02): 34-39 .  百度学术
百度学术
4. 丁琦珂,豆浩,张二山,胡传伟,何静. 郑州市园林绿化树种的含碳率分析. 林草资源研究. 2024(01): 95-101 .  百度学术
百度学术
5. 宋立,顾至欣,郭剑英. “双碳”目标下旅游碳排放影响因素变化规律研究. 生态经济. 2024(05): 132-137+188 .  百度学术
百度学术
6. 钟金发,邓佳露,翁志强,林榅荷. 森林“碳库”经济价值实现机制研究. 林业经济问题. 2024(01): 42-50 .  百度学术
百度学术
7. 张洪宇,程振博. 中国森林碳汇效度动态演进及时空演变格局. 天津农林科技. 2024(03): 37-42 .  百度学术
百度学术
8. 叶军,朱妍妍,陈立勇,张露,邢玮,何冬梅. 泰州市森林碳储量现状及碳汇能力分析. 江苏林业科技. 2024(03): 16-21+57 .  百度学术
百度学术
9. 朱诗柔,牟凤云,黄淇,沈祺林. 2000—2030年多级流域尺度下重庆市林地景观格局碳储量变化. 水土保持通报. 2024(03): 356-366 .  百度学术
百度学术
10. 王彩玲. 定西市林业碳汇高质量发展存在的问题及对策. 甘肃科技纵横. 2024(08): 48-54 .  百度学术
百度学术
11. 康嘉怡,何正斌,刘书言,伊松林. 实木家具制造过程能耗及碳排放分析. 家具. 2024(06): 9-14 .  百度学术
百度学术
12. 曲学斌,王雅莹,李丹,赵岳冀,张岚彪. 内蒙古大兴安岭森林固碳能力时空变化及气象因素影响分析. 沙漠与绿洲气象. 2024(06): 117-123 .  百度学术
百度学术
13. 刘蕊婷,马淑娟,张学万,陈飞勇,杜玉凤,徐景涛,王晋. 森林生态系统五大碳库碳储量估算模型及其影响因素研究进展. 林业建设. 2024(06): 11-25 .  百度学术
百度学术
14. 胡勐鸿,李万峰,吕寻. 日本落叶松自由授粉家系选择和无性繁殖利用. 温带林业研究. 2023(01): 7-16 .  百度学术
百度学术
15. 刘艳丽. 森林碳汇计量关键技术应用研究. 林业勘查设计. 2023(02): 86-90 .  百度学术
百度学术
16. 叶家义,付军,陆卫勇,欧军,何斌. 南亚热带13年生大叶栎人工林固碳功能分析. 亚热带农业研究. 2023(01): 38-43 .  百度学术
百度学术
17. 莫少壮,罗星乐,李嘉方,刘凡胜,何斌. 南丹县毛竹人工林生态系统生物量、碳储量及其分配格局. 农业研究与应用. 2023(01): 39-44 .  百度学术
百度学术
18. 肖龙海. 贵州省林业碳汇发展探索与讨论. 现代园艺. 2023(12): 165-167+170 .  百度学术
百度学术
19. 张少博,叶长存,郭帅,吕俊彦,陈烨,颜鹏,李征珍,李鑫. 农林土壤固碳减排技术研究进展及其在茶树栽培中的应用潜力. 中国茶叶. 2023(11): 10-17 .  百度学术
百度学术
20. 张凯迪,苏建兰. 云南省防护林固碳贡献与增汇对策. 林业建设. 2023(06): 37-43 .  百度学术
百度学术
21. 于欢,魏天兴,陈宇轩,沙国良,任康,辛鹏程,郭鑫. 黄土丘陵区典型人工林土壤有机碳储量的分布特征. 北京林业大学学报. 2023(12): 100-107 .  本站查看
本站查看
22. 蔡爽. 森林培育对生态环境建设的影响研究. 造纸装备及材料. 2022(11): 156-158 .  百度学术
百度学术
23. 周亚敏. 全球发展倡议下的中拉气候合作:基础、机遇与挑战. 拉丁美洲研究. 2022(06): 85-99+156-157 .  百度学术
百度学术
其他类型引用(18)



 下载:
下载: