Analysis of odor-active compounds emitted from Eucalyptus grandis × E. urophylla wood
-
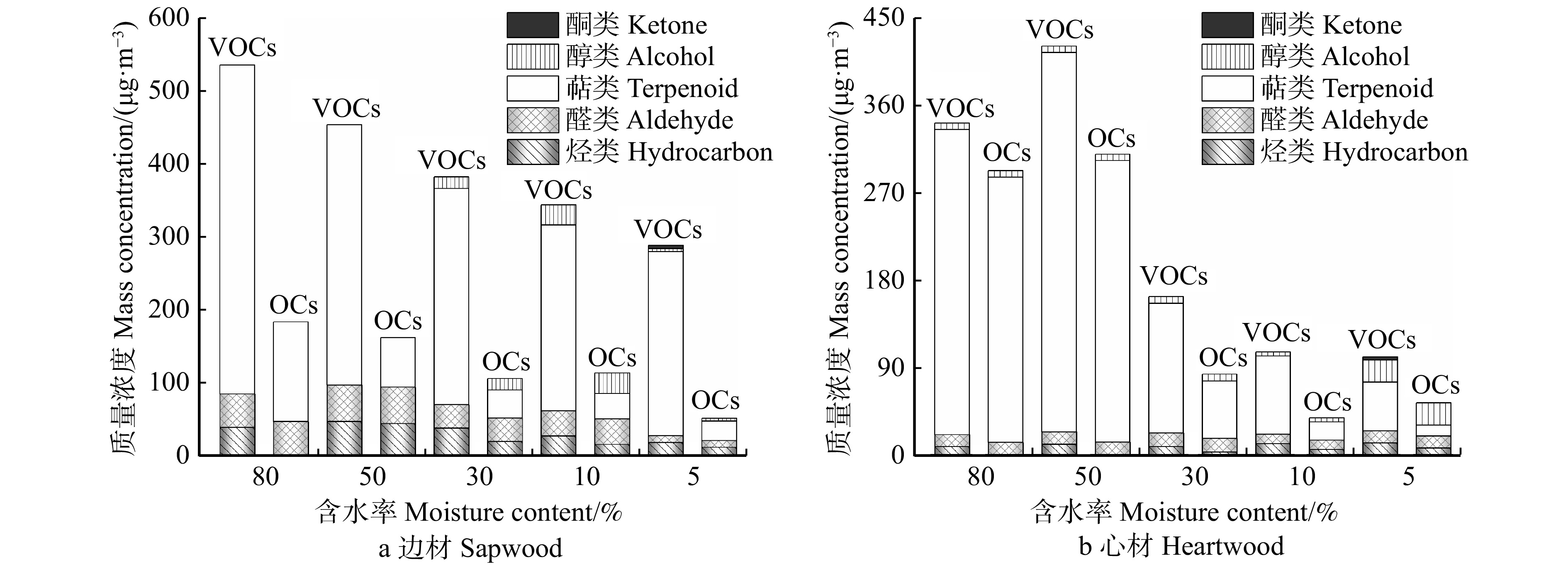
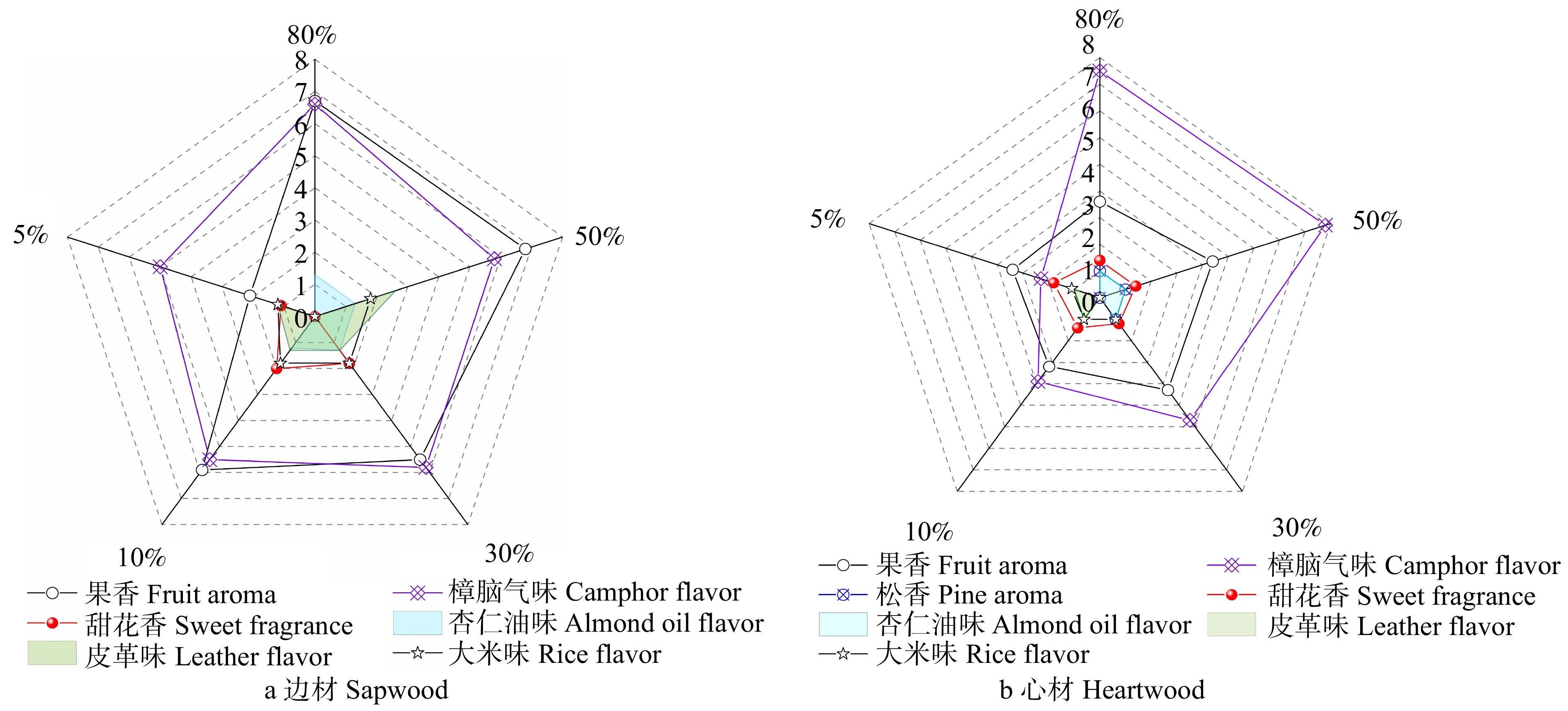
摘要:目的 明确巨尾桉挥发性有机化合物(VOCs)成分和气味特征,阐明其来源和释放机理,为巨尾桉的科学利用提供参考。方法 利用气相色谱–质谱–嗅闻(GC-MS-O)技术,测试不同含水率下巨尾桉心材和边材释放的VOCs成分、气味化合物气味特征和气味强度等指标。结果 巨尾桉共释放41种VOCs,其中13种是气味化合物,桉叶油醇、樟脑、莰烯是巨尾桉释放的主要单体气味化合物,且巨尾桉心材和边材释放的萜类气味物质差异显著,龙脑和γ-松油烯仅存在于巨尾桉心材。木材含水率显著影响巨尾桉气味化合物中萜类、醛类、烃类和醇类等组分的释放,随着含水率的降低,边材气味化合物释放量总体上呈现下降趋势,心材气味化合释放量则表现出先升高后降低的规律;受含水率的影响边材释放物中质量浓度变化显著的组分是萜类和醛类化合物,而心材释放物中变化明显的组分是萜类和醇类。含水率高于30%时,心材气味化合物释放量显著高于边材,含水率10% ~ 30%时则释放量明显低于边材。萜类是构成VOCs和气味化合物的最大组分,释放出樟脑气味和松香味。醛类化合物是第二大组分,主要贡献果香味。樟脑和果香气味是巨尾桉的主要气味特征,甜花香、杏仁油、松香、皮革等气味起修饰作用。随着含水率降低,巨尾桉边材和心材的气味强度呈现先升高后降低的趋势,边材受含水率影响波动幅度最大的气味特征是果香,而心材受影响最大的则是樟脑味。相较于刚采伐的巨尾桉释放出强烈的樟脑味,干燥处理后,樟脑味减弱,与果香相辅相成。结论 巨尾桉释放出了丰富的萜类化合物,可以有助于抗炎杀菌,对人体有保健作用;干燥后木材散发出的气味可以使居住者感到轻松愉悦、精神饱满,适合应用于室内和康复景观中。Abstract:Objective Compositions, odor characteristics, sources and release mechanisms of volatile organic compounds (VOCs) from Eucalyptus grandis × E. urophylla woods were clarified in this paper. It could provide reference for the scientific utilization of wood.Method Chemical components, odor characteristics and odor intensity of VOCs released from heartwood and sapwood with different moisture contents were detected via gas chromatography-mass spectrometry-olfactometry (GC-MS-O).Result In total, 41 substances were successfully identified. Among them, 13 species were odor-active compounds. The main odorants were eucalyptol, camphor and camphene. Terpenoid odorants emitted from sapwood and heartwood were significantly different, such as borneol and γ-terpinen only detected from heartwood. Terpenoids, aldehydes, hydrocarbons and alcohols composing odor-active compounds emitted from E. grandis × E. urophylla woods were dramatically impacted by wood moisture content. With the decrease in moisture content, the total mass concentrations of odor-active compounds released from sapwood decreased in general, while those released from heartwood firstly increased and then decreased. In all the components, the concentrations of terpenoids and aldehydes had significant changes under the influence of sapwood moisture content, and that was terpenoids and alcohols for heartwood. When wood moisture contents were higher than 30%, the amount of odorants from heartwood was significantly higher than sapwood, and it was in the opposite direction at 10%−30% moisture contents. Terpenoids were the most component of odorants, showing smell of camphor and pine aroma. Aldehydes were the second largest component and contributed mainly to fruit flavor. The odour attributes of E. grandis × E. urophylla timber were mainly camphor and fruit aromas, accompanied by sweet fragrance, almond oil aroma, pine aroma, leather aroma and other scents. With the decrease of moisture content, the odor intensity of odorants form sapwood and heartwood increased at first and then decreased. The fruit flavor fluctuated most significantly for sapwood, whereas the camphor flavor was for heartwood when moisture contents were changed. Compared with the fresh eucalyptus with a strong camphor flavor, camphor odor intensity was reduced and together with the fruit flavor after wood drying treatment.Conclusion Abundant terpenoids emitted from E. grandis × E. urophylla woods are beneficial to sterilization, anti-inflammation and health. These odors from well-seasoned wood could make residents feel relaxed and freshened. Therefore, E. grandis × E. urophylla wood is suitable for application in the indoor and rehabilitation landscapes.
-
Keywords:
- Eucalyptus grandis × E. urophylla /
- moisture content /
- sapwood /
- heartwood /
- odor-active compounds /
- odor attribute
-
杨树(Populus spp.)人工林是世界中纬度平原地区集约栽培面积最大的速生用材防护林之一,具有生长快、成林早、易于更新、水分养分需求大等特点。我国杨树天然林面积约300 万 hm2,人工林面积约700 万 hm2,广泛用于三北生态防护林和商业用材林。近地面臭氧(O3)是一种具有强氧化植物毒性的二次污染物,主要由人为源和植物源挥发性有机化合物和氮氧化物等前体物在光照下发生化学反应而生成。“十三五”以来,我国O3污染呈现逐年加重的趋势,年增率达到2.2 ~ 2.4 nmol/mol[1],已成为继PM2.5后困扰我国新的环保难题。高O3污染期常与植物的旺盛生长期(5—9月)重叠,对植物从器官、植株、生态系统方面产生一系列的连锁负效应[2]。树木的叶片和细根都在森林生态系统碳循环和养分(如氮、磷等)循环中起核心作用[3],通过细根分解归还给土壤的碳输入是地上凋落物的2倍以上[4],释放的氮也比地上部分高出18% ~ 45%[5]。目前,针对叶片对O3胁迫的响应研究工作较多[6−7],而细根对O3胁迫响应的研究较缺乏。最新研究发现:细根生物量对O3胁迫的响应比叶敏感[8−9],生物量下降也更明显[9]。除了生物量,植物的光合生理性状、元素含量、非结构性碳水化合物(可溶性糖和淀粉)和次级代谢产物(木质素和单宁)也直接或间接影响着树木的生长发育和对O3胁迫的响应。这些在叶片和细根中关乎树木本身“质量”的化学性状对O3胁迫的响应是否存在差异,成为探讨树木生长和生理生态过程对环境胁迫响应的关键科学问题。
根据不同O3浓度梯度(3个浓度以上)与植物光合性状[10]、解剖性状[11]、生物量[12]等建立剂量响应关系,是定量评价O3对植物伤害的有效方法。目前存在3种剂量−效应关系模型,即线性非阈值胁迫响应模型、阈值胁迫响应模型和应激兴奋胁迫响应模型[13]。线性非阈值胁迫响应模型(线性、无阈值、有剂量就下降)和阈值胁迫响应模型(线性、有毒性阈值、一定剂量累积后下降)是O3的植物风险评估中应用最多的2种模型[10−12,14],即随着O3浓度升高,植物的各尺度性状相比对照(过滤掉O3)均呈现线性下降的格局。最近,Agathokleous等[15−16]发现在植物对O3胁迫的响应关系中还存在一种毒物兴奋效应(hormesis),即O3在低剂量时对植物表现为应激有利作用,如能增加应激性抗性物质、刺激生长发育等,在高剂量时对植物表现为负面影响。这种应激兴奋效应可能源于植物内环境稳定受到破坏后所导致的非特异性超补偿效应,即当O3通过叶片气孔进入到植物体后,生成的活性氧自由基会刺激细胞上调抗氧化物质合成基因的表达,导致合成更多的抗氧化物质,以尽快修复O3胁迫引起的损伤,这被看作是植物体的一种适应性反应机制[15]。随着O3剂量的累积,植物达到自我修复的极限(毒性响应阈值),进入程序性细胞死亡阶段,从之而来的是整个系统的崩溃,表现为植株早衰和死亡。
O3兴奋效应在植物对O3胁迫环境的适应性调控方面具有潜在应用前景[17]。例如:将植物暴露在不超过毒性响应阈值的O3浓度下,让植物启动应激兴奋代谢合成途径,实现自我修复损伤的同时形成上调基因表达路径的“记忆”性反应,从而保护植物在其后的胁迫中免受或少受伤害,即便以后不再遭遇O3胁迫,也有利于植物抵御环境中其他胁迫,如干旱、高温等。兴奋效应产生的反应是非特异性的,在植物应对各种低水平的环境胁迫时都有相近的反应机制[18]。目前对于O3的兴奋效应研究缺乏,一是多数研究只设定单一O3升高浓度,只能得出相比对照树木的生理生化和生物量指标下降的一致结论,无法通过剂量来探讨兴奋效应;二是一些研究虽然设定了4 ~ 5个O3浓度升高梯度,但研究的响应变量多是累积变量(慢变量,如生物量/产量),较难捕捉到O3刺激的兴奋效应现象[12]。本研究选取在北方广泛栽种且对O3胁迫较敏感的杨树(Populus spp.)品种[19],通过杨树快速响应变量(光合生理和化学性状)和慢速响应变量(生物量)在5个O3浓度水平下的响应,提出以下2个假设:(1)叶片和细根性状对O3胁迫的响应可能具有显著差异;(2)快速响应变量比慢速响应变量更易出现O3兴奋效应。本研究旨在找到那些具有O3兴奋效应的性状,为O3污染环境下的植物应对策略提供一定科学指导。
1. 试验区概况与研究方法
1.1 试验区概况
该试验区位于北京市延庆区唐家堡村野外实验与示范基地(116°20′24″E,40°28′12″N),属于北温带半湿润半干旱大陆性季风气候,年降水量500 ~ 700 mm,年均温11 ~ 13 ℃,夏季平均气温22 ~ 25 ℃,年平均日照时数在2 100 ~ 2 700 h之间,全年无霜期190 ~ 200 d。
1.2 试验设计
选用中国林业科学院提供的欧美杨107(Populus euramericana cv. ‘74/76’)扦插苗为试验材料。该杨树品种为三北防护林带等北方人工林的主栽树种。于4月上旬将欧美杨107插条截成15 cm左右的插穗,在清水中浸泡1 d后扦插在容器中进行容器育苗,基质用通常基质的配方(m草炭∶m珍珠岩 = 3∶1)进行配置。等到杨树长势稳定,将长势均匀的杨树幼苗统一移到20 L的圆形花盆中,基质为m草炭∶m当地土壤 = 1∶3。5月将相同基径((6.5 ± 0.8) mm)和株高((38.6 ± 6.7) cm)的幼树移入开顶式气室(OTC),气室为正八面钢化玻璃柱体,高3.0 m,占地12.5 m2,适应10 d后进行O3熏蒸处理。在试验期间,所有树每1 ~ 2 d进行自动滴灌,保持充分一致的土壤含水量。
试验在15个OTC中进行O3熏气,共设置5个O3浓度处理水平:CF(过滤大气, < 40 nmol/mol),NF(环境大气浓度)、NF40(NF + 40 nmol/mol)、NF60(NF + 60 nmol/mol)、NF80(NF + 80 nmol/mol)。每个处理3个OTC重复,每个OTC内6 ~ 8盆树,随机分布。本试验期间各OTC中的O3浓度由美国热电公司49i臭氧分析仪(Model 49i,Thermo Scientific,Franklin,USA)监测,每天熏气时间为10 h(08:00—18:00),霾雨天停止熏气。熏气时间从6月22日—9月24日,持续95 d。在试验持续期间内,5个O3处理的日平均O3浓度分别为(19.2 ± 0.7) nmol/mol、(40.8 ± 0.1) nmol/mol、(67.0 ± 2.9) nmol/mol、(85.7 ± 0.6) nmol/mol和(99.0 ± 0.7) nmol/mol。O3剂量指标AOT40(试验期间小时O3浓度超过40 nmol/mol的累计值)在5个O3处理中对应的值分别为(1.10 ± 0.03) μmol/mol·h、(8.90 ± 0.10) μmol/mol·h、(28.40 ± 2.34) μmol/mol·h、(45.80 ± 0.59) μmol/mol·h和(58.60 ± 0.95) μmol/mol·h。
1.3 指标测定
在9月中旬(生长末期),分别在每个OTC中选择3盆树,于09:30—11:30采集中上部(从顶端数第6 ~ 8片)叶片,用Licor-6400(美国LI-COR公司)测定饱和光合速率和气孔导度。参数设定为:光强1200 μmol/(m2·s),CO2浓度400 μmol/mol,气温控制在环境温度 ± 1 ℃,相对湿度50% ~ 60%。
测定完后进行破坏性取样。每个处理取3盆植物分叶片、茎、根收获。根用清水洗净后分为细根(直径 < 2 mm)和粗根(直径 ≥ 2 mm)。将叶片和细根在105 ℃下杀青15 min后,在65 ℃下烘至恒质量,称量生物量;随后用球磨仪(GT200,Beijing Grinder Instrument Co.,Ltd.,China)把叶片和细根磨成粉末,进行化学含量测定。
碳(C)和氮(N)元素测定采用C-N元素分析仪(Vario EL III,Elementar,Germany)。磷(P)元素测定采用等离子体发射光谱仪(ICP-OES,Prodigy,Leeman,USA)。可溶性糖测定采用高效液相色谱(Waters HPLC2695,Milford,MA,USA)[20],淀粉测定采用高氯酸水解-蒽酮比色法。总非结构性碳水化合物(TNC)为可溶性糖和淀粉的加和。木质素测定采用巯基乙酸法[21]。单宁测定参照Lindroth等[22]。
1.4 数据分析
采用Shapiro-Wilk(W检验)验证数据是否符合正态分布(P > 0.05)。文中数据为平均值 ± 标准误(mean ± SE,n = 3)。采用Turkey’s Honestly Significant Difference(HSD)检验法分析被测指标在不同处理之间的差异。各指标对各个O3暴露水平的响应相对于控制组(CF)的变化定义为响应比(R),计算公式为:
R=μT/μC×100% (1) 式中:
μ 为试验所测定的响应变量(光合生理性状、各器官生物量、化学性状)的值,μ T为每个O3暴露水平下的μ 变量的值,μ C为控制组的μ 变量的值,控制组的响应比为100%,即为参照点。WUE=Pn/Gs (2) 式中:WUE为叶片的水分利用效率,Pn为叶片的饱和光合速率,Gs为气孔导度。
叶片和细根的化学性状含量由各自生物量乘以各化学性状的浓度计算得到。化学性状根叶比由根响应变量含量/叶响应变量含量的比值计算得到。通过Pearson线性相关分析被测指标在叶片和细根的相关性。利用最小二乘回归法评估响应变量与O3暴露剂量的关系,给出最优拟合方程。用非度量多维尺度分析(NMDS)对叶片和细根各O3暴露水平下的化学性状进行分析,检验不同O3暴露水平下的叶片和细根的化学性状是否存在显著差异(PERMANOVA检验,P < 0.05为显著)。运用R软件进行统计分析。
2. 结果与分析
2.1 叶片光合生理性状和生物量的O3剂量响应
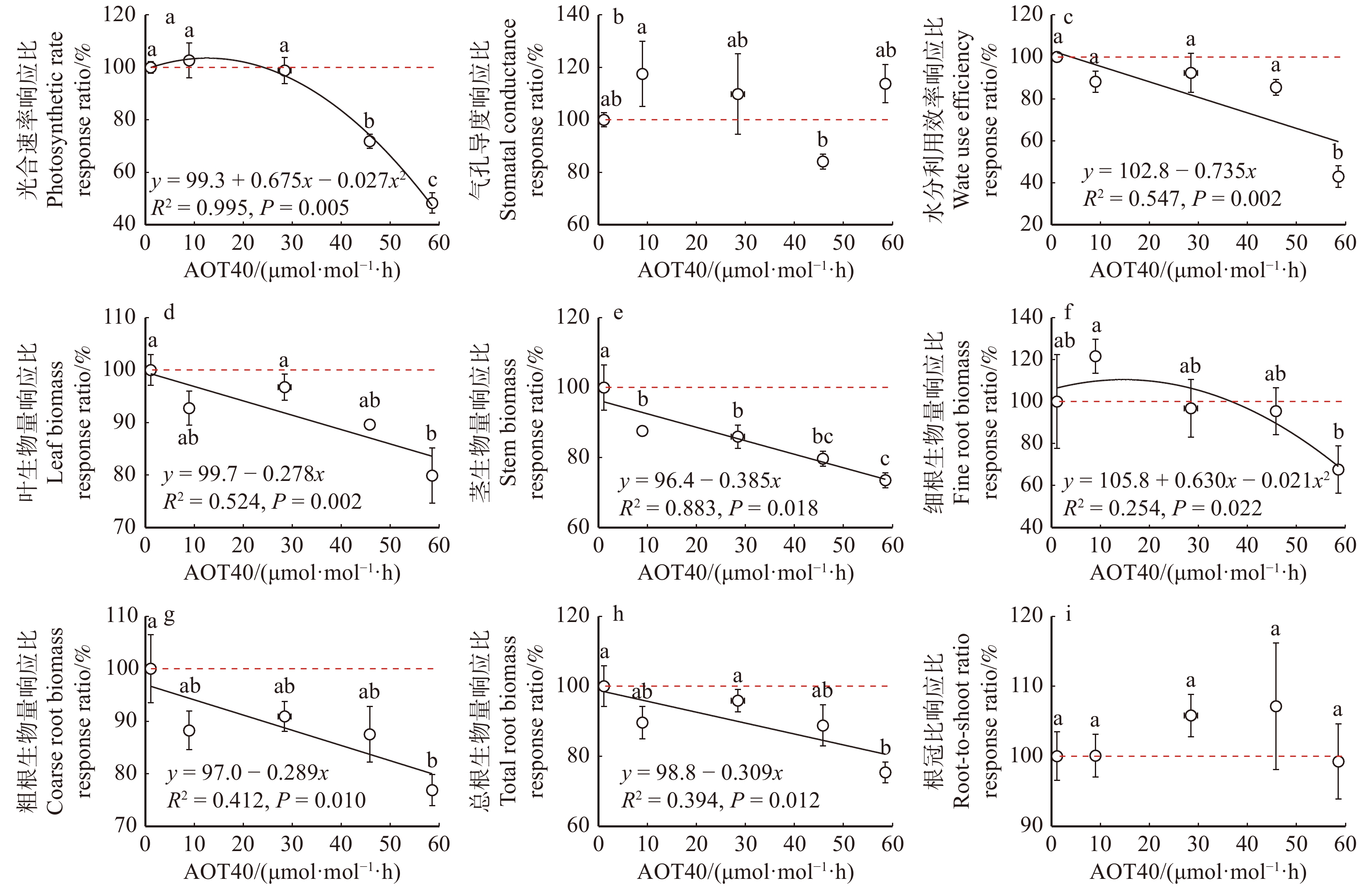
叶片饱和光合速率(图1a)和细根生物量(图1f)沿O3剂量升高梯度呈现先升高后降低的趋势,最优拟合方程为开口向下的二次抛物线。饱和光合速率在23.9 μmol/mol·h O3剂量下出现负响应阈值,细根生物量在37.4 μmol/mol·h O3剂量下出现负响应阈值。与对照(100%响应)相比,水分利用效率(图1c)、叶生物量(图1d)、茎生物量(图1e)、粗根生物量(图1g)和总根生物量(图1h)呈现线性胁迫响应,即沿O3剂量增加显著降低,未出现毒性阈值。气孔导度(图1b)和根冠比(图1i)的O3剂量响应不显著。
![]() 图 1 杨树光合生理特征、生物量积累和分配在5个O3暴露剂量下的响应比AOT40. 试验期间小时O3浓度超过40 nmol/mol的累计值,为O3剂量指标。不同的小写字母表示不同臭氧处理的显著性差异(P < 0.05)。下同。AOT40, the accumulated hourly mean O3 concentration over 40 nmol/mol during fumigation, which is O3-dose index. Lowercase letters indicate significant differences among O3 treatments (P < 0.05). The same below.Figure 1. Response ratios of photosynthetic physiological characteristics, biomass accumulation and distribution of poplar under 5 O3 exposure doses
图 1 杨树光合生理特征、生物量积累和分配在5个O3暴露剂量下的响应比AOT40. 试验期间小时O3浓度超过40 nmol/mol的累计值,为O3剂量指标。不同的小写字母表示不同臭氧处理的显著性差异(P < 0.05)。下同。AOT40, the accumulated hourly mean O3 concentration over 40 nmol/mol during fumigation, which is O3-dose index. Lowercase letters indicate significant differences among O3 treatments (P < 0.05). The same below.Figure 1. Response ratios of photosynthetic physiological characteristics, biomass accumulation and distribution of poplar under 5 O3 exposure doses2.2 叶片和细根的化学性状的O3剂量响应差异
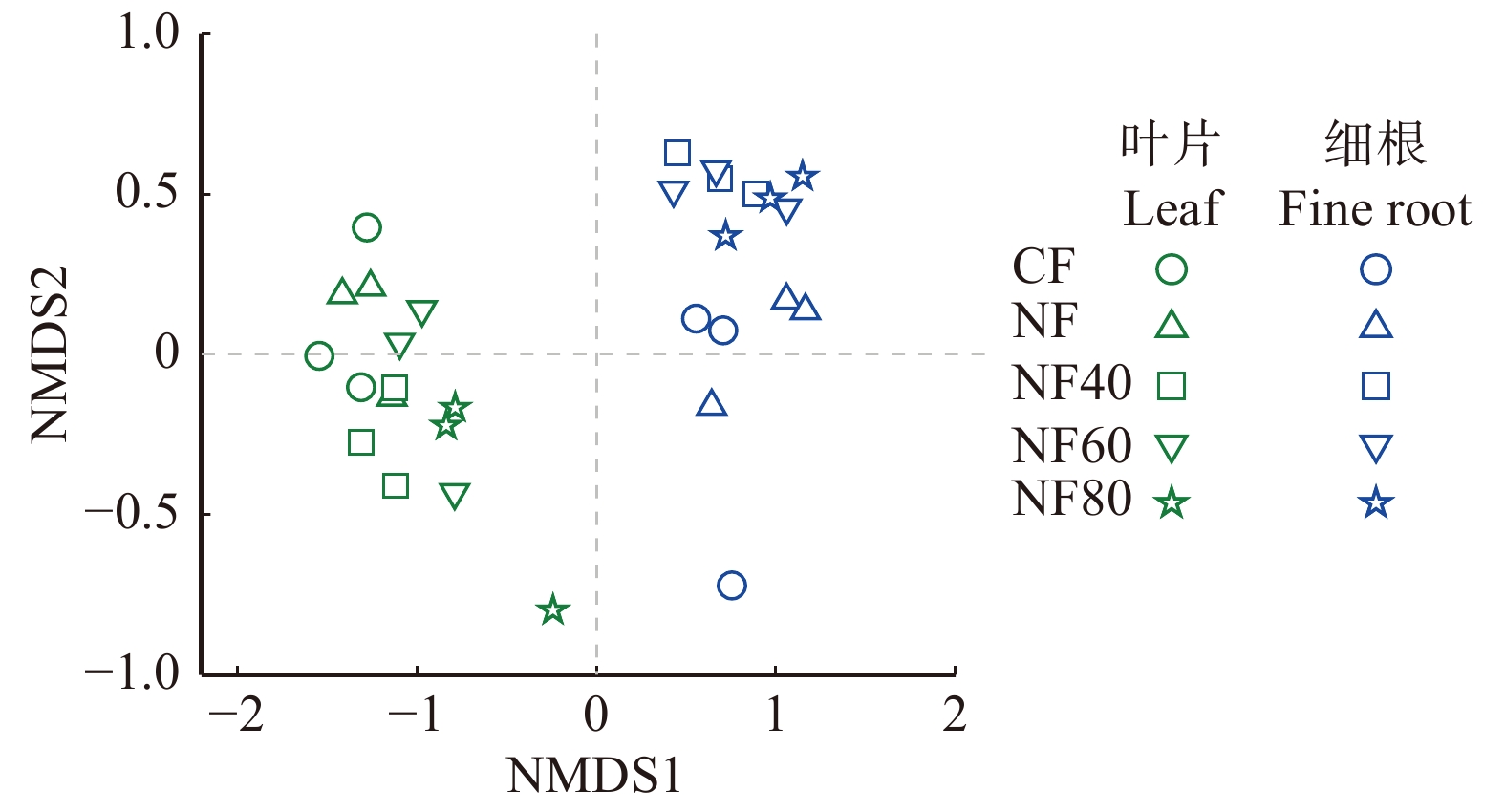
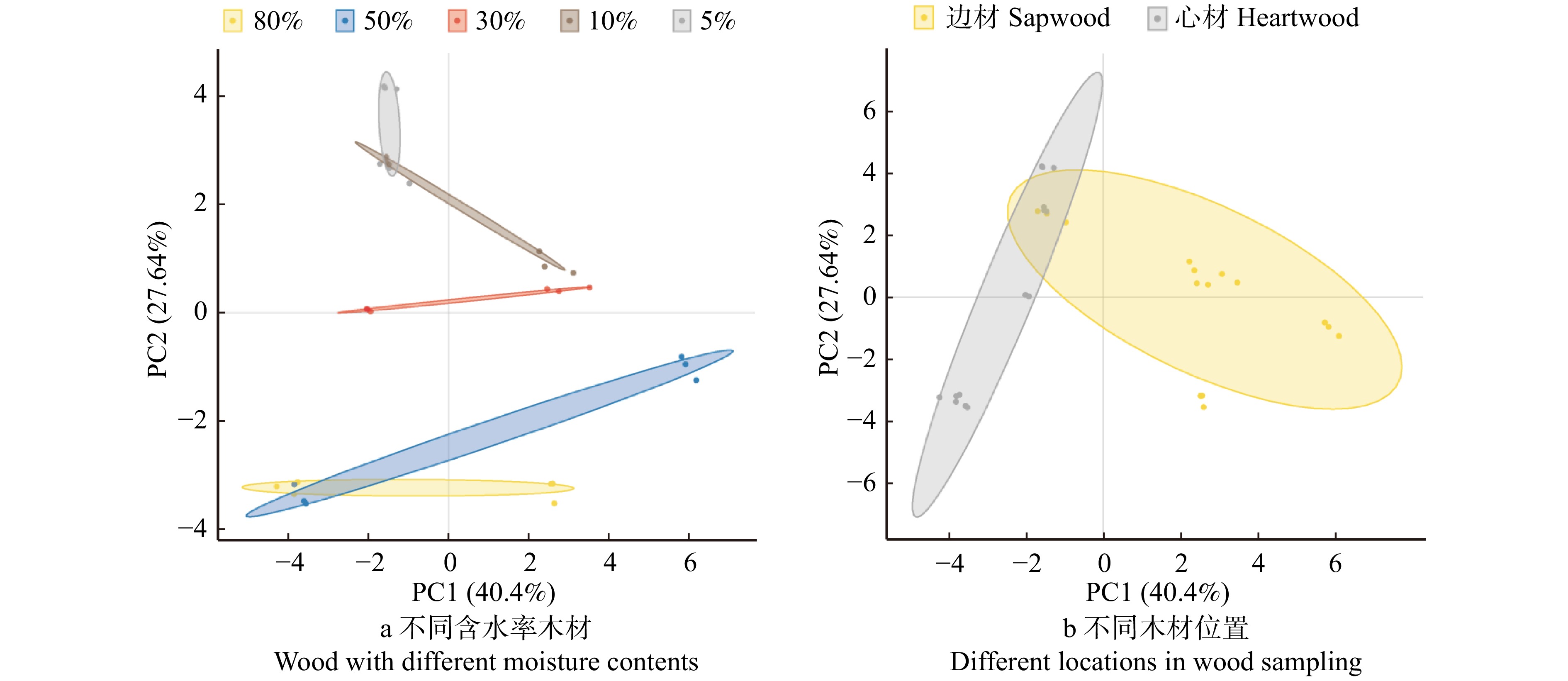
利用NMDS分析5个O3浓度水平下的叶片和细根的所有化学性状发现(图2):叶片和细根的化学性状完全分开(P = 0.001),在叶片或细根内部,各O3浓度水平上的化学性状也具有显著差异(P叶片 = 0.014,P细根 = 0.023)。叶片(表1)和细根(表2)分别的化学性状之间的相关性分析表明:叶片和细根中的木质素∶N都与可溶性糖和TNC显著负相关。细根中的淀粉含量与单宁显著负相关(r =−0.54,P < 0.05,表2),但在叶片中这种相关性不显著(P > 0.05,表1)。叶片中具有显著相关性的化学性状比细根中的多。叶片和细根之间的化学性状之间的相关性中,只有可溶性糖(r = 0.521,P = 0.046)和木质素∶N(r = 0.696,P = 0.004)在叶片和细根之间具有显著正相关,其他化学性状相关性不显著,说明叶片和细根对于O3的响应是解偶联的。
![]() 图 2 杨树叶片和细根的化学性状在5个O3浓度水平的响应差异CF. 过滤大气浓度, < 40 nmol/mol;NF. 环境大气浓度;NF40. NF + 40 nmol/mol;NF60. NF + 60 nmol/mol;NF80. NF + 80 nmol/mol。CF, filtered ambient air concentration, < 40 nmol/mol; NF, ambient air concentration; NF40, NF + 40 nmol/mol; NF60, NF + 60 nmol/mol; NF80. NF + 80 nmol/mol.Figure 2. Response difference of chemical properties of poplar leaves and fine roots at five O3 concentration levels表 1 杨树叶片化学性状之间的相关性Table 1. Pearson’s correlation matrix for chemical traits in poplar leaves
图 2 杨树叶片和细根的化学性状在5个O3浓度水平的响应差异CF. 过滤大气浓度, < 40 nmol/mol;NF. 环境大气浓度;NF40. NF + 40 nmol/mol;NF60. NF + 60 nmol/mol;NF80. NF + 80 nmol/mol。CF, filtered ambient air concentration, < 40 nmol/mol; NF, ambient air concentration; NF40, NF + 40 nmol/mol; NF60, NF + 60 nmol/mol; NF80. NF + 80 nmol/mol.Figure 2. Response difference of chemical properties of poplar leaves and fine roots at five O3 concentration levels表 1 杨树叶片化学性状之间的相关性Table 1. Pearson’s correlation matrix for chemical traits in poplar leaves叶片性状
Leaf traitN P C∶N N∶P C∶P 可溶性糖
Soluble sugar淀粉
StarchTNC 木质素
Lignin木质素∶N
Lignin∶N单宁
TanninC 0.19 0.03 −0.05 0.11 −0.040 0.07 −0.20 −0.14 −0.13 −0.12 0.02 N 0.48 −0.99*** 0.21 −0.777** 0.32 0.01 0.19 −0.33 −0.52* 0.13 P −0.50 −0.76** −0.910*** 0.16 0.27 0.32 −0.02 −0.14 0.02 C∶N −0.18 0.810*** −0.35 −0.08 −0.27 0.36 0.54* −0.14 N∶P 0.440 0.09 −0.29 −0.20 −0.24 −0.24 0.09 C∶P −0.27 −0.23 −0.36 0.19 0.36 −0.08 可溶性糖 Soluble sugar −0.08 0.50 −0.89*** −0.90*** 0.69** 淀粉 Starch 0.82*** −0.01 −0.04 −0.28 TNC −0.52* −0.54* 0.15 木质素 Lignin 0.98*** −0.79*** 木质∶N Lignin∶N −0.73** 注:C. 碳;N. 氮;P. 磷;TNC. 总非结构性碳水化合物;***表示P < 0.001;**表示P < 0.01;*表示P < 0.05。下同。Notes: C, carbon; N, nitrogen; P, phosphorus; TNC, total non-structure carbohydrate; *** indicates P < 0.001; ** indicates P < 0.01; * indicates P < 0.05. The same below. 表 2 杨树细根化学性状之间的相关性Table 2. Pearson’s correlation matrix for chemical traits in poplar fine roots细根性状
Fine root traitC N P C∶N N∶P C∶P 可溶性糖
Soluble sugar淀粉
StarchTNC 木质素
Lignin木质素∶N
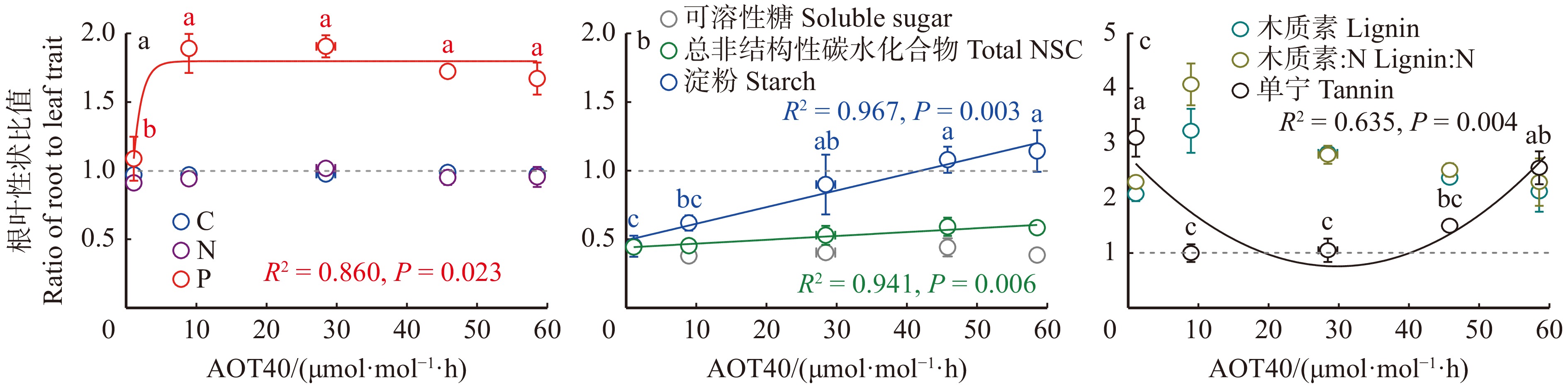
Lignin∶NN −0.32 P 0.26 0.59* C∶N 0.49 −0.98*** −0.50 N∶P −0.41 0.12 −0.95*** −0.17 C∶P −0.35 −0.04 −0.97*** −0.02 0.99*** 可溶性糖 Soluble sugar 0.27 0.37 0.25 −0.30 −0.15 −0.18 淀粉 Starch 0.27 0.18 0.16 −0.10 −0.29 −0.29 0.17 TNC 0.35 0.38 0.27 −0.29 −0.26 −0.29 0.86*** 0.65** 木质素 Lignin −0.33 0.00 0.23 −0.07 −0.19 −0.22 −0.49 −0.10 −0.43 木质∶N Lignin∶N −0.19 −0.36 0.02 0.29 −0.22 −0.20 −0.58* −0.14 −0.53* 0.93*** 单宁 Tannin 0.30 −0.48 −0.16 0.48 −0.03 0.04 −0.23 −0.54* −0.46 −0.27 −0.09 叶片和细根的化学性状沿O3剂量升高梯度呈现不同的响应趋势(图3):对于元素含量及其比值,叶片的C、N和P均未出现显著O3剂量响应(图4a ~ c);细根的C和N未出现显著O3剂量响应,P出现O3兴奋效应现象,即沿O3暴露剂量增加呈现先升高后在32.7 μmol/mol·h O3剂量后降低的趋势(图3a ~ c)。叶片C∶N、N∶P和C∶P均未出现显著O3剂量响应(图3d ~ f);细根C∶N未出现显著O3剂量响应,细根N∶P和C∶P沿O3剂量增加呈现单调下降的响应,未出现O3毒性阈值(图3d ~ f)。对于初级代谢产物,叶片和细根的可溶性糖含量沿O3剂量升高梯度呈现先升高后降低的趋势,最优拟合方程为开口向下的二次抛物线(图3g)。叶片和细根可溶性糖分别在51.6和43.1 μmol/mol·h O3剂量下出现负响应阈值。叶片淀粉和总非结构性碳水化合物含量沿O3剂量增加呈现单调降低的格局,未出现O3毒性阈值(图3h ~ i)。细根淀粉和总非结构性碳水化合物含量均未出现显著O3剂量响应(图3h ~ i)。对于次级代谢产物,叶片和细根的木质素(图3j)和木质素∶N(图3k)沿O3剂量增加均呈现先降低后升高的格局,木质素在叶片和细根中O3剂量的转变阈值分别为24.1和20.5 μmol/mol·h,木质素∶N在叶片和细根中O3剂量的转变阈值分别为23.7和22.9 μmol/mol·h。叶片单宁出现O3兴奋效应现象,沿O3暴露剂量增加呈现先升高后在27.5 μmol/mol·h O3剂量后出现降低趋势;细根单宁对O3剂量的响应不显著(图3l)。
图4显示了化学性状的根叶比沿O3剂量升高梯度的变化趋势。随着O3剂量升高,分配到根中的P含量增加,为分配到叶中P的1.7倍,且P含量随着O3剂量的增加一直维持在相对较高的稳定状态(图4a)。淀粉和总非结构性碳水化合物的根叶比表现为沿O3剂量增加不断增加的趋势(图4b),表明随着O3浓度升高,分配到细根中的淀粉和总非结构性碳水化合物含量增多。单宁的根叶比随着O3剂量增加呈现先降低后升高的趋势(图4c),表明单宁在O3剂量为37.25 μmol/mol·h之前分配到叶片的比例增加,之后分配到细根的比例增加。C、N、可溶性糖、木质素和木质素∶N的根叶比沿O3剂量均无显著变化,说明O3浓度升高未改变这些化学性状在叶片和细根中的分配,即这些化学性状的内稳性较强,并不随环境变化而变化。
3. 结论与讨论
杨树叶片和细根在O3浓度梯度上表现出明显的响应差异(图2、图3),支持假设一。首先,叶片和细根本身的生物理化特征就存在很大差异[4]。叶片N含量比细根大,可溶性糖和淀粉含量比细根高3 ~ 4倍之多[20];而木质素和单宁含量比细根少2 ~ 3倍[4]。其次,叶片是O3伤害的第一攻击位点,O3对叶片光合系统、抗氧化系统和代谢路径可造成直接伤害,而O3通过影响光合作用以及碳氮代谢间接影响细根的数量和质量[23]。尽管如此,最近研究发现:细根是植物响应环境变化最为敏感的器官[24],细根生物量对O3响应的敏感性要大于地上部分[9,25]。本研究发现:细根生物量沿着O3浓度梯度呈现先升高后降低的趋势,直到37.4 μmol/mol·h O3剂量时出现负响应;表明低浓度O3能促进细根生长,这与欧洲赤松(Pinus sylvestris)中2年的低浓度O3熏蒸增加了总短根数和鲜质量的结论一致[26],原因可能是由于低浓度O3也刺激了菌根真菌的侵染[26],细根与菌根真菌的互作使得细根生物量出现增加的格局。而叶、茎、粗根和总根生物量呈现沿O3剂量增加单调递减的趋势,与前人的研究结果一致[8,10,12,14],同时也支持了细根生物量对O3的响应更敏感的结论。
杨树叶片单宁和细根P含量对O3胁迫的响应出现显著毒物兴奋效应,支持假设二。在负响应O3阈值之前,这些响应性状都表现为对O3浓度升高的应激兴奋(增加)响应,这可能源于杨树在O3胁迫下内环境受到破坏后所导致的非特异性超补偿效应[15],即O3诱导植物生成更多的活性氧自由基,刺激了细胞上调抗氧化物质合成基因的表达,导致合成更多的抗氧化物质,用以尽快修复O3胁迫引起的损伤,这是植物体的一种适应性反应机制[15]。当O3胁迫剂量超过负响应O3阈值,即O3剂量的累积超过植物自我修复极限,此时杨树表现为光合系统、抗氧化系统和生长的全面崩溃状态,即程序性细胞死亡、生理代谢缓慢、物质合成衰减、植株早衰和死亡。植物在面对其他环境胁迫(如SO2、NOx、冷害、高温、干旱等)时,也会出现类似的兴奋效应,即低剂量兴奋、高剂量抑制的现象[15−17]。除了植物,在其他生物(动物和微生物)和各类生命现象(生殖、生长和代谢等)中都发现了毒性兴奋效应现象,显示了毒性兴奋效应的普遍性[27]。利用生物体稳态受到环境破坏后能够迅速恢复的能力,将环境污染物的浓度控制在毒性响应阈值内,可以有助于生态系统维持在比对照条件更佳的状态[13]。当前,降低地表O3污染成为环保界的新难题,通过毒物兴奋效应得出的某一类生物的毒性响应阈值所对应的O3浓度,可以作为O3减排的目标。利用生态系统具有的弹性和自适应的特性,既为减排标准的制定提供了一定的弹性空间,也降低了减排的成本。杨树叶片饱和光合速率、可溶性糖以及细根可溶性糖虽然也观察到先升后降的趋势和负响应O3阈值,但并未通过显著性检验(P < 0.05),不能说明出现显著兴奋效应,不支持假设二。可能是由于样本量少和树种单一的原因。后续的研究需增加树种和样本量来验证是否出现显著兴奋效应。
杨树叶片和细根的C和N含量未出现显著O3剂量响应,可能与其固有抗逆性内稳态相关。植株体内较高C、N含量有利于提高植株的防御和修复功能,提高对O3胁迫的适应能力[28−29]。细根P含量在本研究设定的O3剂量(58.6 μmol/mol·h)内一直呈现刺激效应,即各O3处理的值都大于对照值,在70.3 μmol/mol·h O3剂量(超过本研究设定剂量)才表现为比对照降低的趋势,表明细根P含量在O3胁迫下持续升高可能是植物抵御胁迫的一种策略。并且P元素的根叶比沿O3剂量增加也呈现持续上升趋势,表明O3污染环境下植物的养分分配策略通过增加细根中的元素含量(特别是P元素)来应对O3胁迫。植物为适应O3胁迫环境,需要产生更多rRNA合成相关蛋白,而rRNA是植物1个主要的P库[30]。Shafer[31]发现:具有磷酸酶活性的细菌量随O3浓度升高而线性增加,可能是导致细根P含量增加的原因之一。非结构性碳水化合物能快速响应环境变化,是重要的渗透调节物质和适应环境的信号物质[32]。本研究叶片和细根的可溶性糖均出现先升后降的趋势,这与芒果(Mangifera indica)[33]和银杏(Ginkgo biloba)[34]中可溶性糖含量在低浓度O3胁迫下增加、在高浓度O3下降低是一致的。可溶性糖含量在毒性响应阈值之前出现升高,可能是植物为了适应渗透胁迫主动积累一定的可溶性糖用于降低渗透势,从而能适应外界环境胁迫;而在阈值之后的显著降低可能是由于分解酶的累积增加加速了糖分的分解[35]。
杨树叶片和细根的木质素和木质素:N沿O3剂量增加均呈现先降低后升高的趋势,O3剂量的转变阈值在叶片中为23.7 ~ 24.1 μmol/mol·h,在细根中为20.5 ~ 22.9 μmol/mol·h,表明细根对环境变化的响应更敏感[9,25-26]。木质素增加可以加固细胞壁,形成结构屏障,从而抵御环境胁迫;O3胁迫可能刺激了苯丙氨酸解氨酶、过氧化物酶和多酚氧化酶等木质素合成相关酶的活性,导致木质素含量的增加。单宁作为植物处于逆境胁迫后调节自身代谢的一类重要的防御类次生产物,可提高植物自身的适应能力和对外界环境胁迫的抗性[36]。本研究发现沿O3浓度梯度细根单宁含量变化不显著,而叶片单宁出现O3兴奋效应现象,沿O3暴露剂量增加一直处于刺激状态,直至超过本试验设定的最大O3剂量(59.2 μmol/mol·h)时,才出现负响应阈值。基于2个O3浓度梯度,前人研究[34, 37-39]得出O3浓度升高可促进树木叶片单宁含量增加或没有影响的不同结论。这可能是由于单宁含量的增加有助于提高植物叶片的抗氧化能力,但O3浓度过高时叶片早衰严重,自由基大量产生导致抗氧化物质大量消耗,从而单宁含量下降。
本研究发现杨树叶片和细根的一些功能性状出现不同程度的毒性兴奋效应(hormesis),即O3在低剂量时表现为刺激增加效应,在高剂量时表现为毒性降低效应,并出现1个O3剂量的负响应阈值。这就解释了以前研究的结论中O3胁迫对不同响应变量的影响或者增加、或者降低、或者无影响,因为绝大多数试验都只是设定1 ~ 2个O3浓度升高浓度,若设定的O3熏蒸试验浓度在毒性负响应阈值之前,则可能出现响应变量增加或不变的结果;若设定的O3浓度在毒性负响应阈值之后,则得出普遍的O3抑制的结果。比如:只设定1个升高O3浓度(55 nmol/mol)对北美白桦(Betula papyrifera)进行为期5个月的熏蒸试验,叶片中N、可溶性糖、木质素、木质素∶N和单宁与对照相比均未发生显著变化[40]。本研究发现,O3剂量达到51.6和43.1 μmol/mol·h时,叶片和细根的可溶性糖含量才分别降低,在这剂量之前,都是刺激可溶性糖含量增加,这也解释了在李品等[20]研究中观察到可溶性糖在叶片和细根中相比对照都分别显著增加了5.6%和6.9%,因为此研究设定的O3升高浓度在O3剂量的负响应阈值之前。鉴于生物体对环境胁迫的响应具有兴奋效应现象的普遍性,在进行控制试验时,传统的2个处理(对照组 + 升高/降低处理组)观察到的结果可能只是生物响应的局部观,无法全面揭示生物与环境之间互作的机制。未来的研究应设定梯度( > 5个)试验,来解开目前试验结果多样化的原因,也能发现毒物响应的负效应阈值,来探讨生态系统弹性与环境容量的关系。此外,杨树作为我国城市森林的主要优势树种,是植源性挥发性有机化合物(主要是异戊二烯)的重要排放源[19],能促进O3生成和城市空气污染。O3浓度升高反过来会抑制杨树异戊二烯的合成[41]。因此,筛选植源性挥发性有机化合物排放量低的树种来构建绿色基础设施对于缓解城市O3污染也是未来研究的关注点。
-
表 1 不同含水率下巨尾桉边材和心材释放的有机化合物(VOCs)
Table 1 Volatile organic compounds (VOCs) emitted from Eucalyptus grandis × E. urophylla sapwood and heartwood with different moisture contents
化合物分类
Classification of compounds心材和边材共有化合物
Common compounds from heartwood and sapwood边材特有化合物
Characteristic compounds from sapwood心材特有化合物
Characteristic compounds from heartwood萜类
Terpenoidα-蒎烯 α-pinene、莰烯 Camphene、α-水芹烯 α-phellandrene、β-松油烯 β-terpinene、α-月桂烯 α-myrcene、3-蒈烯3-carene、D-柠檬烯 D-limonene、δ-榄香烯 δ-elemene、古巴烯 Copaene、β-榄香烯 β-elemene、石竹烯 Caryophyllene、α-香柠檬烯 trans-α-bergamotene、α-古芸烯 α-gurjunene、花柏烯 Chamigren、异喇叭烯 Isoledene、桉叶油醇 Eucalyptol、樟脑 Camphor、4-萜品醇4-terpineol、α-松油醇 α-terpineol α-毕澄茄油烯 α-cubebene、
α-愈创木烯 α-guaiene、
α-雪松烯 α-himachalene、
α-檀香烯 α-santalene、
柏木烯 Cedrene、
α-橄榄烯 α-maaliene、
α-律草烯 α-humuleneγ-松油烯 γ-terpinen、
龙脑 Borneol醛类
Aldehyde己醛 Hexanal、辛醛 Octanal、苯甲醛 Benzaldehyde、壬醛 Nonanal、
癸醛 Decanal烃类
Hydrocarbon3-甲基-2-庚烯 3-methyl-2-heptene、1-甲基-2-(1-甲基乙基)-苯
1-methyl-2-(1-methylethyl)-benzene、1-亚甲基-1H-茚
1-methylene-1H-indene、十四烷 Tetradecane3,4-二甲基-2-戊烯
3,4-dimethyl-2-pentene3-甲基-3-庚烯
3-methyl-3-heptene醇类 Alcohol 2-乙基-1-己醇 2-ethyl-1-hexanol 酮类 Ketone 苯乙酮 Acetophenone 表 2 不同含水率下巨尾桉边材和心材释放的气味物质
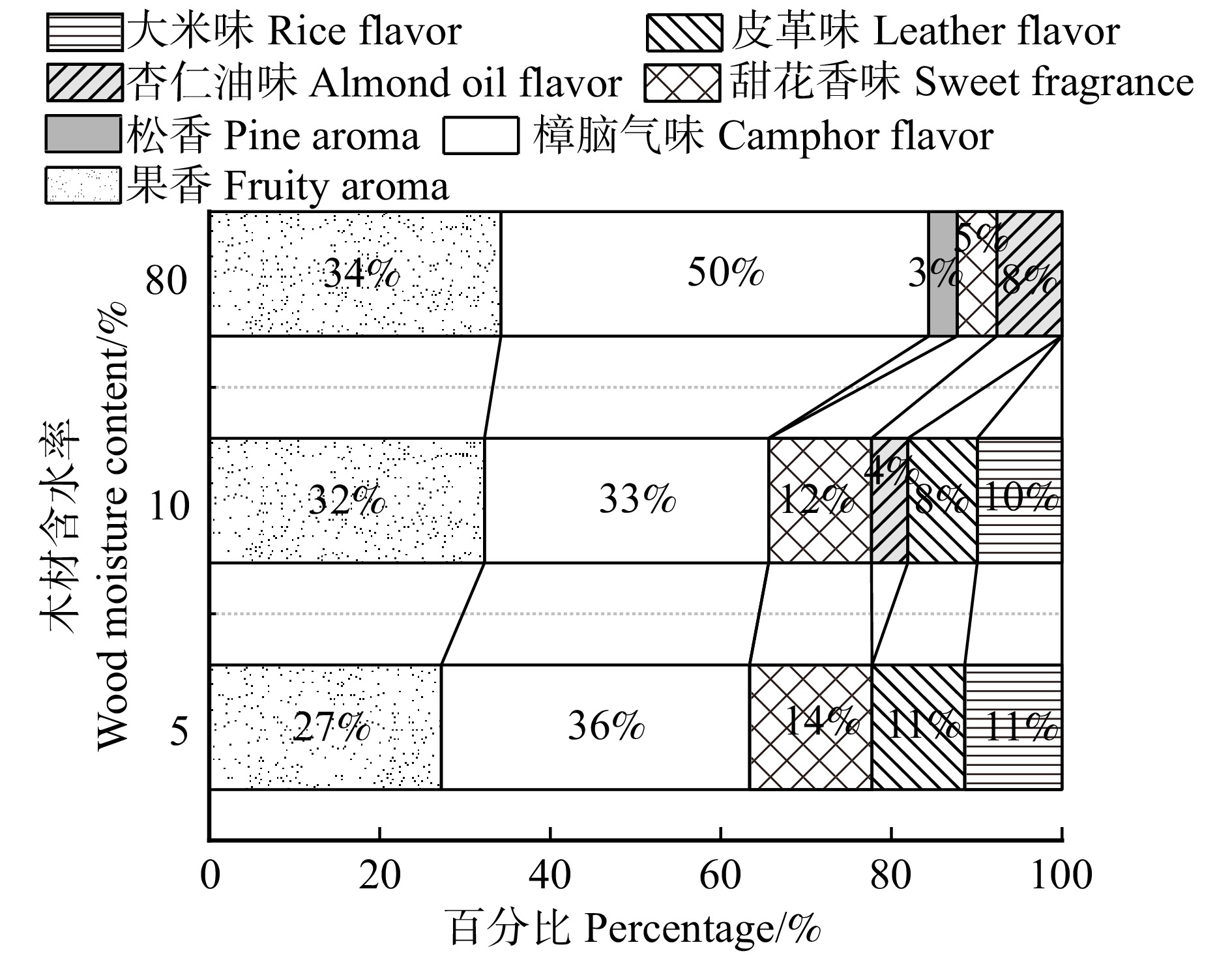
Table 2 Odor compounds from E. grandis × E. urophylla sapwood and heartwood with different moisture contents
化合物名称
Compound name气味描述
Odor description不同含水率下边材释放气味化合物
Odor compounds from sapwood with
different moisture contents不同含水率下心材释放气味化合物
Odor compounds from heartwood with
different moisture contents质量浓度
Mass concentration/(μg·m−3)气味强度
Odor intensity质量浓度
Mass concentration/(μg·m−3)气味强度
Odor intensity80% 50% 30% 10% 5% 80% 50% 30% 10% 5% 80% 50% 30% 10% 5% 80% 50% 30% 10% 5% 1-亚甲基-1H-茚
1-methylene-1H-indene大米味
Rice flavor− 10.97 9.88 7.62 4.67 − 1.8 1.8 1.8 1.2 − − 2.58 2.19 3.83 − − 1.0 1.0 1.1 十四烷
Tetradecane皮革味
Leather flavor− 32.23 8.58 7.04 5.88 − 2.6 1.3 1.3 1.2 − − − 2.87 2.73 − − − 1.0 1.0 己醛
Hexanal青草果香
Aroma of grass and fruity10.49 15.97 8.31 9.32 − 2.0 2.2 1.8 2.0 − 3.53 2.38 3.09 − − 1.2 1.0 1.2 − − 辛醛
Octanal果香酸味
Fruit and acidity flavor9.44 4.48 1.99 4.34 − 2.0 1.3 1.0 1.3 − − 2.21 2.85 2.95 3.09 − 1.0 1.0 1.2 1.4 苯甲醛
Benzaldehyde杏仁油味
Almond oil flavor9.45 7.72 6.97 6.64 − 1.3 1.3 1.3 1.2 − 2.53 2.52 2.79 2.24 3.53 1.0 1.0 1.0 1.0 1.0 壬醛
Nonanal果香酸味
Fruit and acidity flavor9.56 14.06 8.18 7.58 4.39 1.5 1.8 1.5 1.1 1.1 3.34 3.10 2.81 2.26 3.11 1.2 1.2 1.0 1.0 1.0 癸醛
Decanal柑橘
Citrus6.94 8.08 6.89 6.98 4.97 1.2 1.5 1.2 1.5 1.0 3.02 2.50 2.49 2.20 2.91 1.2 1.2 1.1 1.0 1.0 莰烯
Camphene薄荷,酸刺激
Mint, pungent10.03 5.97 7.26 4.52 3.22 1.8 1.6 1.8 1.5 1.2 2.88 4.64 2.71 2.02 − 1.2 1.4 1.2 1.0 − γ-松油烯
γ-terpinen松香
Pine aroma− − − − − − − − − − 2.76 3.55 2.59 − − 1.0 1.0 1.0 − − 桉叶油醇
Eucalyptol樟脑
Camphor88.69 49.89 17.22 15.60 10.99 1.8 1.4 1.2 1.2 1.0 201.15 230.69 36.55 10.40 6.93 3.0 3.3 1.5 1.4 1.0 樟脑
Camphor樟脑
Camphor38.41 11.98 13.90 15.09 12.35 3.0 2.8 2.8 2.8 2.8 64.22 49.08 17.30 6.65 4.24 3.3 3.1 3.0 1.5 1.3 龙脑
Borneol樟脑
Camphor− − − − − − − − − − 2.54 2.25 − − − 1.0 1.0 − − − 2-乙基-1-己醇
2-ethyl-1-hexanol甜花香味
Sweet fragrance flavor0.00 0.00 15.94 28.00 3.92 0.0 0.0 1.8 2.0 1.1 6.52 6.72 6.96 4.04 22.78 1.4 1.4 1.2 1.4 1.8 -
[1] 唐凤鸾, 陈月圆, 赵健, 等. 不同树龄巨尾桉叶片挥发物及水提物的化感作用[J]. 贵州农业科学, 2019, 47(4): 8−12. Tang F L, Chen Y Y, Zhao J, et al. Allelopathy analysis on leaves volatiles and aqueous extract of E. grandis × E. urophylla with different age[J]. Guizhou Agricultural Sciences, 2019, 47(4): 8−12.
[2] 谢耀坚. 我国木材安全形势分析及桉树的贡献[J]. 桉树科技, 2018, 35(4): 3−6. Xie Y J. Analysis of China’s wood resource security and the contributions of Eucalyptus plantation[J]. Eucalypt Science & Technology, 2018, 35(4): 3−6.
[3] 唐启恒, 陈勇平. 国内外人工林桉树木材加工利用现状和展望[J]. 中国人造板, 2020, 27(6): 18−21. Tang Q H, Chen Y P. Status quo and prospect of wood processing and utilization of eucalyptus in China and abroad[J]. China Wood-based Panels, 2020, 27(6): 18−21.
[4] 郭芳钰, 由士权, 李萌, 等. 桉树提取物在化妆品中的应用[J]. 湖北农业科学, 2019, 58(增刊1): 15−17. Guo F Y, You S Q, Li M, et al. Application of eucalyptus extract in cosmetics[J]. Hubei Agricultural Sciences, 2019, 58(Suppl.1): 15−17.
[5] 祝一鸣. 桉树挥发油成分分析及其对青枯病菌抑制作用研究[D]. 广州: 华南农业大学, 2016. Zhu Y M. Anti-Ralstonia solanacearum (Smith) Yabuuchi activity and chemical analysis of common Eucalyptus species volatile oil in Guangdong Province[D]. Guangzhou: South China Agricultural University, 2016.
[6] 暴玮, 张闻杨, 马丽, 等. 巨尾桉果实的挥发油和脂肪酸成分的提取和分析[J]. 广西大学学报(自然科学版), 2019, 44(5): 1435−1441. Bao W, Zhang W Y, Ma L, et al. Extract and analysis of volatile constituents and fatty acid in the fruits of E. grandis × E. urophylla[J]. Journal of Guangxi University (Natural Science Edition), 2019, 44(5): 1435−1441.
[7] 武波晓, 王军民, 万辉, 等. 桉木刨花板 VOCs 的顶空固相微萃取条件优化[J]. 西南林业大学学报, 2022, 42(6): 1−9. Wu B X, Wang J M, Wan H, et al. Optimization of headspace solid-phase microextraction of VOCs in Eucalyptus particleboard[J]. Journal of Southwest Forestry University, 2022, 42(6): 1−9.
[8] Wang W D, Shen X W, Zhang S Q, et al. Research on very volatile organic compounds and odors from veneered medium density fiberboard coated with water-based lacquers[J]. Molecules, 2022, 27: 3626. doi: 10.3390/molecules27113626
[9] Wang Q F, Shen J, Shen X W, et al. Volatile organic compounds and odor emissions from alkyd resin enamel-coated particleboard[J]. BioResources, 2018, 13(3): 6837−6849. doi: 10.15376/biores.13.3.6837-6849
[10] Wang Q F, Shen J, Shao Y L, et al. Volatile organic compounds and odor emissions from veneered particleboards coated with water-based lacquer detected by gas chromatography-mass spectrometry/olfactometry[J]. European Journal of Wood and Wood Products, 2019, 77(5): 771−781. doi: 10.1007/s00107-019-01427-6
[11] 曾彬, 沈隽, 王启繁, 等. 不同含水率阴香木气味释放分析[J]. 林业科学, 2021, 57(4): 133−141. Zeng B, Shen J, Wang Q F, et al. Analysis of odorants in Cinnamomum burmannii wood with different moisture contents[J]. Scientia Silvae Sinicae, 2021, 57(4): 133−141.
[12] Ministry of the Environment. Offensive odor control law: Law No. 91[S]. Tokyo: Government of Japan, 1971.
[13] 李奥欣. 桉树和柳枝稷除草活性成分的分析鉴定及除草活性评价[D]. 北京: 北京化工大学, 2020. Li A X. Analysis, identification, and herbicidal activity evaluation of herbicidal compounds from the Eucalyptus and Panicum virgatum[D]. Beijing: Beijing University of Chemical Technology, 2020.
[14] Wang Q F, Shen J, Wang H Y, et al. Determination of odor-active compounds from Phoebe neurantha (Hemsl.) Gamble and Osmanthus fragrans (Thunb.) Lour. by GC-MS/O and micro-chamber combined with Tenax TA and multi-bed tubes[J]. Wood Science and Technology, 2021, 55(4): 1135−1151. doi: 10.1007/s00226-021-01268-8
[15] Ghadiriasli R, Wagenstaller M, Buettner A. Identification of odorous compounds in oak wood using odor extract dilution analysis and two-dimensional gas chromatography-mass spectrometry/olfactometry[J]. Analytical and Bioanalytical Chemistry, 2018, 410(25): 6595−6607. doi: 10.1007/s00216-018-1264-7
[16] 李昱, 宫静雯, 费程浩, 等. 快速气相电子鼻结合人工神经网络对3种五味子饮片快速识别及气味差异标志物研究[J]. 中草药, 2022, 53(5): 1303−1312. Li Y, Gong J W, Fei C H, et al. Flash GC e-nose combined artificial neural network for rapid identification and odor differential markers of three kinds of Schisandrae chinensis Fructus pieces[J]. Chinese Traditional and Herbal Drugs, 2022, 53(5): 1303−1312.
[17] Schreiner L, Bauer P, Buettner A. Resolving the smell of wood-identification of odor-active compounds in Scots pine (Pinus sylvestris L.)[J]. Scientific Reports, 2018, 8(1): 8294. doi: 10.1038/s41598-018-26626-8
[18] 庞雪威, 王积武, 吴志莲, 等. 植物性食品原料中单萜类化合物形成机理及生物活性综述[J]. 中国酿造, 2016, 35(6): 24−29. Pang X W, Wang J W, Wu Z L, et al. Review of formation mechanism and physiological activity of monoterpenes compounds in edible plants[J]. China Brewing, 2016, 35(6): 24−29.
[19] Wang Q F, Shen J, Zeng B, et al. Identification and analysis of odor-active compounds from Choerospondias axillaris (Roxb.) Burtt et Hill with different moisture content levels and lacquer treatments[J]. Scientific Reports, 2020, 10(1): 14856. doi: 10.1038/s41598-020-71698-0
[20] 朱建才. 花果类香气成分协同作用研究[D]. 无锡: 江南大学, 2020. Zhu J C. Study on the synergism of aroma compounds in flowers and fruits[D]. Wuxi: Jiangnan University, 2020.
[21] 谯正林, 胡慧贞, 鄢波, 等. 花香挥发性苯/苯丙素类化合物的生物合成及基因调控研究进展[J]. 园艺学报, 2021, 48(9): 1815−1826. Qiao Z L, Hu H Z, Yan B, et al. Advances of researches on biosynthesis and regulation of floral volatile benzenoids/ phenylpropanoids[J]. Acta Horticulturae Sinica, 2021, 48(9): 1815−1826.
[22] Baldwin I T. Plant volatiles[J]. Current Biology, 2010, 20(9): 392−397. doi: 10.1016/j.cub.2010.02.052
[23] 谢小洋, 冯永忠, 王得祥, 等. 5种园林树木挥发性成分分析[J]. 西北农林科技大学学报(自然科学版), 2016, 44(7): 146−153. Xie X Y, Feng Y Z, Wang D X, et al. Composition of volatile organic compounds from five landscape trees[J]. Journal of Northwest A&F University (Natural Science Edition), 2016, 44(7): 146−153.
[24] 胥瑞婷, 马音, 朱炜炜. 榄香烯抗肿瘤作用的机制研究现状[J]. 西部中医药, 2022, 35(5): 152−156. Xu R T, Ma Y, Zhu W W. Current state of anti-tumor mechanism of elemene[J]. Western Journal of Traditional Chinese Medicine, 2022, 35(5): 152−156.
[25] 田雪, 赵丽君, 莫晓慧, 等. (+)-4-萜品醇对蜡样芽孢杆菌混菌生物膜的清除及与微酸性电解水协同作用研究[J]. 中国调味品, 2022, 47(4): 14−20. Tian X, Zhao L J, Mo X H, et al. Removal of mixed biofilms of Bacillus cereus by (+)-4-terpineol and its synergistic effect with slightly acidic electrolytic water[J]. China Condiment, 2022, 47(4): 14−20.
[26] Dong H J, Jiang L Q, Shen J, et al. Identification and analysis of odor-active substances from PVC-overlaid MDF[J]. Environmental Science and Pollution Research, 2019, 26(20): 20769−20779. doi: 10.1007/s11356-019-05263-2
[27] 李赵京, 沈隽, 蒋利群, 等. 三聚氰胺浸渍纸贴面中纤板气味释放分析[J]. 北京林业大学学报, 2018, 40(12): 117−123. Li Z J, Shen J, Jiang L Q, et al. Odor emission analysis of melamine faced MDF[J]. Journal of Beijing Forestry University, 2018, 40(12): 117−123.
[28] Wang Q F, Shen J, Zeng B, et al. Effects of environmental conditions on the emission and odor-active compounds from Fraxinus mandshurica Rupr.[J]. Environment Science and Pollution Research, 2022, 29(20): 30459−30469. doi: 10.1007/s11356-021-18244-1
[29] 王娟, 杜静怡, 贾雪颖, 等. 花椒精油及其水提物的香气活性成分分析[J]. 食品工业科技, 2021, 42(20): 229−241. Wang J, Du J Y, Jia X Y, et al. Characterization of the aroma-active compounds in essential oil and water extract of Zanthoxylum bungeanum pericarp[J]. Science and Technology of Food Industry, 2021, 42(20): 229−241.
[30] Feussner I, Wasternack C. The lipoxygenase pathway[J]. Annual Review of Plant Biology, 2002, 53(1): 275−297. doi: 10.1146/annurev.arplant.53.100301.135248
[31] Gigot C, Ongena M, Fauconnier M L, et al. The lipoxygenase metabolic pathway in plants: potential for industrial production of natural green leaf volatiles[J]. Biotechnology, Agronomy, Society and Environment, 2010, 14(3): 451−460.
[32] 王哲, 王喜明. 木材多尺度孔隙结构及表征方法研究进展[J]. 林业科学, 2014, 50(10): 123−133. Wang Z, Wang X M. Research progress of multi-scale pore structure and characterization methods of wood[J]. Scientia Silvae Sinicae, 2014, 50(10): 123−133.
[33] 苗平. 马尾松木材高温干燥的水分迁移和热量传递[D]. 南京: 南京林业大学, 2000. Miao P. Water movement and heat transfer during high temperature drying of Masson’s pine lumber[D]. Nanjing: Nanjing Forestry University, 2000.
[34] 鲍甫成, 赵有科, 吕建雄. 杉木和马尾松木材渗透性与微细结构的关系研究[J]. 北京林业大学学报, 2003, 25(1): 1−5. Bao F C, Zhao Y K, Lü J X. Relationship between permeability and fine structure of common Chinese fir and masson pine wood[J]. Journal of Beijing Forestry University, 2003, 25(1): 1−5.
[35] 贾梅. 康复景观中几种芳香植物挥发物及其对人体健康影响的研究[D]. 临安: 浙江农林大学, 2017. Jia M. Study on volatile compounds of several aromatic plants used in rehabilitation landscape and their impacts of human health[D]. Lin’an: Zhejiang Agriculture & Forestry University, 2017.
[36] 刘郁. 环境色彩、嗅觉、免疫反应物与运动员心理研究: 以贵州省红枫湖水上基地皮划艇运动员为例[J]. 教育文化论坛, 2013, 5(1): 57−61. Liu Y. Relationship between environmental color, smell, immune reactants and athletes’ psychology: a case study of rowing athletes in Guizhou Hongfeng Lake training base[J]. Tribune of Education Culture, 2013, 5(1): 57−61.
[37] Cui X L, Ge M T, Shen X W. Application of comprehensive evaluation in new-product-development evaluation: the case of landscape-architectural outdoor wooden furnishing[J]. Forests, 2022, 13(10): 1552. doi: 10.3390/f13101552
-
期刊类型引用(2)
1. 宋晴,付鸿莉,王铁梅,宿逸然,梁留喜,通拉嘎,胥健,董昊野,邰塔拉. 兴安盟草原灌丛植被潜在适生区分布模拟分析. 草地学报. 2024(02): 579-587 .  百度学术
百度学术
2. 楼科尔,曲文杰,王磊,王兴,郜永贵,张波,尤万学,杨新国. 腾格里沙漠地区4种优势一年生草本植物根构型特征. 应用生态学报. 2024(11): 3015-3022 .  百度学术
百度学术
其他类型引用(1)










 下载:
下载: