Populus euphratica PeMAX2 regulating drought tolerance in Arabidopsis thaliana
-
摘要:目的
MAX2能抑制植物的分枝,且是独角金内酯信号传导途径的关键调控因子。MAX2同时还参与多种激素间的交叉互作,在植物抵御生物和非生物胁迫中发挥至关重要的作用。前期研究发现胡杨PeMAX2能调控拟南芥的离子平衡和耐盐性,但对于PeMAX2的耐旱功能还知之甚少,本文将探索胡杨PeMAX2调控拟南芥耐旱性的作用机制。
方法将胡杨PeMAX2在拟南芥中异源表达,进行渗透胁迫和干旱胁迫,研究过表达PeMAX2拟南芥的生理和分子响应机制。
结果(1)在长期干旱胁迫下,胡杨叶片PeMAX2基因表达水平升高。(2)甘露醇处理后,PeMAX2转基因拟南芥的种子萌发率和根长均高于野生型拟南芥(WT)和max2突变体,并且转基因株系细胞膜受损较轻。渗透胁迫后,转基因株系超氧化歧化酶、过氧化物酶、过氧化氢酶活性及其编码基因上调表达的升高幅度均显著高于拟南芥WT和max2突变体,转基因株系调控根细胞H2O2水平的能力更强。(3)土壤干旱处理10 d后,转基因株系叶绿素含量下降幅度低于WT和max2突变体,而且过表达株系在干旱胁迫下能维持较高水平的PSⅡ最大光化学效率、相对电子传递效率和实际光合量子产量;在碳同化和气孔导度方面,转基因拟南芥叶片的净光合速率和气孔导度均高于WT和突变体,说明过表达PeMAX2提高了拟南芥转基因植株在干旱条件下光合作用的能力。土壤复水后WT和突变体叶绿素含量、荧光和光合作用的恢复程度也明显低于转基因株系。
结论过表达胡杨PeMAX2可以提高拟南芥的耐旱性,主要是由于过表达PeMAX2提高了转基因拟南芥活性氧平衡的调控能力,减弱了干旱胁迫对生物膜的氧化损伤和光合作用的抑制。
Abstract:ObjectiveMAX2 plays an important role in inhibiting plant branching and regulating strigolactone signaling pathway. MAX2 is also involved in multi-phytohormone interactions and in plant response to biotic and abiotic stresses. It has been shown that overexpression of Populus euphratica PeMAX2 can improve ionic homeostasis and the salt tolerance in transgenic plants of Arabidopsis thaliana. However, little is known about the function of PeMAX2 in drought tolerance. The objective of this study is to explore the mechanism of PeMAX2 in regulating drought tolerance of Arabidopsis thaliana.
MethodP. euphratica PeMAX2 was overexpressed in A. thaliana, and the physiological and molecular mechanism underlying the osmotic and drought tolerance of transgenic plants was investigated in this study.
Result(1) The expression of PeMAX2 gene was up-regulated in P. euphratica leaves under long-term of drought stress. (2) After mannitol treatment, the seed germination rate and root length of A. thaliana overexpressing PeMAX2 were significantly higher than those of wild type and max2 mutant. The cell membrane was less damaged in PeMAX2-transgenic plants under osmotic stress compared with WT and max2. The increase of superoxide dismutase, peroxidase and catalase activities and the transcription levels of their encoding genes were higher in transgenic lines than in WT and max2 mutant under osmotic stress. As a result, the ability to regulate H2O2 was increased in root cells of transgenic lines. (3) A 10-d of soil drought decreased the chlorophyll content in all tested lines, and a more pronounced reduction was observed in WT and max2 mutant. Under drought stress, the maximum photochemical efficiency of PSⅡ, relative electron transport rate and actual quantum yield of photosynthesis were less inhibited in PeMAX2-overexpressed plants than in WT and max2. Meanwhile, transgenic plants had higher net photosynthetic rate and stomatal conductance under drought treatment, as compared with WT and mutant plants. This indicated that overexpression of PeMAX2 improved the photosynthetic capacity of transgenic plants under drought conditions. The recovery of chlorophyll content, fluorescence and photosynthesis of WT and mutant were significantly lower than that of transgenic lines after soil rehydration.
ConclusionOverexpression of P. euphratica PeMAX2 improves the drought tolerance of A. thaliana. This is mainly due to the increased ability to scavenge reactive oxygen species in transgenic plants. Consequently, the oxidative damage to cell membrane and the drought inhibition of photosynthesis are alleviated in PeMAX2-transgenic plants under water stress.
-
Keywords:
- Populus euphratica /
- PeMAX2 /
- Arabidopsis thaliana /
- drought tolerance /
- antioxidant enzyme /
- photosynthesis
-
MAX2(more axillary growth 2)具有抑制植物腋芽萌发的功能[1]。深入研究还发现,MAX2能作为F-box蛋白进行胞内的信号转导。在拟南芥中F-box蛋白家族的成员有一个保守的由35 ~ 60个氨基酸组成的F-box结构域,是许多激素信号途径的中心调节成分。F-box蛋白与另外2个蛋白Skp1和Cullin构成SCF(Skp1-Cullin-F-box)泛素复合体,是泛素蛋白降解系统的重要组成部分,泛素化标记的蛋白质被26S蛋白酶体降解。F-box蛋白的底物通常是某一个信号途径中的抑制子,被26S蛋白酶降解后信号通路开启[2−4]。在拟南芥(Arabidopsis thaliana)的独角金内酯(strigolactone,SL)信号途径中,MAX2通过形成SCF复合体,与抑制子SMXL、受体蛋白D14和SL结合,形成一个新的复合体,导致SMXL被泛素化–蛋白酶体降解,解除了对下游转录因子的抑制,激活响应基因的转录,最终调控植物的分枝、叶片伸长等发育过程[5]。SL负调控植物生长素,通过影响生长素的极性运输来控制分枝。max2突变体的枝条多分枝表型是由主茎中生长素运输能力的增加引起的。SL参与的植物分枝途径被称为类胡萝卜素衍生的MAX途径[6−10]。在拟南芥中,烟雾素类似物(karrikin,KAR)与SL几乎共用了这一信号途径,KAR信号途径中的受体KAI2与SL的受体D14是旁系同源物,二者信号抑制子也是同源基因,而且它们还共用MAX2这一个F-box泛素连接酶。KAR与其受体蛋白KAI2、MAX2形成的SCF复合体结合,使下游信号传递抑制子被泛素化,并通过26S蛋白酶体降解,从而使下游信号响应基因表达,执行相应的生物学功能,包括种子萌发、根的发育等过程[11]。
近来的大量研究表明,MAX2不仅能抑制腋芽萌发,还在植物发育过程中扮演多重角色,包括种子萌发、幼苗的光形态建成、植物分枝、SL信号传导、KAR信号传导、温度信号传导、脱落酸(ABA)信号介导和细胞分裂素信号途径等[12−19]。进一步研究还发现,MAX2可以抵御非生物胁迫。在拟南芥中发现MAX2参与ABA和干旱响应,相较于野生型,max2突变体对ABA诱导的气孔关闭的敏感性降低、气孔孔径较大;max2突变体的角质层厚度减少,导致膜通透性增加;其突变体种子萌发和幼苗早期表现出对ABA、氯化钠、甘露醇的超敏反应[20]。有研究者将埃及列当(Orobanche aegyptiaca)MAX2同源基因OaMAX2在拟南芥中异源表达,发现其与过表达AtMAX2拟南芥在耐旱和调控分枝方面的表型一致[21]。在苹果(Malus × domestica)愈伤组织中过表达MdMAX2,增强了花青素的积累,而在拟南芥中过表达MdMAX2,导致花青素含量增加和下胚轴长度减少。此外,过表达MdMAX2的苹果愈伤组织和拟南芥对盐胁迫和干旱胁迫的耐受性增强。因此,MdMAX2在植物光形态建成和胁迫响应中具有正调控作用[22]。大豆(Glycine max)在种子萌发阶段,通过MAX2介导的KAR和SL途径可以调节干旱和盐胁迫下大豆种子的萌发率[23]。这些研究结果表明,MAX2在植物生长发育和应对非生物胁迫过程中发挥着极其重要的作用。而在木本植物中,MAX2对干旱和盐胁迫的响应还未知。
胡杨(Populus euphratica)是能在干旱的荒漠地带成林的乔木树种,已成为研究干旱、盐等非生物胁迫响应的重要木本模式物种[24−25]。目前,胡杨抗逆基因分离、克隆转化及其作用机制解析已成为研究热点[26]。实验室前期研究表明:过表达胡杨PeMAX2基因提高了转基因拟南芥对盐胁迫的耐受性,缓解了高浓度盐胁迫对细胞膜完整性的损伤;过表达株系还能促进根尖Na+的外排,减少K+的外流,维持体内Na+/K+的平衡[27]。但对胡杨MAX2是否会参与干旱胁迫调节及其调控作用机理还未有研究。本文拟明确胡杨MAX2基因的耐旱功能,为利用基因工程提高植物的耐旱性提供理论依据。
1. 材料与方法
1.1 试验材料
一年生胡杨苗购自新疆,栽种于北京林业大学苗圃。野生型拟南芥(Columbia ecotype,WT)、拟南芥max2突变体((SALK_092836),Mut)、含pCAMBIA1300-PeMAX2构件的大肠杆菌菌液保存于实验室。质粒小提试剂盒、cDNA反转录试剂盒、荧光定量PCR试剂盒购自康为世纪生物科技有限公司。胡杨叶片RNA提取试剂盒和其他试剂购自北京拜尔迪生物公司。引物合成、测序由北京睿博兴科公司完成。
1.2 干旱胁迫对胡杨叶片PeMAX2表达量影响处理
在苗圃中选取生长状态良好的胡杨苗,分为2组:1组是不浇水进行干旱处理,分别在干旱处理0、3、7、12 d、复水3 d和复水7 d取胡杨叶片;2组为对照组,每周浇水1 ~ 2次,在对应时间取胡杨叶片;每个处理3个生物学重复。取叶片后迅速用锡箔纸保存,放入液氮中冻存并提取其总RNA,随后反转录为cDNA。用PeMAX2特异性实时荧光定量(RT-qPCR)引物检测胡杨叶片MAX2基因表达量,胡杨PeActin7为内参基因(引物序列见表1)。反应条件:95 ℃ 5 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 10 min。反应结束后分析其表达量。
表 1 本研究所用引物及序列Table 1. Primers and sequences used in this study基因名称
Primer name正向引物(5′—3′)
Forward primer (5′−3′)反向引物(5′—3′)
Reverse primer (5′−3′)PeMAX2-qPCR GGCTCTTAGGAGCATCGACC TGCCGTGATTGCCTGAATCT PeMAX2 CCGCAAGCTTGTCGACATGGCCAGTTCCAGTATG AATGGGTCGCGGATCCGTCGAGGATCTGACGCC PeActin7 ATTGGCCTTGGGGTTAAGAG CACACTGGAGTGATGGTTGG AtACTIN2 GGTAACATTGTGCTCAGTGGTGG AACGACCTTAATCTTCATGCTGC AtSOD AGGAAACATCACTGTTGGAGAT GAGTTTGGTCCAGTAAGAGGAA AtPOD CGTGCCCTTCATATTGTTGG GACGCCATCAACAACGAGTC AtCAT AGGATCAAACTTTGAGGGGTAG CTTGTGGTTCCTGGAATCTACT 1.3 转基因拟南芥阳性植株的获取
将含有pCAMBIA1300-PeMAX2构件的大肠杆菌质粒转化至农杆菌GV3101中。在含有卡那霉素和利福平抗生素LB平板上筛选阳性克隆。通过测序鉴定含有pCAMBIA1300-PeMAX2构件的农杆菌克隆,并利用拟南芥沾花法进行转化。收获的T1代种子在含有潮霉素的1/2 MS培养基上筛选阳性植株,将阳性植株移至土壤(V泥炭土∶V营养土∶V蛭石 = 1∶1∶1)中进行培养,并进行DNA检测,获得T2代种子,将获得的拟南芥T2代种子再次播种到有潮霉素的1/2 MS培养基上,长出4片真叶后将其移到土里,再进行DNA检测,收获的种子继续用潮霉素筛选并进行DNA检测,直至获得T3代纯合种子。利用Trizol法提取野生型、T3代转基因拟南芥(OE1 ~ OE7)叶片的总RNA,经逆转录后进行RT-qPCR检测,选取表达量较高的2个株系用于后续试验。
1.4 转基因拟南芥耐旱性分析方法
1.4.1 种子萌发率
以加入不同浓度甘露醇的1/2 MS 固体培养基模拟干旱逆境,浓度梯度设为0、200、250、300、350 mmol/L,以不加甘露醇(0 mmol/L)作为对照。将拟南芥野生型(WT)、拟南芥max2突变体(Mut)、过表达PeMAX2株系(OE-1、OE-2)分别播种不同梯度浓度的甘露醇的1/2 MS培养基上,每个株系播种50粒,以0 mmol/L作为对照,每种处理3组重复。4 ℃低温春化处理2 ~ 3 d,光照培养箱中培养7 d,统计种子的萌发率。
1.4.2 根 长
将各株系拟南芥种子(WT、Mut、OE-1、OE-2)分别播种在浓度梯度为0、200、250、300、350 mmol/L甘露醇的1/2 MS培养基上,每个株系播种20粒,以0 mmol/L作为对照,每种处理5组重复。4 ℃低温春化处理2 ~ 3 d,光照培养箱中竖直培养8 d,利用图片处理软件Image-J统计根长。
1.4.3 相对电导率
取生长在0和250 mmol/L甘露醇处理的1/2 MS固体培养基上的拟南芥各株系幼苗(WT、Mut、OE-1、OE-2)各10株(每种处理做3组重复),放入去离子水中,室温下静置24 h后,测定其电导率记为EC1。在100 ℃水浴30 min,冷却至室温后,测定其电导率记为EC2。细胞膜的透性是用叶片相对电导率(EL)表示,使用以下公式计算:EL = EC1/EC2 × 100%。
1.5 长期渗透胁迫下拟南芥根尖H2O2含量测定
利用过氧化氢特异性荧光探针H2DCF-DA检测拟南芥根中H2O2含量。取在0和250 mmol/L甘露醇处理的1/2 MS固体培养基上培养8 d的拟南芥各株系幼苗(WT、Mut、OE-1、OE-2),用H2DCF-DA溶液(10 μmol/L)避光孵育15 min。随后用去离子水冲洗3 ~ 5次,将做好的拟南芥临时玻片放在激光共聚焦显微镜(Leica SP8,Wetzlar,德国)下观察并拍照。激发波长为504 nm,发射波长为529 nm,利用Image-J软件计算相对荧光强度。
1.6 长期渗透胁迫下拟南芥根尖Ca2+水平测定
利用钙离子特异性荧光探针Rhod-2/AM测定各株系拟南芥根中Ca2+水平。取在0和250 mmol/L甘露醇处理的1/2 MS固体培养基上培养8 d的拟南芥各株系幼苗(WT、Mut、OE-1、OE-2),利用Ca2+荧光探针Rhod-2/AM溶液(10 μmol/L)避光孵育2 h。之后用去离子水冲洗3 ~ 5次,将做好的拟南芥临时玻片放在激光共聚焦显微镜(Leica SP8,Wetzlar,德国)下观察并拍照。激发波长为552 nm,发射波长为581 nm。利用Image-J软件计算相对荧光强度。
1.7 拟南芥抗氧化酶活性和编码基因表达量的检测
分别取在0和250 mmol/L甘露醇处理的1/2 MS固体培养基上生长8 d的拟南芥各株系幼苗(WT、Mut、OE-1、OE-2),各称取0.1 g,在液氮中迅速研磨至细粉状,随后加入0.9 mL预冷的100 mmol/L PBS缓冲液,pH 7.2 ~ 7.4,冰浴条件下制成匀浆液。4 ℃下12 000 g离心10 min,取上清液进行后续的超氧化歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)活性的测定。其中SOD活性通过NBT光还原法测定[28],POD活性的测定采用愈创木酚法[29],CAT活性测定采用紫外吸收法[30],利用考马斯亮蓝G250法进行蛋白测定,用牛血清白蛋白(BSA)测定标准曲线,根据标准曲线对样品蛋白进行浓度计算。
依据TRIzon(康为世纪)的RNA提取说明书提取各株系拟南芥(WT、Mut、OE-1、OE-2)总RNA,随后利用HiFiScript gDNA Removal RT MasterMix(康为世纪)试剂盒去除基因组DNA,并且完成逆转录得到拟南芥cDNA。拟南芥荧光定量体系参照擎科生物TSINGKE TSE201 2 × TSINGKE® Master qPCR Mix(SYBR Green I)试剂盒说明书,以逆转录得到的cDNA为模板进行实时荧光定量基因扩增检测。拟南芥内参基因为ACTIN2(At3g18780),RT-qPCR使用引物序列见表1。
1.8 生理参数测定
将拟南芥野生型(WT)、拟南芥max2突变体(Mut)和转基因PeMAX2株系(OE-1、OE-2)的种子经消毒后播在1/2 MS固体培养基上。4 ℃低温春化处理2 ~ 3 d,光照培养箱里培养至拟南芥长出4片真叶,把幼苗移栽到土壤中(V泥炭土∶V营养土∶V蛭石 = 1∶1∶1)继续生长。生长条件是:光照强度为100 ~ 200 μmol/(m2·s);相对湿度为75%;温度为白天23 ℃,夜晚20 ℃;光周期为16 h光照,8 h黑暗。及时浇水,生长25 ~ 30 d。之后选取生长状态健康、长势相近的拟南芥,分成2组,一组不浇水模拟土壤自然干旱,另一组正常浇水作为对照组,处理过程中每3 ~ 4 d对土壤湿度进行测定,对处理0 d、干旱10 d、复水3 d、正常浇水对应的各株系拟南芥(WT、Mut、OE-1、OE-2)进行相对叶绿素含量、叶绿素荧光参数和光合参数的测定。其中,叶绿素含量使用便携式叶绿素仪(SPAD-502-Plus)对拟南芥叶片进行原位测定;叶绿素荧光参数使用Junior PAM便携式荧光仪测定,测定前需要将各株系拟南芥黑暗处理20 ~ 30 min,同一株系选出长势相近的叶片进行测定;拟南芥光合参数利用光合仪Yaxin-1102测定;以上每个株系均重复测定6 ~ 8次,最后取平均值。
1.9 数据分析
通过Excel、GraphPad Prism8.0.2、SPSS Statistics 19对实验数据进行统计和绘图。利用SPSS Statistics 19进行单因素方差分析,显著性水平设定为α = 0.05。
2. 结果与分析
2.1 干旱胁迫对胡杨叶片PeMAX2表达量影响
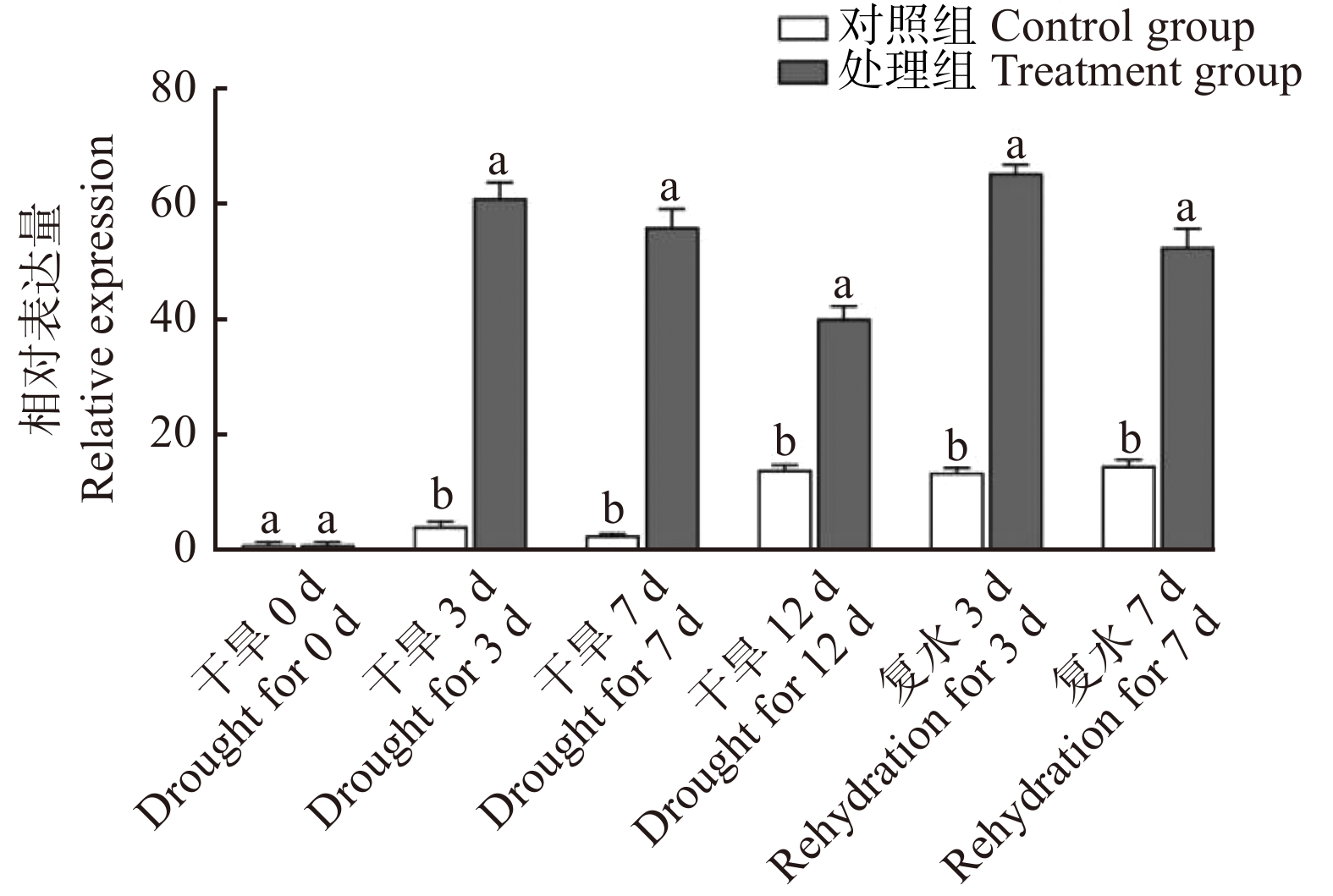
对胡杨苗木进行干旱12 d、复水7 d处理,以正常浇水为对照,利用RT-qPCR检测各处理胡杨叶片中PeMAX2的表达量变化。图1显示:干旱0 d,胡杨PeMAX2基因表达量没有显著变化;干旱处理3 d后,胡杨PeMAX2的表达量大幅度上升,高出对照13.29倍;干旱7 d和12 d,PeMAX2的表达量虽有所降低,但仍处于较高水平;复水3 d和7 d后,胡杨叶片中PeMAX2表达量也未有显著降低。试验结果表明:胡杨能响应干旱胁迫,上调PeMAX2基因的表达,并能长期维持PeMAX2基因的高表达。
2.2 转基因拟南芥高表达株系的筛选
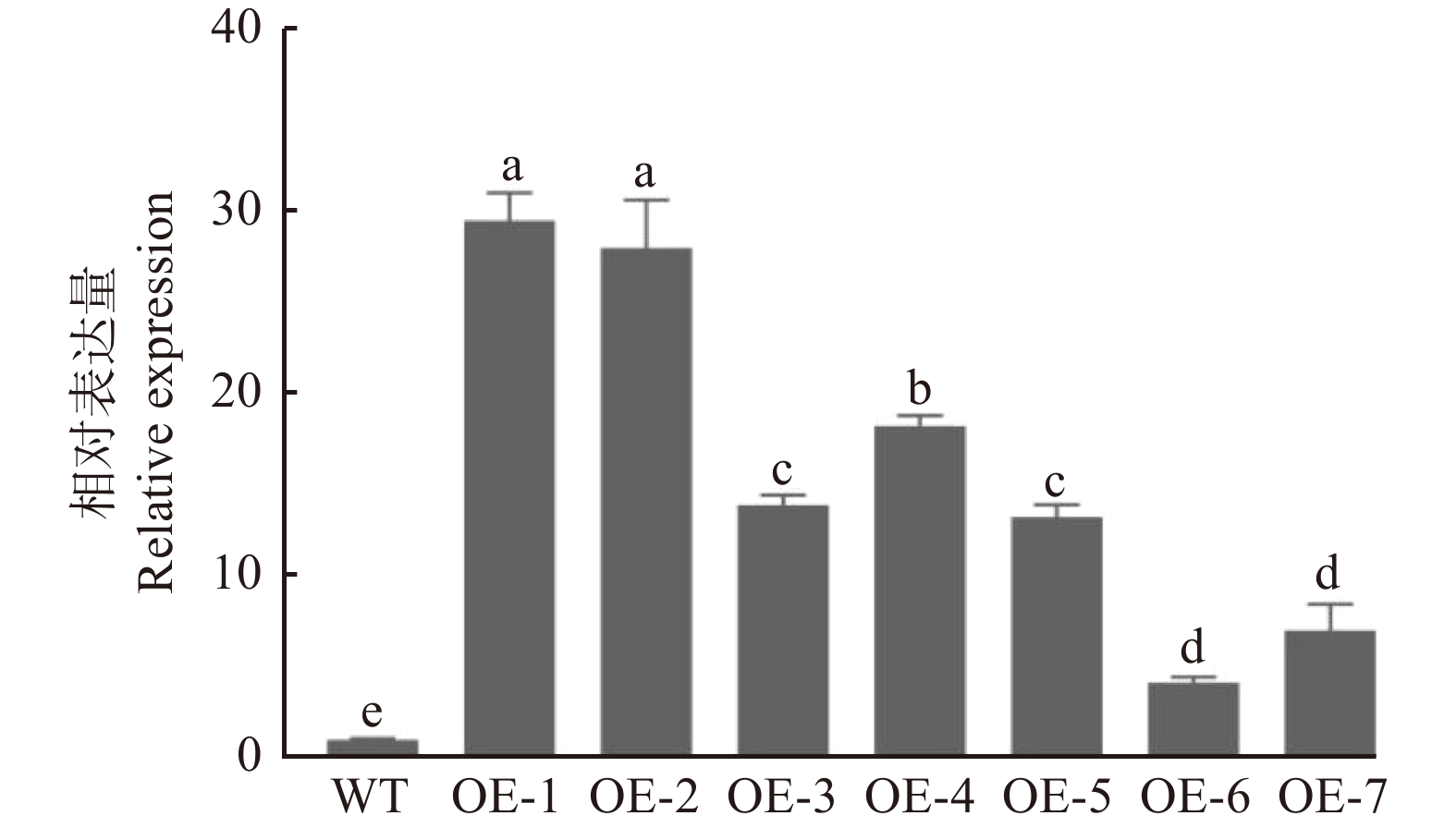
在拟南芥中过表达PeMAX2,共获得7个转基因株系(OE1 ~ OE7)。RT-qPCR结果显示:与野生型相比,PeMAX2的表达量在所有转基因株系中均显著提高(图2)。选择相对表达量高的2个株系OE-1和OE-2进行后续试验。
2.3 转基因拟南芥耐旱性表型分析
2.3.1 渗透胁迫下拟南芥萌发率
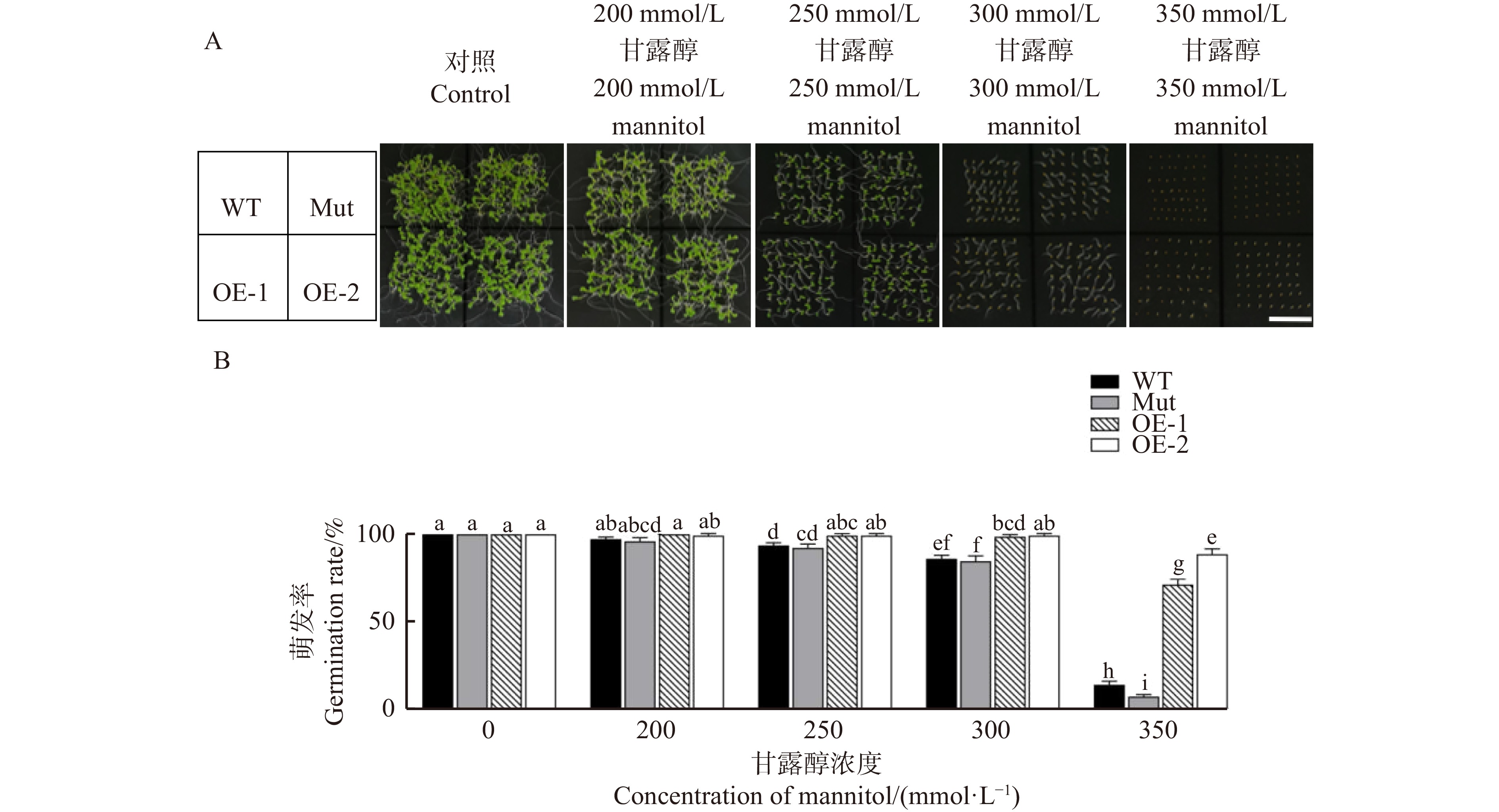
对拟南芥野生型(WT)、拟南芥max2突变体(Mut)、过表达PeMAX2株系(OE-1、OE-2)进行甘露醇浓度梯度处理,比较各株系在渗透胁迫下的种子萌发情况,研究PeMAX2对拟南芥渗透胁迫耐受性的影响。图3A、3B显示:在0 mmol/L甘露醇处理下,各株系拟南芥生长状况和萌发率无明显差异。随着甘露醇浓度梯度的升高,各株系拟南芥的生长受到明显抑制,但是转基因株系OE-1和OE-2的萌发率均高于WT和Mut株系。在200 mmol/L甘露醇处理下,WT和Mut株系的萌发率低于对照组,分别下降至97.3%、96.0%,转基因株系几乎没有下降。在甘露醇浓度为250 mmol/L时,各株系拟南芥的生长受到明显抑制,WT和Mut的萌发率降至93.7%和92.3%,但是转基因株系OE-1和OE-2萌发率与对照组无显著差异。在甘露醇浓度升为300 mmol/L后,WT和Mut的萌发率下降至86.0%和84.7%,而转基因株系OE-1和OE-2的萌发率显著高于WT和Mut。在甘露醇浓度升为350 mmol/L后,所有株系萌发率均显著下降,但转基因株系OE-1和OE-2的萌发率远远显著高于WT和Mut,仍能维持在71.3%和88.7%,而WT和Mut的萌发率骤降至14.0%和7.3%。这说明在渗透胁迫下,过表达PeMAX2的拟南芥株系有较强的适应性,萌发率显著提升。
2.3.2 渗透胁迫下拟南芥根长生长
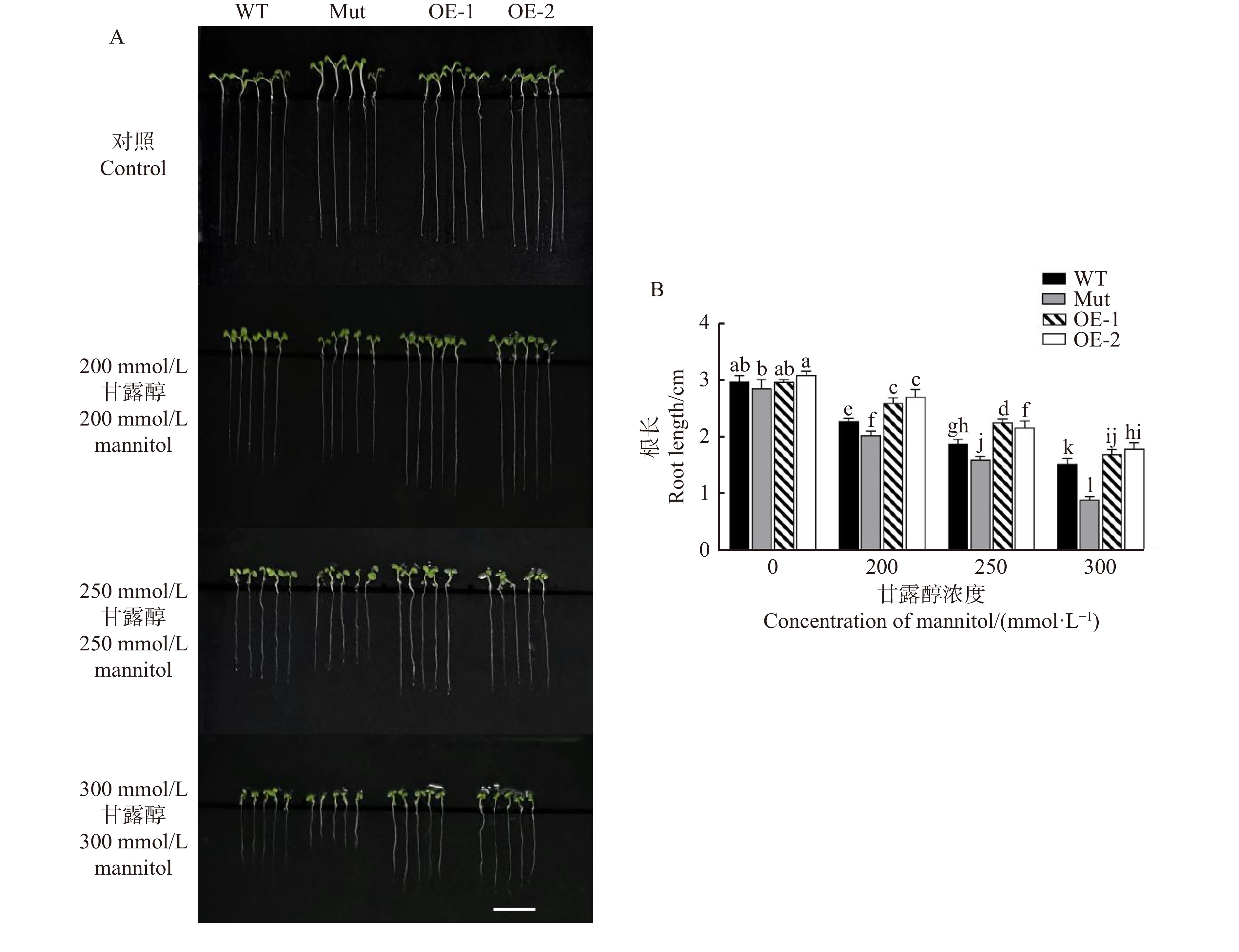
图4A显示:在不添加甘露醇的对照培养基上,所有株系的根长和生长状态均无明显差异。然而,在200 mmol/L甘露醇胁迫下,WT、Mut根长显著下降,明显低于PeMAX2过表达株系,说明WT、Mut株系生长受到明显抑制,而且Mut受到的抑制更为明显。在250 mmol/L甘露醇处理下,WT、Mut根长进一步下降,较对照处理分别下降36.8%和44.1%,OE-1和OE-2也有所下降,下降幅度为24.1%和30.0%。在300 mmol/L甘露醇处理下,各株系生长受到严重抑制,与过表达株系相比,WT、Mut受到的抑制更为显著。以上结果说明,在渗透胁迫下,PeMAX2过表达株系能维持根系的生长态势,有利于提高耐旱性。250 mmol/L甘露醇处理下各株系的表型区别更为显著,且不会严重抑制拟南芥生长,因而以此作为后续试验的处理浓度。
2.4 渗透胁迫下转基因拟南芥相对电导率变化
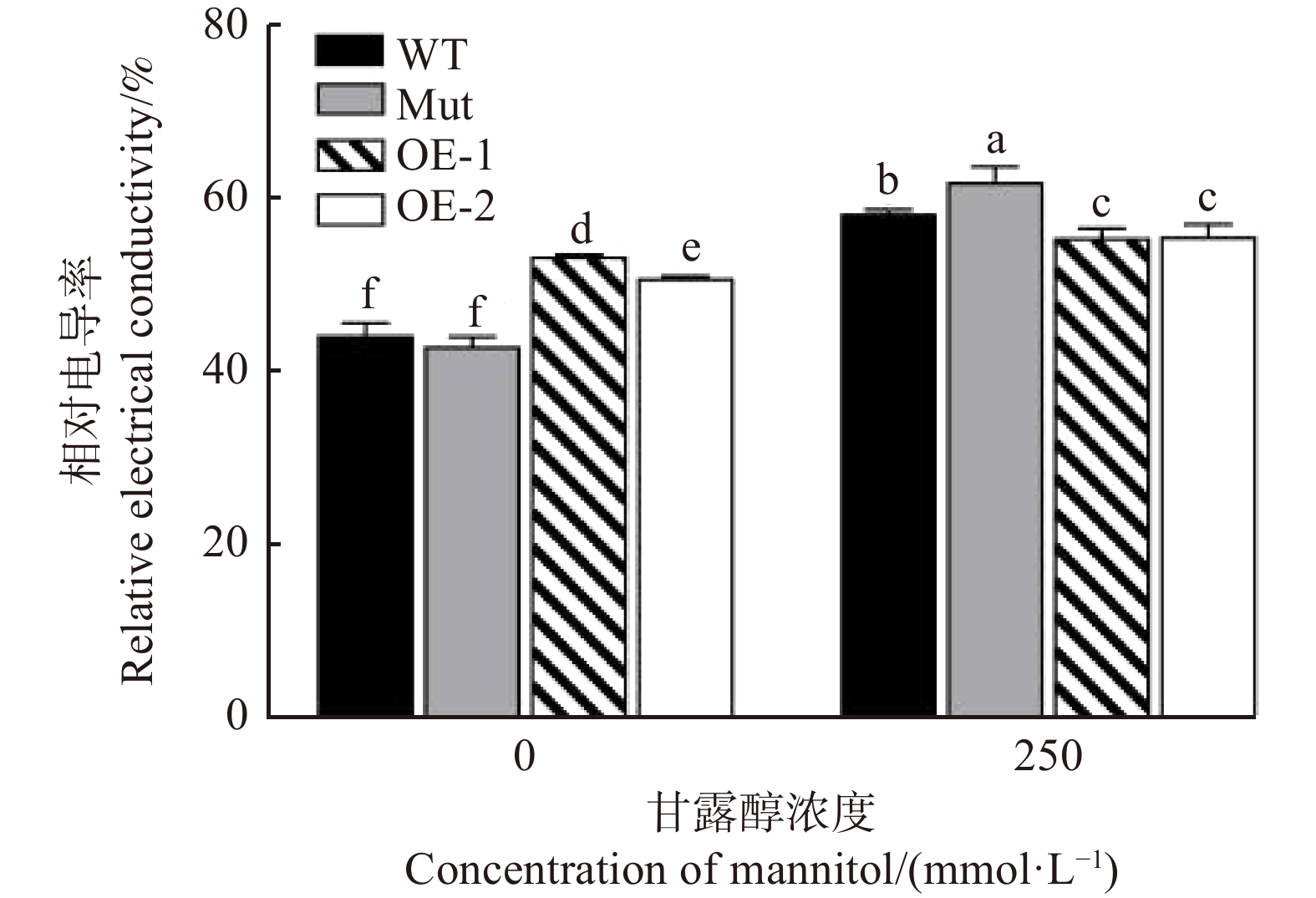
相对电导率是反映植物细胞膜损伤的重要参考数据,当植物受到逆境环境胁迫,细胞膜遭到破坏,膜透性增大,电解质渗漏的程度发生改变。图5显示:250 mmol/L甘露醇处理下,所测株系的相对电导率均有显著性升高,说明在渗透胁迫下各株系拟南芥都存在细胞膜损伤。其中,WT和Mut株系的相对电导率分别增加了30.6%、45.5%,高于转基因株系的升高幅度,说明过表达PeMAX2能减轻渗透胁迫对拟南芥细胞膜造成的伤害。
2.5 长期渗透胁迫下拟南芥根中H2O2含量变化
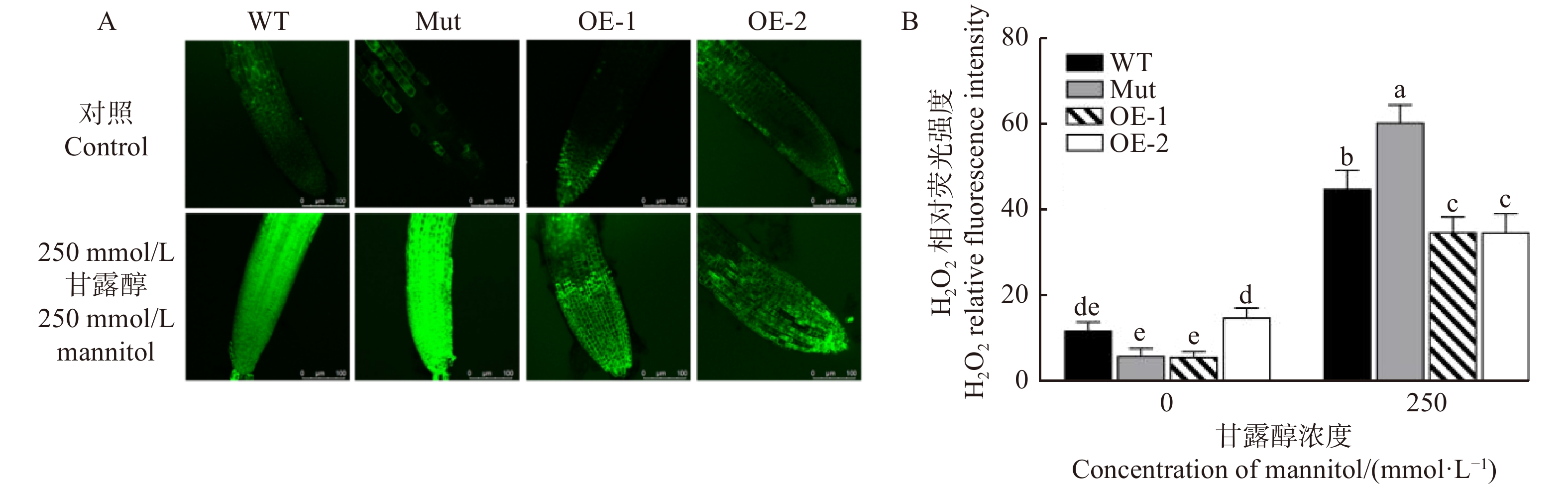
利用荧光探针H2DCF-DA测定了拟南芥在长期渗透胁迫下(250 mmol/L甘露醇处理8 d)的H2O2含量。图6显示:在长期渗透胁迫下,各株系根细胞中H2O2荧光强度显著提升,说明渗透胁迫诱导植物细胞积累了活性氧。其中,相较于转基因株系,WT和Mut根中H2O2荧光强度的提升更为显著,Mut的H2O2水平更高,说明WT和Mut中积累的活性氧水平更高。这些结果表明:在渗透胁迫下,过表达PeMAX2拟南芥清除体内H2O2的能力更高,积累的活性氧更少,抗氧化防御能力强于WT和Mut拟南芥。
![]() 图 6 甘露醇(250 mmol/L)胁迫下拟南芥各株系根细胞H2O2荧光强度的变化A. 不同胁迫下拟南芥根细胞H2O2的绿色荧光,比例尺=100 μm ;B.根细胞中H2O2的荧光强度。A, green fluorescence of H2O2 in Arabidopsis thaliana root cells under different treatments,scale bar=100 μm; B, H2O2 fluorescence intensity of root cells.Figure 6. Changes of H2O2 fluorescence intensity in root cells of different Arabidopsis thaliana lines under mannitol stress (250 mmol/L)
图 6 甘露醇(250 mmol/L)胁迫下拟南芥各株系根细胞H2O2荧光强度的变化A. 不同胁迫下拟南芥根细胞H2O2的绿色荧光,比例尺=100 μm ;B.根细胞中H2O2的荧光强度。A, green fluorescence of H2O2 in Arabidopsis thaliana root cells under different treatments,scale bar=100 μm; B, H2O2 fluorescence intensity of root cells.Figure 6. Changes of H2O2 fluorescence intensity in root cells of different Arabidopsis thaliana lines under mannitol stress (250 mmol/L)2.6 长期渗透胁迫下拟南芥根中Ca2+水平变化
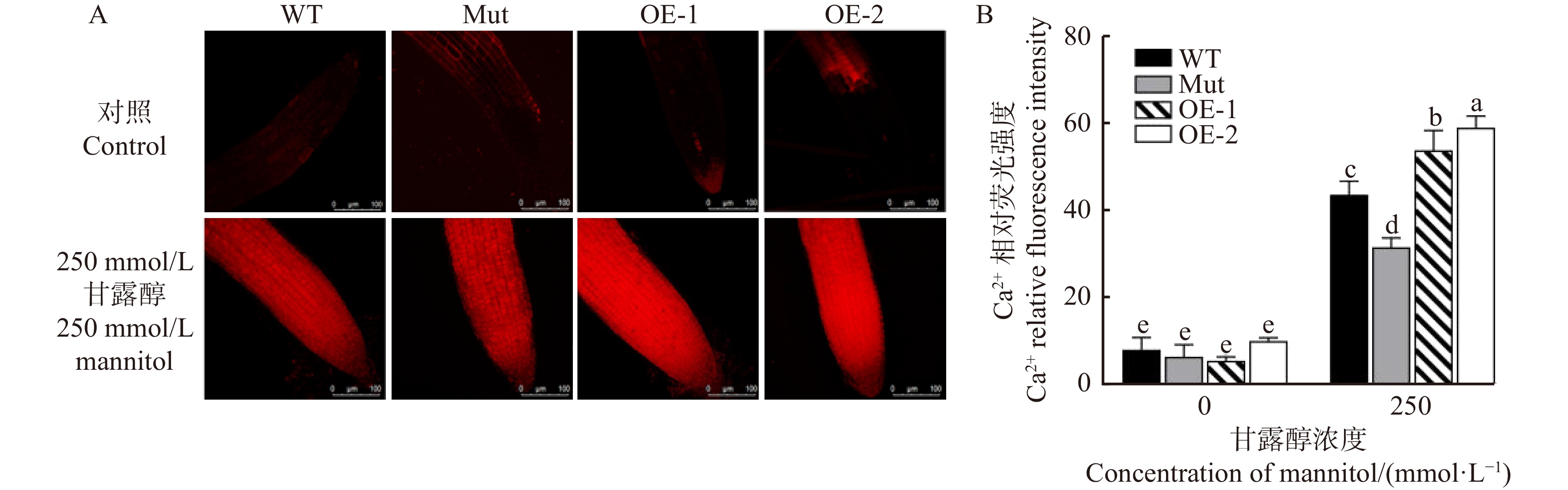
Ca2+作为第二信使,是细胞信号传导的重要成员,胁迫环境通常导致胞内的Ca2+浓度发生变化。为了比较不同株系对渗透胁迫的响应,利用荧光探针Rhod-2/AM测定了长期渗透胁迫下拟南芥根细胞内Ca2+浓度的变化。图7显示:在正常生长条件下,各株系拟南芥根细胞中Ca2+荧光强度很弱且无显著差异;在250 mmol/L甘露醇处理后,各株系Ca2+荧光强度均有显著提升,而且转基因株系根尖Ca2+水平显著高于WT和Mut株系。这说明PeMAX2转基因株系响应环境胁迫能力增强,有助于提高植物耐受水分胁迫的能力。
![]() 图 7 甘露醇(250 mmol/L)胁迫下拟南芥各株系根细胞Ca2+荧光强度的变化A. 不同胁迫下拟南芥根细胞Ca2+的红色荧光,比例尺 = 100 μm;B. 根细胞Ca2+荧光强度。A. red fluorescence of Ca2+ in Arabidopsis thaliana root cells under different treatments, scale bar = 100 μm; B, Ca2+ fluorescence intensity of root cells.Figure 7. Changes of Ca2+ fluorescence intensity in root cells of different Arabidopsis thaliana lines under mannitol stress (250 mmol/L)
图 7 甘露醇(250 mmol/L)胁迫下拟南芥各株系根细胞Ca2+荧光强度的变化A. 不同胁迫下拟南芥根细胞Ca2+的红色荧光,比例尺 = 100 μm;B. 根细胞Ca2+荧光强度。A. red fluorescence of Ca2+ in Arabidopsis thaliana root cells under different treatments, scale bar = 100 μm; B, Ca2+ fluorescence intensity of root cells.Figure 7. Changes of Ca2+ fluorescence intensity in root cells of different Arabidopsis thaliana lines under mannitol stress (250 mmol/L)2.7 渗透胁迫下拟南芥抗氧化酶活性及其编码基因转录水平的变化
与对照条件相比,250 mmol/L甘露醇处理后,拟南芥各株系抗氧化酶SOD、POD、CAT活性均显著提高,其中,转基因株系的3种抗氧化酶活性大小和升高幅度均显著高于WT和Mut株系(图8A ~ C)。与3种抗氧化酶相关的编码基因AtSOD、AtPOD、AtCAT的表达水平变化与酶活性变化趋势相对应(图8D ~ F)。
2.8 干旱对拟南芥生长和光合生理的影响
2.8.1 干旱胁迫对拟南芥生长状态的影响
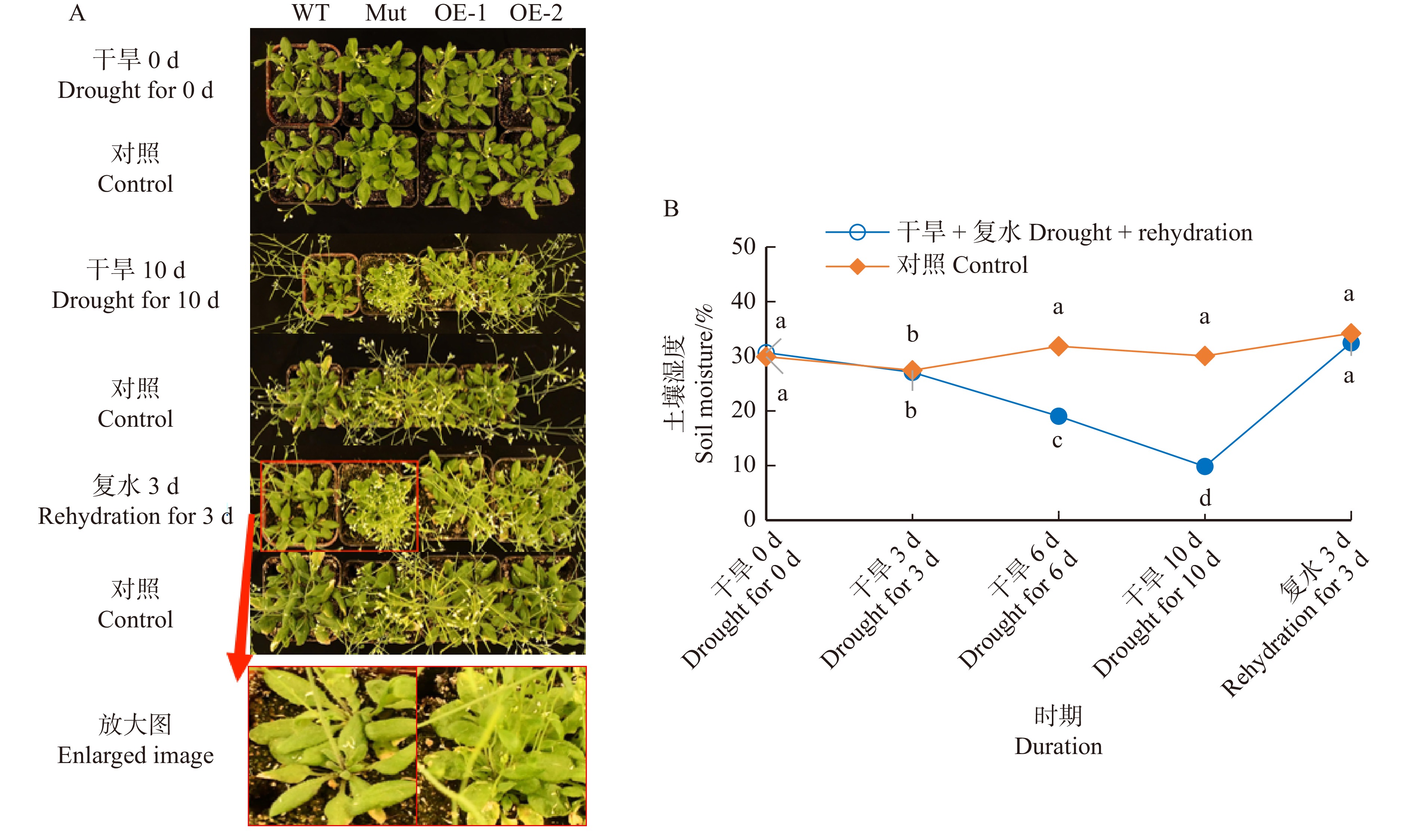
为了进一步验证胡杨PeMAX2能否提高拟南芥对水分胁迫的耐受能力,对各株系(WT、Mut、OE-1、OE-2)进行干旱和复水处理,并监测试验期间土壤湿度变化。图9显示:干旱0 d,各株系生长状态无明显区别;干旱处理10 d后,土壤湿度从30.6%下降至9.8%,WT和Mut株系莲座叶叶片较小且发黄,植株出现萎蔫状态,但PeMAX2过表达株系长势较好,莲座叶叶片较大且萎蔫不明显。另外,无论是干旱处理还是对照处理,max2突变体的株高都较小且分枝较多,叶片角质层厚度明显变薄。复水3 d后,各株系生长状态均有所恢复。
![]() 图 9 干旱和复水处理对不同拟南芥株系生长状况的影响A. 干旱和复水处理后拟南芥生长状况;B. 干旱和复水处理后土壤湿度变化。A, plant performance of Arabidopsis thaliana after treatment of drought and rehydration; B, changes of soil moisture after drought and rehydration treatments.Figure 9. Effects of drought and rehydration treatments on plant performance of different Arabidopsis thaliana lines
图 9 干旱和复水处理对不同拟南芥株系生长状况的影响A. 干旱和复水处理后拟南芥生长状况;B. 干旱和复水处理后土壤湿度变化。A, plant performance of Arabidopsis thaliana after treatment of drought and rehydration; B, changes of soil moisture after drought and rehydration treatments.Figure 9. Effects of drought and rehydration treatments on plant performance of different Arabidopsis thaliana lines2.8.2 干旱胁迫下拟南芥叶绿素含量变化
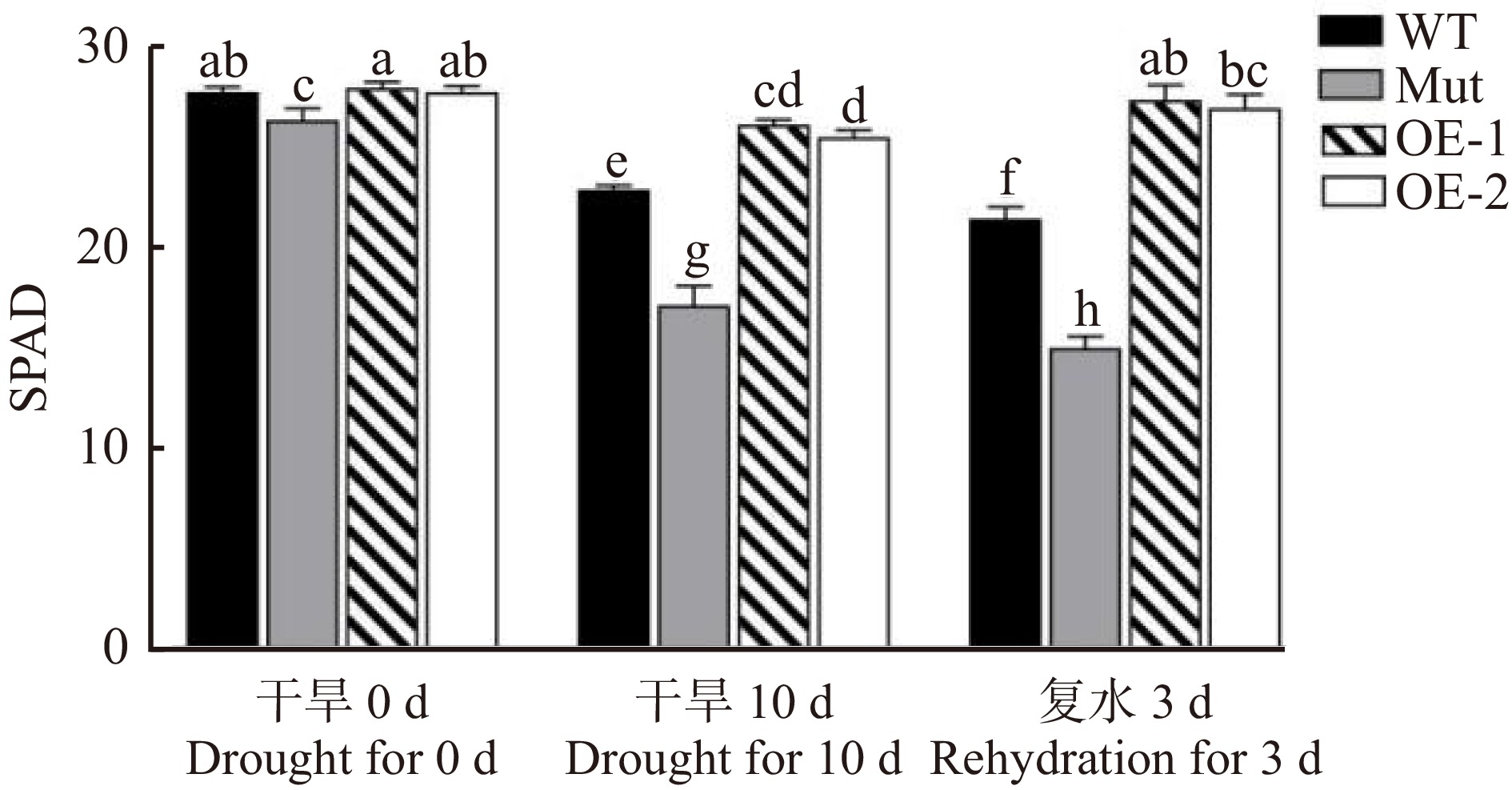
干旱胁迫后拟南芥叶片呈现发黄现象,为检测叶绿素含量变化,分别对干旱处理0 d、10 d、复水3 d的各株系拟南芥叶片进行叶绿素原位测定。图10显示:干旱处理0 d时,除了Mut外,各株系叶绿素含量无显著差异。干旱处理10 d后,各株系叶绿素含量均有显著下降,其中WT和Mut的叶绿素含量下降幅度更大。复水3 d后,转基因株系OE-1和OE-2的叶绿素含量有所升高,但WT和Mut的叶绿素含量进一步下降。这些结果说明:水分亏缺会影响拟南芥叶片中叶绿素的含量,但过表达PeMAX2株系受到的影响较小。
2.8.3 干旱胁迫下拟南芥叶绿素荧光参数变化
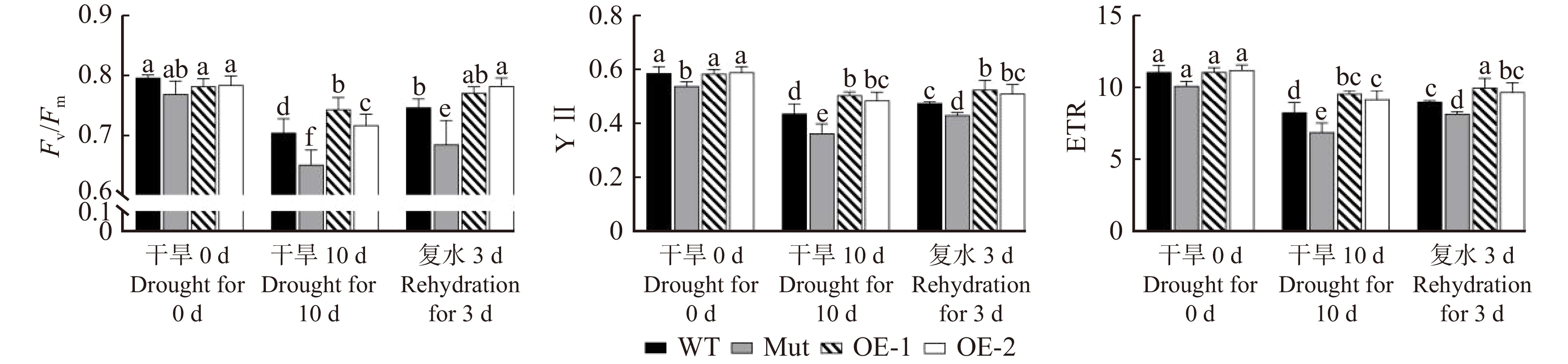
干旱胁迫会影响植物的光合能力,为了研究干旱胁迫对各株系光反应过程的影响,测定了WT、Mut、OE-1、OE-2各株系叶片的叶绿素荧光参数,包括PSⅡ最大光化学效率(Fv/Fm)、实际光合量子产量(YⅡ)和相对电子传递效率(ETR)。
图11显示:在干旱处理0 d,WT、Mut、OE-1、OE-2各株系拟南芥的Fv/Fm没有显著差异;干旱胁迫10 d后,各株系的Fv/Fm显著性下降,其中WT和Mut分别下降11.5%和14.5%,OE-1和OE-2分别下降8.9%和5.1%,转基因株系下降幅度小;复水3 d后,各株系Fv/Fm均有回升,但WT和Mut的Fv/Fm仍显著低于转基因株系OE-1和OE-2。这说明干旱胁迫对PeMAX2过表达株系光反应中心的伤害较小,而对WT和突变体株系光反应中心伤害较大,影响了光反应能力。
![]() 图 11 干旱和复水处理后拟南芥各株系的叶绿素荧光参数变化Fv/Fm. PSⅡ最大光化学效率;YⅡ. 实际光合量子产量;ETR. 相对电子传递效率。Fv/Fm, the maximum photochemical efficiency of PSⅡ; YⅡ, actual quantum yield of photosynthesis; ETR, relative electron transport rate.Figure 11. Changes in chlorophyll fluorescence parameters of Arabidopsis thaliana lines under drought and rehydration treatments
图 11 干旱和复水处理后拟南芥各株系的叶绿素荧光参数变化Fv/Fm. PSⅡ最大光化学效率;YⅡ. 实际光合量子产量;ETR. 相对电子传递效率。Fv/Fm, the maximum photochemical efficiency of PSⅡ; YⅡ, actual quantum yield of photosynthesis; ETR, relative electron transport rate.Figure 11. Changes in chlorophyll fluorescence parameters of Arabidopsis thaliana lines under drought and rehydration treatments除了Mut株系,各株系的YⅡ在干旱处理0 d没有显著差异;干旱胁迫10 d后,WT和Mut株系分别下降27.1%和33.3%,OE-1和OE-2分别下降13.6%和16.9%,说明在干旱胁迫下PeMAX2转基因株系仍能维持较高的实际光合量子产量;复水3 d后,各株系的YⅡ均有所回升,但WT和Mut的YⅡ仍显著低于转基因株系(图11)。
ETR能反映光系统Ⅱ线性电子传递的活性[31],ETR的变化趋势与Fv/Fm相似:即在干旱处理0 d时,各株系的ETR无显著差异;经过10 d干旱胁迫后,各株系ETR显著降低,转基因株系降低幅度相对较小;复水3 d后,各株系ETR数值均有回升,但WT和Mut的ETR仍显著低于转基因株系OE-1和OE-2(图11)。这说明干旱胁迫未明显影响PeMAX2转基因株系光反应过程中的电子传递。
2.8.4 干旱胁迫下拟南芥净光合速率和气孔导度变化
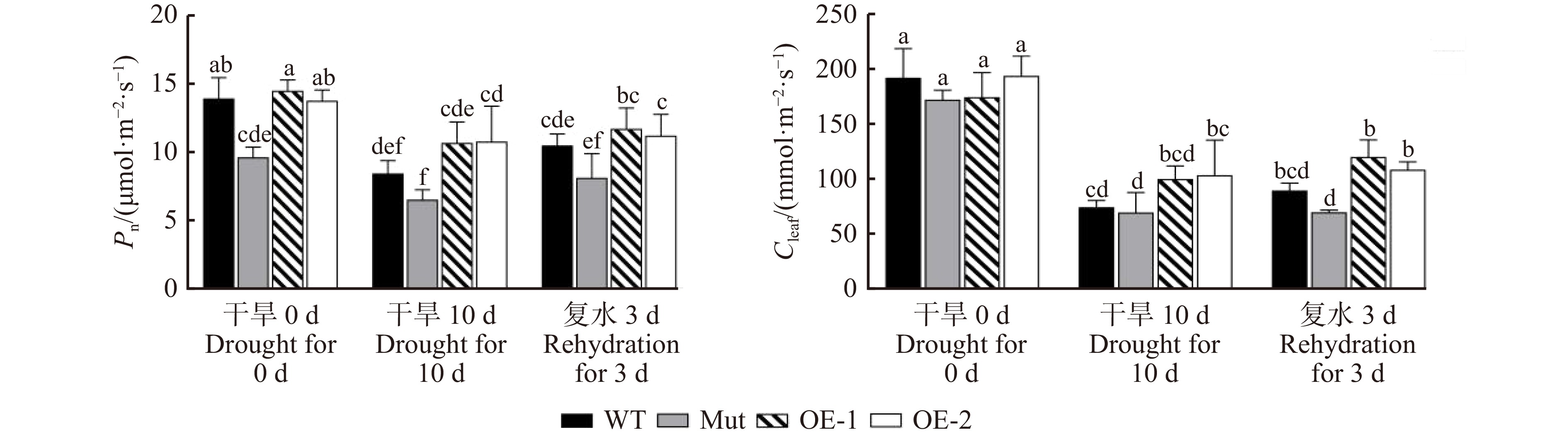
为了探讨长期干旱胁迫对各株系拟南芥碳同化能力的影响,进一步对WT、Mut、OE-1、OE-2拟南芥的净光合速率和气孔导度进行了测定。图12A显示:干旱处理0 d,除Mut外,其他株系之间的净光合速率没有显著差异;干旱处理10 d后,各株系的净光合速率显著降低,其中WT下降39.2%,而OE-1和OE-2各下降26.4%、21.2%,转基因株系净光合速率下降幅度明显低于WT。复水3 d后,各株系的净光合速率虽有所升高,但均不明显。
干旱处理0 d,各株系气孔导度无显著差异。在干旱胁迫下,各株系的气孔导度的变化与净光合速率趋势相似。干旱处理10 d后,各株系气孔导度显著下降,OE-1和OE-2株系的气孔导度高于WT和Mut株系,且下降幅度相对较小。复水3 d后,各株系气孔导度略有恢复,但无显著性升高,转基因株系仍高于WT和Mut株系(图12)。
3. 讨 论
独角金内酯(SL)通过调控水分胁迫下叶片的气孔开度,提高植物的耐旱性[32−33]。本文的研究表明,作为SL信号传导途径核心因子MAX2也同样调控植物对干旱胁迫的响应。甘露醇处理后,胡杨PeMAX2转基因株系OE-1、OE-2的萌发率和根长生长虽受到抑制,但仍显著高于WT和max2突变体,同样,在土壤干旱胁迫下,PeMAX2转基因株系能维持较好的生长态势,长势明显优于WT和max2。这些表型结果说明,过表达胡杨PeMAX2提高了转基因拟南芥对水分胁迫的耐受性。与本研究类似,任广悦[34]在拟南芥中通过超量表达黄瓜(Cucumis sativus)CsMAX2基因,发现转基因拟南芥的萌发率显著高于野生型。将埃及列当的OaMAX2基因在拟南芥Atmax2突变体中过表达,能明显提高转基因拟南芥在干旱胁迫下的生存率[21]。再有,过表达苹果MdMAX2的愈伤组织和拟南芥对干旱胁迫的耐受性增强[22]。本文研究结果表明,胡杨PeMAX2能正向调节植物的耐旱性,这与转基因拟南芥在水分胁迫下维持光合作用、抗氧化能力有关。
长期干旱胁迫条件下,转基因拟南芥的叶片叶绿素含量下降幅度低于WT和max2突变体,有利于光合作用的进行。而且叶绿素动力学荧光诱导曲线的测定结果也证明了PeMAX2转基因拟南芥的光反应能力更强,因此,胡杨PeMAX2有助于缓解干旱胁迫对拟南芥PSⅡ光化学效率的影响。在光合碳同化方面,PeMAX2转基因拟南芥能在干旱胁迫下更好地调节气孔开放,有利于碳同化作用的进行。在拟南芥中过量表达苹果MdMAX2、黄瓜CsMAX2的基因,也发现在干旱胁迫下转基因株系的叶绿素含量显著高于野生型[22,34]。PeMAX2转基因拟南芥能在干旱胁迫下维持光合作用,与其调控气孔开度、保持水分平衡的能力密不可分。An等[22]发现苹果MdMAX2的过表达能提高转基因拟南芥对ABA的敏感度,降低叶片的失水率。有研究表明,拟南芥max2突变体在干旱处理下,植株失水的速率显著高于野生型,且对ABA和干旱诱导的气孔关闭不敏感[32,35],本文研究也证实了max2突变体对土壤干旱和渗透胁迫的敏感表型。因此,推测PeMAX2提高植物的干旱响应可能与ABA信号通路有关。
PeMAX2转基因株系对渗透胁迫具有较高的耐受性,与其较强的ROS清除能力和较高的Ca2+水平有关。甘露醇处理后,PeMAX2转基因株系的抗氧化酶编码基因AtSOD、AtPOD、AtCAT的表达量在渗透胁迫下明显增加,提高了SOD、POD、CAT的酶活,维持活性氧平衡,从而减弱了活性氧对细胞膜、类囊体膜的损伤,提高了转基因株系对水分胁迫的耐受能力。黄瓜CsMAX2基因的过表达也使干旱胁迫相关基因的表达量显著上调[34]。值得注意的是,经甘露醇处理后,PeMAX2转基因拟南芥根尖Ca2+水平显著高于WT和max2。作为第二信使,Ca2+水平的提升有助于提高转基因株系的信号传导功能,使其可以快速响应渗透胁迫信号,提高活性氧清除能力,减轻ROS积累对植株细胞膜的损伤,从而提高PeMAX2转基因拟南芥耐受水分胁迫的能力。Rezayian等[36]也发现,在干旱胁迫下,通过外源施加Ca2+可以显著提高抗氧化酶活性,降低油菜植株体内H2O2含量,提高耐旱能力。
综上所述,胡杨PeMAX2通过提高转基因拟南芥的活性氧平衡能力和光合能力,增强了耐旱性。本文通过探讨独角金内酯信号途径核心因子MAX2对水分胁迫的响应,进一步揭示了独角金内酯信号途径调控植物耐旱性的生理机制。
-
图 6 甘露醇(250 mmol/L)胁迫下拟南芥各株系根细胞H2O2荧光强度的变化
A. 不同胁迫下拟南芥根细胞H2O2的绿色荧光,比例尺=100 μm ;B.根细胞中H2O2的荧光强度。A, green fluorescence of H2O2 in Arabidopsis thaliana root cells under different treatments,scale bar=100 μm; B, H2O2 fluorescence intensity of root cells.
Figure 6. Changes of H2O2 fluorescence intensity in root cells of different Arabidopsis thaliana lines under mannitol stress (250 mmol/L)
图 7 甘露醇(250 mmol/L)胁迫下拟南芥各株系根细胞Ca2+荧光强度的变化
A. 不同胁迫下拟南芥根细胞Ca2+的红色荧光,比例尺 = 100 μm;B. 根细胞Ca2+荧光强度。A. red fluorescence of Ca2+ in Arabidopsis thaliana root cells under different treatments, scale bar = 100 μm; B, Ca2+ fluorescence intensity of root cells.
Figure 7. Changes of Ca2+ fluorescence intensity in root cells of different Arabidopsis thaliana lines under mannitol stress (250 mmol/L)
图 9 干旱和复水处理对不同拟南芥株系生长状况的影响
A. 干旱和复水处理后拟南芥生长状况;B. 干旱和复水处理后土壤湿度变化。A, plant performance of Arabidopsis thaliana after treatment of drought and rehydration; B, changes of soil moisture after drought and rehydration treatments.
Figure 9. Effects of drought and rehydration treatments on plant performance of different Arabidopsis thaliana lines
图 11 干旱和复水处理后拟南芥各株系的叶绿素荧光参数变化
Fv/Fm. PSⅡ最大光化学效率;YⅡ. 实际光合量子产量;ETR. 相对电子传递效率。Fv/Fm, the maximum photochemical efficiency of PSⅡ; YⅡ, actual quantum yield of photosynthesis; ETR, relative electron transport rate.
Figure 11. Changes in chlorophyll fluorescence parameters of Arabidopsis thaliana lines under drought and rehydration treatments
表 1 本研究所用引物及序列
Table 1 Primers and sequences used in this study
基因名称
Primer name正向引物(5′—3′)
Forward primer (5′−3′)反向引物(5′—3′)
Reverse primer (5′−3′)PeMAX2-qPCR GGCTCTTAGGAGCATCGACC TGCCGTGATTGCCTGAATCT PeMAX2 CCGCAAGCTTGTCGACATGGCCAGTTCCAGTATG AATGGGTCGCGGATCCGTCGAGGATCTGACGCC PeActin7 ATTGGCCTTGGGGTTAAGAG CACACTGGAGTGATGGTTGG AtACTIN2 GGTAACATTGTGCTCAGTGGTGG AACGACCTTAATCTTCATGCTGC AtSOD AGGAAACATCACTGTTGGAGAT GAGTTTGGTCCAGTAAGAGGAA AtPOD CGTGCCCTTCATATTGTTGG GACGCCATCAACAACGAGTC AtCAT AGGATCAAACTTTGAGGGGTAG CTTGTGGTTCCTGGAATCTACT -
[1] Toh S, Holbrook-Smith D, Stogios P J, et al. Structure-function analysis identifies highly sensitive strigolactone receptors in Striga[J]. Science, 2015, 350: 203−207. doi: 10.1126/science.aac9476
[2] Li B W, Gao S, Yang Z M, et al. The F-box E3 ubiquitin ligase AtSDR is involved in salt and drought stress responses in Arabidopsis[J]. Gene, 2021, 809: 146011.
[3] Carbonnel S, Torabi S, Gutjahr C. MAX2-independent transcriptional responses to rac-GR24 in Lotus japonicus roots[J]. Plant Signaling & Behavior, 2021, 16(1): 1840852.
[4] Yu H C, Wu J, Xu N F, et al. Roles of F-box proteins in plant hormone responses[J]. Acta BiochimBiophys Sin (Shanghai), 2007, 39(12): 915−922. doi: 10.1111/j.1745-7270.2007.00358.x
[5] Wang L, Wang B, Yu H, et al. Transcriptional regulation of strigolactone signalling in Arabidopsis[J]. Nature, 2020, 583: 277−281. doi: 10.1038/s41586-020-2382-x
[6] Stirnberg P, van de Sande K, Leyser H M O, et al. MAX1 and MAX2 control shoot lateral branching in Arabidopsis[J]. Development, 2002, 129(5): 1131−1141. doi: 10.1242/dev.129.5.1131
[7] Bennett T, Sieberer T, Willett B, et al. The Arabidopsis MAX pathway controls shoot branching by regulating auxin transport[J]. Current Biology, 2006, 16(6): 553−563. doi: 10.1016/j.cub.2006.01.058
[8] Hayward A, Stirnberg P, Beveridge C, et al. Interactions between auxin and strigolactone in shoot branching control[J]. Plant Physiology, 2009, 151(1): 400−412. doi: 10.1104/pp.109.137646
[9] Stirnberg P, Furner I J, Leyser H M O, et al. MAX2 participates in an SCF complex which acts locally at the node to suppress shoot branching[J]. The Plant Journal, 2007, 50(1): 80−94. doi: 10.1111/j.1365-313X.2007.03032.x
[10] 王闵霞, 彭鹏, 龙海馨, 等. 独脚金内酯途径相关基因的研究进展[J]. 分子植物育种, 2014, 12(3): 603−609. Wang M X, Peng P, Long H X, et al. Progress in cloning of strigolactone-related genes[J]. Molecular Plant Breeding, 2014, 12(3): 603−609.
[11] Waters M T, Scaffidi A, Flematti G R, et al. The origins and mechanisms of karrikin signaling[J]. Current Opinion in Plant Biology, 2013, 16(5): 667−673. doi: 10.1016/j.pbi.2013.07.005
[12] Bunsick M, Toh S, Wong C, et al. SMAX1-dependent seed germination bypasses GA signalling in Arabidopsis and Striga[J]. Nature Plants, 2020, 6(6): 646−652. doi: 10.1038/s41477-020-0653-z
[13] Bursch K, Niemann E T, Nelson D C, et al. Karrikins control seedling photomorphogenesis and anthocyanin biosynthesis through a HY5-BBX transcriptional module[J]. Plant Journal, 2021, 107(5): 1346−1362. doi: 10.1111/tpj.15383
[14] Zhao L L, Fang J J, Xing J, et al. Identification and functional analysis of two cotton orthologs of MAX2 which control shoot lateral branching[J]. Plant Molecular Biology Reporter, 2017, 35(5): 480−490. doi: 10.1007/s11105-017-1040-4
[15] Al-Babili S, Bouwmeester H J. Strigolactones, a novel carotenoid-derived plant hormone[J]. Annual Review of Plant Biology, 2015, 66(1): 161−186. doi: 10.1146/annurev-arplant-043014-114759
[16] Swarbreck S M, Guerringue Y, Matthus E, et al. Impairment in karrikin but not strigolactone sensing enhances root skewing in Arabidopsis thaliana[J]. The Plant Journal, 2019, 98(4): 607−621. doi: 10.1111/tpj.14233
[17] Osnato M. Not too short and not too long: SMAX1 optimizes hypocotyl length at warmer temperature[J]. The Plant Cell, 2022, 34(7): 2580−2581. doi: 10.1093/plcell/koac125
[18] Yao C, Finlayson S A. Abscisic acid is a general negative regulator of Arabidopsis axillary bud growth[J]. Plant Physiology, 2015, 169(1): 611−626. doi: 10.1104/pp.15.00682
[19] Li W Q, Nguyen K H, Ha C V, et al. Crosstalk between the cytokinin and MAX2 signaling pathways in growth and callus formation of Arabidopsis thaliana[J]. Biochemical and Biophysical Research Communications, 2019, 511(2): 300−306. doi: 10.1016/j.bbrc.2019.02.038
[20] Bu Q Y, Lü T X, Shen H, et al. Regulation of drought tolerance by the F-box protein MAX2 in Arabidopsis[J]. Plant Physiology, 2014, 164(1): 424−439. doi: 10.1104/pp.113.226837
[21] Li W Q, Nguyen K H, Watanabe Y, et al. OaMAX2 of Orobanche aegyptiaca and Arabidopsis AtMAX2 share conserved functions in both development and drought responses[J]. Biochemical and Biophysical Research Communications, 2016, 478(2): 521−526. doi: 10.1016/j.bbrc.2016.07.065
[22] An J P, Li R, Qu F J, et al. Apple F-box protein MdMAX2 regulates plant photomorphogenesis and stress response[J]. Frontiers in Plant Science, 2016, 7: 1685.
[23] Fu X J, Wang J, Shangguan T W, et al. SMXLs regulate seed germination under salinity and drought stress in soybean[J]. Plant Growth Regulation, 2022, 96(3): 397−408. doi: 10.1007/s10725-021-00786-6
[24] 侯思源, 张会龙, 尧俊, 等. 胡杨PeREM6.5调控拟南芥水分胁迫耐受机制[J]. 北京林业大学学报, 2022, 44(9): 40−51. doi: 10.12171/j.1000-1522.20210195 Hou S Y, Zhang H L, Yao J, et al. Populus euphratica PeREM6.5 regulating tolerance mechanism to water stress in Arabidopsis thaliana[J]. Journal of Beijing Forestry University, 2022, 44(9): 40−51. doi: 10.12171/j.1000-1522.20210195
[25] 武霞, 张一南, 赵楠, 等. 过表达胡杨PeAnn1负调控拟南芥的抗旱性[J]. 北京林业大学学报, 2020, 42(6): 14−25. doi: 10.12171/j.1000-1522.20200031 Wu X, Zhang Y N, Zhao N, et al. Overexpression of PeAnn1 from Populus euphratica negatively regulates drought resistance in transgenic Arabidopsis thaliana[J]. Journal of Beijing Forestry University, 2020, 42(6): 14−25. doi: 10.12171/j.1000-1522.20200031
[26] Ge X L, Zhang L, Du J J, et al. Transcriptome analysis of Populus euphratica under salt treatment and PeERF1 gene enhances salt tolerance in transgenic Populus alba × Populus glandulosa[J]. International Journal of Molecular Sciences, 2022, 23(7): 3727. doi: 10.3390/ijms23073727
[27] 尧俊. 胡杨转录调节因子PeWRKY1调控离子平衡分子网络研究[D]. 北京: 北京林业大学, 2020. Yao J. Populus euphratica transcription factor PeWRKY1 mediates signaling network conferring ionic homeostasis under salt stress[D]. Beijing: Beijing Forestry University, 2020.
[28] Abbasi G H, Ijaz M, Akhtar J, et al. Profiling of anti-oxidative enzymes and lipid peroxidation in leaves of salt tolerant and salt sensitive maize hybrids under NaCl and Cd stress[J]. Sains Malaysiana, 2016, 45(2): 177−184.
[29] Aalifar M, Aliniaeifard S, Arab M, et al. Blue light improves vase life of carnation cut flowers through its effect on the antioxidant defense system[J]. Frontiers in Plant Science, 2020, 11: 511. doi: 10.3389/fpls.2020.00511
[30] Jia M X, Jiang X R, Xu J, et al. CAT and MDH improve the germination and alleviate the oxidative stress of cryopreserved Paeonia and Magnolia pollen[J]. Acta Physiologiae Plantarum, 2018, 40(2): 1−10.
[31] Du G Y, Li X J, Wang J H, et al. Discrepancy in photosynthetic responses of the red alga Pyropia yezoensis to dehydration stresses under exposure to desiccation, high salinity, and high mannitol concentration[J]. Marine Life Science & Technology, 2021, 4(1): 10−17.
[32] Ha C V, Leyva-Gonzalez M A, Osakabe Y, et al. Positive regulatory role of strigolactone in plant responses to drought and salt stress[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(2): 851−856.
[33] Liu J W, He H Z, Vitali M, et al. Osmotic stress represses strigolactone biosynthesis in Lotus japonicus roots: exploring the interaction between strigolactones and ABA under abiotic stress[J]. Planta, 2015, 241(6): 1435−1451. doi: 10.1007/s00425-015-2266-8
[34] 任广悦. 黄瓜SLs信号转导基因CsMAX2的克隆及抗逆功能验证[D]. 哈尔滨: 哈尔滨师范大学, 2020. Ren G Y. Cloning of SLs signal transduction gene CsMAX2 in Cucumis sativus L. and verification of stress resistance[D]. Harbin: Harbin Normal University, 2020.
[35] 吕天晓. 拟南芥MAX2蛋白介导ABA及抗旱反应的分子机制[D]. 长春: 中国科学院东北地理与农业生态研究所, 2015. Lü T X. Functional analysis of MAX2 in regulating ABA signaling and drought stress response in Arabidopsis[D]. Changchun: Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, 2015.
[36] Rezayian M, Niknam V, Ebrahimzadeh H. Penconazole and calcium ameliorate drought stress in canola by upregulating the antioxidative enzymes[J]. Functional Plant Biology, 2020, 47(9): 825−839. doi: 10.1071/FP19341
-
期刊类型引用(3)
1. 张玉翠,闫彩霞,赵琳,谭江红,王成,袁良. 基于MaxEnt模型的不同气候情景下湖北紫荆潜在适生区变化分析. 河南农业科学. 2025(01): 160-169 .  百度学术
百度学术
2. 闫文静,朱学慧,朱玉永. 基于最大熵(MaxEnt)模型预测黄花刺茄、假高粱及毒麦在我国的适生区. 杂草学报. 2024(02): 44-56 .  百度学术
百度学术
3. 李华,覃阳平,罗春林,杨海方,侯文通. 基于MaxEnt模型的云南省华山松潜在适生区研究. 林业调查规划. 2024(05): 24-31 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: