Functional research of transcription factor CmHAT1 regulating the development of somatic embryo in Castanea mollissima
-
摘要:目的
体细胞胚胎发生是板栗有效的离体再生方法。然而,目前板栗体细胞胚胎由于发育慢、再生效率低等问题,制约了板栗体细胞胚胎的再生进程,难以在后续基因功能验证和新种质创制过程中发挥作用。本文旨在通过研究HD-ZIPⅡ基因家族成员CmHAT1在板栗体细胞胚胎发育过程中的作用,进一步加速板栗体细胞胚胎的发育进程。
方法利用生物信息学的方法鉴定了板栗HD-ZIPⅡ基因家族成员,并分析了该家族成员在板栗体细胞胚胎不同发育时期的表达情况,筛选调控体细胞胚胎发育的关键候选基因CmHAT。进一步通过烟草亚细胞定位实验、荧光定量和遗传转化方法,研究关键基因CmHAT的亚细胞定位和基因功能。
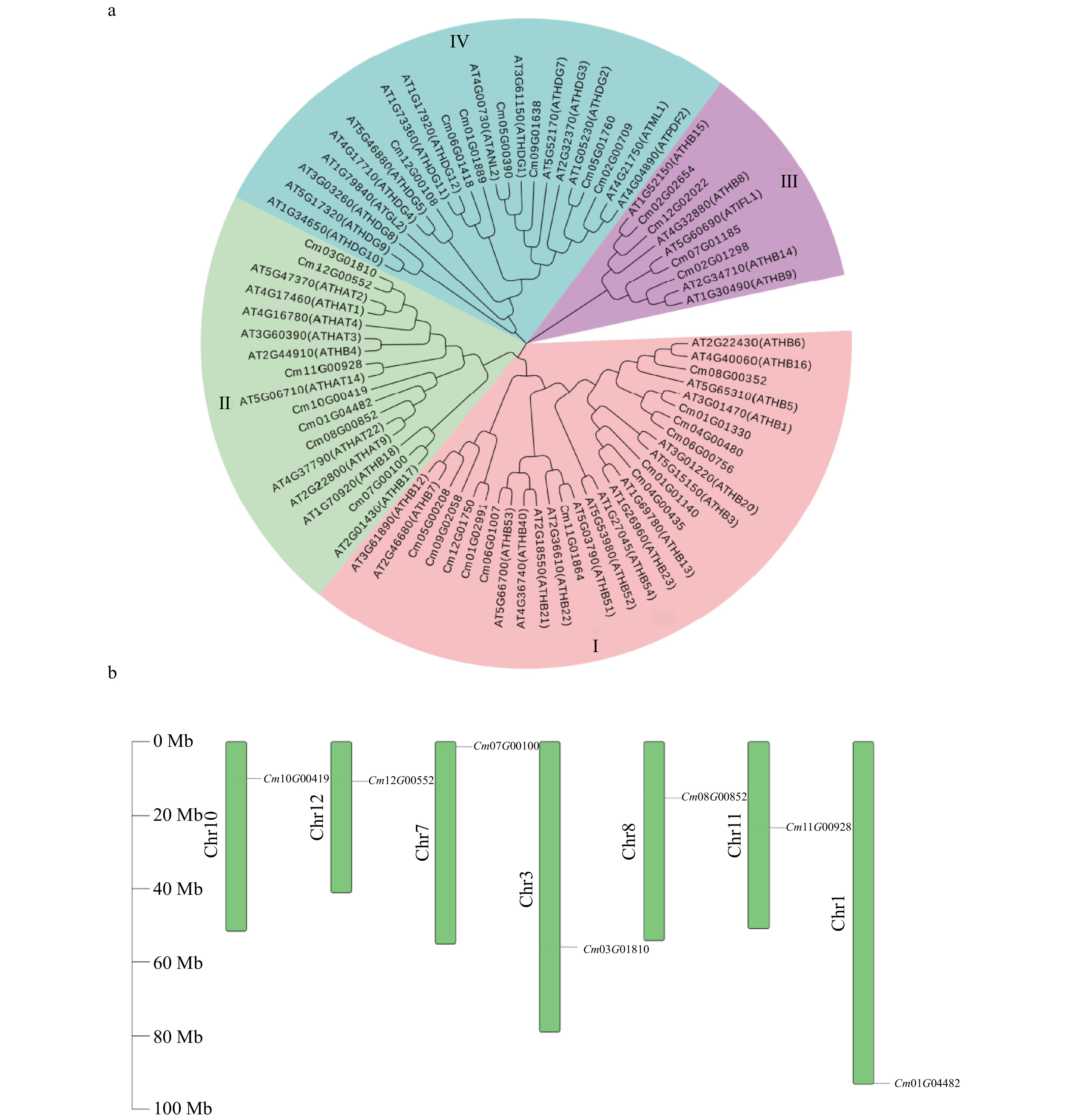
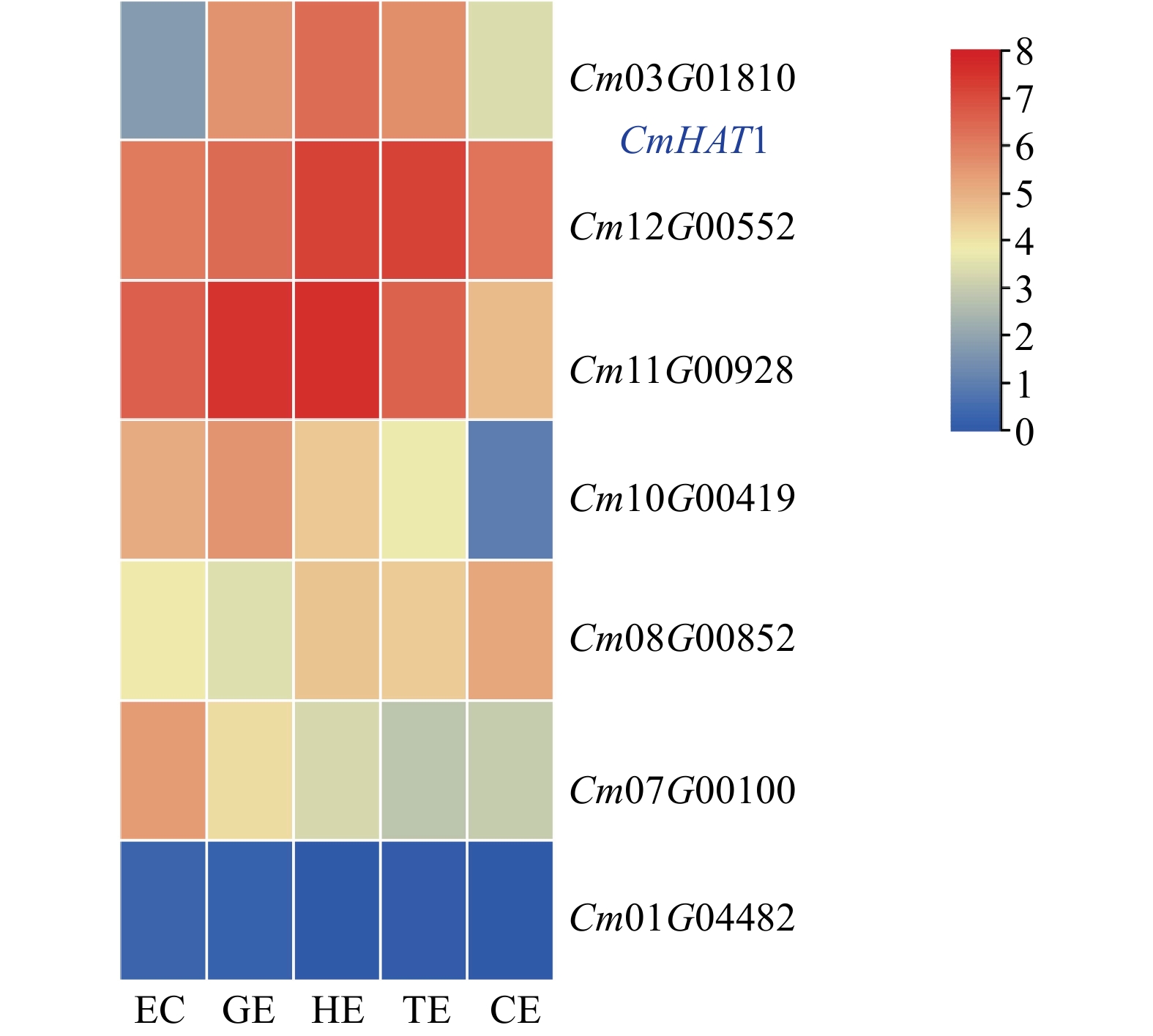
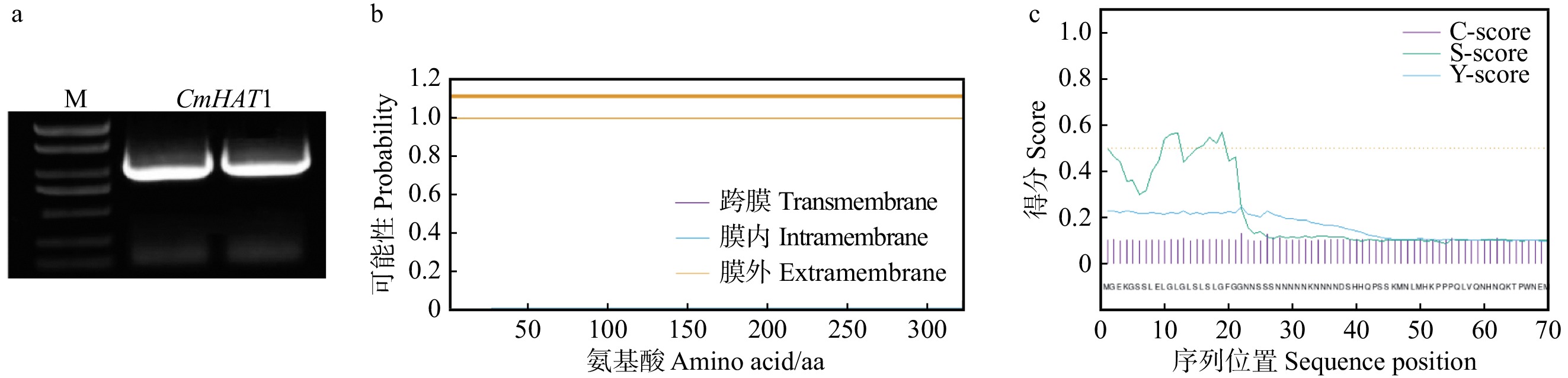
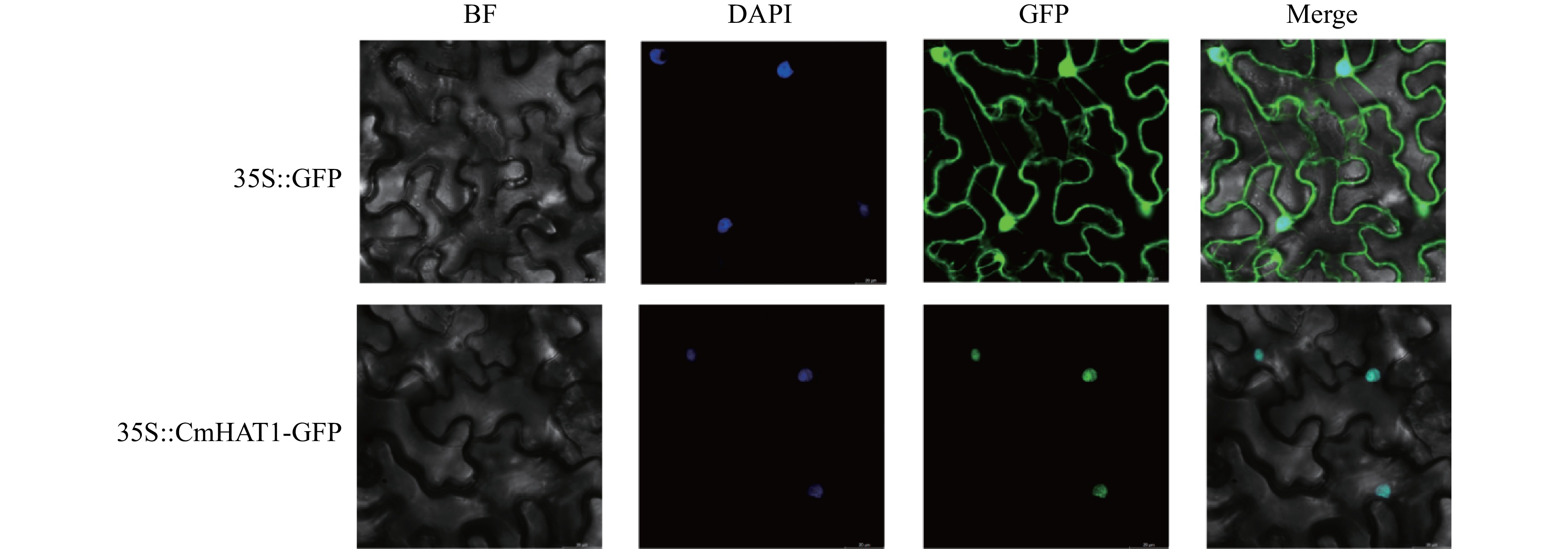
结果(1)板栗HD-ZIPⅡ基因家族有7个成员,大部分CmHD-ZIP Ⅱ 成员在板栗体细胞胚胎发育时期均有表达,其中CmHAT1在愈伤组织时期表达较低,在球形胚时期表达上调,心形胚时期表达最高,而在子叶形胚时期表达下调,因此筛选出CmHAT1作为调控体细胞胚胎发育的关键候选基因。(2)CmHAT1定位在细胞核;与转化空载体相比,过表达CmHAT1使体细胞胚胎数量显著减少,体细胞胚胎体积显著增大,而沉默CmHAT1后体细胞胚胎的表型没有显著性差异。
结论在同等质量的愈伤诱导体细胞胚胎的情况下,过表达CmHAT1后可以调控板栗体细胞胚胎的数量和体积,影响体细胞胚胎的发育。本研究为进一步优化板栗再生体系和遗传转化体系奠定了基础,为利用体细胞胚胎系统创制板栗新种质提供了科学依据。
Abstract:ObjectiveSomatic embryogenesis is an effective approach to in vitro regeneration of Chinese chestnut. However, the slow development of somatic embryos and the low reproduction efficiency of somatic embryos in Castanea mollissima, which had limited the regeneration process of somatic embryo of Chinese chestnut, and it is difficult to provide technical support for the verification of gene function and the creation of new germplasm. The purpose of this study was to investigate the role of CmHAT1, a member of HD-ZIP Ⅱ gene family, in the development of somatic embryo, and to further accelerate the development of somatic embryo in Chinese chestnut.
MethodThe bioinformatics analysis was used to identify the Chinese chestnut HD-Zip gene family, the expression of the family members was analyzed in different developmental stages of Chinese chestnut somatic embryo, and the key candidate gene CmHAT was screened for regulating somatic embryo development. Further, the subcellular localization and gene function of CmHAT were analyzed by tobacco subcellular localization experiment, RT-qPCR and genetic transformation.
Result(1) There were 7 members of the Chinese chestnut HD-ZIP Ⅱ gene family, most CmHD-ZIP Ⅱ members were expressed in somatic embryo development of Chinese chestnut. CmHAT1 was lowly expressed in callus, up-regulated in globular embryos, highly expressed in heart embryo, and down-regulated in cotyledonary embryo. Therefore, CmHAT1 was selected as a candidate gene for regulating somatic embryo development. (2) CmHAT1 was localized in the nucleus, compared with empty vector transformation, overexpression of CmHAT1 significantly reduced the number of somatic embryos and increased the volume of somatic embryos, while there was no significant difference in phenotype of somatic embryos after CmHAT1 silencing.
ConclusionIn the case of somatic embryos induced by callus of the same quality, overexpression of CmHAT1 can regulate the number of somatic embryo and the volume of somatic embryo, affecting the development of somatic embryo in Chinese chestnut. This study lays a solid foundation for the establishment of regeneration system and genetic transformation system, and accelerates the creation of new and excellent germplasm of Chinese chestnut.
-
Keywords:
- Chinese chestnut /
- CmHAT1 /
- somatic embryo development /
- functional research
-
火行为(Fire behavior)是指可燃物被引燃、发展、蔓延直至熄灭整个过程表现出来的综合特征[1]。常见林火类型有地表火、地下火、树冠火,还包括飞火、火旋风等特殊类型[2-4],不同的林火种类表现出不同的火行为,而林下可燃物、火环境(气象、地形和植被)及火源等条件制约着林火的发生[5-6],直接影响火行为的发生、发展和蔓延[7]。
近年来,国内外学者对可燃物火行为特征进行了大量的研究。Klutsch等[8]利用美国科罗拉多州中北部地区松树(Pinus spp.)建群种,研究山松甲虫(Dendroctonus ponderosae)爆发后的潜在火行为特征,指出山松甲虫引起林分和可燃物特性的变化造成了地表火行为增加。Goodrick等[9]应用地表火行为模拟系统,选择美国南部地区不同林龄桉树(Eucalyptus robusta)为研究对象,评估美国南部桉树潜在火行为风险变化。王秋华等[10]利用BehavePlus软件对昆明西山国家森林公园主要树种进行潜在火行为特征研究,指出可燃物负荷量对火行为起到决定性作用。王凯等[11]基于Rothermel模型在不同含水率下对北京鹫峰国家森林公园的潜在火行为进行了探究,认为较低含水率有利于地表火的发生和蔓延。可以看出,对潜在火行为的研究主要集中在小尺度、生物学、生态学特征上的评价分析,而林下植物的组成、生长状况、空间分布和配置等林分因子对潜在火行为的影响研究较少。
本文以北京妙峰山林场分布最广、面积最大、最有代表性的油松(Pinus tabuliformis)林为研究对象,通过Rothermel模型[12]计算油松林地表潜在火行为指标,利用相关性分析、回归分析和方差分解法,探讨油松林地表潜在火行为特征与林分结构指数的相关性,期望通过林分结构调整可以有效降低地表潜在火行为,对控制森林火灾发生、发展具现实意义[13-14]。
1. 研究区概况
北京妙峰山位于北京海淀区(39°54′N、116°28′E),横跨海淀、门头沟2区,总面积832.04hm2。海拔为100~1153m,坡度16°~35°。属于暖温带大陆性季风气候,年均气温为12.2℃,最高气温39.7℃,最低气温-19.6℃,年降水量近700mm,多集中在7—8月,占全年降水量75%。
该地区自然资源丰富,森林覆盖率高达96.2%。天然植被为典型的暖温带落叶阔叶林,现在以次生林和人工林为主。目前主要的森林类型是以油松和侧柏(Platycladus orientalis)为主的针叶林,山顶区域覆盖有部分华北落叶松林(Larix principis-rupprechtii); 阔叶林主要为栓皮栎(Quercus variabilis)林、槲栎(Q. aliena)及刺槐(Robinia pseudoacacia)林。林下植被主要由荆条(Vitex negundo var. heterophylla)、小叶鼠李(Rhamnus parvifolia)、孩儿拳头(Grewia biloba)、胡枝子(Lespedeza fioribunda)、绣线菊(Spiraea trilobata)等灌木和茜草(Rubies cordifolia)、求米草(Cheuopodium album)、狗尾草(Setaira viridis)披针叶苔草(Carex lanceolata)等草本组成。
2. 研究方法
2.1 外业调查
通过对研究区域的全面踏查,选择连续性较好、人为干扰较少具有代表性地段的油松林,分年龄阶段和林分结构设置8块20m×20m标准地。在每个标准地内,测定林分郁闭度、海拔、坡度、坡向和坡位,对林分的乔木层、灌木层、草本枯枝落叶层进行调查。分树种测定树高、胸径、冠幅、活枝下高和死枝下高。在标准地内设置5m×5m样方16个,进行灌木、草本和枯枝落叶层调查。在5m×5m样方内测定灌木种类、灌木盖度、高度,全部收割并分别称质量、取样; 收集10时滞和100时滞枯枝,称质量,取样。在每个5m×5m样方内,固定一个角设置1m×1m样方1个,测定草本植物种类、盖度和高度,分种类收割并称质量、取样; 收集1m×1m样方内1时滞枯枝,称质量、取样; 枯枝落叶上层,收集、称质量、取样; 并测定各层的厚度。可燃物干质量测定,使用塑料袋装载,电子钩秤(精度1g)称取质量,并扣除塑料袋的质量; 采集样品100g左右放入统一规格的牛皮纸信封内,采用电子天平(精度0.01g)称质量,记载日期、标准地号、可燃物种类、质量。把样品带回实验室对可燃物理化性质进行测定。其中,可燃物种类划分标准见表 1[15-16]。
表 1 可燃物种类划分标准Table 1. Classification criteria for fuel类别Category 灌木层Shrub layer 草本层Herbal layer 枯枝落叶层Litter layer 规格Specification 叶Leaf 鲜草Fresh grass 活可燃物Living combustible 小枝Small branch 直径Diameter < 1cm 大枝Big branch 直径Diameter≥1cm 枯草Withered grass 1时滞枯枝Dead branch 1hr 直径Diameter < 0.6cm 枯死可燃物Dead combustible 10时滞枯枝Dead branch 10hr 0.6~2.5cm 100时滞枯枝Dead branch 100hr 2.5~7.5cm 枯叶Withered leaf 落叶层Leaf litter layer 2.2 实验方法与计算
2.2.1 可燃物理化性质
野外采集的样品放入电热风干燥箱内,在105℃条件下,将可燃物烘干至恒质量,根据样品干湿比及野外调查的各类可燃物质量,得出每个样方可燃物负荷量计算公式:
Woi=n∑j=1Woij=n∑j=1WijSj (1) 式中:Woi为第i个样方的有效可燃物负荷量(kg/m2),Woij为第i个样方第j种类可燃物负荷量(kg/m2),Wij为第i个样方第j种类可燃物干质量(kg),Sj为第j种类可燃物调查的样方面积(m2)。
将野外样品烘干、粉碎,取1g压成样品块,再烘干去除水分,用分析天平准确称量(精确到0.0001g),使用PRR3600型全自动氧弹式热量仪测定样品的热值(kJ/kg)。每种可燃物样品做3个重复,求平均值。采用可燃物负荷量加权平均法,计算林分层次可燃物种类的加权平均热值。
最后,根据牛树奎等[15]、Wagner[17]、Bradshaw等[18]研究,有效可燃物总矿质含量0.0555,有效矿质含量0.010;1时滞表面积体积比1250m-1,10时滞表面积体积比253m-1,100时滞表面积体积比77m-1,1000时滞表面积与体积比6.7m-1。参考牛树奎等[15-16]利用表面积载量加权平均法,计算样方可燃物的理化性质。
2.2.2 地表潜在火行为指标计算
胡海清等[1]、Bradstock等[2]和Rothermel[12]指出地表潜在火行为指标普遍较多,通常蔓延速度(Spread speed,R)、火强度(Fire intensity,I)和单位面积热量释放(Heat release per unit area,HPA)这3个指标最具有代表性,能够充分显示出不同森林类型地表潜在火行为状况。因此,本文选择地表火蔓延速度、地表火强度和地表单位面积热量释放作为地表潜在火行为的评价指标。
(1) 地表潜在火行为的计算参考Rothermel模型[12]。其中,反应强度(IR)与可燃物热值、有效负荷量、潜在反应速率、矿物质抑制系数、水分阻滞系数成正比。参考单延龙等[19]转换为国际标准:
R=IRξ(1+ΦW+ΦS)ρbεQg (2) 式中:R为火蔓延速度(m/min),IR为反应强度(kJ/(m2·min)),ξ为与热传导有关的系数,ΦW和ΦS分别为风速和坡度影响系数,ρb为复合可燃物烘干颗粒体密度(kg/m2),ε为与体密度有关的加热系数,Qg点燃单位质量可燃物需要的热量(kJ/kg)。
(2) 地表火强度主要是指燃烧时火头释放热量的速度,是火行为重要指标之一,直接与火焰强度有关[1]。美国物理学家Byram[20]在1959年提出计算火线强度公式。本研究参考单延龙等[19]和牛树奎等[15-16]转换为国际标准:
I=160HWR (3) 式中:I为火线强度(kW/m),H为可燃物热值(kJ/kg),W为有效可燃物负荷量(kg/m2),R为林火的蔓延速度(m/min)。
(3) 单位面积释放热量是指地表火头前端单位面积所释放的热量,不受外界环境的影响仅受可燃物负荷量与其热值的影响[1],一般由以下公式计算[21]:
HPA=TRIR=1259.5IRσ (4) 式中:HPA为单位面积释放热量(kJ/m2),IR为反应强度(kJ/(m2·min)),TR为驻留时间(min),σ为可燃物表面积与体积比的负荷量加权平均值(m-1)。
2.2.3 林分结构指数
本文研究的林分结构包括乔木层和地表层2个主层级,地表层又分为灌木层和草本枯枝落叶层。乔木层选择平均胸径(The average DBH,Dg, cm)、平均树高(The average height,H, m)、平均枝下高(Height of the lowest branches,Ht, m)、平均冠幅(Cverage crown,Ct, m)、冠长率(Rate of crown length,TCRt, %)[22]。地表层包括灌木层和草本枯枝落叶层[22]。其中灌木选择灌木密度(Shrubs density,BDs, kg/m3)、平均盖度(Average coverage,Cs, %)、灌木株数(Shrub number,N)、灌木高度(The average height,Hs, m)这几个指标[23]。草本枯枝落叶层主要选择床层高度(Bed heigh,h, m)、草本盖度(Average coverage,Ch, %)、紧密度(Tightness,β)[12]。
2.2.4 数据处理
本研究使用SPSS 21.0、R统计软件和Ecxel 2016进行数据计算。利用Rothermel模型计算的地表潜在火行为特征值采用箱式图表示,这样可以直观的看出油松林地表潜在火行为的分布特点,分析比较多组数据平均水平和变异程度[24]。
使用SPSS 21.0统计软件进行相关性和回归分析,首先分析地表潜在火行为和林分因子的关系,接着选择与地表潜在火行为有显著相关性的林分结构指标,分析潜在火行为随林分结构的具体变化趋势,最后利用方差分解法计算各层林分结构因子对地表潜在火行为影响的贡献率。其中,方差分解一般分为3个步骤:求取各方差组分、方差各组分的显著性检验、拟合值作图,整个过程可以由R统计软件中的Vegan软件包实现[25]。
3. 结果与分析
3.1 油松林地表潜在火行为特征分析
北京市在防火季节的最大风速为7.6~4.0m/s,平均为5.8m/s。由于森林对风的削减作用,接近树冠时风速降低,一般按照直减率0.4[26],则林下取风速2m/s,作为作用在火焰上的风速平均值,坡度值按照样地调查坡度。由于本文只考虑林分因子对地表潜在火行为的影响,因此设置外界条件相同。
图 1为油松林地表潜在火行为特征值的箱式图,反映了油松林潜在火强度、火蔓延速度和单位面积热量3个指标的最大值、最小值、平均水平、集中区域及变化程度。
在森林火灾防控中,一般将火强度划分为不同的等级:低强度火(350~750kW/m)、中强度火(750~3500kW/m)、高强度火(3500kW/m)[27]。由图 1可以看出,油松林地表潜在火行为普遍处于较小范围,为低强度地表火。其中,蔓延速度主要集中在2~6m/min,均值为3m/min,最小值1.5m/min,最大值10.5m/min,有4个特殊值分别为11、15、20、23m/min。火强度主要集中在300~1400kW/m,含有4个特殊值1900、2100、2800、3100kW/m。单位面积释放的热量主要集中于4000~5500kJ/m2之间,也有4个特殊值都在8000kJ/m2以上。某些油松林一方面受到局部地形的影响,特别是小部分凸起的地形,有利于可燃物积累和林火的蔓延; 另一方面该油松林为成熟林,人为干扰小,导致林内较干燥,可燃物积累较多,多种因素综合作用下导致个别油松林潜在火行为较大。
3.2 油松地表潜在火行为与林分结构的关系
可燃物的潜在火行为除受到风速、坡度、含水率等外界环境和自身理化性质的影响,同时还受林分结构的影响。表 2为地表可燃物潜在火行为和林分因子的Pearson关系。
表 2 油松林地表潜在火行为与林分结构的相关系数Table 2. Correlation coefficients between surface fire behavior and stand structure of Pinus tabuliformis可燃物层Combustible layer 相关性系数Correlation coefficient R I HPA 乔木层Tree layer 平均枝下高Average height of the lowest branches (Ht) 0.220 0.218 0.139 平均冠幅Average crown width (Ct) -0.038 -0.042 0.168 冠长率Rate of crown length (TCRt) 0.136 0.151 -0.101 平均胸径Average DBH (Dg) 0.134 0.164 0.281 平均树高Average tree height (H) 0.391* 0.399* 0.075 地表层
Surface layer灌木层Shrub layer 灌层密度Shrub density (BDs) -0.427** -0.361* 0.219 平均盖度Average coverage (Cs) -0.241 -0.217 -0.065 平均高度Average height (Hs) 0.013 0.150 0.360* 株数Shrub number (N) -0.372* -0.346* -0.044 草本枯枝落叶层
Herb and fuel litter layer床层高度Bed height (h) 0.539** 0.519** -0.034 紧密度Tightness (β) 0.290 0.391* 0.482** 平均盖度Average coverage (Ch) 0.523** 0.524** -0.289 注:**表示在P < 0.01水平上极显著相关,*表示在P < 0.05水平上显著相关。Notes: ** means significant correlation at P < 0.01 level (bilateral), * means significant correlation at P < 0.05 level (bilateral). 在表 2中,各层林分结构指数与地表潜在火行为的相关性系数差异较大。其中,h、β、Ch分别与R、HPA、I的相关系数最大,BDs、Cs、N与R的相关系数次之,H与R、I的相关系数最小。表明乔木、灌木、草本枯枝落叶各层结构因子都会对油松林地表潜在火行为产生影响,由大到小顺序为:草本枯枝落叶层>灌木层>乔木层。同时,草本枯枝落叶层结构因子与油松地表火的关系最密切,影响地表潜在火行为的指标主要有h、Ch、β。其中,h、Ch分别与R、I呈极显著正相关(r分别为0.539、0.519、0.523、0.524);β与I呈显著正相关(r=0.391)与HPA呈极显著正相关(r=0.482)。灌木层中的BDs分别与R、I呈极显著负相关(r=-0.427)和显著负相关(r=-0.361);N分别与R、I呈显著负相关(r=-0.372、r=-0.346);Hs与HPA呈显著正相关(r=0.360),与R、I相关性不显著。乔木层中只有H与R、I呈显著正相关(r=0.391、r=0.399),与HAP相关性不显著; 而Ht、Ct、TCRt、Dg对R、I、HPA的影响均不显著。
3.2.1 地表潜在火行为与乔木层结构因子的回归分析
乔木层林分结构是间接影响地表火行为的主要因素[28]。选择表 2乔木层中,对潜在火行为呈显著相关性的林分结构因子,利用回归分析法绘制潜在火行为的变化趋势图(图 2)。
由图 2可以看出,随着H的增加R、I先缓慢增加,H达到6m时增加速度加快; 即当H < 6m时,潜在火行为指数较小,且潜在火行为缓慢增加,说明油松林龄较小时易形成低强度地表火。当H>6m时,随着H的增大,潜在火行为指数较大,且潜在火行为增加速度也加快,说明林龄较大时油松可能形成高强度地表火,危害较大、不易控制。原因可能是当油松较小时,灌木和枯枝落叶量也较少,地表潜在火行为较低; 而随着树木的生长,地表灌木和枯枝落叶逐渐增加,地表潜在火行为也增大。
3.2.2 地表潜在火行为与地表层结构因子的回归分析
地表层直接影响地表潜在火行为,油松林普遍以灌木和草本枯枝落叶层为燃烧主体,选择与潜在火行为呈显著相关性的地表层林分结构指数,利用回归分析绘制地表潜在火行为的变化趋势图(图 3)。
在图 3A中,Hs与HPA呈正相关,随着Hs的增加HPA也逐渐增加。同时,在Hs为1.5m左右时,HPA出现了几个特殊值; 可能由于灌木负荷量不仅受到灌木株数、种类等其他多种因素影响,还受到灌木自身高度的影响,当灌木高度大于1.5m时,利于可燃物的引燃。在图 3B、3C、3D、3E中,N、BDs与R、I负相关,随着N和BDs的增大R、I先逐渐下降,当BDs和N分别为40株、0.053kg/m3左右时,R、I达到最小值之后又有增大趋势。说明灌木林太少和太多时,都有利于增强地表潜在火行为,反而灌木林适中时,潜在火行为较低。可能是当灌木太少时,林内郁闭度大、地表草本枯枝落叶较多,地表潜在火行为较大; 而灌木较多时,林内灌木负荷量大,有利于形成树冠火,地表潜在火行为也较大。因此,油松林中灌木的增加利于地表可燃物热量释放,灌木1.5m左右时有利于树冠火的形成; 林龄较大林分中,灌木层对地表潜在火行为起到一定的阻碍作用,特别是对林火蔓延速度的影响。
在图 4A、4D中,h与R、logI正相关,随着h增大,R、logI先快速增加,之后logI的增加量开始减少,因此适当降低床层高度有利于降低地表潜在火行为。在图 4B、4E中,Ch与logI正相关,当Ch小于38%时,logI随着Ch的增加迅速增大,当Ch达到45%时,logI几乎不再增加逐渐平缓; Ch与R也呈正相关,且随着Ch增加,R逐渐增加,最后趋于平缓。在图 4C、4F中,β与logI呈正相关,与HPA也呈正相关,当β增加时,HPA也逐渐增加,而logI先逐渐增加之后也趋于平缓。所以草本枯枝落叶层对地表潜在火行为的影响,有一定的限度; 通常随着草本枯枝落叶层可燃物增加地表潜在火行为逐渐增加,达到一定阈值后会趋于平缓。
3.3 林分结构对地表潜在火行为影响的解释力分析
本文通过方差分解法研究乔木、灌木和枯枝落叶层3类林分结构因子对油松林地表潜在火行为影响的解释程度(图 5)。
油松林分结构对地表潜在火行为影响的解释力中,草本枯枝落叶层结构的独立贡献率(34.99%)大于灌木层结构的独立贡献率(20.16%),并且显著大于乔木层结构的独立贡献率(10.2%); 灌木层结构与草本枯枝落叶层的交互作用(6.69%)大于乔木与灌木层(3.23%)和乔木与草本枯枝落叶层(1.23%)的交互作用,且3类林分结构能够解释的累积贡献率77.66%。这可能是由于油松林草本枯枝落叶层是地表火燃烧的主体,灌木燃烧量相对较小,而乔木是通过掉落的枯枝、枯叶间接影响地表火,所以草本枯枝落叶层结构的独立贡献率最大。对于交互作用,同样地表层结构是直接影响地表火,而乔木层间接影响地表火,所以草本枯枝落叶层与灌木层交互的作用大于乔木层与草本枯枝落叶层的交互作用,也大于乔木层与灌木层的交互作用,表明切断草本枯枝层与灌木的联系,能有效降低树冠火的发生。
4. 结论与讨论
本文利用妙峰山林场油松林地表可燃物调查数据,探究油松林地表潜在火行为与林分结构的相关性。
(1) 油松地表潜在火行为普遍属于低强度地表火,可能引发中强度地表火,但是极少发生高强度地表火。油松林地表潜在火蔓延速度、火强度、单位面积热量取值范围分别在2~6m/min、300~1400kW/m、4000~5500kJ/m2之间,也存在一些较大特殊值; 地表潜在火火强度普遍属于低强度地表火,也存在3个2000~35000kW/m的特殊值,有一个数据量大于3500kW/m的值,有发生高强度地表火的可能。
(2) 乔木层的树高,灌木层的密度、株数、盖度,草本枯枝落叶层的草本盖度、床层高度、紧密度对地表潜在火行为产生显著影响; 草本枯枝落叶层和乔木层结构与地表潜在火行为呈正相关,灌木层结构与潜在火行为呈负相关。草本枯枝落叶层中,床层高度、紧密度和草本盖度都与地表潜在火行为呈极显著正相关,该结果与Fréjaville等[29]研究结果相似,地表火行为随着草本盖度的增加先增大达到阈值后逐渐降低。灌木层中,结构指数与潜在火行为呈负相关,随着灌木密度、株数、灌木盖度的增大,地表潜在火行为先减小到达最小值之后有增大趋势。可能由于油松林分郁闭度大时,灌木太少、草本枯枝落叶层可燃物较多地表火较大; 而当林分郁闭度较低时灌木太多、草本枯枝落叶层可燃物较小,不利于林火的蔓延。乔木层中,树高与地表潜在火行为显著正相关,随着乔木生长地表潜在火行为也逐渐增大,说明高大的油松林更易引发高强度地表火。
(3) 根据相关系数及各层贡献率,油松林乔木层和地表层结构指数都对地表潜在火行为产生影响,且影响由大到小为草本枯枝落叶层>灌木层>乔木层。在林分结构对地表潜在火行为影响的解释力中,草本枯枝落叶层的贡献率最大,且草本枯枝落叶层与灌木层结构指数的交互作用大于乔木层与草本枯枝落叶层、灌木层结构指数的交互作用。所以草本枯枝落叶层对地表潜在火行为的大小起到关键作用,这与张景群等[30]得出的地表火以燃烧草本枯枝落叶为主的结论一致。
油松林分结构与地表潜在火行为有显著相关性,根据各层对地表火的作用,处理方式也不同。其中地表层中草本枯枝落叶是地表火燃烧的主体,主要以清理为主。灌木层是树冠火引燃的条件,太多或太少都不利于降低潜在火行为,适中最好; 切断草本枯枝层与灌木的联系,能有效较低树冠火的发生。乔木层是草本和枯枝落叶产生的根源,要特别注意较高油松林分的巡护。本文只研究了林分结构与地表潜在火行为的关系,只考虑了林分结构与地表潜在火行为的相关性,没有考虑林分结构指数多大时能最大限度降低火灾损失,也没有考虑具体结构因子的调控尺度、范围和阈值。因此,林分空间结构、可燃物配置状况和局域环境等因素对地表潜在火行为的影响,还需深入研究。
-
图 5 过表达CmHAT1的转基因愈伤综合分析
a. 过表达CmHAT1的转基因愈伤;b. CmHAT1表达量分析;c. CmHAT1基因过表达后的表型分析;d. CmHAT1基因过表达后的体胚数量分析;e. 体细胞胚胎直径的大小分析。OE-EV. 转空载愈伤;OE-CmHAT1. 转CmHAT1愈伤。*代表存在显著性差异(P < 0.05),**代表存在非常显著性差异(P < 0.01),****代表存在极显著性差异(P < 0.000 1),ns分别代表不存在显著性差异(P > 0.05)。a, overexpressing CmHAT1 calli; b, expression analysis of CmHAT1 gene; c, phenotypic analysis after overexpressing CmHAT1 gene; d, number analysis of somatic embryos after overexpressing CmHAT1 gene; e, diameter analysis of somatic embryo. OE-EV, transgenic empty vector calli; OE-CmHAT1, transgenic CmHAT1 calli. * indicate statistically significant differences at P < 0.05 level, ** indicates statistically significant differences at P < 0.01 level, **** indicates statistically significant differences at P < 0.000 1 level, ns indicates no statistically significant differences (P > 0.05).
Figure 5. Comprehensive analysis of transgenic CmHAT1 calli
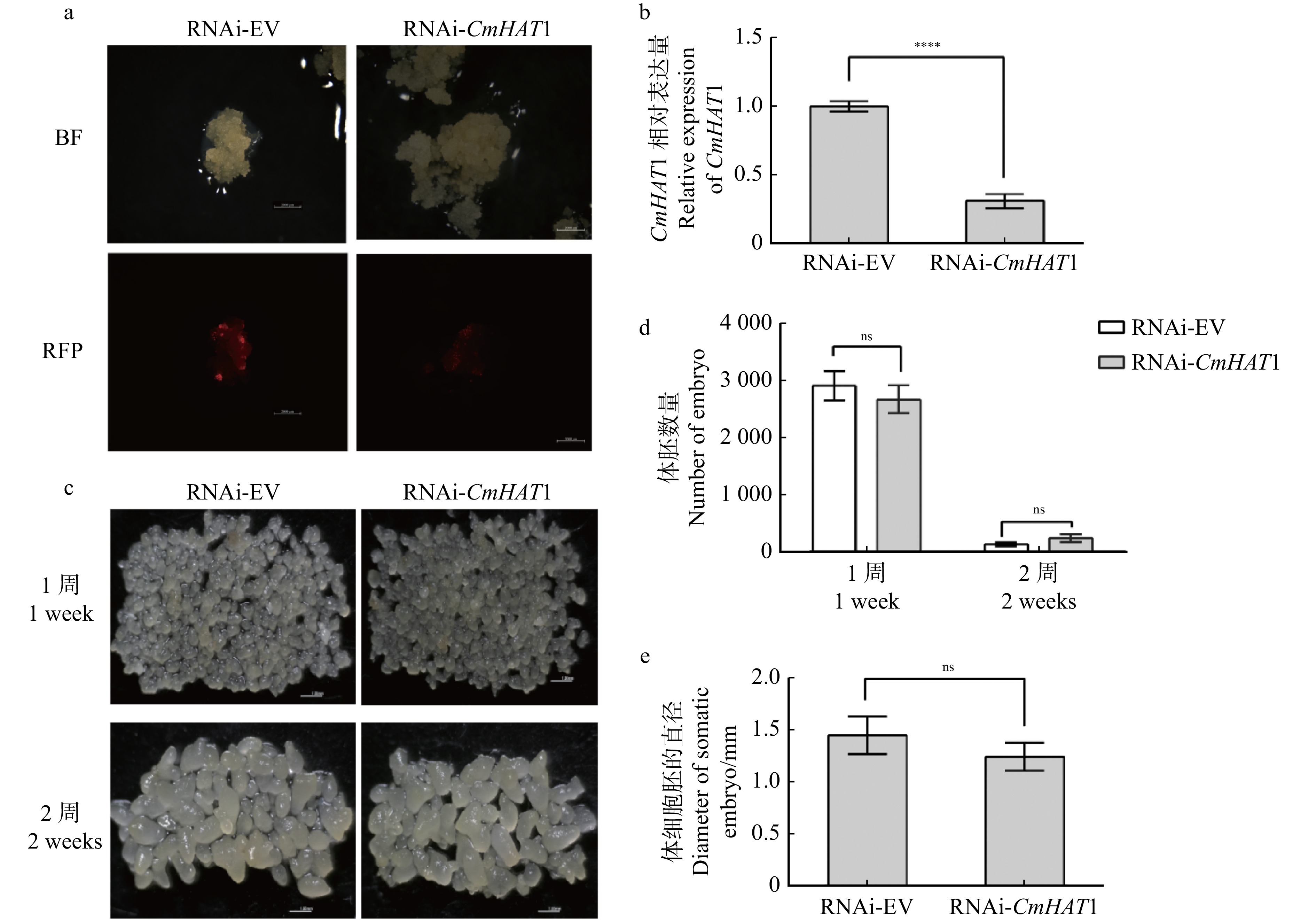
图 6 沉默CmHAT1的转基因愈伤综合分析
a. 沉默CmHAT1的转基因愈伤;b. CmHAT1基因沉默后的表达量分析;c. CmHAT1基因沉默后的表型分析;d. CmHAT1基因沉默后的体胚数量分析; e. 体细胞胚胎直径的大小分析。RNAi-EV. 转空载沉默愈伤;RNAi-CmHAT1. 转CmHAT1沉默愈伤。a, RNAi-CmHAT1 calli; b, expression analysis of CmHAT1 gene after RNAi; c, phenotypic analysis of CmHAT1 gene after RNAi; d, number of somatic embryos after RNAi of CmHAT1 gene; e, diameter of somatic embryo. RNAi-EV, transgenic RNAi-empty vector calli; RNAi-CmHAT1, transgenic RNAi-CmHAT1 calli.
Figure 6. Comprehensive analysis of RNAi-CmHAT1 calli
-
[1] Lu D, Wei W, Zhou W, et al. Establishment of a somatic embryo regeneration system and expression analysis of somatic embryogenesis-related genes in Chinese chestnut (Castanea mollissima Blume)[J]. Plant Cell, Tissue and Organ Culture, 2017, 130: 601−616. doi: 10.1007/s11240-017-1250-3
[2] Hebard F V. The backcross breeding program of the American chestnut foundation[J]. Journal of the American Chestnut Foundation, 2006, 19: 55−77.
[3] Miller A C, Woeste K E, Anagnostakis S L, et al. Exploration of a rare population of Chinese chestnut in North America: stand dynamics, health and genetic relationships[J]. AoB Plants, 2014, 6: 11−15.
[4] Li X W, Sun Z L, Gao Y R, et al. A strategy for establishing an efficient somatic embryo regeneration system in Castanea mollissima Blume[J]. Plant Cell, Tissue and Organ Culture, 2022, 150: 299−312. doi: 10.1007/s11240-022-02269-6
[5] Verdeil J L, Alemanno L, Niemenak N, et al. Pluripotent versus totipotent plant stem cells: dependence versus autonomy?[J]. Trends in Plant Science, 2007, 12: 245−252. doi: 10.1016/j.tplants.2007.04.002
[6] Ikeuchi M, Iwase A, Rymen B, et al. PRC2 represses dedifferentiation of mature somatic cells in Arabidopsis[J]. Nature Plants, 2015, 1: 15089. doi: 10.1038/nplants.2015.89
[7] Andrei S, Bozhkov P. Somatic embryogenesis: life and death processes during apical-basal patterning[J]. Journal of Experimental Botany, 2014, 65: 1343−1360. doi: 10.1093/jxb/eru005
[8] Martins J F, Correia S I, Canhoto J M. Somatic embryogenesis induction and plant regeneration in strawberry tree (Arbutus unedo L.)[J]. Methods in Molecular Biology, 2016, 1359: 329−339.
[9] Das D, Reddy M, Upadhyaya K, et al. An efficient leaf-disc culture method for the regeneration via somatic embryogenesis and transformation of grape (Vitis vinifera L.)[J]. Plant Cell Reports, 2002, 20: 999−1005. doi: 10.1007/s00299-002-0441-4
[10] Yang X M, An L Z, Xiong Y C, et al. Somatic embryogenesis from immature zygotic embryos and monitoring the genetic fidelity of regenerated plants in grapevine[J]. Biologia Plantarum, 2008, 52: 209−214. doi: 10.1007/s10535-008-0047-y
[11] Breton C, Cornu D, Chriqui D, et al. Somatic embryogenesis, micropropagation and plant regeneration of “Early Mature” walnut trees (Juglans regia) that flower in vitro[J]. Tree Physiology, 2004, 24(4): 425−435. doi: 10.1093/treephys/24.4.425
[12] Xu Y, Jia H, Wu X, et al. Regulation of nucellar embryony, a mode of sporophytic apomixis in Citrus resembling somatic embryogenesis[J]. Current Opinion in Plant Biology, 2021, 59: 101984. doi: 10.1016/j.pbi.2020.101984
[13] Maynard C A, Mcguigan L D, Oakes A D, et al. Chestnut, American (Castanea dentata (Marsh.) Borkh.)[J]. Methods in Molecular Biology, 2015, 1224: 143−161.
[14] Corredoira E, Valladares S, Allona I, et al. Genetic transformation of European chestnut somatic embryos with a native thaumatin-like protein (CsTL1) gene isolated from Castanea sativa seeds[J]. Tree Physiology, 2012, 32: 1389−1402. doi: 10.1093/treephys/tps098
[15] Sun Z L, Li X, Zhou W, et al. Agrobacterium-mediated genetic transformation of Chinese chestnut (Castanea mollissima Blume)[J]. Plant Cell, Tissue and Organ Culture, 2020, 140: 95−103. doi: 10.1007/s11240-019-01713-4
[16] 尹丽娟, 侯尹婕, 潘晓娜, 等. 甜瓜HD-ZIP基因家族的鉴定及表达[J/OL]. 分子植物种, 2024: 1−15[2024−04−14]. http://kns.cnki.net/kcms/detail/46.1068.S.20230530.1532.004.html. Yin L J, Hou Y J, Pan X N, et al. Identification and expression analysis of HD-ZIP gene family in melon [J/OL]. Molecular Plant Breeding, 2024: 1−15[2024−04−14]. http://kns.cnki.net/kcms/detail/46.1068.S.20230530.1532.004.html.
[17] Ariel F D, Manavella P A, Dezar C A, et al. The true story of the HD-Zip family[J]. Trends in Plant Science, 2007, 12: 419−426. doi: 10.1016/j.tplants.2007.08.003
[18] Romani F, Ribone P A, Capella M. A matter of quantity: common features in the drought response of transgenic plants overexpressing HD-Zip I transcription factors[J]. Plant Science, 2016, 251: 139−154. doi: 10.1016/j.plantsci.2016.03.004
[19] Turchi L, Carabelli M, Ruzza V, et al. Arabidopsis HD-Zip Ⅱ transcription factors control apical embryo development and meristem function[J]. Development, 2013, 140: 2118−2129. doi: 10.1242/dev.092833
[20] Ooi S E, Ramli Z, Syed A S S R, et al. EgHOX1, a HD-Zip Ⅱ gene, is highly expressed during early oil palm (Elaeis guineensis Jacq.) somatic embryogenesis[J]. Plant Gene, 2016, 8: 16−25. doi: 10.1016/j.plgene.2016.09.006
[21] Khianchaikhan K, Aroonluk S, Vuttipongchaikij S, et al. Genome-wide identification of homeodomain leucine zipper (HD-ZIP) transcription factor, expression analysis, and protein interaction of HD-ZIP IV in oil palm somatic embryogenesis[J]. International Journal of Molecular Sciences, 2023, 24(5): 5000. doi: 10.3390/ijms24055000
[22] Li Z, Zhang C, Guo Y, et al. Evolution and expression analysis reveal the potential role of the HD-Zip gene family in regulation of embryo abortion in grapes (Vitis vinifera L.)[J]. BMC Genomics, 2017, 18: 744. doi: 10.1186/s12864-017-4110-y
[23] Ge X X, Liu Z, Wu X M, et al. Genome-wide identification, classification and analysis of HD-ZIP gene family in Citrus, and its potential roles in somatic embryogenesis regulation[J]. Gene, 2015, 574: 61−68. doi: 10.1016/j.gene.2015.07.079
[24] 逯丹. 板栗体细胞胚再生体系建立及体胚发生相关基因的表达分析 [D]. 北京: 北京农学院, 2017. Lu D. Establishment of a somatic embryo regeneration system and expression analysis of somatic embryogenesis-related genes in chinese chestnut (Castanea mollissima Blume) [D]. Beijing: Beijing University of Agriculture, 2017.
[25] 周婉. 农杆菌介导的板栗体细胞胚遗传转化体系的建立 [D]. 北京: 北京农学院, 2018. Zhou W. The establishment of agrobacterium-mediated genetic transformation of somatic embryos in Chinese chestnut (Castanea mollissima Blume)[D]. Beijing: Beijing University of Agriculture, 2018.
[26] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nature Protocols, 2008, 3: 1101−1108. doi: 10.1038/nprot.2008.73
[27] Roodbarkelari F, Groot E P. Regulatory function of homeodomain-leucine zipper (HD-ZIP) family proteins during embryogenesis[J]. New Phytologist, 2017, 213(1): 95−104. doi: 10.1111/nph.14132
[28] 郝陆洋, 张晓静, 高晨曦, 等. 玉米HD-Zip转录因子基因Zmhdz6的克隆与功能分析[J]. 植物遗传资源学报, 2022(3): 23. Hao L Y, Zhang X J, Gao C X, et al. Cloning and functional analysis of HD-Zip transcription factor gene Zmhdz6 in maize[J]. Journal of Plant Genetic Resources, 2022(3): 23.
[29] Li Y, Yang Z, Zhang Y, et al. The roles of HD-ZIP proteins in plant abiotic stress tolerance[J]. Frontiers in Plant Science, 2022, 13: 1027071. doi: 10.3389/fpls.2022.1027071
[30] Yue H, Shu D, Wang M, et al. Genome-wide identification and expression analysis of the HD-Zip gene family in wheat (Triticum aestivum L.)[J]. Genes, 2018, 9(2): 70. doi: 10.3390/genes9020070
[31] 张春渝, 徐小萍, 陈晓慧,等. 龙眼体胚发生过程HD-Zip全基因组与生物功能分析[J]. 园艺与种苗, 2019, 39(6): 27−32. Zhang C Y, Xu X P, Chen X H, et al. Enome-wide and biological function analysis of HD-Zip during somatic embryogenesis in longan[J]. Horticulture & Seed, 2019, 39(6): 27−32.
[32] Liu T, Longhurst A D, Talavera-Rauh F, et al. The Arabidopsis transcription factor ABIG1 relays ABA signaled growth inhibition and drought induced senescence[J]. Elife, 2016, 5: e13768. doi: 10.7554/eLife.13768
[33] Yang Q, Xiang W, Li Z, et al. Genome-wide characterization and expression analysis of HD-ZIP gene family in Dendrobium officinale[J]. Frontiers in Genetics, 2022, 13: 797014. doi: 10.3389/fgene.2022.797014
[34] Oh S K, Yoon J, Choi G J, et al. Capsicum annuum homeobox 1 (CaHB1) is a nuclear factor that has roles in plant development, salt tolerance, and pathogen defense[J]. Biochemical and Biophysical Research Communications, 2013, 442: 116−121. doi: 10.1016/j.bbrc.2013.11.019
[35] Li H, Cai Z, Wang X, et al. SERK receptor-like kinases control division patterns of vascular precursors and ground tissue stem cells during embryo development in Arabidopsis[J]. Molecular Plant, 2019, 12: 984−1002. doi: 10.1016/j.molp.2019.04.011
[36] Zuo J, Niu Q, Frugis G, et al. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis[J]. The Plant Journal, 2002, 30: 349−359. doi: 10.1046/j.1365-313X.2002.01289.x
[37] Horstman A, Li M, Heidmann I, et al. The BABY BOOM transcription factor activates the LEC1-ABI3-FUS3-LEC2 network to induce somatic embryogenesis[J]. Plant Physiology, 2017, 175(2): 848−857. doi: 10.1104/pp.17.00232
-
期刊类型引用(4)
1. 牟韵洁,高德民,龙腾腾,郭在军,牛海峰. 张家口崇礼区主要植物叶片理化性质及燃烧性分析. 南京林业大学学报(自然科学版). 2024(06): 239-244 .  百度学术
百度学术
2. 王博,韩树文,顾泽,陈锋,白夜,刘晓东. 不同烈度林火对油松林潜在地表火行为的影响. 生态学报. 2023(05): 1812-1821 .  百度学术
百度学术
3. 韩懂懂,杨光,邸雪颖,李兆国. 兴安落叶松林火烧迹地土壤理化性质驱动因子. 生态学报. 2023(21): 8727-8738 .  百度学术
百度学术
4. 王博,韩树文,武英达,牛树奎,刘晓东. 辽河源自然保护区油松林火烧迹地林木更新研究. 北京林业大学学报. 2020(04): 41-50 .  本站查看
本站查看
其他类型引用(6)



 下载:
下载: