Effects of different nitrogen addition forms and levels on N2O emission in the temperate forest soil
-
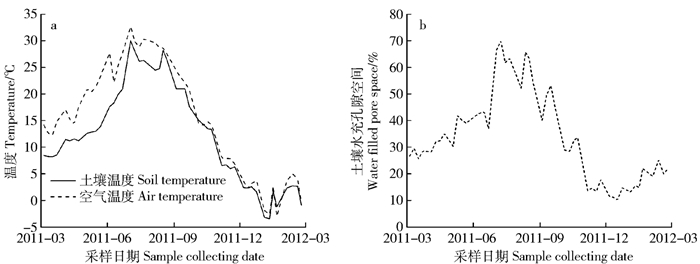
摘要: 土壤中氮形态和氮剂量的有效性是影响土壤氧化亚氮(N2O)排放的重要因子。为了提高氮素化学形态及添加剂量对温带森林土壤N2O排放的影响,本研究在北京林业大学实验林场,以温带油松林土壤为研究对象,通过野外氮添加控制实验,采用静态箱/气相色谱法分析不同水平(对照,CK:0 kg/(hm2·a); 低氮,LN:50 kg/(hm2·a); 中氮,MN:100 kg/(hm2·a); 高氮,HN:150 kg/(hm2·a))和不同形态(混合态氮,AN:NH4NO3; 铵态氮,As:(NH4)2SO4; 硝态氮,Na:NaNO3)的氮添加对温带油松林土壤N2O排放通量的影响。结果表明:氮添加处理样地N2O排放表现出明显的季节性变化特征,排放高峰出现在6—8月,其他季节土壤N2O排放通量相对较低,最小值出现在1月。不同氮添加处理均促进了土壤N2O的排放:在不同水平的氮添加下,随着氮添加水平的增加,土壤N2O排放通量也升高,表现为HN>MN>LN>CK。不同形态的氮输入对N2O排放的促进作用表现为:AN>As>Na,As添加与AN和Na添加没有显著差异(P>0.05),但AN添加与Na添加之间差异显著(P<0.05)。此外,空气温度、土壤温度和土壤孔隙含水量也可以影响土壤N2O的排放。年度土壤N2O排放系数范围是0.34%~0.94%,年均排放系数为0.364%,低于联合国政府间气候变化委员会(IPCC)推荐的默认值。Abstract: Nitrous oxide (N2O) emission can be affected by the amounts and forms of nitrogen (N) available in soils. To improve our understanding of the response of N2O emission to different N addition levels and forms, a manipulative field experiment was conducted to investigate the effects of different forms (ammonium sulfate, As:(NH4)2SO4; sodium nitrate, Na:NaNO3; ammonium nitrate, AN:NH4NO3) and levels (control: 0 kg/(ha·year); low N, LN: 50 kg/(ha·year); MN: 100 kg/(ha·year) and high N, HN: 150 kg/(ha·year)) of N addition on N2O emission of temperate Pinus tabuliformis forest soil using the static closed chamber method at Experimental Forest Station of Beijing Forestry University in Beijing, northern China. Our results showed that soil N2O emission showed a trend of seasonal variation: higher in summer (May to August) but relatively low in the remaining seasons. The minimum value appeared in January. Different levels of N addition increased annual N2O emission in the order of HN>MN>LN>control. The three N forms increased annual N2O emission in the order of AN>As>Na, but the difference was insignificant (P>0.05) between As and AN or As and Na. These results suggested that the N2O emission from temperate forest soil sensitively responded to N addition forms and levels. In addition, soil temperature, air temperature and water-filled pore space also influenced soil N2O fluxes. Annual soil N2O emission factors ranged from 0.34% to 0.94% for different N addition treatments, with an overall emission factor value of 0.364%. The emission factor values were far less than the mean default emission factor proposed by the Intergovernmental Panel on Climate Change (IPCC).
-
Keywords:
- N addition level /
- N addition form /
- N2O emission /
- temperate forest soil /
- Pinus tabuliformis
-
多倍化是一种普遍的自然现象,是植物进化和物种形成的重要推动力[1]。利用2n配子的有性多倍化是植物多倍化的主要途径之一。但自然界中天然2n配子发生频率一般较低,难以应用于植物多倍体育种实践。为了提高2n配子的发生频率,进而提高多倍体得率,育种学家们常常利用物理或化学方法进行2n配子人工诱导。
秋水仙碱作为一种重要的化学诱变剂,已成功应用于诱导林木大孢子、胚囊、合子以及体细胞染色体加倍、选育多倍体的育种实践,获得了数以百计的杨树(Populus spp.)[2-8]、刺槐(Robinia pseudoacacia)[9]、杜仲(Eucommia ulmoides)[10]、尾叶桉(Eucalyptus urophylla)[11]等林木三倍体与四倍体新种质。秋水仙碱也曾用于诱导杨树[12-13]、杜仲[14]以及桉树(Eucalyptus)[15]等树种的花粉染色体加倍研究,获得了20.0% ~ 88.0%的2n花粉。但是,秋水仙碱价格昂贵,且具有剧毒性,容易导致加倍处理操作人员中毒。
高温是一种有效的物理诱导方法,目前已成功应用于诱导杨树[16-19]、杜仲[20]、桉树[21]等树种的大孢子、胚囊以及合子染色体加倍、选育多倍体的育种实践,获得了大量的毛白杨(Populus tomentosa)[16-17]、‘折引3号’杨(P. pseudo-simonⅡ × P. nigra ‘Zheyin3#’)[18]、毛新杨(P. tomentosa × P. bolleana)[19]以及银腺杨(P. alba × P. glandulosa)[19]等杂种三倍体。高温也曾用于诱导毛新杨[22]、响叶杨(P. adenopoda) [23]、银白杨(P. alba)[24]及银灰杨(P. canescens)[25]的花粉染色体加倍研究,确定了高温诱导2n花粉的有效时期为终变期附近,且获得了60.0% ~ 80.0%的高频率2n花粉。但有研究表明:高温诱导获得的2n配子均为SDR型[26],其遗传亲本的杂合性仅为FDR型2n配子的一半,严重限制了高温在多倍体育种中的应用。
赤霉素(gibberellins,GA3)是一类重要的内源植物激素,具有调控细胞分化、种子萌发、叶片扩展、毛状体发育、花粉成熟以及开花转换等方面的功能[27-30]。赤霉素还是一种非生物逆境应激信号分子,水稻(Oryza sativa)经历冷胁迫时,通过降低内源赤霉素水平以抑制根系生长,并阻滞花粉发育[31]。此外,赤霉素能够调节拟南芥(Arabidopsis thaliana)小孢子发生和花粉发育[32],具有诱导拟南芥产生2n花粉的功能[33]。但赤霉素是否能够有效地诱导杨树产生2n花粉尚不清楚。
减数分裂是植物有性生殖过程中配子形成的必要阶段。在植物花粉母细胞减数分裂过程中,微管骨架参与纺锤体和成膜体的形成,以及核周和胞质微管网络的构建,从而决定同源染色体和姐妹染色单体分离以及细胞质的正常分裂[34-36]。有研究表明:植物天然2n花粉的产生与花粉母细胞减数分裂以及胞质分裂的异常密切相关[37],而这些异常的现象均受细胞内微管网络系统的严格调控。研究赤霉素喷洒处理后新疆杨(Populus bolleana)花粉母细胞微管骨架的异常变化,可为赤霉素喷洒处理诱导新疆杨2n花粉的发生机制提供有力的细胞学依据。
新疆杨为杨柳科(Salicaceae)杨属(Populus)白杨派乔木,是银白杨的变种,广泛种植于新疆、内蒙、北京、陕西、辽宁等省市。新疆杨是分布区内生态防护林建设和城市绿化的主要树种之一,在防风固沙和涵养水源方面具有重要作用。但有关新疆杨多倍体育种研究的报道甚少。本研究以新疆杨花粉母细胞为研究对象,在掌握新疆杨花粉母细胞减数分裂规律的基础上,研究赤霉素喷洒处理诱导新疆杨产生2n花粉的可行性及其对花粉母细胞微管骨架的影响,旨在为开发诱导效果好且价格低廉的新型化学诱变剂、构建高效的林木多倍体育种技术体系奠定重要的理论和实践基础。
1. 材料和方法
1.1 试验材料
每年冬季落叶后,从内蒙古自治区包头市国家杨树良种基地采集新疆杨雄花枝,塑料布包裹后运输至北京林业大学温室待用。
1.2 研究方法
1.2.1 新疆杨花粉母细胞减数分裂进程观察
新疆杨雄花枝水培于10 ~ 20 ℃的温室,每隔2 ~ 3 h摘取2 ~ 3个花芽,去除鳞片后,将其放于5 mL的离心管内,利用新配的卡诺固定液进行固定。在4 ℃冰箱固定24 h后,摘取花药,利用醋酸洋红染色法观察花粉母细胞减数分裂进程。染色体制片具体操作参照鲁敏等[23]的方法。在Olympus BX-51光学显微镜下观察花粉母细胞减数分裂进程[38],并运用Olympus DP70数码摄像系统进行照相。
1.2.2 新疆杨雄花芽的赤霉素喷洒处理
以育性良好的新疆杨雄花芽为材料,于花粉母细胞、第一次减数分裂和第二次减数分裂时期,使用浓度为50、100、200 μmol/L的赤霉素对花芽分别进行3、5、7次喷洒处理。当观察到大部分新疆杨花粉母细胞发育至第二次减数分裂时,使用水对花芽分别进行3、5、7次喷洒处理作为对照(表1)。处理后的雄花芽继续在温室中水培至花粉成熟,按照不同处理收集花粉,放置于1.5 mL的离心管中,添加适量的变色硅胶,密封保存于–20 ℃的冰箱。
表 1 新疆杨雄花芽的赤霉素喷洒处理Table 1. GA3 spraying treatment of flower buds in P. bolleana减数分裂时期
Meiotic stage赤霉素浓度
Concentration of
GA3/(μmol· L−1)喷洒次数
Spraying time花粉母细胞时期
Pollen mother cell (PMC) stage50 3 5 7 100 3 5 7 200 3 5 7 第一次减数分裂
Meiosis Ⅰ50 3 5 7 100 3 5 7 200 3 5 7 第二次减数分裂
Meiosis Ⅱ50 3 5 7 100 3 5 7 200 3 5 7 第二次减数分裂(对照)
Meiosis Ⅱ (control)0 3 5 7 1.2.3 新疆杨2n花粉发生频率的统计
用镊子分别夹取少量不同处理组合的花粉,均匀地洒在滴有醋酸洋红的载玻片上制作临时涂片,在Olympus BX-51光学显微镜下随机选取5个视野观察并进行拍照,进一步利用Image J软件测量花粉粒直径。以对照组花粉粒平均直径的1.28倍作为判别2n花粉的标准[39],统计每个视野中总花粉粒数与2n花粉粒的数量,以2n花粉占花粉粒总数的百分比作为2n花粉发生频率,计算出不同处理组合的2n花粉发生频率。试验重复3次,每次重复测量200 ~ 300个花粉粒。
1.2.4 新疆杨成熟花粉精核和营养核的细胞学观察
用镊子夹取少量不同处理组合的花粉,均匀的洒在滴有蒸馏水的载玻片上水合2 h,用DAPI(4,6-diamidino-2-phenylindole)对细胞核进行染色,用Olympus BX-51荧光显微镜观察新疆杨单倍性与2n花粉粒精核与营养核的形态差异。
1.2.5 新疆杨花粉母细胞减数分裂微管骨架的免疫荧光标记
摘取赤霉素处理后的新疆杨雄花芽新鲜花药,迅速投入PEM缓冲液(50 mmol/L PIPES,5 mmol/L EGTA,1 mmol/L MgSO4,pH 6.8)配制的4%多聚甲醛固定液中固定45 min后,参考Brown等[40]的方法,开展赤霉素处理对新疆杨花粉母细胞减数分裂微管骨架的影响研究,利用激光共聚焦扫描显微镜观察并照相。
1.2.6 数据处理方法
2n花粉诱导率等百分比数据经反正弦变换[41]后,利用SPSS18.0统计软件进行差异显著性分析和多重比较。
2. 结果与分析
2.1 新疆杨雄花芽减数分裂进程的观察
温室水培条件下,新疆杨花粉母细胞由减数分裂细线期发育至四分体时期历时约4 d(图1,表2)。其花粉母细胞的减数分裂是一个连续而非同步的过程(表2)。温室水培96 h后,花粉母细胞开始进入减数分裂,大部分花粉母细胞发育至细线期(65.5%)(图1A),此时期染色体呈细丝状,分布杂乱无章。水培至124 h,减数分裂发育至粗线期(40.0%)(图1B),染色体收缩变粗,形态较细线期明显。水培136 h后,大部分花粉母细胞进入双线期(47.5%)(图1C),染色体进一步缩聚,可明显观察到同源染色体非姊妹染色单体间的交叉。水培144 h后,大部分花粉母细胞进入终变期(46.0%)(图1D),此时染色体长度继续缩短,核仁缩小乃至消失,染色体缩聚呈点状,形态清晰可见。水培至152 h时,花粉母细胞发育至中期Ⅰ(27.0%)(图1E),联会的同源染色体整齐地排列在赤道板中央。水培160 h后,大部分花粉母细胞进入后期Ⅰ(22.5%)和末期Ⅰ(37.5%),联会的同源染色体开始分离,移向细胞的两极(图1F)。当染色体抵达细胞的两极后,开始解聚(图1G),随后核仁重新出现,形成2个子核,标志着第一次减数分裂结束。新疆杨花粉母细胞完成第一次减数分裂大约需要64 h。
![]() 图 1 新疆杨花粉母细胞减数分裂进程A. 细线期;B. 粗线期;C. 双线期;D. 终变期;E. 中期Ⅰ;F. 后期Ⅰ;G. 末期Ⅰ;H. 前期Ⅱ;I. 中期Ⅱ;J. 后期Ⅱ;K ~ L. 末期Ⅱ;M. 末期Ⅱ多核仁现象;N. 四分体;O. 三分体。标尺 = 10 μm。A, leptotene; B, pachytene; C, diplotene; D, diakinesis; E, metaphase I; F, anaphase I; G, telophase I; H, prophase Ⅱ; I, metaphase Ⅱ; J, anaphase Ⅱ; K-L, telophase Ⅱ; M, multi-nucleoli phenomena at telophase Ⅱ; N, tetrad; O, triad. Bar = 10 μm.Figure 1. Meiotic process of PMC in P. bolleana表 2 新疆杨花粉母细胞的减数分裂进程Table 2. Meiotic process of PMC in P. bolleana
图 1 新疆杨花粉母细胞减数分裂进程A. 细线期;B. 粗线期;C. 双线期;D. 终变期;E. 中期Ⅰ;F. 后期Ⅰ;G. 末期Ⅰ;H. 前期Ⅱ;I. 中期Ⅱ;J. 后期Ⅱ;K ~ L. 末期Ⅱ;M. 末期Ⅱ多核仁现象;N. 四分体;O. 三分体。标尺 = 10 μm。A, leptotene; B, pachytene; C, diplotene; D, diakinesis; E, metaphase I; F, anaphase I; G, telophase I; H, prophase Ⅱ; I, metaphase Ⅱ; J, anaphase Ⅱ; K-L, telophase Ⅱ; M, multi-nucleoli phenomena at telophase Ⅱ; N, tetrad; O, triad. Bar = 10 μm.Figure 1. Meiotic process of PMC in P. bolleana表 2 新疆杨花粉母细胞的减数分裂进程Table 2. Meiotic process of PMC in P. bolleana% 减数分裂时期
Meiotic stage水培时间 hydroponics time/h 96 110 124 136 144 152 160 168 174 180 186 192 细线期 Leptotene 65.5 28.5 9.0 3.5 偶线期 Zygotene 25.5 51.5 36.5 14.5 5.0 粗线期 Pachytene 9.0 16.5 40.0 27.5 18.0 12.5 双线期 Diplotene 3.5 14.5 47.5 22.0 14.0 终变期 Diakinesis 7.0 46.0 20.5 中期Ⅰ Metaphase Ⅰ 9.0 27.0 8.5 6.0 后期Ⅰ Anaphase Ⅰ 10.0 22.5 8.5 末期Ⅰ Telophase Ⅰ 12.0 37.5 13.0 5.5 2.0 前期Ⅱ Prophase Ⅱ 4.0 21.0 34.0 28.0 11.0 5.5 0.5 中期Ⅱ Metaphase Ⅱ 10.5 30.5 37.0 25.5 6.5 2.0 后期Ⅱ Anaphase Ⅱ 8.0 21.0 39.0 10.5 2.5 末期Ⅱ Telophase Ⅱ 8.5 19.5 50.5 14.0 四分体 Tetrad 3.0 27.0 81.0 注:表中数据为所在时期花粉母细胞比例。 Note: data in the table are the proportion of PMCs in the period. 第一次减数分裂结束后,花粉母细胞未进行细胞质分裂,继续开始第二次分裂。当雄花枝水培至168 h时,花粉母细胞发育至前期Ⅱ(34.0%)(图1H),此时2个子核区的染色体重新缩聚,核仁逐渐消失。水培174 h后,大部分花粉母细胞进入中期Ⅱ(37.0%)(图1I),2组染色体整齐地排列在子细胞的赤道板上。水培180 h后,大部分花粉母细胞进入后期Ⅱ(39.0%)(图1J),姐妹染色单体开始分开,移向子细胞的两极。水培186 h后,花粉母细胞发育至末期Ⅱ(50.5%)(图1K),染色单体抵达子细胞的两极,染色体解螺旋,核仁重新出现(图1L),此时期部分花粉母细胞存在多核仁现象(图1M)。水培192 h后,绝大部分花粉母细胞进入四分体时期(81.0%)(图1N)。此时期还可以观察到少量的三分体存在(图1O)。第二次减数分裂经历的时间明显少于第一次减数分裂,仅需要32 h。
2.2 新疆杨2n花粉的赤霉素诱导
新疆杨雄花芽经不同浓度的赤霉素喷洒处理后,部分花芽因赤霉素的刺激而生长发育过快,导致干枯死亡或提早脱落(图2A),未收集到花粉。存活花芽继续水培于温室,直至花药成熟开裂,均可收集到一定量的花粉。花粉经2%的醋酸洋红染色后,在光学显微镜下进行花粉粒镜检,可观察大部分花粉粒被染成红色,且着色均匀,这说明该花粉粒具有较好的生活力。通过花粉粒形态比较可以发现:新疆杨对照组中存在少量的天然2n花粉(图2B),其发生频率为0.11% ~ 0.42%(表3)。
![]() 图 2 赤霉素喷洒处理诱导新疆杨2n花粉及其对花芽发育的影响A. 赤霉素处理后干瘪的花芽;B. 天然2n花粉(箭头指向);C.赤霉素诱导的2n花粉(箭头指向);D. DAPI染色后的单倍性花粉;E. DAPI染色后的赤霉素诱导的2n花粉。A, the dry flower buds after GA3 treatment; B, natural 2n pollen (arrow); C, induced 2n pollen by GA3 treatment (arrow); D, haploid pollen after DAPI staining; E. induced 2n pollen by GA3 treatment after DAPI staining.Figure 2. 2n pollen induced by GA3 and its effects on the development of male flower buds in P. bolleana表 3 不同赤霉素喷洒处理组合的新疆杨2n花粉诱导率Table 3. Induction rates of 2n pollen with different combinations of GA3 spraying treatments in P. bolleana
图 2 赤霉素喷洒处理诱导新疆杨2n花粉及其对花芽发育的影响A. 赤霉素处理后干瘪的花芽;B. 天然2n花粉(箭头指向);C.赤霉素诱导的2n花粉(箭头指向);D. DAPI染色后的单倍性花粉;E. DAPI染色后的赤霉素诱导的2n花粉。A, the dry flower buds after GA3 treatment; B, natural 2n pollen (arrow); C, induced 2n pollen by GA3 treatment (arrow); D, haploid pollen after DAPI staining; E. induced 2n pollen by GA3 treatment after DAPI staining.Figure 2. 2n pollen induced by GA3 and its effects on the development of male flower buds in P. bolleana表 3 不同赤霉素喷洒处理组合的新疆杨2n花粉诱导率Table 3. Induction rates of 2n pollen with different combinations of GA3 spraying treatments in P. bolleana减数分裂时期 Meiotic stage 赤霉素浓度
Concentration of GA3/(μmol· L−1)喷洒次数
Spraying time2n花粉诱导率
Induction rate of 2n pollen/%花粉母细胞时期 PMC stage 50 3 0.40 ± 0.26 5 1.03 ± 0.92 7 5.01 ± 1.74 100 3 3.01 ± 0.36 5 4.69 ± 0.44 7 5.04 ± 2.16 200 3 3.22 ± 0.40 5 4.89 ± 0.53 7 5.00 ± 3.63 第一次减数分裂 Meiosis Ⅰ 50 3 2.15 ± 1.18 5 2.12 ± 0.21 7 5.98 ± 1.35 100 3 2.67 ± 1.76 5 2.55 ± 0.80 7 4.98 ± 3.78 200 3 5.53 ± 1.64 5 4.03 ± 1.29 7 4.72 ± 0.44 第二次减数分裂 Meiosis Ⅱ 50 3 4.72 ± 1.83 5 5.50 ± 1.89 7 8.83 ± 3.10 100 3 4.08 ± 1.25 5 3.09 ± 0.96 7 3.04 ± 2.75 200 3 4.25 ± 2.13 5 5.66 ± 1.29 7 5.22 ± 1.35 第二次减数分裂(对照) Meiosis Ⅱ (control) 0 3 0.11 ± 0.04 5 0.42 ± 0.27 7 0.26 ± 0.11 不同赤霉素处理组合中,均可观察到一定比例的2n花粉(图2C)。花粉粒经DAPI染色后,无论是单倍性花粉粒(图2D)还是2n花粉粒(图2E),均可观察到1个较大的营养核和2个高度凝缩的精核。但2n花粉粒的营养核和精核明显大于正常的单倍性花粉。这说明赤霉素喷洒处理诱导产生的大花粉的确是2n花粉。
从表3可以看出:不同处理组合的2n花粉诱导率存在明显的差异,其中以50 μmol/L的赤霉素于第二次减数分裂时期喷洒处理7次的效果最好,平均2n花粉诱导率达到(8.83 ± 3.10)%;以50 μmol/L的赤霉素于花粉母细胞时期喷洒处理3次的效果最差,平均2n花粉诱导率仅为(0.40 ± 0.26)%。不同处理组合2n花粉诱导率的方差分析结果表明(表4):处理次数(F = 9.600,P < 0.001)对新疆杨2n花粉诱导率具有极显著影响;处理时期(F = 4.426,P = 0.017)对2n花粉诱导率具有显著影响;赤霉素浓度(F = 2.538,P = 0.088)对2n花粉诱导率的影响不显著。处理时期和处理次数的多重比较结果表明(表5):第二次减数分裂时期的2n花粉诱导率显著高于花粉母细胞时期和第一次减数分裂时期;赤霉素喷施7次的2n花粉诱导率显著高于3次和5次。因此,当花粉母细胞发育至第二次减数分裂时,以50 μmol/L的赤霉素进行7次喷洒处理是诱导新疆杨花粉染色体加倍的最佳处理组合。
表 4 不同处理组合新疆杨2n花粉诱导率的方差分析Table 4. Variance analysis on induction rates of GA3-induced 2n pollen in P. bolleana under different treatment combinations变异来源 Source of variation df F P 减数分裂时期 Meiotic stage 2 4.426* 0.017 喷洒次数 Spraying time 2 9.600** 0.000 赤霉素浓度 Concentration of GA3 2 2.538 0.088 减数分裂时期 × 喷洒次数 Meiotic stage × spraying time 4 0.940 0.448 减数分裂时期 × 赤霉素浓度 Meiotic stage × concentration of GA3 4 5.103** 0.001 喷洒次数 × 赤霉素浓度 Spraying time × concentration of GA3 4 3.565* 0.012 减数分裂时期 × 喷洒次数 × 赤霉素浓度
Meiotic stage × spraying time × concentration of GA38 0.562 0.804 注:**代表差异极显著(P < 0.01),*代表差异显著(P < 0.05)。Notes: ** represents extremely significant differences (P < 0.01), * represents significant differences (P < 0.05). 表 5 不同减数分裂时期和不同喷洒次数新疆杨2n花粉诱导率的多重比较Table 5. Multiple comparisons in induction rates of 2n pollen under different meiotic stages anddifferent spraying times in P. bolleana减数分裂时期
Meiotic stage平均2n花粉诱导率
Average induction rate of 2n pollen/%喷洒次数
Spraying time平均2n花粉诱导率
Average induction rate of 2n pollen/%花粉母细胞时期 PMC stage 3.59 ± 2.18b 3 3.34 ± 1.85b 第一次减数分裂 Meiosis Ⅰ 3.86 ± 2.03b 5 3.73 ± 1.78b 第二次减数分裂 Meiosis Ⅱ 4.93 ± 2.33a 7 5.31 ± 2.54a 注:不同小写字母代表差异显著(P < 0.05)。 Note: different lowercase letters represent significant differences (P < 0.05). 2.3 赤霉素喷洒处理对新疆杨花粉母细胞减数分裂微管骨架的影响
在新疆杨花粉母细胞减数分裂过程中,其微管骨架的分布总体表现出规律性变化(图3A ~ L)。花粉母细胞进入减数分裂前期Ⅰ时,网状核周微管分布于细胞质中,包裹着细胞核(图3A ~ B)。花粉母细胞发育至终变期时,微管发生方向改变,原来分布于胞质中的微管减少,逐步转向细胞核内,包围着细胞核内的染色体(图3C)。当花粉母细胞进入中期Ⅰ时,从两极发出的细而长的极丝微管和与着丝粒相连的短而粗的着丝粒微管聚集形成狭窄的纺锤体维管束,连接着排列在赤道板上的染色体(图3D)。花粉母细胞发育至后期Ⅰ时,纺锤体微管牵引着同源染色体移向细胞两极(图3E)。同源染色体抵达细胞两极后,花粉母细胞进入末期I,此时微管又一次转向,分布至整个细胞质区域(图3F)。
![]() 图 3 新疆杨花粉母细胞减数分裂过程中微管骨架的动态变化A. 细线期;B. 偶线期;C. 终变期;D. 中期Ⅰ;E. 后期Ⅰ;F. 末期Ⅰ;G. 前期Ⅱ;H. 中期Ⅱ;I. 后期Ⅱ;J. 末期Ⅱ;K. 四分体;L. 三分体;M. 赤霉素处理后的前期Ⅱ;N. 赤霉素处理后的中期Ⅱ;O. 赤霉素处理后的后期Ⅱ;P ~ S. 赤霉素处理后的末期Ⅱ;T. 赤霉素诱导的三分体。标尺 = 10 μm。 A, leptotene; B, zygotene; C, diakinesis; D, metaphase I; E, anaphase I; F, telophase I; G, prophase Ⅱ; H, metaphase Ⅱ; I, anaphase Ⅱ; J, telophase Ⅱ; K, tetrad; L, triad; M, prophase Ⅱ by GA3 treatment; N, metaphase Ⅱ by GA3 treatment; O, anaphase Ⅱ by GA3 treatment; P–S, telophase Ⅱ in treated PMCs by GA3 treatment; T, induced triad by GA3 treatment. Bar = 10 μm.Figure 3. Dynamic changes of microtubule cytoskeleton during meiosis of PMCs in P. bolleana
图 3 新疆杨花粉母细胞减数分裂过程中微管骨架的动态变化A. 细线期;B. 偶线期;C. 终变期;D. 中期Ⅰ;E. 后期Ⅰ;F. 末期Ⅰ;G. 前期Ⅱ;H. 中期Ⅱ;I. 后期Ⅱ;J. 末期Ⅱ;K. 四分体;L. 三分体;M. 赤霉素处理后的前期Ⅱ;N. 赤霉素处理后的中期Ⅱ;O. 赤霉素处理后的后期Ⅱ;P ~ S. 赤霉素处理后的末期Ⅱ;T. 赤霉素诱导的三分体。标尺 = 10 μm。 A, leptotene; B, zygotene; C, diakinesis; D, metaphase I; E, anaphase I; F, telophase I; G, prophase Ⅱ; H, metaphase Ⅱ; I, anaphase Ⅱ; J, telophase Ⅱ; K, tetrad; L, triad; M, prophase Ⅱ by GA3 treatment; N, metaphase Ⅱ by GA3 treatment; O, anaphase Ⅱ by GA3 treatment; P–S, telophase Ⅱ in treated PMCs by GA3 treatment; T, induced triad by GA3 treatment. Bar = 10 μm.Figure 3. Dynamic changes of microtubule cytoskeleton during meiosis of PMCs in P. bolleana第一次减数分裂结束后,花粉母细胞不进行细胞质分裂,立即进入第二次减数分裂。花粉母细胞发育至前期Ⅱ时,核周微管移向2个子细胞核内,与染色体相连(图3G)。随着微管的进一步聚合,2个子细胞核内分别出现纺锤体微管,连接着排列在赤道板上的染色体,此时花粉母细胞已发育至中期Ⅱ(图3H)。当花粉母细胞发育至后期Ⅱ时,子细胞内的纺锤体微管牵引着姐妹染色体单体移向两极(图3I),当姐妹染色体抵达子细胞的两极后,辐射状微管在核膜处扩散,延伸至整个细胞质,联系着4个子核,标志着第二次减数分裂结束(图3J)。在辐射状微管的驱动下,自细胞周沿发生向心胞质分裂,形成四分体(图3K),偶尔还可观察到三分体(图3L)。
与对照组相比,在第二次减数分裂时期赤霉素喷洒处理7次的处理组中,其微管骨架除末期Ⅱ呈现异常外(图3P ~ S),其他减数分裂时期的微管变化规律与对照组相似(图3M ~ O)。在新疆杨花粉母细胞第二次减数分裂时期赤霉素喷洒处理7次后,末期Ⅱ相邻子核之间的辐射状微管发生部分缺失(图3P ~ S),与对照组末期Ⅱ的微管骨架明显不同。末期Ⅱ辐射状微管的部分缺失可导致2个相邻子核间胞质分裂失败,从而产生核复原现象,形成三分体(图3T),进而发育成1个单倍性配子和1个2n配子。
3. 讨 论
新疆杨花粉母细胞减数分裂具有连续而不同步性,这可能是植物性母细胞减数分裂过程中的一种普遍现象。研究人员曾在银灰杨[25]、毛白杨[42]、通辽杨(Populus simonⅡ × P. nigra ‘Tongliao’)[43]、响叶杨[44]、美洲黑杨(Populus deltoides)[45]以及胡杨(Populus euphratica)等[46]物种的花粉母细胞减数分裂的研究中均发现不同步性。同一花枝不同部位花芽,其花粉母细胞减数分裂进程不同;同一花芽的不同小花内花粉母细胞减数分裂时期亦不相同;甚至同一小花内的不同花粉母细胞,其减数分裂进程也不相同。在恶劣环境条件下,这种复杂的花芽发育不同步性可以延长花期,有利于增强两性功能的有效作用时间,对其种群繁殖后代有利[47]。
利用化学诱变剂人工诱导植物花粉染色体加倍获得2n花粉时,诱变剂浓度、处理方式和处理时期是影响2n花粉得率的关键影响因素。李赟等[48]利用0.5%的秋水仙碱于细线末期至粗线期时对银白杨花粉母细胞进行7次注射处理,获得了高达82.33%的2n花粉。Zhou等[49]利用0.5%的秋水仙碱于粗线期时对银灰杨花粉母细胞进行11次注射处理,获得了30.3 %的2n花粉。本研究利用50、100、200 μmol/L赤霉素于花粉母细胞、第一次减数分裂以及第二次减数分裂时期对新疆杨雄花芽进行喷洒处理,不同处理组合均可获得一定比例的2n花粉,说明利用赤霉素处理诱导杨树2n花粉是可行的。其中,以50 μmol/L赤霉素于第二次减数分裂时期喷洒处理7次的最佳处理组合仅获得8.83%的2n花粉,原因主要包括2个方面:一是当花粉母细胞发育至第二次减数分裂前后,花芽一直被芽鳞包被,喷洒的赤霉素未能直接与花药接触而被蒸发,降低了赤霉素的处理效果;另一方面则是新疆杨同一花芽不同花药内花粉母细胞减数进程同步性差,影响了赤霉素的处理效果。
微管骨架在细胞分裂过程中发挥着重要作用。植物减数分裂的正常进行与微管骨架的有序分布和动态变化密切相关[47]。王君[18]对通辽杨的减数分裂免疫荧光分析研究发现:减数分裂末期Ⅱ细胞成膜体缺失导致胞质分裂失败,细胞内子核未能正常分离而共存于同1个小孢子内,形成二分体和三分体,进一步发育形成2n花粉。鲁敏[23]在响叶杨天然2n花粉发生机制的研究中发现:减数分裂后期Ⅱ纺锤体微管缺失导致姐妹染色单体不分离,末期Ⅱ成膜体微管缺失导致胞质分裂异常,二者是天然2n花粉产生的细胞学机制。张平冬等[50]在胡杨减数分裂过程中观察到平行纺锤体、三极纺锤体和融合纺锤体,这些异常的纺锤体与胡杨天然2n花粉发生密切相关。Liu等[33]对拟南芥施加赤霉素处理后研究发现:减数分裂末期Ⅱ相邻子核间的微管缺失,导致子核聚集在同1个小孢子中,发育形成2n花粉。本研究通过免疫荧光技术探索了赤霉素处理对新疆杨花粉母细胞微管骨架构建及分布的影响,发现赤霉素处理可导致减数分裂末期Ⅱ辐射状微管产生部分缺失,致使相邻子核间胞质分裂失败,从而产生核复原现象,形成三分体,进而发育成1个单倍性配子和1个2n配子。
针对杨树花药被芽鳞包被而导致赤霉素喷洒处理效果不理想的问题,下一阶段的工作应聚焦于赤霉素处理方式、药剂浓度以及处理时间等技术条件优化研究,旨在提高赤霉素诱导2n花粉的效率。
4. 结 论
在温室水培条件下,新疆杨花粉母细胞完成减数分裂历时约4 d,且存在明显的不同步性。利用浓度为50、100、200 μmol/L赤霉素于花粉母细胞、第一次减数分裂以及第二次减数分裂时期分别对新疆杨雄花芽进行喷洒处理,不同处理组合均可获得一定比例的2n花粉,说明利用赤霉素处理诱导新疆杨获得2n花粉是可行的。其中以50 μmol/L赤霉素于第二次减数分裂时期喷施处理7次为最佳处理组合,可以获得8.83%的2n花粉。在最佳处理组合条件下,新疆杨雄花芽经赤霉素喷洒处理可导致减数分裂末期Ⅱ辐射状微管产生部分缺失,致使相邻子核间胞质分裂失败,从而产生核复原现象,形成三分体,进而产生2n花粉。
-
表 1 土壤基本理化性质
Table 1 Background values of soil physiochemical properties (Mean±SE, n=3)
森林类型
Forest typepH 有机质
Organic matter/(g·kg-1)全氮
Total nitrogen/(g·kg-1)NH4+-N/(mg·kg-1) NO3--N/(mg·kg-1) 油松Pinus tabuliformis 6.31±0.36 44.4±1.88 2.31±0.23 1.29±0.26 0.75±0.25 表 2 6—8月不同形态和水平的氮添加下土壤各样地N2O排放通量重复测量方差分析
Table 2 Results of repeated measures ANOVA of soil N2O emission under different N-level and N-form addition from June to August
项目Item 变异Variation F P 不同水平氮添加 Different N addition level 时间Time 853.815 <0.001 氮水平N level 186.904 <0.001 时间×氮水平Time×N level 97.604 <0.001 不同形态氮添加 Different N addition form 时间Time 1 266.148 <0.001 氮形态N form 1 300.398 <0.001 时间×氮形态Time×N form 262.870 <0.001 表 3 不同水平和形态氮添加下土壤N2O的年累积排放量和排放系数
Table 3 Annual N2O cumulative fluxes and soil N2O emission factor under different N-level and N-form addition
项目
Item不同水平氮添加Different N addition level 不同形态氮添加Different N addition form CK LN MN HN AN Na As 累积排放/(kg·hm-2) Cumulative emission/ (kg·ha-1) 0.40±0.04 c 0.82±0.06 b 0.84±0.04 b 1.00±0.06 a 0.84±0.04 a 0.70±0.04 b 0.81±0.04 bc 排放系数 Emission coefficient/% — 0.936±0.038 5 a 0.497±0.004 0 b 0.453±0.018 0 b 0.497±0.004 0 a 0.343±0.000 6 b 0.457±0.004 9 a 注:同一行中不同字母表示处理间差异显著(P<0.05)。Note:Different superscripts of letters in the same row indicate the significant differences at the level of P<0.05 between the treatments. -
[1] FANG Y, YOH M, KOBA K, et al. Nitrogen deposition and forest nitrogen cycling along an urban-rural transect in southern China[J]. Global Change Biology, 2011, 17(2): 872-885. doi: 10.1111/j.1365-2486.2010.02283.x
[2] GALLOWAY J N, COWLING E B. Reactive nitrogen and the world: 200 years of change[J]. AMBIO: A Journal of the Human Environment, 2002, 31(2): 64-71. doi: 10.1579/0044-7447-31.2.64
[3] BOBBINK R, HICKS K, GALLOWAY J, et al. Global assessment of nitrogen deposition effects on terrestrial plant diversity: a synthesis[J]. Ecological Applications, 2010, 20(1): 30-59. doi: 10.1890/08-1140.1
[4] BUTTERBACH-BAHL K, ROTHE A, PAPEN H. Effect of tree distance on N2O and CH4 fluxes from soils in temperate forest ecosystems[J]. Plant and Soil, 2002, 240(1): 91-103. doi: 10.1023/A:1015828701885
[5] SOLOMON S. IPCC (2007): climate change the physical science basis[J]. American Geophysical Union, 2007, 9(1): 123-124.
[6] RAVISHANKARA A, DANIEL J S, PORTMANN R W. Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326: 123-125. doi: 10.1126/science.1176985
[7] HANSEN J E, LACIS A A. Sun and dust versus greenhouse gases: an assessment of their relative roles in global climate change[J]. Nature, 1990, 346: 713-719. doi: 10.1038/346713a0
[8] BRUMME R, VERCHOT L V, MARTIKAINEN P J, et al. Contribution of trace gases nitrous oxide (N2O) and methane (CH4) to the atmospheric warming balance of forest biomes[J]. Seb Experimental Biology, 2005, 27(7): 293-317. http://europepmc.org/abstract/MED/17633041
[9] 方华军, 程淑兰, 于贵瑞, 等.大气氮沉降对森林土壤甲烷吸收和氧化亚氮排放的影响及其微生物学机制[J].生态学报, 2014, 34(17): 4799-4806. http://d.old.wanfangdata.com.cn/Periodical/stxb201417001 FANG H J, CHENG S L, YU G R, et al. Microbial mechanisms responsible for the effects of atmospheric nitrogen deposition on methane uptake and nitrous oxide emission in forest soils: a review[J]. Acta Ecologica Sinica, 2014, 34(17): 4799-4806. http://d.old.wanfangdata.com.cn/Periodical/stxb201417001
[10] 莫江明, 方运霆, 林而达, 等.鼎湖山主要森林土壤N2O排放及其对模拟N沉降的响应[J].植物生态学报, 2006, 30(6): 901-910. doi: 10.3321/j.issn:1005-264X.2006.06.003 MO J M, FANG Y T, LIN E D, et al. Soil N2O emission and its response to simulated N deposition in the main forests of Ding Hushan in subtropical china[J]. Chinese Journal of Plant Ecology, 2006, 30(6): 901-910. doi: 10.3321/j.issn:1005-264X.2006.06.003
[11] ADAMS M, INESON P, DAN B, et al. Soil functional responses to excess nitrogen inputs at global scale[J]. Ambio A Journal of the Human Environment, 2004, 33(8): 530-536. doi: 10.1579/0044-7447-33.8.530
[12] CHEN G C, TAM N F Y, YE Y. Spatial and seasonal variations of atmospheric N2O and CO2 fluxes from a subtropical mangrove swamp and their relationships with soil characteristics[J]. Soil Biology & Biochemistry, 2012, 48(4): 175-181. https://www.sciencedirect.com/science/article/abs/pii/S0038071712000508
[13] ZHU J, MULDER J, SOLHEIMSLID S O, et al. Functional traits of denitrification in a subtropical forest catchment in China with high atmogenic N deposition[J]. Soil Biology & Biochemistry, 2013, 57(3): 577-586. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=52b212985a958c0e6b39fc77f5ccbee8
[14] PENG Q, QI Y, DONG Y, et al. Soil nitrous oxide emissions from a typical semiarid temperate steppe in Inner Mongolia: effects of mineral nitrogen fertilizer levels and forms[J]. Plant and Soil, 2011, 342(1-2): 345-357. doi: 10.1007/s11104-010-0699-1
[15] WANG L, CAI Z. Nitrous oxide production at different soil moisture contents in an arable soil in China[J]. Soil Science & Plant Nutrition, 2008, 54(5): 786-793. doi: 10.1111/j.1747-0765.2008.00297.x
[16] WANG F, LI J, WANG X, et al. Nitrogen and phosphorus addition impact soil N2O emission in a secondary tropical forest of South China[J]. Sci Rep, 2014, 4: 5615-5615. https://www.nature.com/articles/srep05615
[17] BAI E, LI W, LI S L, et al. Pulse increase of soil N2O emission in response to N addition in a temperate forest on Mt Changbai, Northeast China[J]. Plos One, 2014, 9(7): e102765-e102765. doi: 10.1371/journal.pone.0102765
[18] LIU X, DONG Y, QI Y, et al. Response of N2O emission to water and nitrogen addition in temperate typical steppe soil in Inner Mongolia, China[J]. Soil and Tillage Research, 2015, 151(1): 9-17. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=27d040258af08910c79d76190dfa17ae
[19] HATCH D, JARVIS S, PHILIPPS L. Field measurement of nitrogen mineralization using soil core incubation and acetylene inhibition of nitrification[J]. Plant and Soil, 1990, 124(1): 97-107. doi: 10.1007/BF00010937
[20] DONG Y, ZHANG S, QI Y, et al. Fluxes of CO2, N2O and CH4 from a typical temperate grassland in Inner Mongolia and its daily variation[J]. Chinese Science Bulletin, 2000, 45(17): 1590-1594. doi: 10.1007/BF02886219
[21] MATSON A, PENNOCK D, BEDARD-HAUGHN A. Methane and nitrous oxide emissions from mature forest stands in the boreal forest, Saskatchewan, Canada[J]. Forest Ecology and Management, 2009, 258(7): 1073-1083. doi: 10.1016/j.foreco.2009.05.034
[22] YUPING Y, LIQING S, MIN C, et al. Fluxes of CH4 and N2O from soil under a tropical seasonal rain forest in Xishuangbanna, Southwest China[J]. Journal of Environmental Sciences, 2008, 20(2): 207-215. doi: 10.1016/S1001-0742(08)60033-9
[23] VAN GROENIGEN J W, VELTHOF G L, VAN DER BOLT F J, et al. Seasonal variation in N2O emissions from urine patches: effects of urine concentration, soil compaction and dung[J]. Plant and Soil, 2005, 273(1-2): 15-27. doi: 10.1007/s11104-004-6261-2
[24] DONOSO L, SANTANA R, SANHUEZA E. Seasonal variation of N2O fluxes at a tropical savannah site: soil consumption of N2O during the dry season[J]. Geophysical Research Letters, 1993, 20(13): 1379-1382. doi: 10.1029/93GL01537
[25] 欧阳扬, 李叙勇.干湿交替频率对不同土壤CO2和N2O释放的影响[J].生态学报, 2013, 33(4): 1251-1259. http://d.old.wanfangdata.com.cn/Periodical/stxb201304025 OUYANG Y, LI X Y. Impacts of drying-wetting cycles on CO2 and N2O emissions from soils in different ecosystems[J]. Acta Ecologica Sinica, 2013, 33(4): 1251-1259. http://d.old.wanfangdata.com.cn/Periodical/stxb201304025
[26] LIN S, IQBAL J, HU R, et al. Nitrous oxide emissions from rape field as affected by nitrogen fertilizer management: a case study in Central China[J]. Atmospheric Environment, 2011, 45(9): 1775-1779. doi: 10.1016/j.atmosenv.2011.01.003
[27] 陈哲, 陈媛媛, 高霁, 等.不同施肥措施对黄河上游灌区油葵田土壤N2O排放的影响[J].应用生态学报, 2015, 26(1): 129-139. http://d.old.wanfangdata.com.cn/Periodical/yystxb201501018 CHEN Z, CHEN Y Y, GAO J, et al. Effects of different fertilization measures on N2O emission in oil sunflower field in irrigation area of upper Yellow River[J]. The Journal of Applied Ecology, 2015, 26(1): 129-139. http://d.old.wanfangdata.com.cn/Periodical/yystxb201501018
[28] 王海云, 邢光熹.不同施氮水平对稻麦轮作农田氧化亚氮排放的影响[J].农业环境科学学报, 2009, 28(12): 2631-2636. doi: 10.3321/j.issn:1672-2043.2009.12.030 WANG H Y, XING G X. Effect of nitrogen fertilizer rates on nitrous oxide emission from paddy field under rice-wheat rotation[J]. Journal of Agro-Environment Science, 2009, 28(12): 2631-2636. doi: 10.3321/j.issn:1672-2043.2009.12.030
[29] 蔺照兰, 王春梅, 王汝南.冻融期温带森林土壤N2O排放对模拟大气氮沉降的响应[J].生态环境学报, 2012, 21(11): 1804-1809. doi: 10.3969/j.issn.1674-5906.2012.11.006 LIN Z L, WANG C M, WANG R N. Effects of simulated N deposition on N2O emssion from temperate forest soil subject to freezing-thawing process[J]. Ecology and Environmental Sciences, 2012, 21(11): 1804-1809. doi: 10.3969/j.issn.1674-5906.2012.11.006
[30] ZHU J, MULDER J, WU L P, et al. Spatial and temporal variability of N2O emissions in a subtropical forest catchment in China[J]. Biogeosciences, 2013, 10(3): 1309-1321. doi: 10.5194/bg-10-1309-2013
[31] HEFTING M M, BOBBINK R, DE CALUWE H. Nitrous oxide emission and denitrification in chronically nitrate-loaded riparian buffer zones[J]. Journal of Environmental Quality, 2003, 32(4): 1194-1203. doi: 10.2134/jeq2003.1194
[32] DAVIDSON E A. Sources of nitric oxide and nitrous oxide following wetting of dry soil[J]. Soil Science Society of America Journal, 1992, 56(1): 95-102. doi: 10.2136/sssaj1992.03615995005600010015x
[33] LIU D Y, SONG C C. Effects of inorganic nitrogen and phosphorus enrichment on the emission of N2O from a freshwater marsh soil in Northeast China[J]. Environmental Earth Sciences, 2010, 60(4): 799-807. doi: 10.1007/s12665-009-0217-z
[34] STAPLETON L M, CROUT N M J, SÄWSTRÖM C, et al. Microbial carbon dynamics in nitrogen amended Arctic tundra soil: measurement and model testing[J]. Soil Biology and Biochemistry, 2005, 37(11): 2088-2098. doi: 10.1016/j.soilbio.2005.03.016
[35] LIU D Y, SONG C C. Effects of phosphorus enrichment on mineralization of organic carbon and contents of dissolved carbon in a freshwater marsh soil[J]. China Environmental Science, 2008, 28(9): 769-774. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zghjkx200809001
[36] LUBETSKY J, STEINER B A, LANZA R. 2006 IPCC guidelines for national greenhouse gas inventories[M]. Arlington: Institute for Global Environmental Strategies, 2006.
[37] HE F F, JIANG R F, CHEN Q, et al. Nitrous oxide emissions from an intensively managed greenhouse vegetable cropping system in Northern China[J]. Environmental Pollution, 2009, 157(5): 1666-1672. doi: 10.1016/j.envpol.2008.12.017
-
期刊类型引用(3)
1. 李婧,左欣欣,赵培伶,张陆玉,徐文鸾,张徐杨,倪德江,王明乐. 茶树高亲和硝酸盐转运蛋白家族基因NRT2的鉴定与表达. 应用与环境生物学报. 2022(01): 50-56 .  百度学术
百度学术
2. 杨利艳,高源,朱满喜,邓妍,王创云. 藜麦NRT2基因家族的鉴定及表达分析. 华北农学报. 2022(S1): 8-18 .  百度学术
百度学术
3. 张云,赵艳菲,王雅平,牟彬,张嘉越,马浩然,韩玉珠. 延薯4号马铃薯对氮素的生理生化响应及转录组分析. 广东农业科学. 2021(02): 56-66 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: