Analysis of smHsp genes in Lymantria dispar and its response to carbaryl stress
-
摘要: 昆虫小分子热激蛋白(smHsp)是分子质量在12~43 kDa、具有分子伴侣活性的应激蛋白,可以在环境胁迫下帮助蛋白质折叠和转运。本文为明确舞毒蛾的smHsp基因特性及对杀虫剂甲萘威胁迫的响应,从舞毒蛾无参照全转录本文库中鉴定获得6个小分子热激蛋白家族基因,全长基因开放阅读框为444~567 bp,编码147~188个氨基酸,理论等电点为5.58~6.17。根据分子质量大小分别命名为LdHsp17.0、LdHsp18.7、LdHsp19.1、LdHsp20.3、LdHsp21.3和LdHsp21.4。亚致死剂量(LC5、LC10和LC30)的甲萘威处理可诱导舞毒蛾smHsp家族中LdHsp20.3、LdHsp19.1和LdHsp17.0上调表达,但抑制了LdHsp21.4、LdHsp21.3和LdHsp18.7的表达,且甲萘威处理对smHsp基因表达量的影响存在质量浓度和剂量效应。以上结果为进一步研究舞毒蛾小分子热激蛋白功能及其参与对杀虫剂抗性的机制提供了基础。Abstract: Small heat shock proteins of insect with molecular weight from 12 to 43 kDa are stress proteins with molecular chaperone activity and can assist protein folding and transporting under environmental stress. In present study, the full length of six smHsp cDNA was identified from Lymantria dispar transcriptome. The open reading frames (ORF) of smHsps were from 444 to 567 bp encoding proteins of 147-188 amino acid residues with the theoretical pI of 5.58-6.17. These smHsps were named as LdHsp17.0, LdHsp18.7, LdHsp19.1, LdHsp20.3, LdHsp21.3 and LdHsp21.4 according to their molecular mass. The effects of sublethal concentrations (LC5, LC10 and LC30) of carbaryl on smHsp gene expression in L. dispar larvae were analyzed using real-time RT-PCR technology. The results showed that the expressions of LdHsp20.3, LdHsp19.1 and LdHsp17.0 were induced while those of LdHsp21.4, LdHsp21.3 and LdHsp18.7 were inhibited under three sublethal concentrations of carbaryl. The smHsp gene expressions were in concentration- and time-dependent way. Our study provides the basis for further studying the functions of smHsp and their roles in insecticide resistance in L. dispar.
-
Keywords:
- Lymantria dispar /
- smHsp /
- carbaryl /
- expression analysis
-
热激蛋白(Heat stress proteins, Hsp)主要参与生物体内新生肽的运输、折叠、组装、定位以及变性蛋白的复性和降解,具有分子伴侣作用[1],广泛存在于自然界原核与真核细胞中,在生物体内具有多种复杂的功能。当受到环境胁迫时,生物体就会开启该类应激基因的迅速表达,产生结构上非常保守的特殊蛋白质,使生物体快速调整细胞的存活机制,促进细胞恢复正常的结构和机能[2]。热激蛋白按照蛋白分子质量大小和同源性分为5类:Hsp100(80~110 kDa)、Hsp90(82~96 kDa)、Hsp70(67~76 kDa)、Hsp60(58~65 kDa)和小分子热激蛋白(40 kDa以下)[3]。除昆虫小分子热激蛋白(smHsp)外,其余4类热激蛋白均比较保守,但smHsp在结构和功能上具有共同特征,分子质量范围12~43 kDa,所有小分子热激蛋白含有保守的80~100个氨基酸组成的α晶体结构域(α-crystallin domain,ACD),可产生数量较多的低聚体,能被胁迫因子诱导并具有分子伴侣活性[4-9]。Hsp70和Hsp40分子伴侣活性需要ATP能量,主动介导底物结合/释放循环,但smHsp的分子伴侣活性不同,其本身具有和同等质量变性底物结合的能力,而不需要直接重新折叠热诱导的非折叠变性蛋白,从而形成稳定的复合体,并且防止不可逆的非特异性聚集的发生[10]。smHsp能够与其他热激蛋白互作阻止靶蛋白的聚合,并在靶蛋白的重折叠过程中发挥重要作用[11-12]。许多研究表明smHsp参与生物体的生长发育和氧化还原代谢、维持细胞完整性以及增强对环境胁迫能力等重要生理功能[9-10]。目前,研究证实昆虫smHsp在生长发育、生殖调节以及滞育和休眠中均发挥着重要作用[11],而对杀虫剂胁迫响应方面研究甚少。
舞毒蛾(Lymantria dispar)是一种周期性发生的世界性林业食叶害虫,国内报道取食杨树(Populus spp.)、马尾松(Pinus massoniana)、栎(Quercus spp.)、红松(Pinus koraiensis)等500多种植物,主要分布于东北、华北、华中和西北地区,其传播和蔓延的速度快[12],给农林业生产带来了巨大损失,化学防治仍是目前有效控制舞毒蛾危害的主要防治措施之一。本文从舞毒蛾转录本文库中获得了舞毒蛾Hsp家族中6个smHsp基因的全长cDNA序列,分析该基因生物学特性,在此基础上进一步采用实时荧光定量RT-PCR技术,探讨了smHsp对杀虫剂甲萘威胁迫的响应,为进一步研究smHsp应对外源杀虫剂响应作用机制提供依据。
1. 材料与方法
1.1 供试昆虫
舞毒蛾卵块和人工饲料购自中国林业科学研究院森林生态环境与保护研究所,幼虫置于温度(25±1) ℃,光照14 L:10 D,相对湿度75%的条件下的培养箱内,人工饲料饲养,取健康、大小一致的2龄幼虫进行试验。
1.2 smHsp基因克隆与分析
从1~6龄的舞毒蛾幼虫中,分别随机挑选活泼、健康、大小一致的幼虫各10头,采用RNeasy Mini动物组织总RNA提取试剂盒(Qiagen),分别提取舞毒蛾幼虫各龄期的总RNA,然后将各龄幼虫提取的总RNA等比例混匀,20 μg总RNA用于转录组文库构建,用Illumina HiSeqTM 2000对建好的测序文库进行测序(深圳华大基因科技有限公司)[13-14]。对转录组文库中Unigenes在NCBI上进行Blastx和Blastn分析,根据功能注释结果,查找并获得smHsp基因序列,然后设计引物进行RT-PCR验证,通过测序确定所获得的smHsp基因全长序列。用ORF founder(http://www.ncbi.nlm.nih.gov/gorf.html)程序来确定其开放读码框。用ProtParam(http://au.expasy.org/tools/protparam.html)软件计算推导蛋白质的分子质量及理论等电点。在NCBI上用Conserved Domains程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)来预测蛋白的保守区。利用Blast程序(http://www.ncbi.nlm.nih.gov/BLAST/)来进行序列同源性搜索,选择与其相似程度高的鳞翅目昆虫的smHsp蛋白氨基酸序列,用ClustalW多序列联配程序进行多序列比对。应用Clustalx 1.83和MEGA 5.1,采用邻接法(Neighbor-Joining, N-J)构建系统发育树[15]。
1.3 实时荧光定量RT-PCR
采用含有LC5(0.031 mg/g)、LC10(0.041 mg/g)和LC30(0.075 mg/g)剂量的甲萘威人工饲料毒饵饲喂舞毒蛾2龄幼虫,以不含甲萘威的人工饲料作为对照组,分别于饲喂舞毒蛾幼虫6、12、24、48和72 h后,随机挑取活泼幼虫提取其总RNA,用DNase I(Promega)消化总RNA中的DNA,测定其质量浓度,采用PrimeScriptTM RT reagent Kit(TaKaRa)合成cDNA,将合成cDNA稀释10倍,作为模板备用,使用试剂盒SYBR Green Real-time PCR Master mix(Toyobo)进行实时荧光定量PCR。内参基因(Actin、EF1α和TUB)和smHsp基因引物序列见表 1。实时荧光定量PCR反应体系为:10 μL 2×SYBR premix Ex Taq酶、正向和反向引物(10 μmol/L)各1、2 μL稀释的cDNA模板,加去离子水补足20 μL;反应条件:94 ℃预变性30 s,94 ℃变性12 s,60 ℃退火45 s,72 ℃延伸45 s,81 ℃读板1 s,45个循环,每样品和每处理各重复3次,用2-△△Ct方法进行基因相对表达量分析[16]。
表 1 实时荧光定量RT-PCR引物序列Table 1. Primer sequences of real-time RT-PCR基因
Gene正向引物序列(5′-3′)
Forward primer sequence (5′-3′)反向引物序列(5′-3′)
Reverse primer sequence (5′-3′)LdHsp20.3 AGACGTCGGCTCTACTATCA CATCACGGAATCGGCATCTA LdHsp18.7 GACTCCACAGCATCAGGATTAG GGATGCCGGATCTTCAATCA LdHsp21.4 CTCTGCTCTCCGATGACTACTA CGAACTGTCGACTGATGTATCC LdHsp19.1 CTCCGTACTGGATGCGTTATC CACCTTCTTCCCGTCGATTT LdHsp17.0 GGAGCGTGACAAGTACGAAA CCGAGGTACGGTGATAACTAGA LdHsp21.3 GGGTGTACTGGCTAACATCAA CCGAAATGAGGAAGATGGAAGA Actin AGAAGCACTTGCGGTGGACAAT ACCTGTACGCCAACACTGTCAT EF1α TTTGCCTTCCTTGCGCTCAACA TGTAAAGCAGCTGATCGTGGGT TUB AATGCAAGAAAGCCTTGCGCCT ATGAAGGAGGTCGACGAGCAAA 1.4 数据统计与分析
采用SPSS 17.0(SPSS Inc., USA)统计软件进行单因素方差分析(One-way ANOVA,Duncan)检测同一基因在同一浓度的甲萘威胁迫下,不同时间点表达量差异的显著性(P<0.05)。采用OriginPro 8.5软件,进行数据统计和绘图。
2. 结果与分析
2.1 smHsp基因全长克隆与分析
通过舞毒蛾转录组文库分析和RT-PCR验证获得6个舞毒蛾smHsp家族全长基因,开放阅读框大小为444~567 bp;编码147~188个氨基酸;理论等电点为5.58~6.17,均为酸性蛋白(表 2)。BLASTP对6个舞毒蛾smHsp保守区的预测结果表明,该类蛋白属于alpha-crystallin-Hsps-p23-like超级家族蛋白(图 1)。
表 2 舞毒蛾smHsp基因特性Table 2. Characteristics of smHsp genes in L. dispar基因
Gene开放阅读框
Open reading frame/bp编码氨基酸
Encoding amino acids分子质量
Molecular weight/kDa理论等电点
Theoretical pI含量最多的氨基酸
The most abundant amino acids/%LdHsp17.0 444 147 17.00 6.15 Lys(9.5%) LdHsp18.7 501 166 18.79 5.58 Val(9.6%) LdHsp19.1 495 164 19.10 6.13 Glu(11.0%) LdHsp20.3 534 177 20.30 5.76 Glu(8.5%) LdHsp21.4 567 188 21.42 6.17 Leu(9.0%) LdHsp21.3 564 187 21.37 5.79 Ser(11.8%) 舞毒蛾smHsp蛋白的系统进化树分析表明,6个smHsp蛋白分为二大类,LdHsp20.3、LdHsp21.4、LdHsp18.7和LdHsp17.0聚为一大类,其中LdHsp20.3、LdHsp21.4和LdHsp18.7分别与甘蓝夜蛾(Mamestra brassicae)、印度谷斑螟(Plodia interpunctella)和大红斑蝶(Danaus plexippus)亲缘关系最近而聚为一类。舞毒蛾LdHsp21.3和LdHsp19.1与艺神袖蝶(Heliconius erato)、斜纹夜蛾(Spodoptera litura)、棉铃虫(Helicoverpa armigera)和柑橘凤蝶(Papilio xuthus)聚为一大类(图 2)。
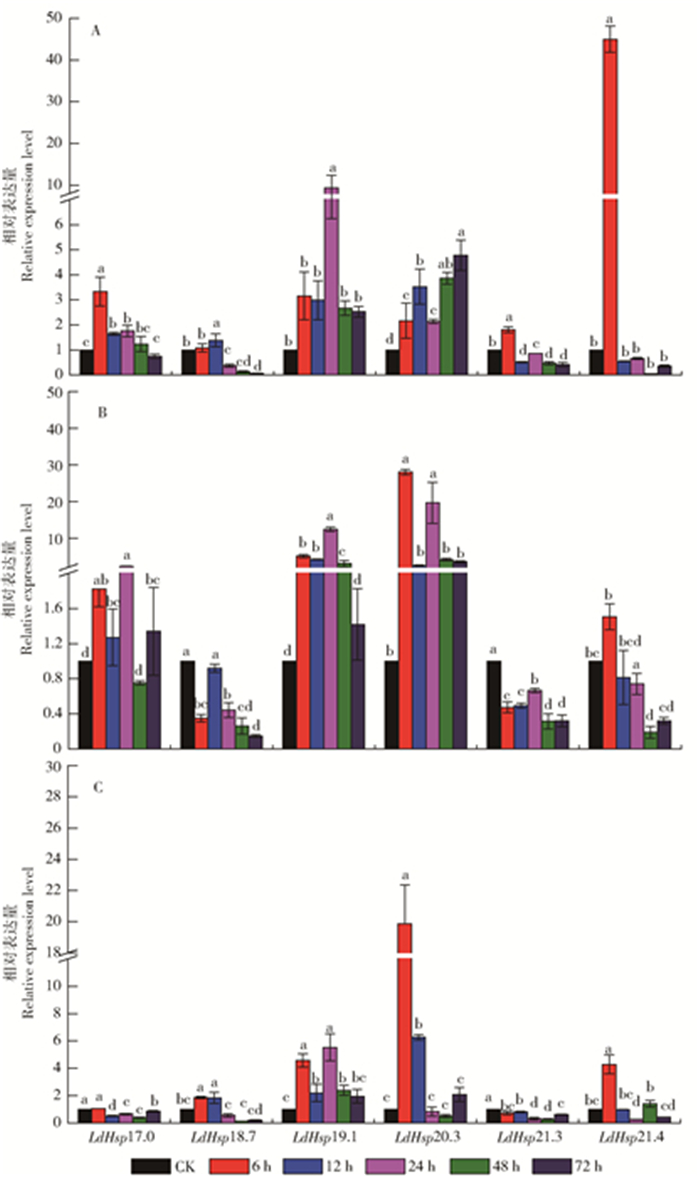
2.2 甲萘威胁迫对smHsp基因表达量的影响
为了探讨杀虫剂甲萘威对舞毒蛾smHsp基因表达的影响,运用实时荧光定量RT-PCR技术分析了亚致死剂量(LC5、LC10和LC30)的甲萘威对舞毒蛾2龄幼虫6个smHsp基因表达量的影响(图 3)。亚致死剂量甲萘威对舞毒蛾smHsp表达量的影响结果分为两类:一类是对LdHsp20.3、LdHsp19.1和LdHsp17.0主要表现为诱导上调;另一类是对LdHsp21.4、LdHsp21.3和LdHsp18.7主要表现为抑制其表达。
![]() 图 3 甲萘威胁迫对舞毒蛾smHsp基因表达量的影响A.亚致死剂量LC5处理组smHsp基因表达量;B.亚致死剂量LC10处理组smHsp基因表达量;C.亚致死剂量LC30处理组smHsp基因表达量。不同小写字母表示同一基因不同处理间的表达量差异显著(P<0.05)。Figure 3. Effects of carbaryl on smHsp gene expressions in L. dispar larvaeA, smHsp gene expression under LC5 of sublethal dose stress; B, smHsp gene expression under LC10 of sublethal dose stress; C, smHsp gene expression under LC30 of sublethal dose stress. Different lowercase letters show significant differences between treatment groups for the same gene at P < 0.05 level.
图 3 甲萘威胁迫对舞毒蛾smHsp基因表达量的影响A.亚致死剂量LC5处理组smHsp基因表达量;B.亚致死剂量LC10处理组smHsp基因表达量;C.亚致死剂量LC30处理组smHsp基因表达量。不同小写字母表示同一基因不同处理间的表达量差异显著(P<0.05)。Figure 3. Effects of carbaryl on smHsp gene expressions in L. dispar larvaeA, smHsp gene expression under LC5 of sublethal dose stress; B, smHsp gene expression under LC10 of sublethal dose stress; C, smHsp gene expression under LC30 of sublethal dose stress. Different lowercase letters show significant differences between treatment groups for the same gene at P < 0.05 level.LC5和LC10甲萘威胁迫处理后,舞毒蛾LdHsp20.3基因的表达量在6~72 h均表现为显著上调,且LC10胁迫诱导作用高于LC5;LC10胁迫6 h时诱导作用最大,为对照的28.08倍;而LC30处理24 h和48 h时LdHsp20.3的表达量分别下降为对照的84%和50%。与对照相比,LC5、LC10和LC30甲萘威胁迫对舞毒蛾LdHsp19.1的表达均表现为显著的诱导作用,表达量为对照的1.42~12.46倍,其中胁迫24 h是表达量最高。LC5和LC10甲萘威对LdHsp17.0主要表现为诱导作用,LC5胁迫6 h其表达量为对照的3.34倍;但LC30甲萘威在处理的72 h内(除6 h)主要表现为抑制作用,表达量为对照的39%~86%。
亚致死剂量甲萘威对舞毒蛾LdHsp21.3和LdHsp18.7的表达主要表现为显著的抑制作用。与对照相比,LC5、LC10和LC30甲萘威处理72 h(除LC5胁迫6 h)均显著抑制了LdHsp21.3的表达,表达量为对照的28%~86%,其中LC30甲萘威胁迫48 h抑制作用最大,抑制率为72%。甲萘威处理24~72 h均显著抑制了LdHsp18.7的表达,表达量为对照的13%~55%。对于LdHsp21.4,除了甲萘威胁迫6 h表现为诱导作用外,随着作用时间的延长均表现为显著的抑制作用,表达量为对照的5%~98%,其中LC5甲萘威处理48 h抑制作用最大,抑制率达95%。
3. 讨论与结论
热激蛋白是生物体细胞在一些应激源(如:高温、缺氧、重金属、氧化应激、饥饿、代谢毒物等)诱导下,激活Hsp基因从而高效表达的一组进化上高度保守的蛋白质。其中,smHsp在N端和C端氨基酸序列和长度差异较大,但它们的中段α晶体序列长度和结构上比较相似,都具有“三明治”的β折叠[17]。昆虫体内有众多smHsps,每种昆虫体内所含有的种类和功能各不相同。本文获得舞毒蛾6个含有1个α晶体结构域smHsp蛋白,系统进化树分析表明舞毒蛾smHsp蛋白序列差异性大,同源性小,LdHsp20.3、LdHsp21.4、LdHsp18.7和LdHsp17.0亲缘关系较近而聚为一大类,LdHsp19.1和LdHsp21.3聚为另一类。
热激蛋白是有机体在压力胁迫下诱导表达的参与自身保护反应的一类特殊蛋白,在陆地和水生系统,其化学物质胁迫响应机制已成为主要研究方向之一[18-19]。在外源有毒物质对生物体毒性作用的研究中,不仅大分子Hsps基因作为生物标志基因被广泛研究,而且smHsp基因在生物体应对外源化合物胁迫响应中所起的重要作用也有所报道。有研究发现黑腹果蝇(Drosophila melanogaster)3龄幼虫暴露于0.02~2.00 μg/mL的硫丹12~48 h,Hsp83、Hsp70、Hsp60和Hsp26与对照组相比没有显著表达差异,但发现Hsp23和Hsp22的表达量随处理质量浓度和时间的增加而增加,并且在48 h后,Hsp23表达量高于Hsp22,推测Hsp22和Hsp23在果蝇应对硫丹介导的细胞压力中担当重要的保护角色[20]。王瑞娴等采用双跟踪标定定量分析法测定表明家蚕(Bombyx mori)取食蜕皮激素(2×10-3 μg/μL)和芸香苷(5×10-2 ng/μL)溶液浸泡的桑叶2 h后,BmHsp19.9基因在中肠、脂肪体和马氏管组织中的转录水平均有上升[21]。王利华等报道在毒死蜱长期筛选的灰飞虱(Laodelpphax striatellus)种群中LsHsp70-2、LsHsp90-1和LsHsp90-2的表达量分别上升2.32、1.53和2.28倍;且高温(42 ℃)热激后毒死蜱抗性品系的存活率比敏感品系高23.58%[22]。寇利花等发现Cd急性诱导下中华稻蝗(Oxya chinensis)OcsHSPs(OcHsp19.1、OcHsp19.8、OcHsp20.4、OcHsp20.7、OcHsp21.1)基因在精巢和卵巢的表达模式不同,其表达量与Cd质量浓度和作用时间有关[23]。本文研究结果表明3个亚致死剂量的甲萘威胁迫舞毒蛾2龄幼虫后,其smHsp基因呈现不同的表达模式。甲萘威处理对舞毒蛾LdHsp20.3和LdHsp19.1表现出高的诱导表达效应,但对LdHsp17.0诱导效果较小,在高质量浓度(LC30)下则表现为抑制作用。这些舞毒蛾smHsps基因的上调表达使得细胞内smHsp蛋白增多,进而及时与变性蛋白结合,形成稳定的复合体,防止不可逆的非特异性聚集,可能为DnaK/Hsp70蛋白争取更多机会与变性蛋白结合,进而增强害虫应对外界胁迫时产生的蛋白修复能力。然而,舞毒蛾LdHsp21.4、LdHsp21.3和LdHsp18.7对甲萘威胁迫的响应则主要表现为下调表达,虽然在胁迫初期表现出一定诱导作用,这表明3个smHsp基因在低质量浓度短时间胁迫下具有迅速应激响应来保护自身免受损伤的能力,但随着质量浓度和时间的延长胁迫压力增大而丧失。随着全球气候变暖和害虫抗药性日益严重,害虫对生境适应能力增强,对热激蛋白的深入研究可为探讨害虫抗逆机制以及害虫综合治理提供一定的理论基础。
-
图 3 甲萘威胁迫对舞毒蛾smHsp基因表达量的影响
A.亚致死剂量LC5处理组smHsp基因表达量;B.亚致死剂量LC10处理组smHsp基因表达量;C.亚致死剂量LC30处理组smHsp基因表达量。不同小写字母表示同一基因不同处理间的表达量差异显著(P<0.05)。
Figure 3. Effects of carbaryl on smHsp gene expressions in L. dispar larvae
A, smHsp gene expression under LC5 of sublethal dose stress; B, smHsp gene expression under LC10 of sublethal dose stress; C, smHsp gene expression under LC30 of sublethal dose stress. Different lowercase letters show significant differences between treatment groups for the same gene at P < 0.05 level.
表 1 实时荧光定量RT-PCR引物序列
Table 1 Primer sequences of real-time RT-PCR
基因
Gene正向引物序列(5′-3′)
Forward primer sequence (5′-3′)反向引物序列(5′-3′)
Reverse primer sequence (5′-3′)LdHsp20.3 AGACGTCGGCTCTACTATCA CATCACGGAATCGGCATCTA LdHsp18.7 GACTCCACAGCATCAGGATTAG GGATGCCGGATCTTCAATCA LdHsp21.4 CTCTGCTCTCCGATGACTACTA CGAACTGTCGACTGATGTATCC LdHsp19.1 CTCCGTACTGGATGCGTTATC CACCTTCTTCCCGTCGATTT LdHsp17.0 GGAGCGTGACAAGTACGAAA CCGAGGTACGGTGATAACTAGA LdHsp21.3 GGGTGTACTGGCTAACATCAA CCGAAATGAGGAAGATGGAAGA Actin AGAAGCACTTGCGGTGGACAAT ACCTGTACGCCAACACTGTCAT EF1α TTTGCCTTCCTTGCGCTCAACA TGTAAAGCAGCTGATCGTGGGT TUB AATGCAAGAAAGCCTTGCGCCT ATGAAGGAGGTCGACGAGCAAA 表 2 舞毒蛾smHsp基因特性
Table 2 Characteristics of smHsp genes in L. dispar
基因
Gene开放阅读框
Open reading frame/bp编码氨基酸
Encoding amino acids分子质量
Molecular weight/kDa理论等电点
Theoretical pI含量最多的氨基酸
The most abundant amino acids/%LdHsp17.0 444 147 17.00 6.15 Lys(9.5%) LdHsp18.7 501 166 18.79 5.58 Val(9.6%) LdHsp19.1 495 164 19.10 6.13 Glu(11.0%) LdHsp20.3 534 177 20.30 5.76 Glu(8.5%) LdHsp21.4 567 188 21.42 6.17 Leu(9.0%) LdHsp21.3 564 187 21.37 5.79 Ser(11.8%) -
[1] SZABO A, KORSZUN R, HARTL F U, et al. A zinc finger-like domain of the molecular chaperone DnaJ is involved in binding to denatured protein substrates[J]. Embo Journal, 1996, 15(2): 408-417. doi: 10.1002/j.1460-2075.1996.tb00371.x
[2] 陈华友, 张春霞, 马晓珂, 等.极端嗜热古菌的热休克蛋白[J].生物工程学报, 2008, 24(12): 2011-2021. doi: 10.3321/j.issn:1000-3061.2008.12.001 CHEN H Y, ZHANG C X, MA X K, et al. Heat shock proteins of the hyperthermophilic archaea[J]. Chinese Journal of Biotechnology, 2008, 24(12): 2011-2021. doi: 10.3321/j.issn:1000-3061.2008.12.001
[3] SǾRENSEN J G, KRISTENSEN T N, LOESCHCKE V. The evolutionary and ecological role of heat shock proteins[J]. Ecology Letters, 2003, 6(11): 1025-1037. doi: 10.1046/j.1461-0248.2003.00528.x
[4] FRANK E, MADSEN O, VAN RHEELE T, et al. Evolutionary diversity of vertebrate small heat shock proteins[J]. Journal of Molecular Evolution, 2004, 59(6): 792-805. doi: 10.1007/s00239-004-0013-z
[5] HASLBECK M, FRANZMANN T, WEINFURTNER D, et al. Some like it hot: the structure and function of small heat-shock proteins[J]. Nature Structural & Molecular Biology, 2005, 12(10): 842-846. doi: 10.1038-nsmb993/
[6] EYLES S J, GIERASCH L M. Nature's molecular sponges: small heat shock proteins grow into their chaperone roles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(7): 2727-2728. doi: 10.1073/pnas.0915160107
[7] NARBERHAUS F. Alpha-crystallin-type heat shock proteins: socializing mini chaperones in the context of a multi chaperone network[J]. Microbiology and Molecular Biology Reviews, 2002, 66(1): 64-93. https://www.ncbi.nlm.nih.gov/pubmed/11875128
[8] KIM K K, KIM R, KIM S H. Crystal structure of a small heat-shock protein[J]. Nature, 1998, 394: 595-599. doi: 10.1038/29106
[9] GARRIDO C, PAUL C, SEIGNEURIC R, et al. The small heat shock proteins family: the long forgotten chaperones[J]. International Journal of Biochemistry & Cell Biology, 2012, 44(10): 1588-1592.
[10] WETTSTEIN G, BELLAYE P S, MICHEAU O, et al. Small heat shock proteins and the cytoskeleton: an essential interplay for cell integrity?[J]. International Journal of Biochemistry & Cell Biology, 2012, 44(10): 1680-1686. https://www.sciencedirect.com/science/article/pii/S1357272512001902
[11] 陆明星, 徐静, 杜予州.昆虫小分子量热激蛋白的研究进展[J].应用昆虫学报, 2015, 52(6): 1326-1332. http://d.old.wanfangdata.com.cn/Periodical/kczs201506002 LU M X, XU J, DU Y Z. Progress in research on insect small heat shock proteins[J]. Chinese Journal of Applied Entomology, 2015, 52(6): 1326-1332. http://d.old.wanfangdata.com.cn/Periodical/kczs201506002
[12] LAZAREVI C J, ANDJELKOVIC M. Host plant effects on the genetic variation and correlations in the individual performance of the gypsy moth[J]. Functional Ecology, 1998, 12(1): 141-148. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.1046/j.1365-2435.1998.00166.x
[13] 曹传旺, 孙丽丽, 问荣荣, 等.舞毒蛾LdOA1基因克隆分析及对3种杀虫剂胁迫的响应[J].林业科学, 2014, 50(8): 102-107. http://d.old.wanfangdata.com.cn/Periodical/lykx201408015 CAO C W, SUN L L, WEN R R, et al. Cloning and analysis of LdOA1 in Lymantria dispar and its response to the stress of three kinds of insecticides[J]. Scientia Silvae Sinicae, 2014, 50(8): 102-107. http://d.old.wanfangdata.com.cn/Periodical/lykx201408015
[14] CAO C W, SUN L L, WEN R R, et al. Characterization of the transcriptome of the Asian gypsy moth Lymantria dispar identifies numerous transcripts associated with insecticide resistance[J]. Pesticide Biochemistry and Physiology, 2015, 119: 54-61. doi: 10.1016/j.pestbp.2015.02.005
[15] BRODSKY L I, DRACHEV A L, LEONTOVICH A M, et al. A novel method of alignment of biopolymer sequences[J]. Biosystems, 1993, 30(1-3): 65-79. doi: 10.1016/0303-2647(93)90063-I
[16] PFAFFL M W, HORGAN G W, DEMPFLE L. Relative expression software tool (REST) for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J]. Nucleic Acids Research, 2002, 30: 36. doi: 10.1093/nar/30.9.e36
[17] VIERLING E. The role of heat shock proteins in plants[J]. Plant Molecular Biology, 1991, 42: 579-620. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_1206773
[18] ARTS M J, SCHILL R O, KNIGGE T, et al. Stress proteins (hsp70, hsp60) induced in isopods and nematodes by field exposure to metals in a gradient near Avonmouth, UK[J]. Ecotoxicology, 2004, 13(8): 739-755. doi: 10.1007/s10646-003-4473-5
[19] PIANO A, VALBONESI P, FABBRI E. Expression of cytoprotective proteins, heat shock protein 70 and metallothioneins, in tissues of Ostrea edulis exposed to heat and heavy metals[J]. Cell Stress & Chaperones, 2004, 9(2): 134-142. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_1065293
[20] SHARMA A, MISHRAA M, SHUKLAA A K, et al. Organochlorine pesticide, endosulfan induced cellular and organismal response in Drosophila melanogaster [J]. Journal of Hazardous Materials, 2012, 221-222(4): 275-287. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=b291a9bde3cd280f96323a2ec52aad52
[21] 王瑞娴, 高瑞娜, 张婷, 等.外源物质诱导家蚕小分子热激蛋白基因HSP19. 9的组织表达活性分析[J].蚕业科学, 2010, 36(5): 780-784. doi: 10.3969/j.issn.0257-4799.2010.05.008 WANG R X, GAO R N, ZHANG T, et al. An analysis on tissue expression activities of Bombyx mori small molecule heat shock protein gene HSP19. 9 induced by exogenous substances[J]. Science of Sericulture, 2010, 36(5): 780-784. doi: 10.3969/j.issn.0257-4799.2010.05.008
[22] 王利华, 单丹, 姚静, 等.温度和毒死蜱对灰飞虱雌成虫热激蛋白70和90基因的诱导表达特性研究[J].应用昆虫学报, 2015, 52(4): 828-836. http://d.old.wanfangdata.com.cn/Periodical/kczs201504005 WANG L H, SHAN D, YAO J, et al. Induced expression of the heat shock protein 70 and 90 genes by exposure to high temperature and chlorpyrifosin female of Laodelphax striatellus[J]. Chinese Journal of Applied Entomology, 2015, 52(4): 828-836. http://d.old.wanfangdata.com.cn/Periodical/kczs201504005
[23] 寇利花, 吴海花, 刘耀明, 等.镉急性染毒对中华稻蝗精卵巢小分子热休克蛋白基因表达的影响[J].农业环境科学学报, 2015, 34(1): 7-14. http://d.old.wanfangdata.com.cn/Periodical/nyhjbh201501002 KOU L H, WU H H, LIU Y M, et al. Expression analysis of OcsHSP genes in testis and ovary of Oxya chinensis exposed to acute cadmium[J]. Journal of Agro-Environment Science, 2015, 34(1): 7-14. http://d.old.wanfangdata.com.cn/Periodical/nyhjbh201501002
-
期刊类型引用(7)
1. 于秋莹,郭苗苗,许岢昕,刘建斌,王聪,郑健,张克中,张炎. 欧洲丁香品种‘Downfield’花序和花序轴愈伤组织诱导和悬浮培养. 东北林业大学学报. 2023(03): 47-53 .  百度学术
百度学术
2. 胡家锋,代鲁鲁,戴瑜,姚芳,姜韬,谈家金. 常熟市枫香刺小蠹野外危害调查及防治效果评价. 天津农业科学. 2023(06): 56-61 .  百度学术
百度学术
3. 韩娟,李亚鹏,田彦挺,郭琪,李云,孙宇涵,邓永平,牛东升,苏立琢,李秀宇,彭祚登. 刺槐离体叶片高效再生体系的优化. 林业科学. 2023(04): 68-78 .  百度学术
百度学术
4. 胡家锋,谈家金,姚芳,戴瑜,姜韬,代鲁鲁. 6种药剂对枫香刺小蠹幼虫及成虫的室内毒力测定. 东北林业大学学报. 2023(11): 157-161 .  百度学术
百度学术
5. 王玉娟,罗成凤,幸伟年,李进,占志勇,何小三. 中国枫香×北美枫香杂交子代生长表现及初步评价. 南方林业科学. 2022(06): 15-18 .  百度学术
百度学术
6. 李亦轩,江帅菲,董明亮,齐帅征,张金凤,Lisheng Kong. 油松胚性愈伤组织成熟培养的影响因素. 东北林业大学学报. 2020(04): 20-23+49 .  百度学术
百度学术
7. 高磊,王建国,王章训,李猷,鞠瑞亭. 危险性害虫枫香刺小蠹的形态特征及发生现状. 林业科学. 2020(03): 193-198 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: