Leaf morphological characteristics and related gene expression characteristic analysis in Betula pendula 'Dalecarlica' and Betula pendula
-
摘要: 为了探寻欧洲白桦变种裂叶桦的叶缘分裂机制。以2种桦树为研究对象,在叶片形态特征和解剖特征观测的基础上,进行了顶芽及叶片叶尖、裂片及凹缺等不同组织部位相关基因表达定量分析、内源激素IAA含量测定以及IAA活体标记的GUS染色分析。结果表明,裂叶桦叶片两侧叶缘自叶基到叶尖分裂出由大到小3~4个裂片,叶背面的叶脉呈明显的管状隆起,叶宽、平均二级脉间距、主脉横切面积等分别较欧洲白桦大了21.12%、12.64%、21.46%。BpmiR164s及靶基因的组织表达特性分析结果证明,BpmiR164-2及靶基因BpCUC2与裂片的形成关系密切,是裂叶性状产生的主要调控基因。生长素输出载体BpPINs基因的组织表达特性分析结果证明,6个基因中只有BpPIN2和BpPIN5在裂叶桦的叶尖、裂片及顶芽等组织器官中呈现上调表达。内源激素IAA的活体标记发现,在顶芽、幼叶中IAA的含量较高,而在叶片中,叶尖、叶齿及裂片处是激素的高表达部位,利用液相色谱—质谱联用仪(LC-MS)对2种桦树的上述不同组织部位的生长素测定也证明了激素的上述分布特点。综合上述,裂叶桦裂片产生是激素在叶脉、叶缘的极性运输及相关基因调控的结果。Abstract: In order to explore the mechanism of marginal cleavage in Betula pendula 'Dalecarlica', the research took Betula pendula 'Dalecarlica' and Betula pendula as research projects, based on leaf morphological characters and anatomical feature, we conducted qRT-PCR of leaf cleavage relating genes in apical buds, leaf tips, lobes, sinuses and other tissues, and also measured the endogenous IAA content and analyzed the GUS dyeing of IAA living tag(DR5). It turned out that Betula pendula 'Dalecarlica' blades owned three or four lobes from base to tip in both leaf sides, the veins on the back showed obvious tubular uplift, leaf width, mean distance between secondary veins, cross sectional areas of main veins were respectively bigger, namely 21.12%, 12.64%, 21.46%. Tissue expression characteristic analysis of BpmiR164s and target genes demonstrated that BpmiR164-2 and BpCUC2 played an important role in the formation of lobes, which was the major regulating gene in producing lobes; tissue expression characteristic analysis of BpPINs indicated that only BpPIN2 and BpPIN5 in six auxin efflux carriergenes presented up-regulated expression; living tag of endogenous IAA manifested that IAA content enriched in apical buds and spires, meanwhile, the tissues of leaf tips, teeth and lobes in leaf expressed more IAA, we also got the IAA distribution features from results of LC-MS in above-mentioned tissues. Above all, the formation of lobes was bound up with polar transportation of hormone in the veins and some related gene regulation.
-
Keywords:
- Betula pendula 'Dalecarlica' /
- BpmiR164 /
- BpCUC2 /
- IAA /
- DR5
-
裂叶桦(Betula pendula ‘Dalecarlica’)是欧洲白桦(Betula pendula)的一个品种,由于其叶缘具有分裂明显的裂片,观赏价值较高,在欧美被广泛应用于园林绿化[1-2]。近年来裂叶桦与欧洲白桦的杂交试验发现裂叶性状在子代中呈现有规律分离,属于质量性状;因此,裂叶桦是探寻裂叶形成机制的理想材料。对拟南芥(Arabidopsis thaliana)、苜蓿(Medicago truncatula)、白菜(Brassica rapa ssp.chinensis)等植物的裂叶突变体研究发现,叶缘分裂或锯齿的形成与生长素的极性运输产生浓度梯度密切相关,呈现越靠近叶片锯齿或裂片尖端处激素浓度越高的趋势。参与生长素极性运输的基因主要有PINs、CUC2[2-10]。另外,对拟南芥叶缘分裂突变体的研究还发现,miR164是CUC2基因家族的负调控因子,miR164发生突变可引起CUC2基因表达量升高,从而导致拟南芥叶缘分裂的产生;反之,靶基因CUC2中与miR164碱基配对部分发生突变不能被miR164降解,造成靶基因CUC2过表达的拟南芥叶缘仍然产生分裂表型[3, 7, 11]。正是由于生长素的运输载体基因PINs、生长素和CUC2的协同作用,保证了叶缘不同部位生长素浓度的差异,从而使某些植物叶缘产生程度不同的凹缺[2, 7]。可是,裂叶桦叶片分裂是否与这些基因有关, 在CUC2基因家族中尚有BpNAC1、BpNAC100等也将被miR164负调控,而miR164在基因组中也存在功能相同结构略有区别的不同成员,这些miR164s及所有靶基因在叶片分裂过程中的作用需要理清。因此,本实验以裂叶桦及欧洲白桦为试材,研究了2种桦树叶片的形态和解剖特征,定量分析BpmiR164s及其靶基因BpNAC1、BpNAC、BpCUC2和生长素输出载体BpPINs等基因的组织部位表达特性,同时对叶片不同组织部位的激素进行定量、定位分析,为探讨裂叶桦叶缘分裂形成机理和桦树叶型分子设计育种奠定基础。
1. 材料与方法
1.1 材料
实验于2014年6月中旬至7月中旬,以定植于东北林业大学白桦育种基地5年生裂叶桦及欧洲白桦为试材,各选取5株生长一致的无性系分株为研究对象。
1.2 方法
1.2.1 叶形态特征及叶脉横切面积测定
1) 叶形态特征测定。分别选取裂叶桦及欧洲白桦幼树当年生侧枝顶端第4片成熟叶30个,测定叶长、叶宽、粗二级脉数量、一级叶齿数,并求算裂片数以及二级脉间距。叶长:测定叶基至叶尖的长度;叶宽:测定叶片最宽部分的宽度;粗二级脉数量:在主叶脉中直接分出来的二级脉;一级叶齿数:即叶缘处较大的叶齿数量;裂片数:对叶边缘突起长度大于等于突起尖端到中脉距离1/4的裂片进行数量统计;二级脉间距=叶长/每叶二级脉数,利用SPSS21进行t检验统计学分析。
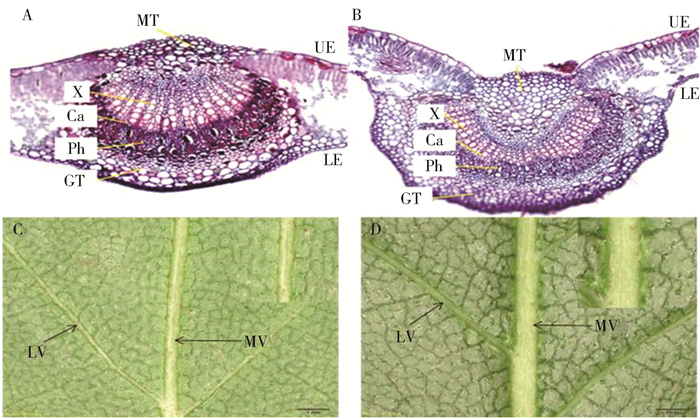
2) 叶脉显微观察及横切面积测定。取材同上。切取一级脉与第2个二级脉交汇处0.3cm×0.3cm大小的叶片(图 1B、1C中示意v的部位),采用常规石蜡切片法制片,切片厚度为10μm,番红-固绿对染,树胶封片后光学显微镜下测量叶脉横切面积。2种桦树各观察统计30个切片。
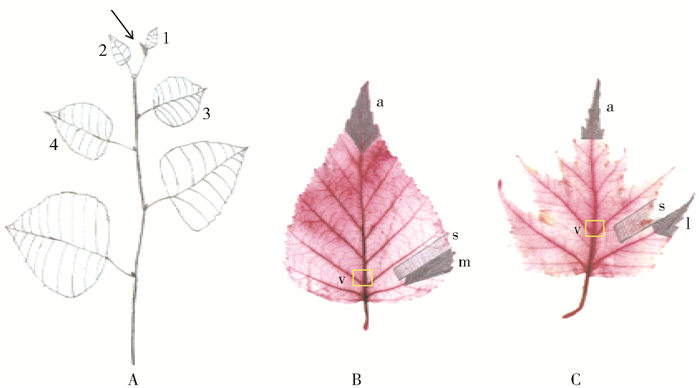
![]() 图 1 枝条顶芽、叶片取材部位和主叶脉石蜡切片取材部位A.枝条顶芽取材部位,1、2、3、4分别代表第1片叶、第2片叶、第3片叶、第4片叶;B.欧洲白桦叶片;C.裂叶桦叶片。a.叶尖;m.叶缘;l.裂片;s.凹缺;v.主叶脉石蜡切片取材部位。Figure 1. Sketch map of apical bud in branches, different parts of blade sampling and the main vein sampling of paraffin sectionA, Sampling of apical bud in branches, thereinto, 1, 2, 3, 4 respectively represents the first, second, third and forth blade; B, Betula pendula blade; C, Betula pendula 'Dalecarlica' blade. a, apex; m, margin; l, lobe; s, sinus; v, main vein sampling.
图 1 枝条顶芽、叶片取材部位和主叶脉石蜡切片取材部位A.枝条顶芽取材部位,1、2、3、4分别代表第1片叶、第2片叶、第3片叶、第4片叶;B.欧洲白桦叶片;C.裂叶桦叶片。a.叶尖;m.叶缘;l.裂片;s.凹缺;v.主叶脉石蜡切片取材部位。Figure 1. Sketch map of apical bud in branches, different parts of blade sampling and the main vein sampling of paraffin sectionA, Sampling of apical bud in branches, thereinto, 1, 2, 3, 4 respectively represents the first, second, third and forth blade; B, Betula pendula blade; C, Betula pendula 'Dalecarlica' blade. a, apex; m, margin; l, lobe; s, sinus; v, main vein sampling.1.2.2 关键基因的确定及qRT-PCR分析
1) 关键基因的确定。根据拟南芥AtmiR164s和毛果杨PtmiR164s序列及靶基因序列、生长素输出载体BpPINs序列,与白桦基因组(http://birch.genomics.cn)比对,在白桦基因组中获得2条BpmiR164s成熟序列,3条靶基因BpNAC1、BpNAC100、BpCUC2序列,6条BpPINs基因序列。
2) 关键基因分析的取材部位确定及qRT-PCR分析。确定枝条的顶芽、叶片的脉尖、叶缘或裂片、二级脉之间的凹缺处等为关键基因分析的取材部位。
顶芽:切取树冠中上部枝条上直径约0.15cm左右的顶芽组织(图 1A);叶尖:切取正在发育过程中第3叶片(下同)的叶尖(图 1B、1C的a);叶缘或裂片:切取欧洲白桦从叶基部开始的第1个粗二级脉叶齿及两侧的叶缘(图 1B的m),裂叶桦第1个粗二级脉对应的裂片(图 1C的l);叶片凹缺:即从基部数第1个粗二级脉和第2个粗二级脉区间的凹缺(图 1B、1C的s)部位。将5株树的相同组织部位混样后,迅速放入液氮中带回实验室于-80℃保存,用于BpmiR164s、靶基因以及BpPINs的qRT-PCR分析。
反应体系和程序根据文献[12-13]的方法,分别进行BpmiR164s及BpNAC1、BpNAC100、BpCUC2、BpPIN1、BpPIN2、BpPIN3、BpPIN4、BpPIN5、BpPIN6等基因的qRT-PCR,引物见表 1。
表 1 qRT-PCR引物序列Table 1. Sequences of qRT-PCR primers引物名称
Primer name引物序列
Primer sequence(5′- 3′)18S rRNA-F ATCTTGGGTTGGGCAGATCG 18S rRNA-R CATTACTCCGATCCCGAAGG BpUBC-F GGTTTCTGGGTTACAGTAAAGTTTC BpUBC-R CTTGAAGCCTGCATGTGG BpNAC1-F GAAGCTGCCACCTGGATTTCG BpNAC1-R GTCGCCTTCCAGTACCCTGA BpNAC100-F GGTCATGCACGAATACAGATTGG BpNAC100-R CACGTAAGCCGACTCAGCAA BpCUC2-F ACTTACCTCCCGGTTTTCGC BpCUC2-R CCTGTTTGTTCTAAGCCCCG BpPIN1-F CATGTTGAAATGCCTGCTATCATAGC BpPIN1-R AGAGCTGCCTGGACAATGG BpPIN2-F GGATATTGGGGCAAAGAAACACCAA BpPIN2-R GAGCTTCGGTTGTAAAGCCATGAAC BpPIN3-F CTGGGCCGGTGAGGAATCTA BpPIN3-R CATGTTGAAATGCCTGCTATCATAGC BpPIN4-F TGCCACATGCTTTTGTCATCCTG BpPIN4-R GTTCCACAAGCAATAATCCGGGGC BpPIN5-F GCAAGCATACGCTACAAGTGG BpPIN5-R CTGCCTGCACAATAGCCTCTC BpPIN6-F GGAAGATCAAGATGCCTGCGATC BpPIN6-R GACAATCCCTTGAGGAAGAGCTG BpmiR164-1F TGGAGAAGCAGGGCACGTGCA BpmiR164-2F TGCACGTGCCCTGCTTCTCCA U6-F GGTCCTTCGGGACATCCGAT 根据公式XN =-ΔΔCt计算外源基因的相对定表达量,式中:Ct即循环阈值,表示每一个反应管内的荧光信号到达设定的阀值时所经历的循环数,ΔCt=目的基因的平均Ct值-管家基因的平均Ct值,ΔΔCt=ΔCt(样本1)-ΔCt(样本2),以计算完成的-ΔΔCt值为原始数据,用Excel 2007进行数据处理和绘制柱状图。
1.2.3 内源生长素IAA的组织定位及含量测定
1) 生长素活体标记特异报告基因的载体构建。植物不同组织部位的激素表达可以通过染色标记,这主要得益于人工改造的应答植物生长素信号的启动子DR5,通过DR5驱动报告基因的表达能够反应生长素在植物体内的分布情况[14]。实验根据文献报道的生长素特异启动子DR5序列[14],由金唯智生物科技有限公司完成DR5启动子序列的合成,采用酶切连接的方法构建生长素响应特异报告载体PromDR5∷GUS,电击转化法制备工程菌EHA105(PromDR5∷GUS)。
2) 白桦的遗传转化及GUS染色。采用农杆菌介导的白桦合子胚法进行遗传转化[15],在50mg/L潮霉素B(Hygromycin B,Hyg)筛选条件下,获得3个PromDR5∷GUS抗性愈伤组织,分别将抗性愈伤组织接种至WPM+0.02mg/L NAA+0.8mg/L6-BA+0.5mg/L GA3+50mg/L Hyg+200mg/L头孢霉素培养基上诱导不定芽,进而获得丛生继代苗,WPM+0.4mg/L IBA的固体培养基进行生根培养,20d后,对苗高10cm左右的生根苗进行GUS染色[16-17]。
3) 内源IAA含量的测定。欧洲白桦及裂叶桦的叶尖、叶缘或裂片、凹缺组织各200mg,按文献[18]方法提取内源IAA,利用液相色谱串联质谱检测内源IAA的含量[18]。
2. 结果与分析
2.1 裂叶桦叶片及叶脉表型特征
由图 1可见,欧洲白桦的叶片呈现三角状卵形(图 1B),这是白桦属树种叶片典型形状,而裂叶桦叶片呈现分裂状,叶片顶部具有细长的叶尖,叶片两侧各有3~4个自下而上逐渐由大变小的裂片(图 1C )。对2种桦树叶片主要性状测量发现,裂叶桦的叶宽、平均二级脉间距、主脉横切面积等性状与欧洲白桦有明显差异(图 1B、1C,表 2),分别较欧洲白桦大了21.12%、12.64%、21.46%;但裂叶桦的1级齿数显著少于欧洲白桦的1级齿数。
表 2 叶形态相关性状统计学分析Table 2. Analysis of leaf morphological characteristics物种
Species性状Trait 叶长
Leaf length/cm叶宽
Leaf width/cm叶缘1级齿数
The first ranking teeth at the margine裂片数
Number of lobes平均二级脉间距
Avertage distance between the second ranking vein/cm主脉横切面积
Cross-sectional area of the major vein/dm2欧洲白桦Betula pendula 8.65±0.91 5.23±0.49 17.29±1.11** 0 0.76±0.06 20.75±0.82 裂叶桦Betula pendula ‘Dalecarlica’ 9.57±1.16 6.63±0.57** 12.00±0.82 6±0.23** 0.87±0.09** 26.42±2.08** 注:*和**分别表示P < 0.05和P < 0.01差异显著水平。Notes:* and ** represent significant difference at P < 0.05, P < 0.01 level respectively. 叶脉横切面解剖观察显示(图 2A、2B),2种桦树显著不同的是裂叶桦的机械输导组织非常发达,且叶脉横切面积显著大于欧洲白桦,较欧洲白桦大27.33%。实体显微镜下观察第4片叶的叶脉发现(图 2C、2D),裂叶桦的叶脉在叶片背面明显隆起,类似于管道摆放在叶背表面,主脉上着生刺及绒毛,叶背面也密披绒毛(见图 2D右上角),而欧洲白桦的主脉及叶背面没有刺及绒毛(见图 2C右上角)。
![]() 图 2 2种桦树叶片的番红固绿染色、主脉横切面及叶背面显微镜图像A、B分别为欧洲白桦、裂叶桦主叶脉横切面微镜图像,其中,MT为机械组织,GT为基本组织,X为木质部,Ph为韧皮部,Ca为形成层,UE为近轴面,LE为远轴面;C、D分别为欧洲白桦、裂叶桦叶片背面实体显微照片,其中MV为主脉,LV为侧脉。Figure 2. Sarranine and solid green dyeing of birch leaves, the main vein cross-sections and microscope image of blade backA, B respectively represent the microscope image of main vein cross-sections in Betula pendula and Betula pendula 'Dalecarlica', thereinto, MT is mechanical tissue, GT is basal tissue, X is xylem, Ph is phloem, Ca is cambium, UE is adaxial side, LE is abaxial side; C, D respectively represent the blade back in Betula pendula and Betula pendula 'Dalecarlica', thereinto, MV is main vein, LV is lateral vein.
图 2 2种桦树叶片的番红固绿染色、主脉横切面及叶背面显微镜图像A、B分别为欧洲白桦、裂叶桦主叶脉横切面微镜图像,其中,MT为机械组织,GT为基本组织,X为木质部,Ph为韧皮部,Ca为形成层,UE为近轴面,LE为远轴面;C、D分别为欧洲白桦、裂叶桦叶片背面实体显微照片,其中MV为主脉,LV为侧脉。Figure 2. Sarranine and solid green dyeing of birch leaves, the main vein cross-sections and microscope image of blade backA, B respectively represent the microscope image of main vein cross-sections in Betula pendula and Betula pendula 'Dalecarlica', thereinto, MT is mechanical tissue, GT is basal tissue, X is xylem, Ph is phloem, Ca is cambium, UE is adaxial side, LE is abaxial side; C, D respectively represent the blade back in Betula pendula and Betula pendula 'Dalecarlica', thereinto, MV is main vein, LV is lateral vein.2.2 BpmiR164s及靶基因的组织表达特性
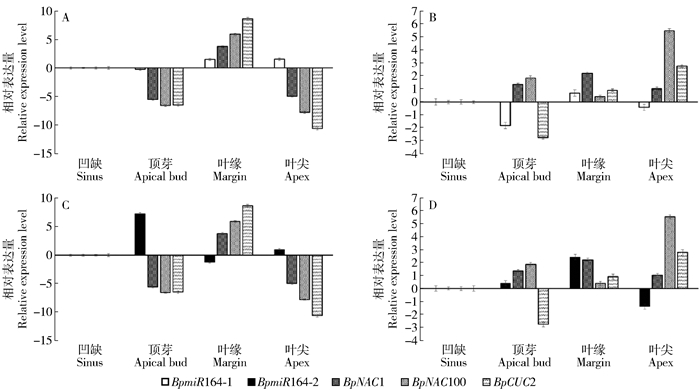
针对裂叶桦及欧洲白桦顶芽、叶尖、叶缘或裂片等部位,分析BpmiR164s及靶基因的相对表达量,进而解析叶片分裂与基因表达的调控关系。实验以叶片凹缺组织部位的BpmiR164及3条靶基因表达量为对照,分析各组织部位基因的表达特性(图 3)。由图 3可知,在2种桦树的不同组织部位中BpmiR164s与其靶基因的负调控关系最大的差别出现在2种桦树的叶尖处,在裂叶桦的叶尖处,BpmiR164-1和BpmiR164-2的表达呈现明显降低,其靶基因呈现明显增加;而在欧洲白桦的叶尖处,上述基因的表达与裂叶桦相比呈现相反的规律。另外的差别出现在裂叶桦的裂片处及欧洲白桦相对应的叶缘处以及在2种桦树的顶芽处,在裂叶桦中BpmiR164s仅与1~2个靶基因呈现负调控关系,并且只有BpmiR164-2与BpCUC2在裂片及顶芽中呈现此消彼长的关系;而在欧洲白桦的2个部位中BpmiR164-2与全部3个靶基因呈现负调控关系。综合上述结果,如果在BpmiR164s及靶基因中寻找与裂叶相关的基因应该为BpmiR164-2及BpCUC2。
![]() 图 3 BpmiR164s及靶基因的组织表达特性A和C分别为欧洲白桦BpmiR164-1、BpmiR164-2与靶基因的组织表达特性;B和D分别为裂叶桦BpmiR164-1、BpmiR164-2与靶基因的组织表达特性。Figure 3. Expression levels of BpmiR164s and target genes in different tissuesA, C respectively represent the relative expression levels about BpmiR164-1, BpmiR164-2 and taget genes in Betula pendula; B, D respectively represent the relative expression levels about BpmiR164-1, BpmiR164-2 and target genes in Betula pendula 'Dalecarlica'.
图 3 BpmiR164s及靶基因的组织表达特性A和C分别为欧洲白桦BpmiR164-1、BpmiR164-2与靶基因的组织表达特性;B和D分别为裂叶桦BpmiR164-1、BpmiR164-2与靶基因的组织表达特性。Figure 3. Expression levels of BpmiR164s and target genes in different tissuesA, C respectively represent the relative expression levels about BpmiR164-1, BpmiR164-2 and taget genes in Betula pendula; B, D respectively represent the relative expression levels about BpmiR164-1, BpmiR164-2 and target genes in Betula pendula 'Dalecarlica'.2.3 生长素输出载体BpPINs基因的组织表达特性
研究已证明,植物的IAA合成后通过载体的极性运输到达目的地才可发挥作用。PIN基因产物蛋白就是IAA输出载体之一,该蛋白主要负责IAA的流向和局部累积,因此PIN基因对植物的形态建成和极性确立至关重要[19]。裂叶桦叶片分裂的形成必然与BpPINs基因有关,为了探讨白桦中哪些BpPINs基因与裂叶桦叶缘变异有关,实验仍然对2种桦树的顶芽、叶尖、叶缘或裂片、凹缺部位进行qRT-PCR分析(图 4)。结果显示,裂叶桦中BpPIN2基因表达量变化最突出,相对凹缺部位该基因的表达量比顶芽、裂片及叶尖均显著上调,分别高于凹缺部位的8.480、3.295、9.370倍;其次是BpPIN5基因,分别高于凹缺部位的1.135、3.89、2.96倍。因此,认为这2条基因可能参与裂叶桦叶缘的形态建成。
2.4 不同组织部位内源激素IAA的定位及定量
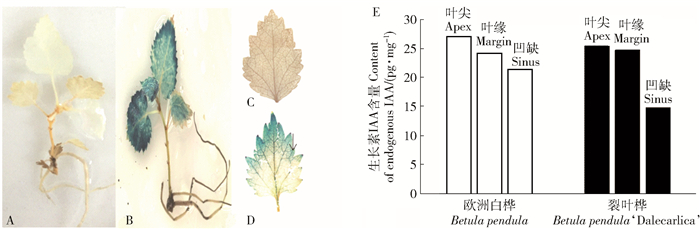
采用农杆菌介导的合子胚转化法将启动子DR5驱动GUS标记基因转入白桦基因组中,对转基因白桦整株和从顶芽数起第3片叶进行GUS染色标记IAA(见图 5)。结果显示:幼嫩的转基因白桦叶片IAA含量较老叶要多,转基因苗木的第3片叶内源生长素IAA主要分布在叶尖,叶缘、凹缺、叶脉也有分布。
![]() 图 5 野生型和转PromDR5∷GUS白桦GUS染色A.野生型生根苗(WT);B.转PromDR5∷GUS白桦生根苗;C.野生型白桦第3片叶;D.转PromDR5∷GUS白桦第3片叶(注:黑色箭头的方向为生长素浓度由高到低);E.欧洲白桦和裂叶桦内源激素IAA含量。Figure 5. GUS dyeing of wild type and transgenic plants(PromDR5∷GUS)A, wild type; B, transgenic plants(PromDR5∷GUS); C, third blade in WT; D, third blade in transgenic plants(PromDR5∷GUS); E, IAA content in Betula pendula and Betula pendula 'Dalecarlica'.
图 5 野生型和转PromDR5∷GUS白桦GUS染色A.野生型生根苗(WT);B.转PromDR5∷GUS白桦生根苗;C.野生型白桦第3片叶;D.转PromDR5∷GUS白桦第3片叶(注:黑色箭头的方向为生长素浓度由高到低);E.欧洲白桦和裂叶桦内源激素IAA含量。Figure 5. GUS dyeing of wild type and transgenic plants(PromDR5∷GUS)A, wild type; B, transgenic plants(PromDR5∷GUS); C, third blade in WT; D, third blade in transgenic plants(PromDR5∷GUS); E, IAA content in Betula pendula and Betula pendula 'Dalecarlica'.利用LC-MS对裂叶桦和欧洲白桦的叶尖、叶缘或裂片、凹缺等不同组织部位的生长素分布情况进行了测定分析,发现2种桦树在叶尖、叶缘或裂片和凹缺的内源激素IAA含量均呈现不同的趋势,欧洲白桦按照叶尖、叶缘、凹缺部位依次递减,裂叶桦叶尖与裂片之间没有明显差异,但明显较凹缺处的IAA含量高。其中,叶尖处的激素较凹缺处高了41.83 %。
3. 结论与讨论
通过叶片的实体观察可明显区分出欧洲白桦的变种裂叶桦(图 1B、1C)。但进一步解剖镜下观察发现,裂叶桦叶脉在叶片的背面呈现明显的管状隆起(图 2D),而欧洲白桦的叶脉被包埋在叶片中间(图 2C),石蜡切片显微测定发现裂叶桦的主叶脉横切面积较欧洲白桦大了27.33%(图 2A、2B,表 2)。植物叶脉为叶片输送水分、生长素、养分和支撑叶片的作用[20-22],叶脉直径决定着叶脉系统的水力导度[23-24],其越粗,物质运输能力越强[25]。水稻(Oryza sativa)叶片披垂的无中叶脉dl2突变体的产生,导致生长素在叶片内的极性运输存在缺陷,运输能力与野生型相比也显著降低的结果[22]。在本研究中,裂叶桦主脉较欧洲白桦粗壮,机械组织较欧洲白桦发达,所以其叶片内的水分、生长素、养分和光合产物的分配运输能力强于欧洲白桦,这是裂叶桦产生裂片的因素之一。
生长素、PIN、CUC2与植物叶缘锯齿的发育存在密切关系[7]。PIN基因家族是一类调控植物生长素极性运输的重要载体元件[26]。当拟南芥突变pin1基因后,其叶缘锯齿变浅甚至消失[7]。生长素与AtPIN1存在负反馈调节的作用,即AtPIN1负责将生长素由细胞内运输到细胞外,当生长素达到一定浓度时,对AtPIN1基因的表达产生抑制和极性定位,从而形成生长素浓度的最大量和最小量[7]。CUC2是植物NAC超家族转录因子之一[7-8],在生长素极性运输过程中,AtCUC2促进AtPINs极性定位,如果AtCUC2在叶片边缘不表达,叶子不会产生锯齿[7]。同时miRNA164又是CUC2的负调控因子,如果miR164缺失会导致锯齿的加深[7, 9]。生长素也会负反馈调节AtCUC2基因使生长素最大量达到稳定[7]。所以,叶缘最终发育成齿尖取决于高浓度的生长素、AtPIN1、AtCUC2的协调作用。本研究的转植物激素活体报告基因白桦株系发现,生长素在顶芽、幼嫩叶片均较多,在叶片中生长素主要分布在叶尖、叶齿处,离开这些组织部位的激素浓度呈现逐渐降低的梯度分布规律(图 5)。利用LC-MS对裂叶桦不同组织部位的IAA测定也证明了叶尖、裂片明显较凹缺处高(图 5)。裂叶桦生长素极性运输载体PINs家族基因的BpPIN2和BpPIN5在裂片及叶尖等明显上调表达,说明其是裂片产生的重要参与者。PINs基因家族的其他成员或许是由于组织特性表达的结果,在叶片上述组织中低表达。对白桦基因组中的2条成熟的miRl64s表达量分析证明,仅BpmiR164-2与裂片的形成有关。在BpCUC2、BpNAC1、BpNAC100等被miRl64s负调控的基因中,BpCUC2是与裂片形成密切相关。
综合上述,裂叶桦裂片的产生是激素在叶脉、叶缘等极性运输的结果。在此过程中,BpPIN2和BpPIN5等生长素极性运输载体基因参与了激素的极性运输,BpCUC2基因促进BpPINs的极性定位,而BpmiR164-2负调控了BpCUC2基因的表达。正是上述基因与生长素的协调作用,使叶尖、裂片尖及叶齿尖等组织部位生长素浓度较高,远离这些组织部位的激素浓度逐渐降低,形成了浓度梯度,这是裂叶桦产生裂片的机制。
-
图 1 枝条顶芽、叶片取材部位和主叶脉石蜡切片取材部位
A.枝条顶芽取材部位,1、2、3、4分别代表第1片叶、第2片叶、第3片叶、第4片叶;B.欧洲白桦叶片;C.裂叶桦叶片。a.叶尖;m.叶缘;l.裂片;s.凹缺;v.主叶脉石蜡切片取材部位。
Figure 1. Sketch map of apical bud in branches, different parts of blade sampling and the main vein sampling of paraffin section
A, Sampling of apical bud in branches, thereinto, 1, 2, 3, 4 respectively represents the first, second, third and forth blade; B, Betula pendula blade; C, Betula pendula 'Dalecarlica' blade. a, apex; m, margin; l, lobe; s, sinus; v, main vein sampling.
图 2 2种桦树叶片的番红固绿染色、主脉横切面及叶背面显微镜图像
A、B分别为欧洲白桦、裂叶桦主叶脉横切面微镜图像,其中,MT为机械组织,GT为基本组织,X为木质部,Ph为韧皮部,Ca为形成层,UE为近轴面,LE为远轴面;C、D分别为欧洲白桦、裂叶桦叶片背面实体显微照片,其中MV为主脉,LV为侧脉。
Figure 2. Sarranine and solid green dyeing of birch leaves, the main vein cross-sections and microscope image of blade back
A, B respectively represent the microscope image of main vein cross-sections in Betula pendula and Betula pendula 'Dalecarlica', thereinto, MT is mechanical tissue, GT is basal tissue, X is xylem, Ph is phloem, Ca is cambium, UE is adaxial side, LE is abaxial side; C, D respectively represent the blade back in Betula pendula and Betula pendula 'Dalecarlica', thereinto, MV is main vein, LV is lateral vein.
图 3 BpmiR164s及靶基因的组织表达特性
A和C分别为欧洲白桦BpmiR164-1、BpmiR164-2与靶基因的组织表达特性;B和D分别为裂叶桦BpmiR164-1、BpmiR164-2与靶基因的组织表达特性。
Figure 3. Expression levels of BpmiR164s and target genes in different tissues
A, C respectively represent the relative expression levels about BpmiR164-1, BpmiR164-2 and taget genes in Betula pendula; B, D respectively represent the relative expression levels about BpmiR164-1, BpmiR164-2 and target genes in Betula pendula 'Dalecarlica'.
图 5 野生型和转PromDR5∷GUS白桦GUS染色
A.野生型生根苗(WT);B.转PromDR5∷GUS白桦生根苗;C.野生型白桦第3片叶;D.转PromDR5∷GUS白桦第3片叶(注:黑色箭头的方向为生长素浓度由高到低);E.欧洲白桦和裂叶桦内源激素IAA含量。
Figure 5. GUS dyeing of wild type and transgenic plants(PromDR5∷GUS)
A, wild type; B, transgenic plants(PromDR5∷GUS); C, third blade in WT; D, third blade in transgenic plants(PromDR5∷GUS); E, IAA content in Betula pendula and Betula pendula 'Dalecarlica'.
表 1 qRT-PCR引物序列
Table 1 Sequences of qRT-PCR primers
引物名称
Primer name引物序列
Primer sequence(5′- 3′)18S rRNA-F ATCTTGGGTTGGGCAGATCG 18S rRNA-R CATTACTCCGATCCCGAAGG BpUBC-F GGTTTCTGGGTTACAGTAAAGTTTC BpUBC-R CTTGAAGCCTGCATGTGG BpNAC1-F GAAGCTGCCACCTGGATTTCG BpNAC1-R GTCGCCTTCCAGTACCCTGA BpNAC100-F GGTCATGCACGAATACAGATTGG BpNAC100-R CACGTAAGCCGACTCAGCAA BpCUC2-F ACTTACCTCCCGGTTTTCGC BpCUC2-R CCTGTTTGTTCTAAGCCCCG BpPIN1-F CATGTTGAAATGCCTGCTATCATAGC BpPIN1-R AGAGCTGCCTGGACAATGG BpPIN2-F GGATATTGGGGCAAAGAAACACCAA BpPIN2-R GAGCTTCGGTTGTAAAGCCATGAAC BpPIN3-F CTGGGCCGGTGAGGAATCTA BpPIN3-R CATGTTGAAATGCCTGCTATCATAGC BpPIN4-F TGCCACATGCTTTTGTCATCCTG BpPIN4-R GTTCCACAAGCAATAATCCGGGGC BpPIN5-F GCAAGCATACGCTACAAGTGG BpPIN5-R CTGCCTGCACAATAGCCTCTC BpPIN6-F GGAAGATCAAGATGCCTGCGATC BpPIN6-R GACAATCCCTTGAGGAAGAGCTG BpmiR164-1F TGGAGAAGCAGGGCACGTGCA BpmiR164-2F TGCACGTGCCCTGCTTCTCCA U6-F GGTCCTTCGGGACATCCGAT 表 2 叶形态相关性状统计学分析
Table 2 Analysis of leaf morphological characteristics
物种
Species性状Trait 叶长
Leaf length/cm叶宽
Leaf width/cm叶缘1级齿数
The first ranking teeth at the margine裂片数
Number of lobes平均二级脉间距
Avertage distance between the second ranking vein/cm主脉横切面积
Cross-sectional area of the major vein/dm2欧洲白桦Betula pendula 8.65±0.91 5.23±0.49 17.29±1.11** 0 0.76±0.06 20.75±0.82 裂叶桦Betula pendula ‘Dalecarlica’ 9.57±1.16 6.63±0.57** 12.00±0.82 6±0.23** 0.87±0.09** 26.42±2.08** 注:*和**分别表示P < 0.05和P < 0.01差异显著水平。Notes:* and ** represent significant difference at P < 0.05, P < 0.01 level respectively. -
[1] VALOBRA C P, JAMES D J. In vitro shoot regeneration from leaf discs of Betula pendula 'Dalecarlica' EM 85[J]. Plant Cell, Tissue and Organ Culture, 1990, 21:51-54. doi: 10.1007/BF00034491
[2] MU H Z, LIN L, LIU G F, et al. Transcriptomic analysis of incised leaf-shape determination in birch[J]. Gene, 2013, 531(2):263-269. doi: 10.1016/j.gene.2013.08.091
[3] HAY A, BARKOULAS M, TSIANTIS M. ASYMMETRIC LEAVES1 and auxin activities converge to repress BREVIPEDICELLUS expression and promote leaf development in Arabidopsis[J]. Development, 2006, 133:3955-3961. doi: 10.1242/dev.02545
[4] NIKOVICS K, BLEIN T, PEAUCELLE A, et al. The balance between the MIR164A and CUC2 genes controls leaf margin serration in Arabidopsis[J]. Plant Cell, 2006, 18:2929-2945. doi: 10.1105/tpc.106.045617
[5] SCARPELLA E, MARCOS D, FRIML J, et al. Control of leaf vascular patterning by polar auxin transport[J].Genes Dev, 2006, 20:1015-1027. doi: 10.1101/gad.1402406
[6] KOYAMA T, MITSUDA N, SEKI M, et al. TCP transcription factors regulate the activities of ASYMMETRIC LEAVES1 and miR164, as well as the auxin response, during differentiation of leaves in Arabidopsis[J]. Plant Cell, 2010, 22:3574-3588. doi: 10.1105/tpc.110.075598
[7] BILSBOROUGH G D, RUNIONS A, MICHALIS B, et al.Model for the regulation of Arabidopsis thaliana leaf margin development[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108:3424-3429. doi: 10.1073/pnas.1015162108
[8] HASSON A, PLESSIS A, BLEIN T, et al. Evolution and diverse roles of the CUP-SHAPED COTYLEDON genes in arabidopsis leaf development[J]. Plant Cell, 2011, 23:54-68. doi: 10.1105/tpc.110.081448
[9] ZHOU C E, HOU C Y, METELLI A, et al. Developmental analysis of a Medicago truncatula smooth leaf margin1 mutant reveals context-dependent effects on compound leaf development[J]. Plant Cell, 2011, 23:2106-2124. doi: 10.1105/tpc.111.085464
[10] 惠麦侠, 张鲁刚, 余祥, 等.白菜NAC转录因子BrcCUC3基因克隆及其对叶缘和主枝发育的影响[J].农业生物技术学报, 2012, 20(4):337-346. doi: 10.3969/j.issn.1674-7968.2012.04.001 HUI M X, ZHANG L G, YU X, et al.Clonging of BrcCUC3 from Brassica rapassp ssp.chinensis and its effect on leaf morphology and inflorescence structure[J].Journal of Agricultural Biotechnology, 2012, 20(4):337-346. doi: 10.3969/j.issn.1674-7968.2012.04.001
[11] 赵益超.盐芥microRNA164基因功能研究[D].济南: 山东师范大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10445-2009126230.htm ZHAO Y C. Research on function of miRNA164 in Thellungiella sabuginea[D].Jinan: Shandong Normal University, 2009. http://cdmd.cnki.com.cn/article/cdmd-10445-2009126230.htm
[12] 黄海娇.白桦BpAP1基因的功能研究[D].哈尔滨: 东北林业大学, 2014. HUANG H J. Function research of AP1 in Betula platyphylla×Betula pendula[D]. Harbin: Northeast Forestry University, 2014.
[13] 石玉波, 张荻, 申晓辉, 等.百子莲CONSTANS同源基因的克隆及表达分析[J].北京林业大学学报, 2014, 36(4):113-120. doi: 10.13332/j.cnki.jbfu.2014.04.021 SHI Y B, ZHANG D, SHEN X H, et al.Molecular cloning andexpression pattern analysis ofa CONSTANS homolog from Agapanthus praecox ssp.orientalis[J]. Journal of Beijing Forestry University, 2014, 36(4):113-120. doi: 10.13332/j.cnki.jbfu.2014.04.021
[14] 刘晓柱.荠菜心皮发育过程中生长素分布研究[D].长沙: 湖南农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10537-1011203804.htm LIU X Z.The study on the auxin's distribution during the development of carpel of Capsella bursapastoris[D].Changsha: Hunan Agricultural University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10537-1011203804.htm
[15] 张瑞萍.脱水素基因逆境表达模式与白桦遗传转化研究[D].哈尔滨: 东北林业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10225-2009132247.htm ZHANG R P.Study on expression pattern of ThDHN responding to different abiotic stress and establishment of genetic transformation of Betula platyphylla[D]. Harbin: Northeast Forestry University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10225-2009132247.htm
[16] 杨光.白桦BpGH3.5基因的功能研究[D].哈尔滨: 东北林业大学, 2015. YANG G.Function of BpGH3.5 gene in Betula platyphylla×Betula pendula[D].Harbin: Northeast Forestry University, 2015.
[17] 杨桂燕, 赵震, 赵玉琳, 等.ThMYB3和ThDof2对ThVHAc1基因表达的调控[J].北京林业大学学报, 2015, 37(12):1-6. doi: 10.13332/j.1000-1522.20140486 YANG G Y, ZHAO Z, ZHAO Y L, et al.Upstream regulators of ThVHAc1[J].Journal of Beijing Forestry University, 2015, 37(12):1-6. doi: 10.13332/j.1000-1522.20140486
[18] FU J H, CHU J F, SUN X H, et al. Sample, rapid, and simultaneous assay of multiple carboxyl containing phytohormones in wounded tomatoes by UPLC-MS/MS using single SPE purification and isotope dilution[J].Analytical Science, 2012, 28:1081-1087. doi: 10.2116/analsci.28.1081
[19] 莫亿伟, 李夏杰, 王海, 等.IAA对水稻根毛形成与水通道蛋白基因表达关系的研究[J].中国农业科学, 2015, 48(21):4227-4239. doi: 10.3864/j.issn.0578-1752.2015.21.004 MO Y W, LI X J, WANG H, et al. Effect of auxin treatment on root hair formation and aquaporins genes expression in root hair of rice[J]. Scientia Agricultura Sinica, 2015, 48(21):4227-4239. doi: 10.3864/j.issn.0578-1752.2015.21.004
[20] 黄俊丽, 马娜娜, 车树刚, 等.植物叶脉发育的分子机制[J].生命科学, 2011, 23(8):804-811. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=smkx201108014 HUANG J L, MA N N, CHE S G, et al.Molecular mechanism of plant leaf vein development[J]. Chinese Bulletin of Life Sciences, 2011, 23(8):804-811. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=smkx201108014
[21] 杨桂丽, 罗建中, 林彦.不同种源/家系的细叶桉苗期叶脉密度比较[J].桉树科技, 2015, 32(1):16-20. doi: 10.3969/j.issn.1674-3172.2015.01.003 YANG G L, LUO J Z, LIN Y.Comparison of the vein density in Eucalyptus tereticornis seedling of different provenances and families[J].Eucalypt Science & Technology, 2015, 32(1):16-20. doi: 10.3969/j.issn.1674-3172.2015.01.003
[22] 车树刚.水稻无中脉突变体dl2的生理机制分析及中脉发育基因DL2的初步定位[D].重庆: 重庆大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10611-1012049730.htm CHE S G.Study on the physiological mechanism of the rice ribless mutant dl2 and preliminary mapping of DL2 regulating midrib formation[D]. Chongqing: Chongqing University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10611-1012049730.htm
[23] SACK L, HOLBROOK N M. Leaf hydraulics[J].Annual Review of Plant Biology, 2006, 57:361-381. doi: 10.1146/annurev.arplant.56.032604.144141
[24] SACK L, SCOFFONI C, MCKOWN A D, et al.Developmentally based scaling of leaf venation architecture explains global ecological patterns[J].Nature Communications, 2012, 3:837. doi: 10.1038/ncomms1835
[25] SACK L, COWAN P D, HOLBROOK N M. The major veins of mesomorphic leaves revisited:tests for conductive over-load in Acer saccharum(Aceraceae) and Quercus rubra(Fagaceae)[J].American Journal of Botany, 2003, 90:32-39. doi: 10.3732/ajb.90.1.32
[26] 王占军, 杨立伟, 徐忠东, 等.麻风树PIN基因家族的鉴定与生物信息学分析[J].分子植物育种, 2015, 13(5):1111-1122. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fzzwyz201505030 WANG Z J, YANG L W, XU Z D, et al.Identification and bioinformatics analysis of the PIN gene family in Jatropha curcas[J].Molecular Plant Breeding, 2015, 13(5):1111-1122. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fzzwyz201505030
-
期刊类型引用(7)
1. 杨蕴力,曹俐,王阳,顾宸瑞,陈坤,刘桂丰. BpGLK1基因干扰表达对裂叶桦叶色及生长的影响. 南京林业大学学报(自然科学版). 2024(01): 18-28 .  百度学术
百度学术
2. 顾宸瑞,袁启航,姜静,穆怀志,刘桂丰. 基于转录组测序的关联分析定位裂叶桦叶形调控基因. 南京林业大学学报(自然科学版). 2024(01): 39-46 .  百度学术
百度学术
3. 杨蕴力,渠畅,王阳,刘桂丰,姜静. 白桦BpPIN5基因启动子组织定位及外源激素应答分析. 植物研究. 2022(01): 104-111 .  百度学术
百度学术
4. Chang Qu,Xiuyan Bian,Rui Han,Jing Jiang,Qibin Yu,Guifeng Liu. Expression of BpPIN is associated with IAA levels and the formation of lobed leaves in Betula pendula 'Dalecartica'. Journal of Forestry Research. 2020(01): 87-97 .  必应学术
必应学术
5. 田世龙,马庆,王阳,林昕,杨蕴力,葛梦妍,顾宸瑞,刘桂丰. 紫叶桦与裂叶桦杂交子代的种子活力及叶片性状分离. 林业科学研究. 2019(03): 40-48 .  百度学术
百度学术
6. 陈继英,刘超逸,王朔,徐文娣,黄海娇,姜静. 白桦BpTOPP1基因功能. 东北林业大学学报. 2018(08): 13-19 .  百度学术
百度学术
7. 陈晨,邢宝月,边秀艳,许思佳,刘桂丰,姜静. 转BpCUCt白桦生长特征及内源IAA含量的变化. 植物研究. 2018(04): 506-517 .  百度学术
百度学术
其他类型引用(7)



 下载:
下载: