Influence of biological soil crusts on soil moisture in Artemisia ordosica community in Mu Us Desert, northwestern China
-
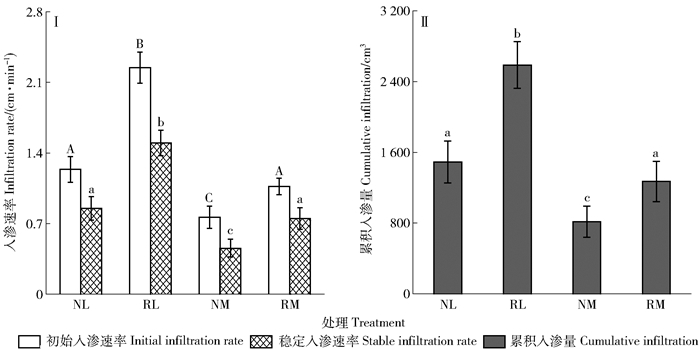
摘要: 为进一步探究毛乌素沙地油蒿群落内结皮对土壤水分的影响,研究了结皮(地衣结皮和苔藓结皮)未受干扰和移除处理下的土壤水分入渗、蒸发及含水量状况。结果显示:1)两种结皮均对土壤水分入渗具有抑制作用,移除两种结皮后,土壤水分初渗速率、稳渗速率以及累积入渗量均显著增大(P < 0.05);2)结皮对土壤蒸发的影响与结皮类型及蒸发阶段有关,地衣结皮对整个蒸发过程中日蒸发量及蒸发总量无显著影响(P>0.05),而苔藓结皮对土壤日蒸发量的影响在模拟蒸发前期表现为抑制(第1~5天),后期表现为促进(第6~15天),但对总蒸发量的影响不显著(P>0.05);3)总体来看,地衣结皮覆盖区0~40cm土层含水量高于地衣结皮移除区,而苔藓样地规律则相反。从不同土层来看,相比于移除结皮,地衣结皮覆盖区40cm深度以上各层土壤含水量均较高,苔藓结皮覆盖区土壤含水量在5和10cm深度较高,20和40cm较低。研究结果表明,地衣结皮提高了油蒿群落土壤水分有效性,应对其进行保护;苔藓结皮降低了油蒿种群土壤水分有效性,却提高了浅根系草本土壤水分有效性,这是驱动油蒿群落演替的重要因素之一。研究在为毛乌素沙地油蒿群落提供水分管理依据的同时,也从土壤水分方面为该群落的演替提供一定解释。Abstract: Biological soil crusts (BSCs) are widely distributed in Artemisia ordosica community in Mu Us Desert, northwestern China. They have been proved to play vital hydrological and ecological roles in desert ecosystems. However, the influence of BSCs on soil hydrological processes remains uncertain and controversial. In this study, we conducted a field experiment with two treatments (undisturbed and removed) for two biological soil crusts (lichen crusts and moss crusts) in A. ordosica community in the Mu Us Desert. We compared soil infiltration, evaporation and soil water volume in crust-covered and crust-removed soil. The initial infiltration rate, stable infiltration rate and cumulative infiltration significantly increased under crust-removed treatment (P < 0.05), suggesting that lichen and moss crusts had inhibitory effects on soil water infiltration. The effect of BSCs on soil evaporation was related to the type of BSCs and the evaporation stage. The lichen crusts had no effect on daily soil evaporation and total soil evaporation(P>0.05).The influence of moss crusts on total soil evaporation was similar to that of lichen crusts. The moss crusts inhibited daily soil evaporation in early soil evaporation stage (1-5th day), and promoted it in the late stage (6-15th day). Generally, the soil moisture above 40cm depth under crust-covered soil was higher than that in crust-removed soil, but opposite in moss soil. The soil moisture at each layer above 40cm depth in crust-covered soil was higher than that in crust-removed soil. Compared with the crust-removed soil, soil moisture in crust soil was higher at 5 and 10cm, but lower at 20 and 40cm. The results indicated that lichen crusts should be reserved with no disturbance. Whether the moss crusts should be reserved or disturbed need further discussion. Our results highlight the different hydrological roles of lichen and moss crusts and provide important implications for the management of soil water resource in semiarid areas of northwestern China.
-
Keywords:
- Artemisia ordosica community /
- lichen crust /
- moss crust /
- water infiltration /
- soil evaporation /
- soil moisture
-
转录因子通过调节动物和植物基因的时空表达水平,来调控生物体的细胞增殖、生长发育及免疫反应过程[1]。TCP基因家族编码植物特有的转录调控因子,该家族成员在植物生长[2]、花瓣的不对称性[3-4]、细胞分裂[5]、叶形态发生[6-7]、衰老[8-9]、胚胎生长[10]、昼夜节律[2]中起着关键作用。基于蛋白质的DNA结构域不同,该家族成员分为Class I(PCF类)和Class II(CIN和CYC/TB1)两类。目前,Class I类基因功能在草本植物中研究的较为深入。在拟南芥(Arabidopsis thaliana)中,AtTCP11通过上调VND7基因的表达,引起维管发育缺陷[11];AtTCP14通过细胞增殖控制叶的形态发生;AtTCP20通过抑制茉莉酸(JA)在植物体内的合成,降低其抑制细胞增殖的能力,从而使细胞大小发生改变[12],同时转AtTCP20::EAR拟南芥表现出发芽延迟、茎尖和根尖分生组织生长速度放缓、子叶变黄,下胚轴区域膨胀等特征[13]。
TCP基因参与多种激素信号传递过程,调控植物形态发育。在拟南芥中,AtTCP5、AtTCP13和AtTCP17通过PIFs依赖途径和不依赖PIFs途径两种方式来促进生长素的合成,进而介导拟南芥下胚轴在遮荫条件下的伸长[14];AtTCP3和AtTCP15通过调控生长素响应相关基因SHY2/IAA3和SAUR的表达参与生长素信号的转导[15-16];AtTCP9通过改变JA的代谢从而改变根长[17];在陆地棉(Gossypium hirsutum)中,GhTCP1基因通过促进JA的合成而使棉花纤维伸长并促进根毛发育[18]。AtTCP14和AtTCP15参与细胞分裂素(CK)信号途径的应答,影响细胞分裂[19];I类TCP转录因子家族参与赤霉素(GA)信号转导,研究发现GA通过刺激DELLA蛋白的降解来控制茎和节间伸长,而DELLA蛋白直接调节植物特异性I类TCP转录因子家族的活性,从而控制细胞增殖,同时拟南芥tcp8、tcp14、tcp15、tcp22这4个基因的突变体表现出严重的侏儒症和对GA作用的反应敏感性降低的性状[20]。目前对PCF亚类基因的研究主要集中在草本植物上,而在木本植物中研究较少。
白桦(Betula platyphylla),桦木科(Betulaceae)落叶类乔木,白桦树干修直、洁白,且耐严寒,生长较快,是我国东北地区珍贵阔叶树种之一。本研究以白桦为试材,克隆了BpTCP2基因编码区的全长序列,对其进行生物信息学分析,同时采用qRT-PCR分析该基因在白桦不同组织部位的表达特征以及对植物激素处理和非生物胁迫的应答机制,为揭示白桦的生长发育、抗逆机制,以及培育优良的白桦新品系提供参考。
1. 材料与方法
1.1 材 料
1.1.1 植物材料
材料于2018年夏季取自东北林业大学林木遗传育种白桦强化育种基地栽植的2年生白桦组培苗木,依次选取5株的顶芽、腋芽、第1到第7茎节(幼嫩到成熟)、成熟茎节的木质部和韧皮部、第1到第13片叶(包括叶片从幼嫩到衰老过程)。以上植物材料经液氮速冻后,放入− 80 ℃超低温冰箱保存,用于RNA的提取和研究BpTCP2在白桦不同组织部位的表达。
从白桦强化育种基地采集的白桦全同胞家系种子通过水培萌发,待长出两片子叶时,分别取10株长势均一的植株,放置在涂有相应外源激素和非生物胁迫试剂的WPM培养基中。激素处理的种类及浓度分别为:50 mg/L IAA,100 μmol/L ABA,0.2 mg/L油菜素类固醇(BR),1 μmol/L JA,350 μmol/L 水杨酸(SA)。非生物胁迫处理的浓度分别为:0.4 mol/L NaCl,0.3 mol/L NaHCO3,150 μmol/L CdCl2,20% PEG。分别在0、2、4、6、12和24 h取材并放置于1.5 mL离心管中,液氮速冻后,放入− 80 ℃超低温冰箱内保存,用于RNA提取。
1.1.2 试 剂
RNA提取试剂盒为通用植物总RNA提取试剂盒(离心柱型),购置于北京百泰克生物技术有限公司,反转录试剂盒为ReverTra Ace® qPCR RT Master Mix with gDNA Remover试剂盒,购置于东洋纺(上海)生物科技有限公司,TransStart Top Green qPCR SuperMix(Perfect Real Time染料法实时荧光定量)购置全式金生物(北京)有限公司,Topo试剂盒为pENTRTM/D-TOPO® Cloning Kit购置于invitrogen公司,大肠杆菌Trans1-T1感受态细胞购自世国生物科技(哈尔滨)有限公司。引物由擎科(哈尔滨)公司合成。
1.2 方 法
1.2.1 白桦BpTCP2基因的克隆
根据白桦基因组和转录组序列比对获得BpTCP2基因的序列设计引物,上、下游引物序列分别为5′-CACCGACATGGCAGAGAGCAAGC-3′、5′-ATTCTTCTACTGCCTTGACC-3′。以白桦不同组织部位的cDNA为模板,PCR扩增BpTCP2基因目标片段,反应体系如下:10 × KOD Buffer 1.7 μL,2 mmol/L dNTPs 1.7 μL,MgSO4 0.8 μL,cDNA模板0.4 μL,上、下游引物各为10 mmol/L 0.6 μL,KOD Plus 0.4 μL,ddH2O补足20 μL。PCR扩增程序为94 ℃预变性2 min;94 ℃变性45 s,58 ℃退火45 s,68 ℃延伸2 min,35个循环;68 ℃延伸10 min。PCR产物经1.0% 琼脂糖凝胶电泳检测,并进行胶回收纯化,将纯化产物进行Topo反应,连接体系为:胶回收产物1 μL,Topo Vector 0.5 μL,Salt Solution 0.5 μL,用ddH2O补足反应体系至3 μL。25 ℃连接30 min,连接反应完成后,通过热击法将连接产物转化到大肠杆菌Trans1-T1感受态细胞中。对获得的单克隆进行PCR检测,条带位置正确后送公司测序,保存经测序对比正确的菌液。
1.2.2 生物信息学分析
采用NCBI ORF Finder查找序列的ORF;用在线软件BioEdit预测该基因氨基酸序列;用Blastx进行同源序列比对,搜索不同物种中的同源基因及蛋白,并先将氨基酸序列利用Clustal X进行多序列比对的分析,借助MEGA 5.1软件的Neighbor-Joining算法,1 000次重复,以默认参数构建系统发育进化树[21]。
1.2.3 Real-time PCR分析BpTCP2基因的表达特性
使用RNA提取试剂盒提取白桦不同组织部位(顶芽、腋芽、木质部、韧皮部、1 ~ 7茎节、1 ~ 13叶片)、5种外源植物激素(IAA、ABA、BR、JA、SA)及4种非生物胁迫(NaCl、NaHCO3、CdCl2、PEG)处理后的整株材料的总RNA,并进行反转录。根据克隆获得的BpTCP2基因的全长cDNA序列设计定量引物,同时选用α-Tubulin作为内参基因[21](引物见表1)。获得的cDNA稀释10倍作为qPCR模板。实时定量PCR反应体系为:6 μL Top qMix,0.24 μL Passive Reference Dye,2 μL cDNA,10 μmol/L的上、下游引物各0.24 μL,用ddH2O补足反应体系至12 μL。扩增反应在ABI PRISM® 7500荧光定量PCR仪上完成,反应程序为94 ℃预变性30 s,94 ℃变性5 s,56 ℃退火15 s,72 ℃延伸34 s(45个循环),绘制溶解曲线的温度为95 ℃持续15 s,60 ℃持续1 min,95 ℃持续30 s。所有样品均进行3次重复,采用– ΔΔCt方法进行基因的相对定量分析。
表 1 实时荧光定量PCR引物序列Table 1. Real-time PCR primer sequences引物名称 Primer name 上游引物序列(5′→3′) Forward primer (5′→3′) 下游引物序列(5′→3′) Reverse primer (5′→3′) BpTCP2 5′-GCTTGCATACAAAGATGGAAGG-3′ 5′-GGAAAAGCTCAATGGACCCAG-3′ α-Tubulin 5′-GCACTGGCCTCCAAGGAT-3′ 5′-TGGGTCGCTCAATGTCAAGG-3′ 2. 结果与分析
2.1 BpTCP2基因的克隆
以白桦不同组织部位的cDNA为模板,根据白桦基因组序列和转录组数据比对获得BpTCP2基因序列设计特异性引物,PCR扩增其全长cDNA序列,扩增产物于1.0%琼脂糖凝胶电泳检测(图1),纯化后的胶回收产物通过Topo反应进行菌液PCR检测,结果显示在813 bp处获得特异性条带,与预期目标条带大小一致(图2)。
2.2 白桦BpTCP2基因的生物信息学分析
2.2.1 白桦BpTCP2基因编码区序列分析
利用BLASTx及NCBI ORF Finder预测BpTCP2基因的ORF全长,利用生物学软件BioEdit预测BpTCP2基因的ORF全长为804 bp,编码267个氨基酸(图3)。
2.2.2 白桦BpTCP2基因结构域分析
分别选取拟南芥、葡萄(Vitis vinifera)、水稻(Oryza sativa)、毛果杨(Populus trichocarpa)4个物种PCF亚类基因各2条与BpTCP2基因进行氨基酸的多序列比对分析,结果如图4所示,BpTCP2基因与其他物种PCF亚类基因的氨基酸序列均含有TCP保守结构域bHLH[22]。bHLH基序由44个氨基酸组成,包括一个能与DNA结合的碱性区域和α螺旋1-环-α螺旋2(Helix1- Loop-Helix2)组成[23-24],其中Basic结构域含有16个氨基酸,helixI、loop和helixII结构域分别含有11、8和9个氨基酸。从比对结果可以看出无论是Basic结构域还是其他3个结构域均高度保守。
2.2.3 白桦BpTCP2基因的进化树分析
利用MEGA 5.1对白桦BpTCP2与拟南芥、水稻、葡萄及毛果杨TCP的蛋白序列进行聚类分析,结果如图5所示,97个TCP成员被清楚的分为Class I(PCF)和Class II(CIN和CYC/TB1)两大类,其中BpTCP2属于PCF亚类,并与毛果杨的TCP1基因相似性较高。
2.3 BpTCP2基因的组织表达特性分析
2.3.1 不同组织部位
以叶为对照,分析了BpTCP2基因在顶芽、腋芽、嫩茎、木质部及韧皮部的表达情况(图6),结果表明:该基因在腋芽中表达量最低,而在其他4个组织部位中均上调表达,尤其在木质部和韧皮部中,表达量分别上调32倍和16倍。
2.3.2 不同叶发育阶段
根据白桦叶片的发育情况,分别选取从幼嫩到衰老整个发育阶段的叶片(图7),并以第1片叶为对照,分析了BpTCP2基因在叶片不同发育时期的表达情况(图8),结果表明:该基因随着叶龄的增加整体呈现下调的趋势;在前期发育过程中(第1 ~ 4片叶)BpTCP2表达量呈现先下调后上调的趋势;在中期发育过程(第5 ~ 9片叶),该基因表达量变化并不明显(< 2倍),但低于对照;在后期发育过程(第10 ~ 13片叶)中,该基因持续下调,在第12片叶时下调达到峰值,为对照的128倍,在第13片叶时表达量略有回升。
2.3.3 茎节发育阶段
根据白桦茎节的发育情况,选取了白桦从幼嫩到成熟的茎节如(图9),分析BpTCP2基因在茎节发育阶段的表达情况(图10),以第1茎节为对照,该基因在茎发育初期,表达量呈现持续上调的趋势,尤其是在第4茎节中表达量达到最高峰,为对照的4倍。但从第5茎节到成熟茎节其在韧皮部中的表达量变化不明显(< 2倍)。
2.4 激素应答分析
在BR、JA、SA、IAA、ABA这5种激素处理下,BpTCP2的表达情况呈现不同的表达趋势,如图11所示。在BR处理下,BpTCP2基因呈现下调表达的趋势,尤其是在4 h时表达量达到最低值,下调为对照的256倍,随着处理时间的延长,其略有上升但还是低于处理前(0 h);在JA处理过程中,除6、12 h与对照相比变化不明显外,其他时间点均呈现上调表达的趋势,尤其在4 h时,其表达量明显比对照提高了32倍;SA处理后,BpTCP2的表达量在12 h前均上调,且在6 h时达到峰值,为未处理的8倍,而在24 h时骤然下调为4倍;在IAA的处理过程中,BpTCP2基因呈现下调表达的趋势,且除了6 h外,在其他时间点BpTCP2基因的表达量没有发生明显的变化(< 2倍);在ABA处理过程中,BpTCP2的表达量呈现波动,在12 h时表达量达到最高峰,为对照的32倍,而在24 h时表达量最低,为对照的64倍。
2.5 非生物胁迫应答分析
通过CdCl2、NaCl、NaHCO3、PEG 4种胁迫处理,分析BpTCP2的表达情况,结果如图12所示。其中,在CdCl2、NaCl和NaHCO3处理下,BpTCP2基因的表达模式相似且均为高表达,并且CdCl2和NaCl在处理12 h时上调表达量达到峰值,分别为对照的128倍和64倍,NaHCO3处理后表达量最高峰出现在24 h,为对照的64倍;在PEG胁迫处理过程中,BpTCP2与对照相比变化并不明显(< 2倍)。
3. 讨 论
通过对白桦的BpTCP2氨基酸序列以及葡萄、拟南芥、水稻、毛果杨TCP氨基酸序列进行系统聚类分析,根据其序列差异将其分为Class I(PCF)和Class II(CIN和CYC/TB1)两大类,其中BpTCP2属于Class I类PCF亚类。Class I类和Class II类相比,Class I类在Basic结构域上有4个氨基酸的缺失[25-26]。
分析BpTCP2在不同组织部位的特异性表达发现,该基因在嫩茎、木质部、韧皮部、顶芽中均呈上调表达,且在木质部中表达量最高,表明BpTCP2可能与木质素的生物合成相关。在安家兴等人[11]的研究中,也证明了Class I类PCF亚类的AtTCP11通过改变VND7的表达量从而影响维管束的发育。分析BpTCP2在茎节发育中的表达水平,从第1茎节到第4茎节表达量呈现持续上调的趋势,说明BpTCP2可能参与白桦茎的初期发育,Kieffer等[27]发现了AtTCP15和AtTCP14的突变体通过影响细胞增殖来影响茎节发育。在叶片发育的表达分析中,随着叶龄的增加,BpTCP2表达量整体呈现一个下调的趋势说明BpTCP2可能和延缓衰老相关,张春雷等[28]人在对拟南芥的PCF亚类基因AtTCP15、AtTCP22研究时发现,35S::TCP15-SRDX和35S::TCP22-SRDX同时表现出提前衰老的现象。
近年研究发现TCP转录因子除了在植物发育过程中发挥重要作用外,还参与植物激素及胁迫的信号传导等过程[29],同时我们对BpTCP2基因的启动子序列进行分析,也发现其含有多种激素和胁迫的应答元件(未发表),故本研究对BpTCP2基因进行了外源激素和非生物胁迫应答分析,结果表明,在植物激素处理下,BpTCP2呈现不同的表达趋势。经ABA处理后,BpTCP2呈现出先上调后下调的波动型表达模式,说明该基因参与ABA的信号应答。Mukhopadhyay等[30]对PCF亚类的OsTCP19的信号通路进行研究,发现OsTCP19通过与转录因子ABI4的互作来调控ABI3的表达从而对ABA信号通路进行调控;经BR处理后,BpTCP2整体均呈现下调表达,尤其在4 h时表达量最低,说明BpTCP2明显的响应了BR的信号且为负响应模式。DWARF4是BR生物合成中的关键酶,在拟南芥中,通过染色体免疫共沉淀发现AtTCP1可以促进DWF4的表达,使内源BR含量增加,促进植物的生长[29];在IAA处理后,BpTCP2在6 h时呈现下调表达的趋势而在其他时间点表达量变化并不明显,说明BpTCP2也响应了IAA的初期信号。在拟南芥中CIN类的AtTCP3可以引起IAA合成的负调节因子CYP83B1/SUR2的上调[31],AtTCP15(PCF类)也可间接诱导IAA3/SHY2表达[2],通过使用IAA响应原件DR5::GUS分析,AtTCP15和AtTCP3在一定程度上功能冗余,表明他们在IAA信号通路中可能发挥着相同的作用,这与BpTCP2处理后的结果类似;在JA处理后,BpTCP2除6 h、12 h与对照相比变化不明显外,其他时间点均呈现上调表达的趋势,说明BpTCP2响应了JA的信号且为正响应模式,在冯志娟等人[29]的研究中,LIPOXYGENASE2(LOX2)基因受TCP转录因子的调控且LOX2的诱导使JA积累;在SA处理下,BpTCP2的表达量在12 h前均为上调表达,但在24 h时骤然下降,说明BpTCP2响应了SA的信号,拟南芥AtTCP8(PCF亚类)与ICS1转录激活因子SARD1和WRKY28以及ICS1阻遏蛋白NAC019相互作用,ICS1基因是编码SA生物合成过程中必需的酶[32]且拟南芥中AtTCP8可以作为效应诱导免疫过程中的正向调节者[29]。
在CdCl2、NaCl、NaHCO3处理过程中,BpTCP2呈现上调表达的趋势,表明该基因在相应的非生物胁迫过程中表现出正调控模式,这一结果与水曲柳(Fraxinus mandschurica)和木薯(Manihot esculenta)的研究结果一致,水曲柳的FmTCP4和木薯的MeTCPs基因在盐胁迫下也呈现出正响应模式[33-34];在水稻中,OsTCP19的过表达导致LOX2(茉莉酸信号通路基因)的下调,从而减少水分流失和活性氧的缺失以及脂肪的积累,进而提高植株的耐盐性[30];本实验团队前期对PromTCP7::GUS拟南芥株系进行盐、旱处理,发现该基因对盐、旱途径均有不同程度响应[35]。耐盐性结果与本实验基本一致,但在PEG(干旱)处理下,BpTCP2的变化并不明显。目前,miR319的靶位点已在多个物种的TCP基因中被发现,在植物非生物胁迫应答的过程中,miR319与TCP基因的模式靶向关系为负调控[29],作为miR319的靶基因,TCP家族基因间存在功能冗余与分歧;并且在拟南芥中Viola等[36]发现,半胱氨酸(Cys-20)是AtTCP15保守结构域中的重要组成部分,AtTCP15通过其在氧化胁迫条件下发生的氧化反应从而抑制该基因的转录水平,进而参与非生物胁迫过程。
4. 结 论
本实验成功克隆了BpTCP2基因,生物信息分析表明该基因属于Class I类PCF亚类且含有高度保守的bHLH结构域;BpTCP2参与木质素的生物合成、初期茎节发育及叶片发育过程;BpTCP2参与植物外源激素(ABA、IAA、BR、JA、SA)及非生物胁迫(重金属、盐、碱)的响应。
-
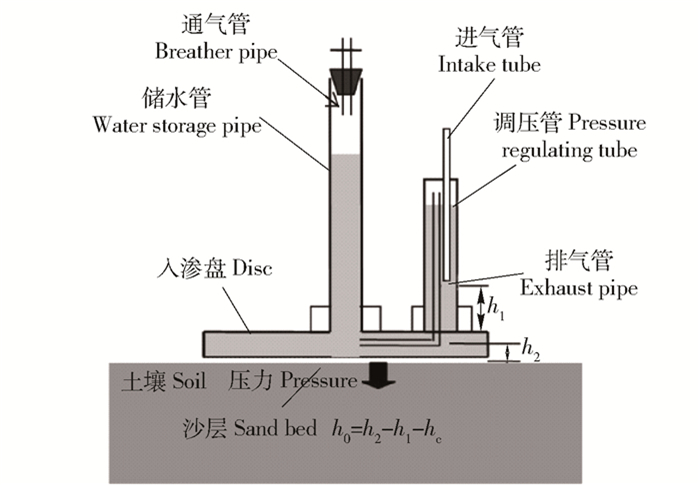
图 3 微型蒸发器及结皮处理示意图
NL.地衣结皮未受干扰处理;RL.移除地衣结皮处理;NM.苔藓结皮未干扰处理;RM.移除苔藓结皮处理。下同。
Figure 3. Schematic diagram of micro-lysimeters and treatments
NL, treatment of undisturbed lichen crusts; RL, treatment of removed lichen crusts; NM, treatment of undisturbed moss crusts; RM, treatment of removed moss crusts. The same below.
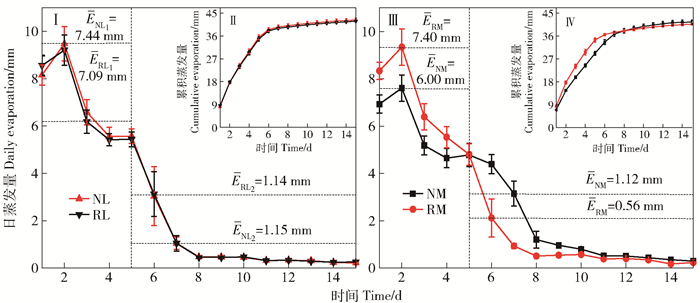
图 5 不同处理下土壤日蒸发量(Ⅰ, Ⅲ)和累积蒸发量(Ⅱ, Ⅳ)
E表示不同阶段的平均土壤日蒸发量,“1”和“2”分别表示蒸发前期和蒸发后期(n=3)。
Figure 5. Daily soil evaporation(Ⅰ, Ⅲ) and cumulative evaporation (Ⅱ, Ⅳ) under different treatments
E represents average daily soil evaporation in different stages. "1" and "2"represent pre-evaporation and late evaporation, respectively(n=3).
图 6 降雨量及移除结皮前后各层土壤含水量差值的动态变化
Ⅰ为研究期间降雨量,Ⅱ为移除地衣结皮与地衣结皮未受干扰的土壤含水量差值,Ⅲ为移除苔藓结皮与苔藓结皮未受干扰的土壤含水量差值;θ为土壤含水量。彩色线表示各层含水量差值。黑色线表示0~40cm土层含水量差值,浅灰色区域表示0~40cm土层含水量差值的标准差范围,深灰色虚线表示0~40cm土层含水量差值的线性回归趋势线(可直观地反映研究期间该土层含水量差值的变化趋势)(n=3)。
Figure 6. Dynamic variations in rainfall and soil moisture differences between crust-undisturbed and crust-removed soil
Ⅰ is rainfall during the study period, Ⅱ is soil moisture difference between lichen-removed and lichen-undisturbed soil, Ⅲ is soil moisture difference between moss-removed and moss-undisturbed soil; θ is soil moisture content. The colorful lines indicate soil moisture difference in each depth. The black line indicates the average soil moisture differences across 0-40cm soil layers, and the light grey area indicates one s. d. either side of the mean. The dark grey dotted line indicates the linear regression (which can reflect the variation trend of water content difference in the study period)(n=3).
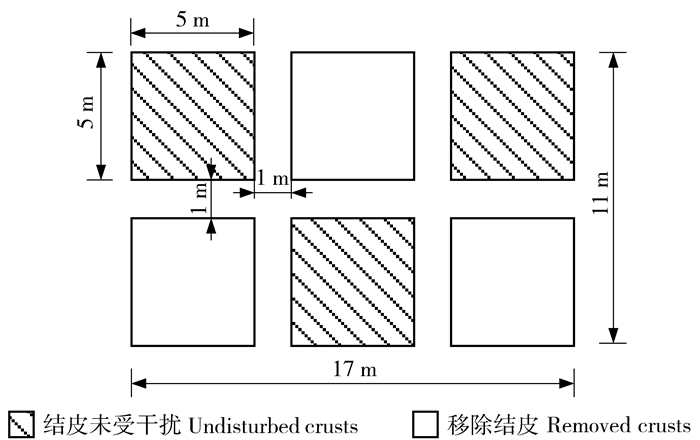
表 1 群落概况
Table 1 Basic information of communities
群落类型
Community type地形
Terrain坡度
Slope gradient/(°)结皮特征
BSCs characteristics主要植物种
Main plant species植被盖度
Vegetationcoverage/%覆盖地衣结皮的油蒿群落Artemisia ordosica community with lichen crusts 丘间地
Interdunes3 结皮总盖度88%,地衣结皮相对盖度94%,厚度(0.63±0.12)cm Total coverage of BSCs was 88%; relative coverage of lichen crusts was 94%; thickness of lichen crusts was (0.63±0.12)cm 油蒿Artemisia ordosica
细叶小苦荬Ixeridium gracile
蒙古虫实Corispermum mongolicum
沙鞭Psammochloa villosa33.2 覆盖苔藓结皮的油蒿群落Artemisia ordosica community with moss crusts 丘间地
Interdunes7 结皮总盖度90%,苔藓结皮相对盖度91%,厚度(1.20±0.25)cm Total coverage of BSCs was 90%; relative coverage of moss crusts was 91%; thickness of moss crusts was (1.20±0.25)cm 油蒿Artemisia ordosica
细叶小苦荬Ixeridium gracile
刺藜Chenopodium aristatum40.9 表 2 结皮层及其下土壤理化性质
Table 2 Physicochemical properties of crusts and the underneath soil
项目Item 深度Depth 地衣结皮Lichen crust 苔藓结皮Moss crust 土壤密度Soil bulk density /(g·cm-3) 结皮层Crust layer 1.32±0.03aA 1.25±0.05aB 层下土壤Underneath soil 1.63±0.03bA 1.52±0.08bA 多糖含量Polysaccharide content/(μg·mg-1) 结皮层Crust layer 2.28±0.04aA 3.82±0.03aB 层下土壤Underneath soil 0.72±0.02bA 1.24±0.02bA 饱和持水量Saturation moisture capacity/% 结皮层Crust layer 27.65±1.88aA 39.51±2.06aB 层下土壤Underneath soil 19.37±1.75bA 29.14±1.25bB 黏粒Clay(0~2μm)/% 结皮层Crust layer 1.67±0.13aA 2.04±0.21aA 层下土壤Underneath soil 1.09±0.12bA 1.92±0.19aB 粉粒Silt(2~50μm)/% 结皮层Crust layer 13.59±2.21aA 20.51±2.56aB 层下土壤Underneath soil 9.31±1.44aA 16.11±1.57bA 砂粒Sand(>50μm)/% 结皮层Crust layer 84.74±4.62aA 77.45±5.31aB 层下土壤Underneath soil 89.60±2.75bA 81.97±7.43bB 注:不同小写字母表示同一结皮类型不同深度在P<0.05水平上差异性显著。不同大写字母表示相同深度不同结皮类型在P<0.05水平上差异性显著(n=3)。Notes: Different lowercase letters mean significant difference among different depths of the same crust at P < 0.05 level. Different capital letters mean significant difference among different crusts of the same depths at P < 0.05 level(n=3). -
[1] 史志华, 朱华德, 陈佳, 等.小流域土壤水分空间异质性及其与环境因子的关系[J].应用生态学报, 2012, 23(4): 889-895. http://d.old.wanfangdata.com.cn/Periodical/yystxb201204004 SHI Z H, ZHU H D, CHEN J, et al. Spatial heterogeneity of soil moisture and its relationships with environmental factors at small catchment level[J]. Chinese Journal of Applied Ecology, 2012, 23(4): 889-895. http://d.old.wanfangdata.com.cn/Periodical/yystxb201204004
[2] CHAMIZO S, CANTON Y, LAZARO R, et al. Crust composition and disturbance drive infiltration through biological soil crusts in semiarid ecosystems[J]. Ecosystems, 2012, 15(1): 148-161. doi: 10.1007/s10021-011-9499-6
[3] 杨秀莲, 张克斌, 曹永翔.封育草地土壤生物结皮对水分入渗与植物多样性的影响[J].生态环境学报, 2010, 19(4): 853-856. doi: 10.3969/j.issn.1674-5906.2010.04.020 YANG X L, ZHANG K B, CAO Y X. Effects of biological soil crusts on water infiltration and plant diversity in fenced grassland soil[J]. Ecology and Environmental Sciences, 2010, 19(4): 853-856. doi: 10.3969/j.issn.1674-5906.2010.04.020
[4] ELDRIDGE D J. Cryptogam cover and soil surface condition: effects on hydrology on a semiarid woodland soil[J]. Arid Land Research and Management, 1993, 7(3): 203-217. doi: 10.1080/15324989309381351
[5] LI S Z, XIAO H L, CHENG G D, et al. Mechanical disturbance of microbiotic crusts affects ecohydrological processes in a region of revegetation-fixed sand dunes[J]. Arid Land Research and Management, 2006, 20(1): 61-77. doi: 10.1080/15324980500369467
[6] CORTINA J, MARTÍN N, MAESTRE F T, et al. Disturbance of the biological soil crusts and performance of Stipa tenacissima in a semi-arid Mediterranean steppe[J]. Plant and Soil, 2010, 334(1-2): 311-322. doi: 10.1007/s11104-010-0384-4
[7] CHAMIZO S, CANTÓN Y, DOMINGO F, et al. Evaporative losses from soils covered by physical and different types of biological soil crusts[J]. Hydrological Processes, 2013, 27(3): 324-332. doi: 10.1002/hyp.8421
[8] WANG X P, LI X R, XIAO H L, et al. Effects of surface characteristics on infiltration patterns in an arid shrub desert[J]. Hydrological Processes, 2007, 21(1): 72-79. doi: 10.1002/hyp.6185
[9] YANG Y S, BU C F, MU X M, et al. Effects of differing coverage of moss-dominated soil crusts on hydrological processes and implications for disturbance in the Mu Us Sandland, China[J]. Hydrological Processes, 2015, 29(14): 3112-3123. doi: 10.1002/hyp.10428
[10] 陈昌笃.走向宏观生态学-陈昌笃论文集[M].北京:科学出版社, 2009: 85-115. CHEN C D. To the macroscopic ecology-proceedings of CHEN Chang-du[M]. Beijing: Science Press, 2009: 85-115.
[11] 张军红.毛乌素沙地油蒿群落生物结皮的分布特征[J].水土保持通报, 2014, 34(3): 227-230. http://d.old.wanfangdata.com.cn/Periodical/stbctb201403045 ZHANG J H. Distribution characteristics of biological soil crust for Artemisia ordosica community in Mu Us Sandy Land[J]. Bulletin of Soil and Water Conservation, 2014, 34(3): 227-230. http://d.old.wanfangdata.com.cn/Periodical/stbctb201403045
[12] WU Y S, HASI E, WU G, et al. Characteristics of surface runoff in a sandy area in southern Mu Us Sandy Land[J]. Chinese Science Bulletin, 2012, 57(Z1): 270-275. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=kxtb201134011
[13] 张军红, 吴波.油蒿群落生物结皮对降水入渗过程的影响[J].中国科学院大学学报, 2014, 31(2): 214-220. http://d.old.wanfangdata.com.cn/Periodical/zgkxyyjsyxb201402011 ZHANG J H, WU B. Influences of biological soil crust in Artemisia ordosica community on the precipitation infiltration process[J]. Journal of University of Chinese Academy of Sciences, 2014, 31(2): 214-220. http://d.old.wanfangdata.com.cn/Periodical/zgkxyyjsyxb201402011
[14] YANG Y S, BU C F, MU X M, et al. Interactive effects of moss-dominated crusts and Artemisia ordosica on wind erosion and soil moisture in Mu Us Sandland, China[J/OL]. Scientific World Journal, 2014(4)[2016-10-12]. DOI: 10.1155/2014/649816.
[15] 雷雅凯.毛乌素沙地油蒿种群格局研究[D].北京: 中国林业科学研究院, 2012. LEI Y K. Spatial pattern of Artemisia ordosica population in Mu Us Sandland, in Inner Mongolia[D]. Beijing: Chinese Academay of Forestry, 2012.
[16] 赵灿, 张宇清, 秦树高, 等. 3种典型沙生灌木NPP及其分配格局[J].北京林业大学学报, 2014, 36(5): 62-67. doi: 10.13332/j.cnki.jbfu.2014.05.013 ZHAO C, ZHANG Y Q, QIN S G, et al. NPP and its distribution pattern of three typical sandy shrubs[J]. Journal of Beijing Forestry University, 2014, 36(5): 62-67. doi: 10.13332/j.cnki.jbfu.2014.05.013
[17] SHE W W, ZHANG Y Q, QIN S G, et al. Habitat effect on allometry of a xeric shrub (Artemisia ordosica Krasch) in the Mu Us Desert of northern China[J]. Forests, 2015, 6(12): 4529-4539. doi: 10.3390/f6124385
[18] 邵晨曦, 秦树高, 冯薇, 等.生物土壤结皮物理因子对植物种子萌发的影响[J].中国农业大学学报, 2016, 21(2): 20-30. http://d.old.wanfangdata.com.cn/Periodical/zgnydxxb201602003 SHAO C X, QIN S G, FENG W, et al. Effects of physical characteristics of biological crusts on seed germination[J]. Journal of China Agricultural University, 2016, 21(2): 20-30. http://d.old.wanfangdata.com.cn/Periodical/zgnydxxb201602003
[19] 许明祥, 刘国彬, 卜崇峰, 等.圆盘入渗仪法测定不同利用方式土壤渗透性试验研究[J].农业工程学报, 2002, 18(4): 54-58. http://d.old.wanfangdata.com.cn/Periodical/nygcxb200204013 XU M X, LIU G B, BU C F, et al. Experimental study on soil infiltration characteristics using disc permeameter[J]. Transactions of the Chinese Society of Agricultural Engineering, 2002, 18(4): 54-58. http://d.old.wanfangdata.com.cn/Periodical/nygcxb200204013
[20] 佘冬立, 高雪梅, 房凯.利用圆盘入渗仪测定不同土地利用类型土壤吸渗率[J].农业工程学报, 2014, 30(18): 151-158. doi: 10.3969/j.issn.1002-6819.2014.18.019 SHE D L, GAO X M, FANG K. Measurement of soil sorptivity rate under different land uses by disc infiltrometer[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(18): 151-158. doi: 10.3969/j.issn.1002-6819.2014.18.019
[21] 冯薇.毛乌素沙地生物结皮光合固碳过程及对土壤碳排放的影响[D].北京: 北京林业大学, 2014. FENG W. Photosythetic carbon fixation of biological soil crust in a desert and their impact on soil carbon mission[D]. Beijing: Beijing Forestry University, 2014.
[22] WANG W B, LIU Y D, LI D H, et al. Feasibility of cyanobacterial inoculation for biological soil crusts formation in desert area[J]. Soil Biology and Biochemistry, 2009, 41(5): 926-929. doi: 10.1016/j.soilbio.2008.07.001
[23] 吴丽, 陈晓国, 张高科, 等.人工生物结皮的发育演替及表土持水特性研究[J].环境科学, 2014, 35(3): 1138-1143. http://d.old.wanfangdata.com.cn/Periodical/hjkx201403045 WU L, CHEN X G, ZHANG G K, et al. Development and succession of artificial biological soil crusts and water holding characteristics of topsoil[J]. Environmental Science, 2014, 35(3): 1138-1143. http://d.old.wanfangdata.com.cn/Periodical/hjkx201403045
[24] BROTHERSON J D, RUSHFORTH S R. Influence of cryptogamic crusts on moisture relationships of soils in Navajo National Monument, Arizona[J]. The Great Basin Naturalist, 1983, 43(1): 73-78. https://www.jstor.org/stable/41711969
[25] ELDRIDGE D J. Biological soil crusts and water relations in Australian deserts[C]//BELNAP J, LANGE O L, Eds. Biological soil crusts: structure, function and management. Berlin: Springer, 2003: 315-325.
[26] FISCHER T, VESTE M, WIEHE W, et al. Water repellency and pore clogging at early successional stages of microbiotic crusts on inland dunes, Brandenburg, NE Germany[J]. Catena, 2010, 80(1): 47-52. doi: 10.1016/j.catena.2009.08.009
[27] 张培培.黄土丘陵区生物结皮对水分入渗的影响及模拟[D].杨凌: 中国科学院水利部水土保持研究所, 2014. ZHANG P P. The effect of biological soil crusts on water infiltration and simulation in hilly and gully region of the Loess Plateau[D]. Yangling: Institute of Soil and Water Conservation, Chinese Academy of Sciences & Ministry of Water Resources, 2014.
[28] 余韵, 卫伟, 吴南生, 等.黄土丘陵区不同土地利用类型下生物土壤结皮的入渗效应[J].环境科学研究, 2014, 27(4): 415-421. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=49265266 YU Y, WEI W, WU N S, et al. Effects of biological soil crusts on water infiltration in a semiarid loess hilly area[J]. Research of Environmental Sciences, 2014, 27(4): 415-421. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=49265266
[29] XIAO B, ZHAO Y G, SHAO M G. Characteristics and numeric simulation of soil evaporation in biological soil crusts[J]. Journal of Arid Environments, 2010, 74(1): 121-130. doi: 10.1016/j.jaridenv.2009.06.013
[30] 陈兰周, 刘永定, 宋立荣.微鞘藻胞外多糖在沙漠土壤成土中的作用[J].水生生物学报, 2002, 26(2): 155-159. doi: 10.3321/j.issn:1000-3207.2002.02.008 CHEN L Z, LIU Y D, SONG L R. The function of exopolysaccharides of Microcoleus in the formation of desert soil[J]. Acta Hydrobiologica Sinica, 2002, 26(2): 155-159. doi: 10.3321/j.issn:1000-3207.2002.02.008
[31] XIAO B, ZHAO Y G, WANG H, et al. Natural recovery of moss-dominated biological soil crusts after surface soil removal and their long-term effects on soil water conditions in a semi-arid environment[J]. Catena, 2014, 120: 1-11. doi: 10.1016/j.catena.2014.03.018
[32] 于晓娜, 黄永梅, 陈慧颖, 等.土壤水分对毛乌素沙地油蒿群落演替的影响[J].干旱区资源与环境, 2015, 29(2): 92-98. http://d.old.wanfangdata.com.cn/Periodical/ghqzyyhj201502016 YU X N, HUANG Y M, CHEN H Y, et al. The influence of soil moisture on the succession of Artemisia ordosica community in Mu Us Sandland[J]. Journal of Arid Land Resources and Environment, 2015, 29(2): 92-98. http://d.old.wanfangdata.com.cn/Periodical/ghqzyyhj201502016
[33] 李新荣, 张元明, 赵允格.生物土壤结皮研究:进展、前沿与展望[J].中国沙漠, 2009, 24(1): 11-24. http://d.old.wanfangdata.com.cn/Periodical/gpxygpfx200808035 LI X R, ZHANG Y M, ZHAO Y G. A study of biological soil crusts: recent development, trend and prospect[J]. Advances in Earth Science, 2009, 24(1): 11-24. http://d.old.wanfangdata.com.cn/Periodical/gpxygpfx200808035
-
期刊类型引用(1)
1. 吕思毓,安旆其,王朋阳,刘牧田,吕汐,祁明惠,张磊. 长白落叶松HD-Zip基因对外源激素的响应模式. 东北林业大学学报. 2021(02): 1-4 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: