PLFA analysis of soil microorganism under Robinia pseudoacacia and Pinus tabuliformis plantation in loess area
-
摘要:目的研究黄土丘陵沟壑区不同人工林恢复对土壤微生物群落结构多样性产生的影响,为该区植被恢复评价提供数据参考。方法以山西吉县典型刺槐和油松人工林以及自然恢复的荒草地为研究对象,采用磷脂脂肪酸(PLFA)生物标记法(MIDI系统),分别对土壤表层0 ~ 20 cm和20 ~ 40 cm土层的PLFA种类进行分析,比较不同人工林植被恢复后土壤微生物PLFA数量以及微生物群落结构的差异,并探讨土壤化学性质对土壤微生物群落结构的影响。结果土壤微生物PLFA总量,细菌、放线菌、革兰氏阳性菌和丛枝菌根真菌PLFA含量及多样性指标(Shannon-Wiener、 Simpson及Pielou指数)均呈现出刺槐林最高、油松林次之,且均显著高于荒草地的趋势(P < 0.05)。2种人工林土壤中表征环境胁迫的直链饱和脂肪酸/单不饱和脂肪酸(SAT/MONO)值显著低于荒草地(P < 0.05)。主成分分析结果显示,不同植被类型及土层深度的土壤微生物群落结构存在差异,且3种植被表层土壤微生物群落结构之间的差异达到了显著水平(P < 0.05)。冗余分析和Pearson相关分析结果显示,土壤微生物群落结构变化的主要影响因素是土壤全氮含量和pH值。结论刺槐和油松人工林的恢复对土壤微生物群落结构多样性有显著影响,对土壤生态系统的修复具有积极意义。与油松相比,刺槐更有利于土壤微生物状况的改善。Abstract:Objective This paper aims to investigate the effects of artificial vegetation restoration on soil microbial community composition in the loess hilly-gully region, and provide data reference for regional vegetation restoration evaluation.Method Three typical vegetation types, including Robinia pseudoacacia, Pinus tabuliformis plantation and grassland, were chosen in Jixian County, Shanxi Province of northern China. Soil samples from depth of 0−20 cm and 20−40 cm were collected respectively, and soil microbial community composition was evaluated by phospholipid fatty acid (PLFA) analysis (MIDI-Sherlock system). Based on the PLFA analysis, we studied the differences between soil microbial PLFA contents and soil microbial community after restoration, and further explored the effect of soil chemical properties on soil microbial community structure.Result Results showed that total PLFAs, biomasses of bacteria, actinomycetes, gram-positive bacteria, arbuscular mycorrhizal fungi and diversity indicators (Shannon-Wiener, Simpson and Pielou index) followed the order of Robinia pseudoacacia > Pinus tabuliformis > grassland (P < 0.05). Meanwhile, the ratio of Saturated fatty acids to Monounsaturated fatty acids (SAT/MONO) in the two plantations was significantly lower than grassland (P < 0.05), which implied that environmental stress on soil microorganisms had reduced. Principal component analysis indicated that soil microbial community structure differed among various vegetation types and soil depths, and that the difference reached a significant level in topsoil (P < 0.05). Redundancy analysis and Pearson correlation analysis showed that soil total nitrogen and pH were the main factors leading to the changes of soil microbial community structure.Conclusion The restoration of Robinia pseudoacacia, Pinus tabuliformis impacted the diversity of soil microbial community structure significantly, and both typical plantations had positive effect on soil ecosystem restoration. Our findings suggest that Robinia pseudoacacia was more conducive to the improvement of soil microbial ecological environment than Pinus tabuliformis.
-
工业革命以来,过度使用化石燃料,大量排放二氧化碳(CO2)、二氧化氮(NO2)和甲烷(CH4)等温室气体造成全球气候系统持续变暖[1]。IPCC第五次工作报告表明,2003—2012年全球陆地和海洋表面平均温度的总升温幅度为0.72 ~ 0.85 ℃。Collins等[2]研究指出,到21世纪末,全球气温将进一步上升1.1 ~ 6.4 ℃。温度持续升高会对植物的生长和生理状态造成伤害,进而影响生态系统服务和碳、氮循环[3-5]。
光合作用是对高温胁迫最为敏感的生理过程[6]。当温度在0 ~ 35 ℃间,大多数植物光合作用随温度的变化是可逆的,此时光系统耐热性提升,光合作用被优化,固碳能力强[7-9]。若温度继续升高,会导致植物净光合速率降低,碳同化量减少,进而改变同化碳的分配,抑制植物的生长,造成不可逆伤害[10-11]。张桂莲等[12]研究结果表明:37 ℃高温能够使水稻(Oryza sativa)剑叶净光合速率(Pn)和气孔导度(Gs)下降,胞间CO2浓度(Ci)上升。徐超等[13]对草莓(Fragaria × ananassa)的研究表明:当温度超过38 ℃时,叶片光系统Ⅱ(PSⅡ)的光化学反应受到抑制,最大光量子产量(Fv/Fm)呈下降趋势,高温阻碍了PSⅡ中心类囊体能量的传递,发生不可逆的失活。但也有研究[14-15]发现:生长温度的升高会增加树木的净光合速率,叶片气孔导度则不受影响。Way等[16]研究表明:温带落叶树种在比其正常生长温度提升5 ~ 9 ℃的高温环境下,碳同化量显著增加,净光合速率提升,光合作用能力增强。以上研究表明不同植物光合生理的变化可能与升温程度有关。此外,植物光合作用对高温胁迫的响应还受内在因素调控。吴韩英等[17]在甜椒(Capsicum frutescens)中发现:高温胁迫降低了净光合速率,当温度为35 ~ 40 ℃时,Fv/Fm的值没有显著变化,叶片光合作用受到抑制是气孔因素引起的;而45 ~ 50 ℃高温时,甜椒Fv/Fm值大幅下降,光合速率的降低是由非气孔因素造成的。尹赜鹏等[18]通过对比番茄(Lycopersicon esculentum)光合生理特性对不同高温处理的响应发现:与25 ℃相比,30 ~ 35 ℃下番茄叶片光合能力的降低主要是气孔因素引起,此时番茄可通过增加非光化学淬灭参数−热耗散系数(NPQ)来缓解光抑制;然而,当温度上升为40 ℃,光合能力的降低则主要由非气孔效应引起。由此可见,高温程度与光合生理的内在调控机制可能存在耦合。然而,Zubaidi等[19]结果表明:高温胁迫下小麦(Triticum aestivum)的气孔导度下降,光合电子传递受阻,量子通量较低,光合速率的下降是气孔和非气孔效应协同作用的结果。因此,有必要进一步探索光合生理对不同程度高温胁迫响应的内在调控机制,以及二者间的关系。
我国开展高温抗性方面的研究较早,主要以草本、农作物、宿根花卉为主[13,20]。然而,全球气候持续变暖条件下,对分布较广的落叶栎类幼苗光合系统对高温胁迫的响应的研究较少[21]。栎属(Quercus)树种是温带及亚热带落叶阔叶林的优势组成成分,在亚欧大陆从10°S印度尼西亚的爪哇岛直到62°N北欧的斯堪迪纳亚半岛附近均有分布[22-23]。栎属树种在国内外被广泛应用于水源涵养和水土保持,也是重要的珍贵用材树种,其叶片、果实、栓皮等具有重要的工业、商业和药用价值[24-25]。栎类自种子萌发成苗到实现定居,是其生活史中最为脆弱的阶段[26],若此时经历高温胁迫,可能引起其光合速率降低,碳同化下降,进而影响其苗木建成和生长发育[27-28]。此外,许多关于热应激的试验受控条件都使用了短期胁迫[29],而鲜少见有关于持续高温胁迫对栎类幼苗的影响研究。
栓皮栎(Quercus variabilis)和锐齿槲栎(Quercus aliena var. acuteserrata )是天然分布近乎一致的常见本土落叶栎属树种[30-31],在全国20余省均有分布。其主根发达,适应性强,且耐干旱瘠薄,常用作绿化、防护树种,具有十分重要的经济价值和生态价值[32-33]。与锐齿槲栎相比,栓皮栎的木材硬度更强,淀粉含量较高。另有部分研究指出:锐齿槲栎是不耐荫树种,更新过程中具有只见幼苗不见幼树的重要特点[32]。然而,尚未有研究探究二者光合生理对高温胁迫的响应。本文以栓皮栎与锐齿槲栎为研究对象,设3个温度梯度,通过测定胁迫前后叶绿素荧光参数、气体交换参、以及快速光响应曲线等的变化,探究2种落叶栎幼苗光合生理特性对高温胁迫的响应,以及其内在调控机制与升温间的关系。本研究可为高温条件下落叶栎类幼苗的培育和耐热性树种的筛选提供理论参考。
1. 材料与方法
1.1 试验材料
2019年8月进行采种,栓皮栎种子来自北京市鹫峰林场及大觉寺的天然林,锐齿槲栎种子来自河南省天宝池及山西省运城天然林。所采种子用50 ℃温水浸泡1 h,以杀死潜藏在种子内的象鼻虫幼虫和虫卵,并摒弃漂浮在水面上的劣种,剩余种子沥水后平铺在吸水纸上,置于阴凉地方阴干12 h,随后装入带有透气孔的塑料自封袋,置于2 ℃冷藏柜中保存[23]。播种前2周,选择层积催芽法进行催芽。2020年4月10日,于北京市鹫峰北京林业大学鹫峰温室(40°03′54″N、116°05′45″E)进行播种。挑选催芽后均匀饱满、有光泽且稍露胚根的种子播种到阔叶树专用育苗容器D60(上口直径6.4 cm,深35.6 cm,体积983 mL,Stuewe & Sons, Inc., Oregon, USA)。基质为按体积比例3∶1充分混合均匀的草炭土与蛭石,并将精准奥绿肥(20 g/株,15% N + 9% P2O5 + 12% K2O + 2% MgO + truce element)及稀释600倍的多菌灵与基质均匀混合装入容器中。每个树种90株,10盘;2树种共180株,20盘。
1.2 试验设计
试验开始前,先将苗木置于室外7 d以适应自然环境条件。设置3个温度梯度:27 ℃(对照,CK)、35 ℃(HT1)、42 ℃(HT2)。2种栎树苗共6个处理,每个处理30株一年生幼苗,合计180株苗木。2020年8月3日起进行高温处理。高温胁迫处理期锐齿槲栎和栓皮栎幼苗生长形态特征如图1所示。按照树种和处理的不同,将幼苗分别放入3个人工模拟气候室,空调及制热器控温,相对湿度日变化范围为48% ~ 85%,其他环境条件一致,控制浇水频率使各温度处理土壤相对湿度均保持在65% ~ 70%之间。每天6 h(11:00—17:00)的高温胁迫之后恢复室温,连续8 d(北京市近30年来年均高温天数为8.3 d)。利用温湿度电子记录仪进行温度监测,每5 s记录一次读数,胁迫期间24 h不间断记录(图2)。
![]() 图 1 高温胁迫处理期锐齿槲栎(A)和栓皮栎幼苗(B)生长形态特征CK为对照组(27 ℃),HT1为35 ℃处理组,HT2为42 ℃处理组。下同。CK is control group (27 ℃),HT1 is 35 ℃ treatment group,HT2 is 42 ℃ treatment group. The same below.Figure 1. Growth and morphology characteristics of Quercus aliena var. acuteserrata (A) and Quercus variabilis (B) seedlings under high temperature stress
图 1 高温胁迫处理期锐齿槲栎(A)和栓皮栎幼苗(B)生长形态特征CK为对照组(27 ℃),HT1为35 ℃处理组,HT2为42 ℃处理组。下同。CK is control group (27 ℃),HT1 is 35 ℃ treatment group,HT2 is 42 ℃ treatment group. The same below.Figure 1. Growth and morphology characteristics of Quercus aliena var. acuteserrata (A) and Quercus variabilis (B) seedlings under high temperature stress1.3 指标测定
随机选择各处理下长势相似的幼苗中部叶位的成熟、全展叶片,于胁迫结束时(试验开始第8天)测定快速光响应曲线、叶绿素荧光参数(Fv/Fm、Fy、NPQ、YⅡ、qP)及气体交换参数(Pn、Gs、Ci、Tr),并在胁迫结束一周后(试验开始第15天)再次测定气体交换参数。
1.3.1 叶绿素荧光参数
采用MINI-PAM-Ⅱ叶绿素荧光仪测定叶片叶绿素荧光参数。将光纤连接到一个叶片暗适应夹上,使样品免受环境光的影响。测定栓皮栎和锐齿槲栎幼苗叶片前暗适应20 min,然后打开测量光,紧接着打开一个持续时间仅有1.5 s的饱和脉冲,荧光迅速达到PSⅡ初级光化学的最大量子产率。在经过暗适应并测定最大光量子产量(Fv/Fm)和荧光量子产率(Fy)后,打开光化光,对栎类幼苗样品叶片进行光量子能量为600 μmol/(m2·s)的光照射,进行叶绿素荧光诱导,间隔30 s打开一个饱和脉冲,测量出的
F′m 、F′o 和Fy可以求出在当前的光照状态下光系统Ⅱ的实际量子产率(YⅡ)、NPQ和光化学淬灭参数(qP)。三者计算公式为[34]:YII=ΦPSII=ΔFy/F′m=(F′m−Fy)/F′m (1) NPQ=(Fm−F′m)/F′m=Fm/F′m−1 (2) qP=(F′m−Fy)/F′v=1−(Fy−F′o)/(F′m−F′o) (3) 1.3.2 气体交换参数
采用LI-6400XT系列便携式光合仪,于上午10:00—11:30在开放模式下测定了叶片的气体交换参数:净光合速率(Pn)、气孔导度(Gs)、胞间CO2 浓度(Ci)和蒸腾速率(Tr)。设定光合有效辐射(PAR)为1 000 μmol/(m2·s),温度为28 ℃,CO2浓度为400 μmol/(m2·s),空气相对湿度为50% ~ 70%。并根据测得的气体交换参数计算叶片水分利用效率(WUE),计算公式为:
WUE=Pn/Tr (4) 1.3.3 快速光响应曲线的测定
利用MINI-PAM-Ⅱ叶绿素荧光仪的调制叶绿素荧光技术测定快速光响应曲线(RLC)。PAR梯度为0、23、45、66、92、128、196、295、435、650、850 μmol/(m2·s),每个梯度持续20 s并打开饱和脉冲测量相对电子传递速率(rETR),rETR随光强的变化曲线即为快速光响应曲线[35]。在得出一条典型的快速光曲线后,为了对其进行定量化描述,需要进行非线性曲线拟合。本文中运用的快速光曲线拟合方程为[36]:
P=PAR/(a⋅PAR2+b⋅PAR+c) (5) α=1/c,rETRmax (6) 式中:P即为rETR,rETRmax代表无光抑制时的最大潜在相对电子传递速率,α是快速光曲线的初始斜率,代表光能利用效率。a、b、c为非线性曲线拟合方程参数。
1.4 数据处理
树种和温度(和时间)及交互对叶绿素荧光参数(或气体交换参数)的影响通过双因素(或三因素)方差分析评估。若数据不满足方差分析条件,则先进行对数或平方根转换。当方差分析结果显著,则通过FISHER LSD检验进行多重比较(α = 0.05)。采用Eilers and Peeters模型进行非线性回归分析,计算快速光响应曲线的相关参数并进行拟合。利用Excel 2016进行数据处理,采用SPSS 19.0进行数据统计分析,运用ORIGIN2018作图。
2. 结果与分析
2.1 高温胁迫对叶绿素荧光参数的影响
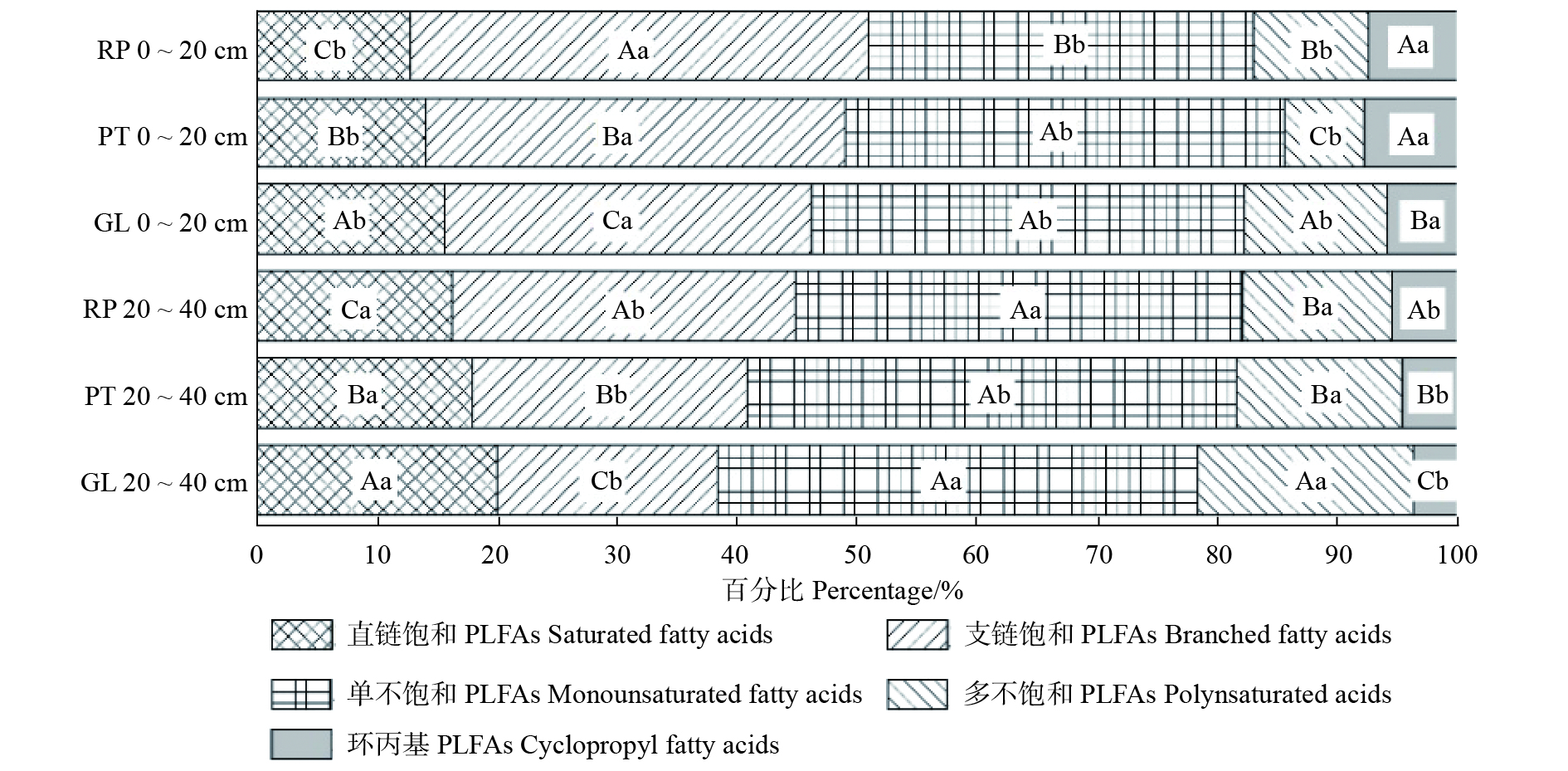
高温胁迫能显著影响2种栎树的Fy、YⅡ、qP值(图3、表1)。与CK相比,高温胁迫使锐齿槲栎的Fy和YⅡ值分别下降了44.4% ~ 45.8%和60.0% ~ 65.0%,栓皮栎的Fy和YⅡ值分别下降了33.9% ~ 41.6%和71.4% ~ 76.2%,而高温胁迫处理间差异不显著。此外,2种栎树的qP值对高温胁迫的响应不同(图3、表1)。随着温度的升高,锐齿槲栎的qP值表现出先上升后降低的趋势。与CK相比,当温度为HT1时,qP值显著提高了7.2%;当温度为HT2时,qP值显著降低了5.8%。然而,栓皮栎的qP值随温度的升高逐步下降,与CK相比,高温胁迫使qP值降低了18.5% ~ 34.6%。高温胁迫对2种栎树的Fv/Fm和NPQ值则无显著影响(表1)。
![]() 图 3 树种与温度对栓皮栎和锐齿槲栎幼苗Fy(A),YII(B),qP(C)值的影响Fy. 荧光量子产率;YII. 实际量子产率;qP. 光化学淬灭参数;QA. 锐齿槲栎;QV. 栓皮栎。不同小写字母表示处理间差异显著。下同。Fy, fluorescence yield; YII, actual quantum yield; qP, photochemical quenching parameter; QA, Quercus aliena var. acuteserrata; QV, Quercus variabilis. Different lowercase letters indicate significant differences between treatments. The same below.Figure 3. Effects of tree species and temperature on Fy(A), YII(B), qP(C) of Q. variabilis and Q. aliena var. acuteserrata seedlings at nursery表 1 温度、树种及交互效应对栓皮栎和锐齿槲栎幼苗叶绿素荧光参数值的影响Table 1. Effects of temperature, tree species and interaction on chlorophyll fluorescence parameters of Q. variabilis and Q. aliena var. acuteserrata seedlings
图 3 树种与温度对栓皮栎和锐齿槲栎幼苗Fy(A),YII(B),qP(C)值的影响Fy. 荧光量子产率;YII. 实际量子产率;qP. 光化学淬灭参数;QA. 锐齿槲栎;QV. 栓皮栎。不同小写字母表示处理间差异显著。下同。Fy, fluorescence yield; YII, actual quantum yield; qP, photochemical quenching parameter; QA, Quercus aliena var. acuteserrata; QV, Quercus variabilis. Different lowercase letters indicate significant differences between treatments. The same below.Figure 3. Effects of tree species and temperature on Fy(A), YII(B), qP(C) of Q. variabilis and Q. aliena var. acuteserrata seedlings at nursery表 1 温度、树种及交互效应对栓皮栎和锐齿槲栎幼苗叶绿素荧光参数值的影响Table 1. Effects of temperature, tree species and interaction on chlorophyll fluorescence parameters of Q. variabilis and Q. aliena var. acuteserrata seedlings变化来源 Source of variation Fv/Fm Fy YII qP NPQ F P F P F P F P F P 树种 Tree species 0.225 0.639 0.122 0.729 2.114 0.156 8.332 0.007 5.901 0.021* 温度 Temperature 0.319 0.729 29.740 < 0.001** 134.87 < 0.001** 93.427 < 0.001** 0.403 0.672 树种 × 温度 Tree species × temperature 0.063 0.939 0.063 0.628 0.956 0.396 54.873 < 0.001** 2.466 0.102 注:Fv/Fm. 最大光量子产量;NPQ. 热耗散系数。**表示在P < 0.01 水平上有显著性差异,*表示在P < 0.05水平上有显著差异。下同。Notes: Fv/Fm, maximum light quantum yield; NPQ, heat dissipation coefficient. ** means significant difference at P < 0.01 level, * means significant difference at P < 0.05 level. The same below. 2.2 高温胁迫对气体交换参数的影响
高温胁迫能显著影响2种栎树的Pn、Gs和Ci(表2、表3)。胁迫结束后,与CK相比,高温胁迫使锐齿槲栎的Pn显著降低了23.3% ~ 29.9%,高温处理间差异不显著;当温度为HT1时,栓皮栎的Pn显著下降了31.8%,当温度继续升高到HT2,栓皮栎的Pn与CK差异不显著。胁迫结束7 d后,高温胁迫对2种栎树Pn的影响不显著。随着温度的升高,锐齿槲栎表现出上升的趋势而栓皮栎表现出下降的趋势。
表 2 高温胁迫后栓皮栎和锐齿槲栎幼苗的气体交换特征参数Table 2. Gas exchange parameters of Q. variabilis and Q. aliena var. acuteserrata seedlings after high temperature stress时间 Time 变异来源
Source of variationPn/(μmol·m−2·s−1) Gs/(mmol·m−2·s−1) Ci/(μmol·mol−1) Tr/(g·m−2·h−1) WUE/(μmol·g−1) 胁迫后1 d
1 d after stressQACK 7.95 ± 0.25a 0.08 ± 0.010ab 241.07 ± 6.74abcde 1.54 ± 0.13bcd 5.46 ± 0.46a QAHT1 5.57 ± 0.40cde 0.06 ± 0.010bcde 229.20 ± 7.44cdef 1.52 ± 0.13bcd 3.72 ± 0.14cd QAHT2 6.10 ± 0.39bcd 0.08 ± 0.010abc 246.08 ± 7.66abc 1.85 ± 0.17ab 3.37 ± 0.16d QVCK 6.28 ± 0.65bcd 0.07 ± 0.010bcd 257.83 ± 10.72ab 1.47 ± 0.10bcde 4.21 ± 0.24bcd QVHT1 4.28 ± 0.51f 0.05 ± 0.010f 217.18 ± 9.26f 1.10 ± 0.13e 3.90 ± 0.22cd QVHT2 5.62 ± 0.35cde 0.06 ± 0.004cde 220.97 ± 6.05def 1.44 ± 0.09cde 3.93 ± 0.12bcd
胁迫后7 d
7 d after stressQACK 6.46 ± 0.35 bc 0.09 ± 0.010a 240.57 ± 7.51bcde 1.43 ± 0.14cde 4.84 ± 0.61ab QAHT1 6.78 ± 0.37 abc 0.08 ± 0.010 ab 242.34 ± 6.56abcd 1.78 ± 0.11abc 3.84 ± 0.15cd QAHT2 7.18 ± 0.58 ab 0.10 ± 0.010 a 253.13 ± 10.40ab 2.07 ± 0.22a 3.61 ± 0.25d QVCK 5.73 ± 0.56 cde 0.07 ± 0.010 bcd 262.80 ± 7.41a 1.34 ± 0.13de 4.60 ± 0.64abc QVHT1 5.05 ± 0.51 def 0.05 ± 0.010 def 220.35 ± 4.70ef 1.49 ± 0.18bcde 3.52 ± 0.16d QVHT2 4.47 ± 0.43 ef 0.05 ± 0.005 ef 230.12 ± 7.34cdef 1.36 ± 0.12de 3.32 ± 0.21d 注: Pn. 净光合速率;Gs. 气孔导度;Ci. 胞间二氧化碳浓度;Tr. 蒸腾速率;WUE. 水分利用效率。下同。Notes: Pn, net photosynthetic rate; Gs, stomatal conductance; Ci, intercellular carbon dioxide concentration; Tr, transpiration rate; WUE, water use efficiency. The same below. 表 3 树种、温度、时间及交互效应对栓皮栎和锐齿槲栎幼苗气体交换参数值的影响Table 3. Effects of tree species, temperature, time and interaction on gas exchange parameters ofQ. variabilis and Q. aliena var. acuteserrata seedlings变异来源 Source of variation Pn Gs Ci Tr WUE F P F P F P F P F P 树种 Tree species 29.277 < 0.001 41.882 < 0.001 2.529 0.116 16.316 < 0.001 1.439 0.234 温度 Temperature 6.872 0.002 7.666 0.001 8.891 < 0.001 3.263 0.043 15.866 < 0.001 时间 Time 0.006 0.936 2.449 0.121 1.86 0.176 1.213 0.274 0.562 0.456 树种 × 温度 Tree species × temperature 0.205 0.815 1.277 0.284 8.911 < 0.001 2.858 0.063 1.945 0.149 树种 × 时间 Tree species × time 1.172 0.282 4.471 0.037 0.008 0.929 0.168 0.683 0.091 0.763 温度 × 时间 Temperature × time 4.778 0.011 0.935 0.397 0.189 0.829 2.468 0.091 0.015 0.985 树种 × 温度 × 时间
Tree species × temperature × time3.017 0.054 0.622 0.539 0.268 0.765 0.549 0.580 2.238 0.113 胁迫结束后,高温胁迫对锐齿槲栎的Gs和Ci无显著影响,而显著影响栓皮栎的Gs和Ci。与CK相比,当温度为HT1时,栓皮栎的Gs和Ci分别降低了28.6%和15.8%;当温度升高到HT2,对栓皮栎的Gs影响不显著,而Ci显著降低(14.3%)。胁迫结束7 d后,高温胁迫对锐齿槲栎的Gs和Ci无影响,而显著降低了栓皮栎的Gs(28.6%)和Ci(12.4% ~ 16.2%)。
高温胁迫结束7 d后,与CK相比,HT2显著提高了锐齿槲栎的Tr(44.8%),除此之外,升温胁迫对Tr无显著影响(表2、表3)。然而,胁迫结束后,锐齿槲栎高温胁迫处理下的WUE比CK显著降低了31.9% ~ 38.3%,而栓皮栎差异不显著。当胁迫结束7 d后,2种栎树的WUE都显著降低。与CK相比,锐齿槲栎下降了20.7% ~ 25.4%,栓皮栎下降了23.5% ~ 27.8%(表2、表3)。
2.3 相对电子传递速率的光响应
快速光响应曲线能够在光能捕获和传递层面诠释光系统的实际状态[37]。2树种在不同高温胁迫下rETR的快速光曲线如图4所示:随高温胁迫的增强,2种幼苗rETR均呈梯度递减的趋势,整体上栓皮栎幼苗下降幅度大于锐齿槲栎幼苗。
利用Eilers和Peeters快速光响应模型对快速光响应曲线参数进行拟合,结果见表4。锐齿槲栎和栓皮栎幼苗在经过HT1、HT2高温胁迫后,其快速光响应曲线拟合出的电子传递速率潜在最大值(rETRmax)均显著降低。初始斜率值(α)一般用来反映光合器官对光能的利用效率,如表4所示:锐齿槲栎幼苗HT1(35 ℃)组的α大于HT2(42 ℃)组;栓皮栎幼苗在高温胁迫下光曲线的α均值由大到小依次为:QVHT2(0.23) > QVHT1(0.22) > QVCK(0.21),但整体差异相对较小。总体上,HT2高温组rETRmax值下降幅度最大,表明树种间42 ℃高温条件下差异最明显,锐齿槲栎幼苗的α值随高温胁迫的加强而下降。
表 4 快速光响应曲线拟合参数表Table 4. Fitting parameters of fast light response curves树种
Tree species处理组
Treatment grouprETRmax平均值
Average value of
rETRmaxα平均值
Average value
of αQA CK 30.63 0.2 HT1 19.44 0.18 HT2 16.26 0.16 QV CK 27.82 0.21 HT1 12.69 0.22 HT2 10.59 0.23 注:rETRmax和α平均值均为胁迫后7 d所测数值。Note: average values of rETRmax and α measured 7 d after stress. 3. 讨 论
3.1 栎类幼苗光合生理对高温胁迫的响应
本研究中,2种栎的Fv/Fm值始终保持在0.83以上,与多数健康维管束植物的Fv/Fm值相似[38],表明8 d的高温胁迫并未对光系统Ⅱ的活性潜力产生影响。这与先前许多乔木树种的研究结果一致[27,39]。然而,高温胁迫显著降低了2种栎树的F、YⅡ、qP和rETR值(图3、图4),表明高温胁迫增加了天线色素的光能耗散,降低了实际量子产率,进而削弱了电子传递速率[40-41]。然而,2种栎类幼苗的NPQ值对高温胁迫的响应不同,栓皮栎NPQ值随温度升高先增加后减少,锐齿槲栎则先减少后增加。赵丽丽等[42]研究指出:高温胁迫下高羊茅(Festuca arundinacea)叶片的NPQ值呈现先升高后降低的变化趋势。对杂交酸模(Rumex tianschanicus × Rumex patientia)叶片进行高温处理的结果也表明:单位叶面积吸收的光能会随着高温处理时间的延长而下降,进而导致单位叶面积热耗散增加[43]。徐建旭等[44]对温州蜜柑(Citrus unishiu)叶片进行高温处理后NPQ值显著下降。造成不同树种NPQ对高温胁迫响应差异的原因可能与叶黄素循环活性有关[45]。一般情况下,植物在高温等逆境胁迫下叶黄素循环的活性会明显增强,从而光合器官处理过剩光能的能力提高,具体表现为荧光淬灭值NPQ的升高,这与本研究中栓皮栎NPQ值的变化情况相同[46-47]。而锐齿槲栎NPQ值减少可能是因为其叶黄素循环机制中的紫黄质脱化环酶活性受环境高温的制约而降低,导致叶黄素的形成减少,进而降低了叶黄素循环活性[48-49]。另一方面,温度设定、树种特性、试验条件等不同也可能导致不同的响应结果[50]。
在所有气体交换指标中,Pn、Gs和Tr在树种间差异显著(P < 0.05),Pn随温度的升高而下降(表2、表3)。栓皮栎CK组的Gs、Pn指标均高于锐齿槲栎CK组,表明在无高温胁迫条件下栓皮栎净光合速率高,固碳能力强,生长较快(表2)。当温度升高到HT1,2树种的Pn和Gs显著降低,表明Pn和Gs间存在正相关关系[51]。此时,2栎类树种的Ci值降低,表明其为气孔限制。当温度升高到HT2,栓皮栎的Pn有下降趋势,而Gs与CK处理组相比呈降低趋势,此时,Ci值略有上升;而锐齿槲栎的Pn有升高趋势,Gs与CK无显著差异,此时,Ci值明显升高,表明42 ℃条件下栓皮栎和锐齿槲栎幼苗的光合作用能力与气孔对高温的反应无关,并且极有可能是由于幼苗叶片的电子传递速率受阻和量子产量的降低而产生的非气孔因素造成的[19,29]。这表明光合作用的内在调控机制与升温程度相关,相似结果在甜椒(Capsicum frutescens)、番茄(Lycopersicon esculentum)中都有报道[6,52]。在相对较低幅度的升温条件下,温暖的环境刺激了苗木的气孔关闭,气孔导度降低以减少水分散失,缓解高温胁迫对植物的影响。此时,进入植物的CO2浓度降低,碳同化量减少,光合速率下降,这主要是气孔因素限制了幼苗的光合能力;而在更高温度的胁迫条件下,气孔的开闭失去调控,叶肉细胞光合活性下降,此时,植物的捕光能力降低,电子传递受阻,碳同化过程中1,5-二磷酸核酮糖(RuBP)再生速率下降,这主要是非气孔因素限制了幼苗的碳同化能力[53-54]。然而,对火炬松(Pinus taeda)幼苗的研究表明气孔和非气孔效应的调控与温度无关[15]。温度设定、物种差异、试验条件等都是可能造成差异结果的原因[55]。
3.2 高温胁迫后栎类幼苗光合作用的受抑制恢复能力
本试验结果表明:温度显著影响了气体交换参数Pn、Gs
、Ci、Tr、WUE,并且在热胁迫解除一段时间(7 d)后,栓皮栎和锐齿槲栎幼苗的大部分生理生化指标恢复正常(表2、表3),这暗示了驯化和恢复机制有助于提升幼苗的耐热性[56]。Havaux[55]的研究证实:马铃薯(Solanum tuberosum)叶片的光合机制在经过35 ℃的亚高温锤炼后,不仅不会发生不可逆的失活,还能快速适应高温(> 40 ℃)胁迫的环境条件。本试验中结果出现差异的原因可能是试验条件或树种、基因型差异等造成的[55]。此外,本试验中随着温度升高,Tr呈先减少后增加趋势,WUE呈持续降低趋势,且胁迫一周后并未恢复。原因可能是:当温度升到HT1时,气孔导度的限制导致叶片的蒸腾速率也有所下降;当温度升到HT2时,蒸腾速率随之增强,幼苗在高温下能够利用蒸腾作用耗散热能,起到降温作用,从而保护叶片免受高温的危害[15,17]。Vu等[57]对甜橙(Citrus reticulata)幼树的高温光合适应研究表明:高温胁迫显著降低了叶片的WUE,这与张源达等[58]对高温胁迫下菊花品种(Chrysanthemum morifolium)光合特性的研究结果相一致,也与本试验结果相符合。原因可能是高温胁迫下栎类幼苗的光合作用受到气孔导度降低、衰老加速、源库关系改变的限制,进而导致净光合速率下降[59-60]。而二者比值即WUE也呈下降趋势,说明幼苗的高温适应力通常与水资源利用率降低有关,并且高温更容易造成植物的水分流失[61-62]。在胁迫恢复7 d后,2树种净光合速率的变化在高温处理(HT1、HT2)与CK间没有显著差异,表明该试验条件下,高温胁迫并未对光合作用造成不可逆伤害,这虽与计玮玮等[63]的研究结果相悖,但与Haldimann等[24]、孙宪芝等[64]的研究一致。 本试验发现,光合作用的内在调控机制与升温程度相关。在HT1处理下,2树种Pn、Gs和Ci均显著降低,表明较低程度的升温(< 35 ℃)条件下,2栎树幼苗通过降低气孔导度以减少水分散失,可缓解高温胁迫对其负面影响。在HT2处理下,2种栎树的Fy、YⅡ、qP和rETR值显著降低,Gs值未升高,而Ci值呈上升趋势,表明极端高温(> 40 ℃)导致幼苗叶片气孔开闭失去调控,叶肉细胞活性下降,捕光能力降低,从而降低了PSⅡ实际量子产率,削弱了电子传递速率,最终造成2栎树幼苗光合能力持续下降。此外,在热胁迫(HT2)解除一段时间(7 d)后,栓皮栎和锐齿槲栎幼苗的大部分生理生化指标恢复正常,表明其叶片光合作用的最佳温度可能会随着大气温度的增加而升高。然而,本研究中并未考虑高温胁迫下2栎树的生化反应,以及对生长的影响。另外,本研究模拟的高温胁迫为稳定持续的,而自然环境中的极端高温出现可能是间断的、非稳态的,故而有必要进一步对2种栎树生理生化及生长等指标进行动态监测,探究在非稳态极端高温胁迫下2栎树幼苗的响应状况,为筛选耐逆性树种提供参考。
4. 结 论
本研究探究了栓皮栎和锐齿槲栎幼苗光合生理特性对高温胁迫的响应,结果将为其内在调控机制的后续探究奠定前期理论基础。结果表明:(1)高温胁迫显著降低了2种栎类幼苗光系统Ⅱ的YⅡ、qP、rETR值。(2)35 ℃时,2种栎类幼苗的Pn、Gs、Ci值均显著降低,表明其光合抑制作用的主要因素是气孔限制;42 ℃时,2种栎类幼苗的Pn值呈下降趋势,而Gs和Ci值均未降低,表明2种栎类幼苗光合能力的降低主要由非气孔因素引起。(3)锐齿槲栎幼苗不仅在高温逆境下能维持较高的电子传递速率,保持相对较高的光合作用潜力;其胁迫后实际光合转化效率(YⅡ)波动幅度、胁迫解除后的气体交换指标(Pn、Gs、Ci、Tr)恢复状况均比栓皮栎稳定性更高,因此锐齿槲栎幼苗在高温胁迫环境下耐受力更强。
-
表 1 样地基本信息
Table 1 General information of sample sites
植被 Vegetation 坡度
Slope gradient/(°)坡向
Slope aspect/(°)树龄/a
Stand age/year密度/(株·hm− 2) Density/(tree·ha− 1) 树高
Tree height/m胸径 DBH/cm 生物量/(t·hm− 2) Biomass/(t·ha− 1) 刺槐林
Robinia pseudoacacia forest (RP)25 ES32 19 1 550 9.3 15.7 4.628 油松林
Pinus tabuliformis forest (PT)23 ES36 19 1 175 9.6 12.3 4.281 荒草地
Grassland (GL)20 ES37 注:ES表示东南方向。Note: ES means southeast direction. 表 2 不同植被下土壤的化学性质
Table 2 Soil chemical properties under different vegetations
土壤参数
Soil parameter0 ~ 20 cm 20 ~ 40 cm RP PT GL RP PT GL pH 7.55 ± 0.01 Bb 7.53 ± 0.02 Bb 7.74 ± 0.01 Ab 7.64 ± 0.02 Ba 7.61 ± 0.02 Ba 7.89 ± 0.01 Aa 有机质
Organic matter (OM)/(g.kg− 1)10.41 ± 0.03 Aa 8.89 ± 0.02 Ba 5.47 ± 0.04 Ca 8.38 ± 0.02 Bb 9.11 ± 0.01 Ab 5.5 ± 0.04 Ca 全氮
Total nitrogen (TN)/(g.kg− 1)0.97 ± 0.04 Aa 0.84 ± 0.02 Ba 0.70 ± 0.02 Ca 0.67 ± 0.01 Ab 0.62 ± 0.02 Bb 0.48 ± 0.02 Cb 全磷
Total phosphorus (TP)/(g.kg− 1)0.61 ± 0.00 Aa 0.60 ± 0.00 Ba 0.56 ± 0.00 Cb 0.60 ± 0.00 Aa 0.58 ± 0.00 Cb 0.59 ± 0.00 Ba 全钾
Total potassium (TK)/(g.kg− 1)10.62 ± 0.49 Ba 11.88 ± 0.26 Aa 7.62 ± 0.56 Ca 9.02 ± 0.16 Ab 8.27 ± 0.11 Bb 6.41 ± 0.43 Cb 速效氮
Available nitrogen (AN)/(mg.kg− 1)16.26 ± 0.06 Aa 12.77 ± 0.09 Bb 12.28 ± 0.01 Ca 14.9 ± 0.09 Ab 13.48 ± 0.03 Ba 10.08 ± 0.13 Cb 有效磷
Available phosphorus (AP)/(mg.kg− 1)5.29 ± 0.03 Aa 5.13 ± 0.05 Ba 4.48 ± 0.03 Cb 5.24 ± 0.01 Aa 5.12 ± 0.00 Ba 5.05 ± 0.01 Ca 速效钾
Available potassium (AK)/(mg.kg− 1)116.26 ± 1.67 Ba 121.47 ± 0.89 Aa 83.82 ± 0.32 Cb 92.72 ± 0.42 Bb 117.22 ± 1.38 Ab 90.32 ± 0.49 Ca 注:同一指标下,大写字母表示同一土层深度不同植被间差异显著(P < 0.05),小写字母表示同一植被不同土层间差异显著(P < 0.05)。下同。Notes: under the same indicator, uppercase letters indicate significant differences between different vegetation types within the same soil depth (P < 0.05), and lowercase letters indicate significant differences between different soil depths of the same vegetation type (P < 0.05). Same as below. 表 3 不同植被下土壤微生物PLFA总量
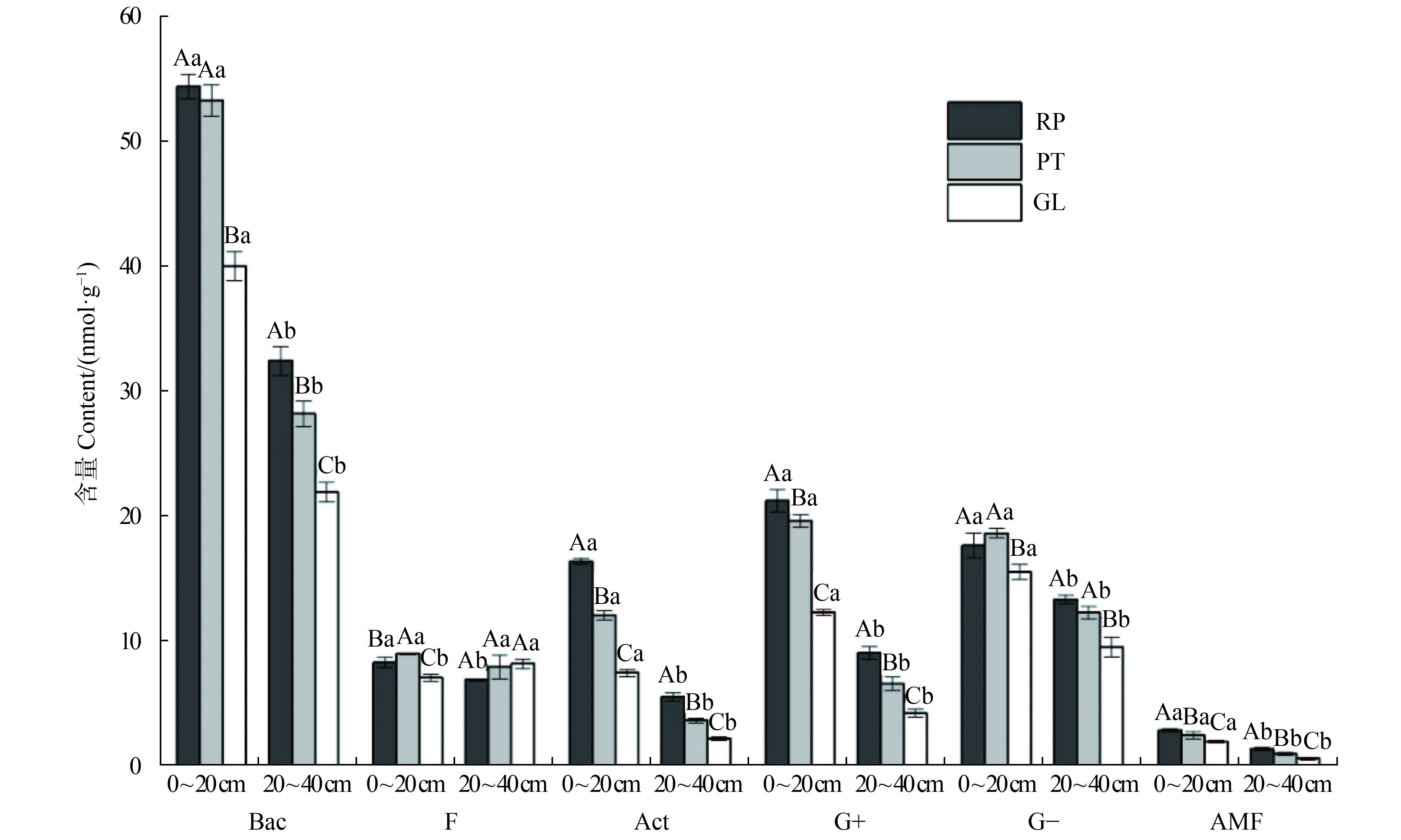
Table 3 Total amount of soil microbial PLFA under different vegetations
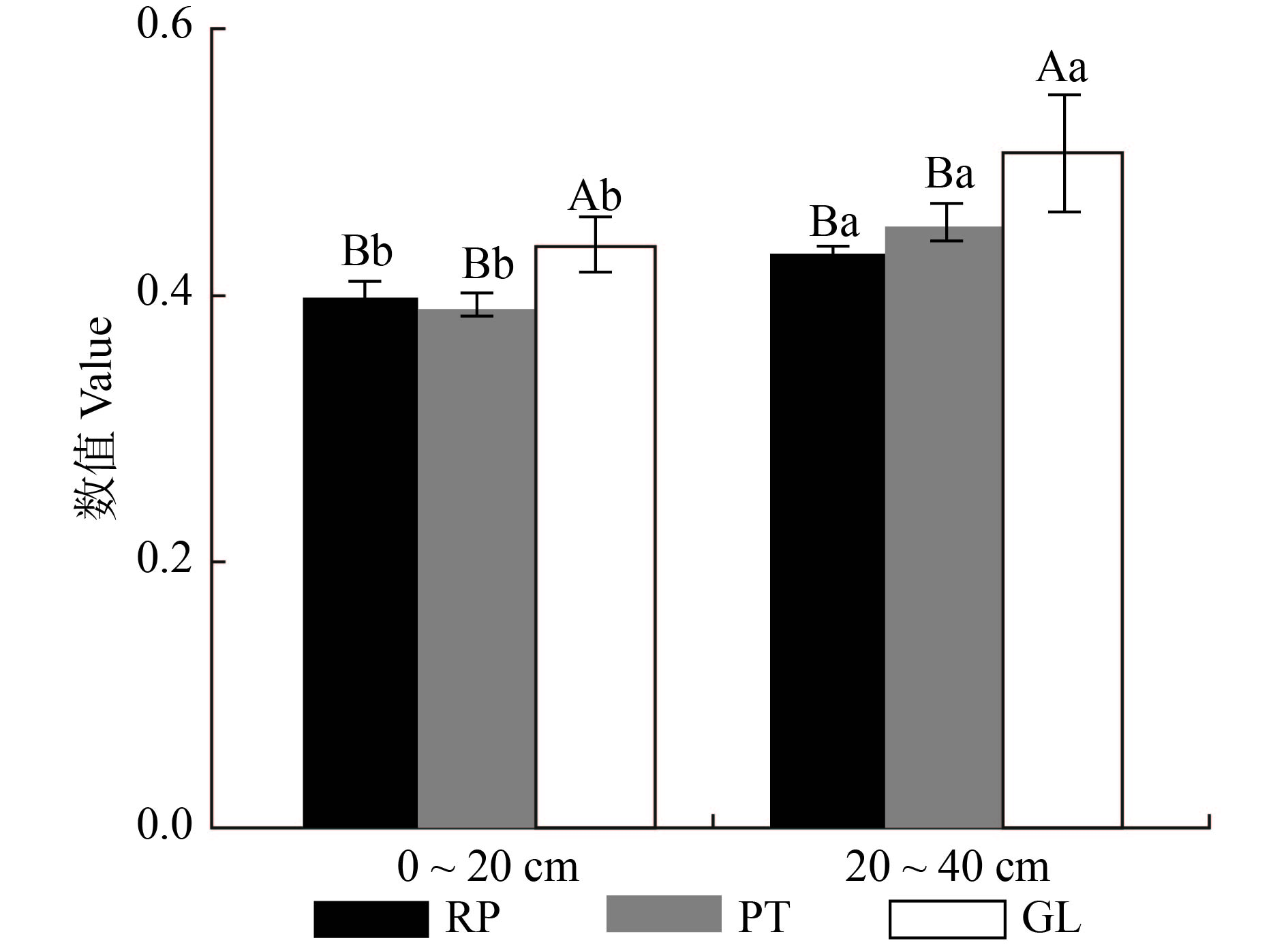
nmol/g 项目 Item 0 ~ 20 cm 20 ~ 40 cm RP PT GL RP PT GL PLFA总量 Total PLFA 110.38 ± 1.77 Aa 97.00 ± 2.33 Ba 75.24 ± 1.12 Ca 59.93 ± 1.24 Ab 50.27 ± 1.46 Bb 39.66 ± 0.84 Cb 表 4 不同植被下土壤微生物PLFA多样性指数
Table 4 Soil microbial PLFA diversity index under different vegetations
多样性指数 Diversity index 0 ~ 20 cm 20 ~ 40 cm RP PT GL RP PT GL Shannon-Wiener指数 Shannon-Wiener index 3.32 ± 0.03 Aa 3.31 ± 0.01 Aa 3.20 ± 0.01 Ba 3.16 ± 0.02 Ab 3.04 ± 0.01 Bb 2.93 ± 0.02 Cb Simpson指数 Simpson index 0.95 ± 0.00 Aa 0.95 ± 0.00 Aa 0.94 ± 0.00 Ba 0.94 ± 0.00 Ab 0.93 ± 0.0 0Bb 0.92 ± 0.00 Cb Pielou指数 Pielou index 0.87 ± 0.01 Aa 0.87 ± 0.00 Aa 0.84 ± 0.00 Ba 0.82 ± 0.00 Ab 0.80 ± 0.00 Bb 0.77 ± 0.01 Cb 表 5 土层、植被类型及其交互作用对微生物群落结构的影响(P值)
Table 5 Effects of soil depths, vegetation types and their interactions on microbial community structure (P values)
因子 Factor Bac F Act G+ G− AMF 植被类型 Vegetation type (VT) < 0.001 0.012 < 0.001 < 0.001 < 0.001 < 0.001 土层 Soil depth (SD) < 0.001 0.072 < 0.001 < 0.001 < 0.001 < 0.001 VT × SD < 0.001 0.001 < 0.001 < 0.001 0.038 0.652 表 6 不同植被在主成分1和主成分2上的得分
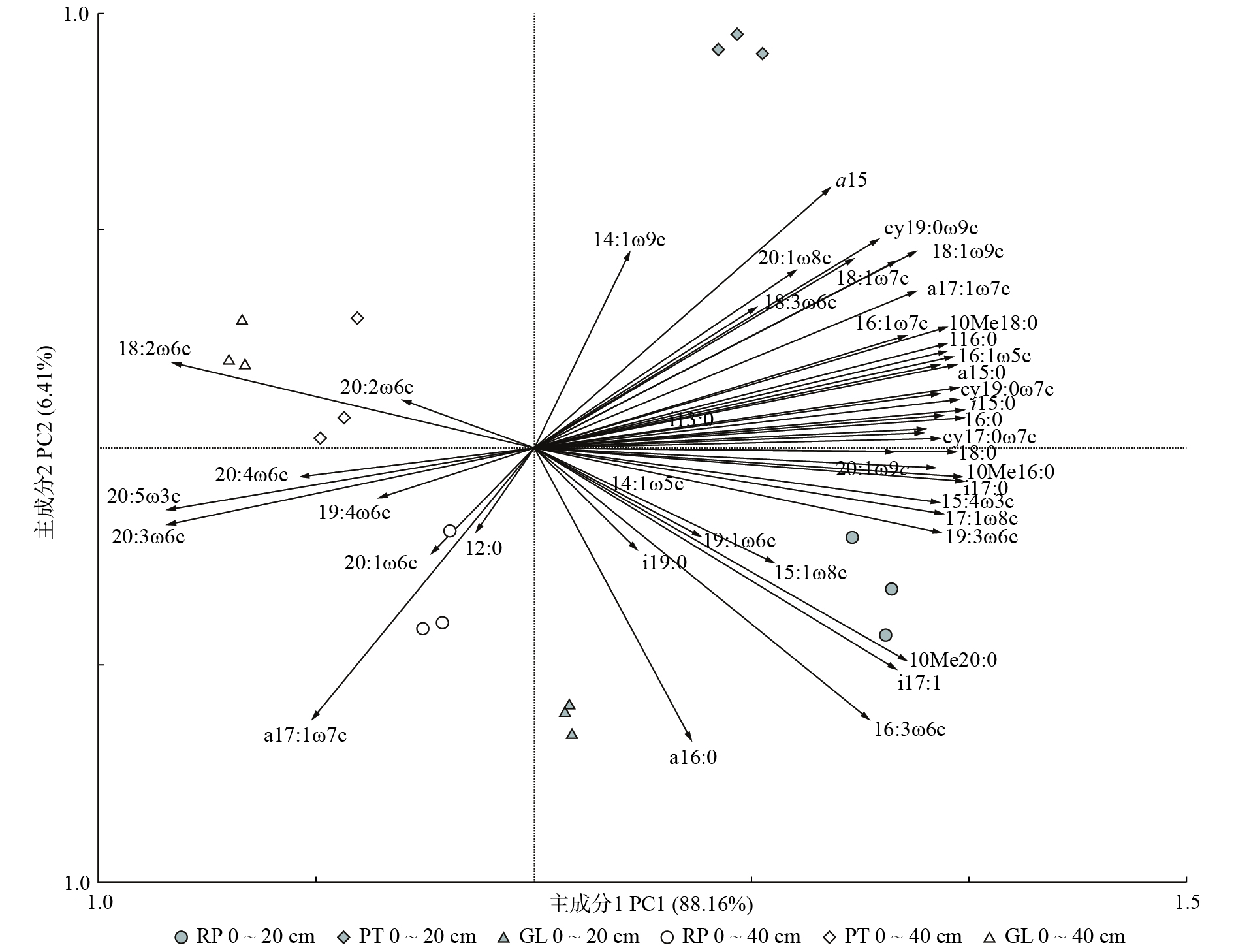
Table 6 Scores of different vegetations in PC1 and PC2
主成分 Principal component 0 ~ 20 cm 20 ~ 40 cm RP PT GL RP PT GL 主成分1 PC1 1.59 ± 0.02 Aa 0.88 ± 0.10 Ba 0.14 ± 0.01 Ca − 0.40 ± 0.06 Ab − 0.90 ± 0.08 Bb − 1.30 ± 0.04 Cb 主成分2 PC2 − 0.60 ± 0.12 Ba 1.83 ± 0.05 Aa − 1.20 ± 0.07 Cb − 0.70 ± 0.24 Ba 0.25 ± 0.29 Ab 0.42 ± 0.11 Aa 表 7 土壤微生物群落结构与土壤化学性质间的相关系数
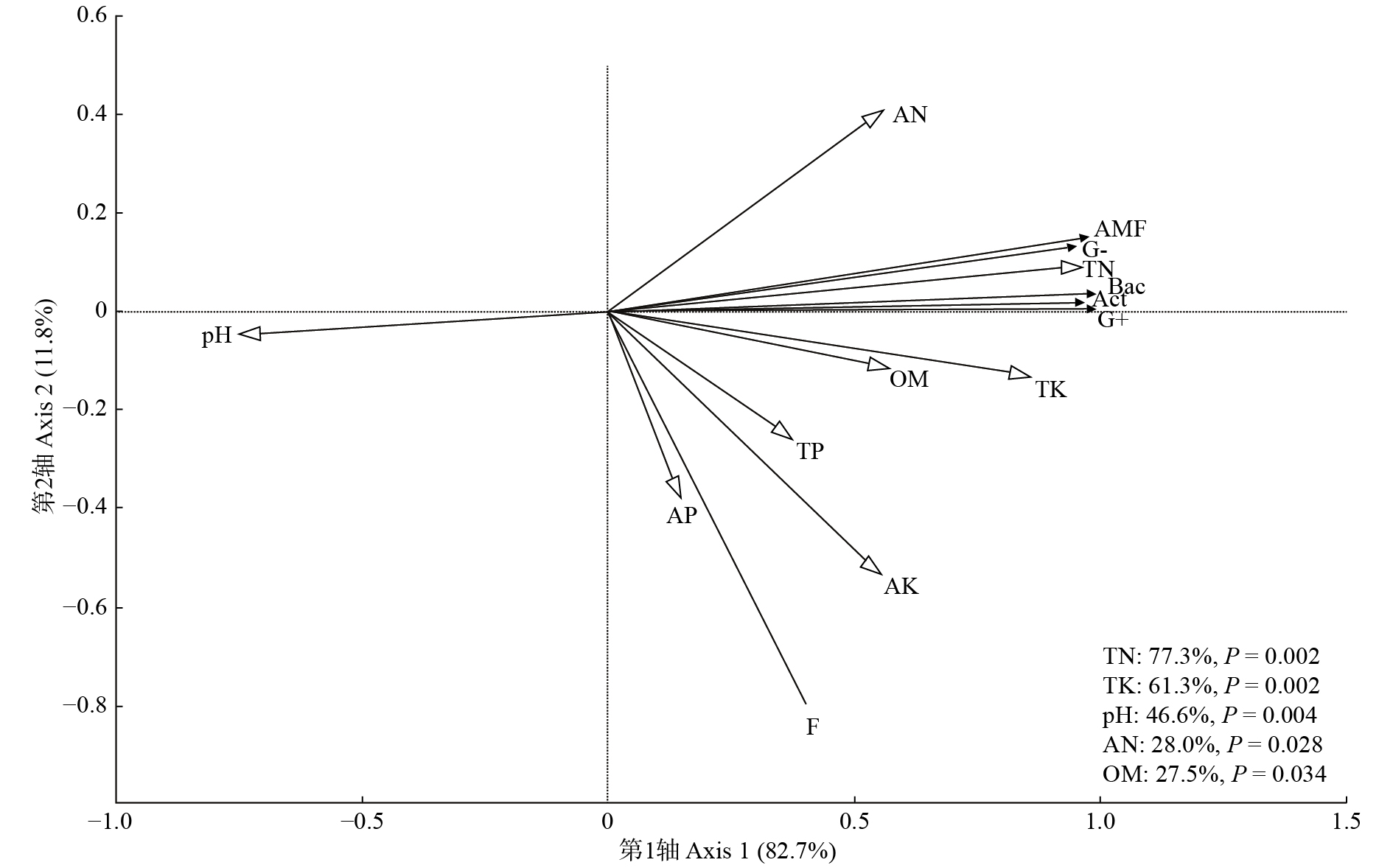
Table 7 Correlation coefficients between soil microbial community structure and soil chemical properties
土壤化学性质
Soil chemical propertyBac F Act G+ G− AMF pH − 0.753** − 0.270 − 0.710** − 0.741** − 0.776** − 0.707** OM 0.553* 0.322 0.618** 0.573* 0.510* 0.520* TN 0.958** 0.316 0.975** 0.965** 0.903** 0.959** TP 0.349 0.351 0.449 0.400 0.251 0.310 TK 0.860** 0.461 0.802** 0.854** 0.855** 0.787** AN 0.552* − 0.114 0.642** 0.565* 0.527* 0.594** AP 0.113 0.355 0.233 0.165 0.021 0.058 AK 0.526* 0.663** 0.526* 0.537* 0.491* 0.437 注:标粗的数据表示差异显著,**表示在P < 0.01水平上差异显著,*表示在P < 0.05水平上差异显著。Notes: bold data indicate a significant difference, ** indicates significant difference at P < 0.01 level, * indicates significant difference at P < 0.05 level. -
[1] 胡婵娟, 郭雷. 植被恢复的生态效应研究进展[J]. 生态环境学报, 2012, 21(9):1640−1646. doi: 10.3969/j.issn.1674-5906.2012.09.023 Hu C J, Guo L. Advances in the research of ecological effects of vegetation restoration[J]. Ecology and Environmental Sciences, 2012, 21(9): 1640−1646. doi: 10.3969/j.issn.1674-5906.2012.09.023
[2] 胡建忠, 朱金兆. 黄土高原退化生态系统的恢复重建方略[J]. 北京林业大学学报(社会科学版), 2005, 4(1):13−19. doi: 10.3969/j.issn.1671-6116.2005.01.003 Hu J Z, Zhu J Z. Tactics of vegetation restoration and reconst-ruction for degraded ecosystem in the Loess Plateau[J]. Journal of Beijing Forestry University (Social Sciences), 2005, 4(1): 13−19. doi: 10.3969/j.issn.1671-6116.2005.01.003
[3] 汪滨, 张志强. 黄土高原典型流域退耕还林土地利用变化及其合理性评价[J]. 农业工程学报, 2017, 33(7):235−245. Wang B, Zhang Z Q. Land use change driven by sloping land conversion program in typical watershed on Loess Plateau and its rationality evaluation[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(7): 235−245.
[4] 赵阳, 余新晓. 黄土丘陵沟壑区典型流域气候和土地利用变化对径流泥沙产量的影响[J]. 北京林业大学学报, 2013, 35(3):39−45. Zhao Y, Yu X X. Effects of climate variation and land use change on runoff-sediment yield in typical watershed of loess hilly-gully region[J]. Journal of Beijing Forestry University, 2013, 35(3): 39−45.
[5] 张学霞, 陈丽华. 黄土高原地区流域景观格局对水土流失的影响分析[J]. 北京林业大学学报, 2008, 30(增刊2):95−102. Zhang X X, Chen L H. Effects of watershed landscape pattern on soil and water loss in the Loess Plateau Region[J]. Journal of Beijing Forestry University, 2008, 30(Suppl.2): 95−102.
[6] 李梁, 张建军, 陈宝强, 等. 晋西黄土区封禁小流域植被群落特征变化[J]. 北京林业大学学报, 2017, 39(10):78−89. Li L; Zhang J J, Chen B Q, et al. Changes of vegetation commu-nity characteristics in closed small watershed of the Loess Plateau in western Shanxi Province, northern China[J]. Journal of Beijing Forestry University, 2017, 39(10): 78−89.
[7] 胡婵娟, 傅伯杰, 刘国华, 等. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性[J]. 生态学报, 2009, 29(2):727−733. doi: 10.3321/j.issn:1000-0933.2009.02.022 Hu C J, Fu B J, Liu G H, et al. Soil microbial functional and diversity under typical artificial woodlands in the hilly area of the Loess Plateau[J]. Acta Ecologica Sinica, 2009, 29(2): 727−733. doi: 10.3321/j.issn:1000-0933.2009.02.022
[8] Xiao L, Liu G B, Zhang J Y, et al. Long-term effects of vegeta-tional restoration on soil microbial communities on the Loess Plateau of China[J]. Restoration Ecology, 2016, 24(6): 794−804. doi: 10.1111/rec.2016.24.issue-6
[9] 罗达, 史作民, 唐敬超, 等. 南亚热带乡土树种人工纯林及混交林土壤微生物群落结构[J]. 应用生态学报, 2014, 25(9):2543−2550. Luo D, Shi Z M, Tang J C, et al. Soil microbial community structure of monoculture and mixed plantation stands of native tree species in south subtropical China[J]. Chinese Journal of Applied Ecology, 2014, 25(9): 2543−2550.
[10] 范周周, 卢舒瑜, 王娇, 等. 岩溶与非岩溶区不同林分根际土壤微生物及酶活性[J]. 北京林业大学学报, 2018, 40(7):55−61. Fan Z Z, Lu S Y, Wang J, et al. Microbial and enzyme activities in rhizosphere soil of different forest stand in karst and non karst areas[J]. Journal of Beijing Forestry University, 2018, 40(7): 55−61.
[11] Chang E H, Tian G L, Chiu C Y. Soil microbial communities in natural and managed cloud montane forests[J]. Forests, 2017, 8(2): 33. doi: 10.3390/f8010033
[12] 安文明, 韩晓阳, 李宗善, 等. 黄土高原不同植被恢复方式对土壤水分坡面变化的影响[J]. 生态学报, 2018, 38(13):4852−4860. An W M, Han X Y, Li Z S, et al. Effects of different vegetation restoration types on the slope difference of soil water content in the Loess Plateau[J]. Acta Ecologica Sinica, 2018, 38(13): 4852−4860.
[13] 刘玉林, 朱广宇, 邓蕾, 等. 黄土高原植被自然恢复和人工造林对土壤碳氮储量的影响[J]. 应用生态学报, 2018, 29(7):2163−2172. Liu Y L, Zhu G Y, Deng L, et al. Effects of natural vegetation restoration and afforestation on soil carbon and nitrogen storage in the Loess Plateau, China[J]. Chinese Journal of Applied Ecology, 2018, 29(7): 2163−2172.
[14] 张海涵, 唐明, 陈辉, 等. 黄土高原5种造林树种菌根根际土壤微生物群落多样性研究[J]. 北京林业大学学报, 2008, 30(3):85−90. doi: 10.3321/j.issn:1000-1522.2008.03.015 Zhang H H, Tang M, Chen H, et al. Diversity of soil microbial communities in the mycorrhizosphere of five afforestation tree species in the Loess Plateau[J]. Journal of Beijing Forestry University, 2008, 30(3): 85−90. doi: 10.3321/j.issn:1000-1522.2008.03.015
[15] 王雅, 刘爽, 郭晋丽, 等. 黄土高原不同植被类型对土壤养分、酶活性及微生物的影响[J]. 水土保持通报, 2018, 38(1):62−68. Wang Y, Liu S, Guo J L, et al. Influence of different vegetation types on soil nutrients, enzyme activities and microbial diversities in Loess Plateau[J]. Bulletin of Soil and Water Conservation, 2018, 38(1): 62−68.
[16] 李静, 蔚晓燕, 唐明. 黄土高原纸坊沟流域不同植物对土壤微生物生物量和土壤酶活性的影响[J]. 西北植物学报, 2013, 33(2):387−393. doi: 10.3969/j.issn.1000-4025.2013.02.027 Li J, Yu X Y, Tang M. Effects of Different plants on soil microbial biomass and enzyme activities in Zhifanggou Watershed of Loess Plateau[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(2): 387−393. doi: 10.3969/j.issn.1000-4025.2013.02.027
[17] 李彦林, 陈吉祥, 张彦, 等. 半干旱黄土高原生态区不同土地利用类型土壤可培养微生物群落分析[J]. 干旱区资源与环境, 2017, 31(9):150−155. LI Y L, Chen J X, Zhang Y, et al. Analysis of culturable microbial communities in different land utilization types in semi-arid loess plateau ecological zones[J]. Journal of Arid Land Resources and Environment, 2017, 31(9): 150−155.
[18] 翟辉, 张海, 张超, 等. 黄土峁状丘陵区不同类型林分土壤微生物功能多样性[J]. 林业科学, 2016, 52(12):84−91. doi: 10.11707/j.1001-7488.20161210 Zhai H, Zhang H, Zhang C, et al. Soil microbial functional diversity in different types of stands in the hilly-gully regions of Loess Plateau[J]. Scientia Silvae Sinicae, 2016, 52(12): 84−91. doi: 10.11707/j.1001-7488.20161210
[19] 刘国华, 叶正芳, 吴为中. 土壤微生物群落多样性解析法: 从培养到非培养[J]. 生态学报, 2012, 32(14):4421−4433. Liu G H, Ye Z F, Wu W Z. Culture-dependent and culture-independent approaches to studying soil microbial diversity[J]. Acta Ecologica Sinica, 2012, 32(14): 4421−4433.
[20] 白震, 何红波, 张威, 等. 磷脂脂肪酸技术及其在土壤微生物研究中的应用[J]. 生态学报, 2006, 26(7):2387−2394. doi: 10.3321/j.issn:1000-0933.2006.07.043 Bai Z, He H B, Zhang W, et al. PLFAs technique and it's application in the study of soil microbiology[J]. Acta Ecologica Sinica, 2006, 26(7): 2387−2394. doi: 10.3321/j.issn:1000-0933.2006.07.043
[21] Bloem J, Hopkins D W, Benedetti A. Microbiological methods for assessing soil quality[M]. Wallingford: CABI Publishing, 2005: 205.
[22] Dong W Y, Zhang X Y, Dai X Q, et al. Changes in soil microbial community composition in response to fertilization of paddy soils in subtropical China[J]. Applied Soil Ecology, 2014, 84(3): 140−147.
[23] Willers C, Jansen Van Rensburg P J, Claassens S. Microbial signature lipid biomarker analysis, an approach that is still preferred, even amid various method modifications[J]. Journal of Applied Microbiology, 2015, 118(6): 1251−1263. doi: 10.1111/jam.2015.118.issue-6
[24] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 146−196. Lu R K. Soil agricultural chemical analysis method[M].Beijing: China Agricultural Science and Technology Press, 2000: 146−196.
[25] Bossio D. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utili-zation patterns[J]. Microbial Ecology, 1998, 35(3-4): 265−278.
[26] 李欣玫, 左易灵, 薛子可, 等. 不同荒漠植物根际土壤微生物群落结构特征[J]. 生态学报, 2018, 38(8):2855−2863. Li X M, Zuo Y L, Xue Z K, et al. Characteristics of microbial community structure in rhizosphere soil of different desert plants[J]. Acta Ecologica Sinica, 2018, 38(8): 2855−2863.
[27] 李南洁, 曾清苹, 何丙辉, 等. 缙云山柑橘林土壤微生物磷脂脂肪酸(PLFAs)及酶活性的季节变化特征[J]. 环境科学, 2017, 38(1):309−317. Li N J, Zeng Q P, He B H, et al. Seasonal variations of soil microbial PLFAs and soil enzyme activity under the citrus plantation in Mt[J]. Environmental Science, 2017, 38(1): 309−317.
[28] 吴则焰, 林文雄, 陈志芳, 等. 武夷山不同海拔植被带土壤微生物PLFA分析[J]. 林业科学, 2014, 50(7):105−112. Wu Z Y, Lin W X, Chen Z F, et al. Phospholipid fatty acid analy-sis of soil microbes at different elevation of Wuyi Mountains[J]. Scientia Silvae Sinicae, 2014, 50(7): 105−112.
[29] 杨淑娇, 杨永平, 石玲玲, 等. 基于PLFA的高山栎和高山松林松茸菌塘土壤微生物群落特征研究[J]. 生态学报, 2018, 38(5):1630−1638. Yang S J, Yang Y P, Shi L L, et al. Comparison of soil microbial community composition and structure in Tricholoma matsutake shiro and non-shiro soils in Quercus semecarpifolia and Pinus densata forests[J]. Acta Ecologica Sinica, 2018, 38(5): 1630−1638.
[30] 刘海燕, 魏天兴, 王仙. 黄土丘陵区人工林土壤微生物PLFA标记多样性分析[J]. 北京林业大学学报, 2016, 38(1):28−35. Liu H Y, Wei T X, Wang X. Soil microbial community structure and functional diversity in typical plantations marked by PLFA in hilly loess region[J]. Journal of Beijing Forestry University, 2016, 38(1): 28−35.
[31] Pollierer M M, Ferlian O, Scheu S. Temporal dynamics and variation with forest type of phospholipid fatty acids in litter and soil of temperate forests across regions[J]. Soil Biology Biochemistry, 2015, 91: 248−257. doi: 10.1016/j.soilbio.2015.08.035
[32] Fisk M C, Ruether K F, Yavitt J B. Microbial activity and functional composition among northern peatland ecosystems[J]. Soil Biology Biochemistry, 2003, 35(4): 591−602. doi: 10.1016/S0038-0717(03)00053-1
[33] Zhang Q, Wu J, Yang F, et al. Alterations in soil microbial community composition and biomass following agricultural land use change[J]. Scientific Reports, 2016, 6: 36587. doi: 10.1038/srep36587
[34] Kang H, Gao H, Yu W, et al. Changes in soil microbial community structure and function after afforestation depend on species and age: case study in a subtropical alluvial island[J]. Science of the Total Environment, 2018, 625: 1423−1432. doi: 10.1016/j.scitotenv.2017.12.180
[35] 孔滨, 孙波, 郑宪清, 等. 水热条件和施肥对黑土中微生物群落代谢特征的影响[J]. 土壤学报, 2009, 46(1):100−106. doi: 10.3321/j.issn:0564-3929.2009.01.014 Kong B, Sun B, Zheng X Q, et al. Effect of hydrothermal conditions and fertilization on metabolic characteristics of microbial community in a black soil[J]. Acta Pedologica Sinica, 2009, 46(1): 100−106. doi: 10.3321/j.issn:0564-3929.2009.01.014
[36] 郑灏, 杨志坚, 冯金玲, 等. 不同林下套种模式对油茶幼林根区土壤化学特性及微生物的影响[J]. 福建农林大学学报(自然版), 2015, 44(2):147−153. Zheng H, Yang Z J, Feng J L, et al. Effects of interplanting patterns on chemical properties and microbial community in root zone soils of young Camellia oleifera forest[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(2): 147−153.
[37] 樊芳玲, 谢德体, 魏朝富, 等. 坡耕地−桑树系统土壤微生物群落结构的PLFA分析[J]. 生态学报, 2016, 36(12):3812−3823. Fan F L, Xie D T, Wei C F, et al. PLFA analysis showed that the configuration modes of sloping crop-mulberry systems affect the soilmicrobial community structure[J]. Acta Ecologica Sinica, 2016, 36(12): 3812−3823.
[38] Richter A, Schöning I, Kahl T, et al. Regional environmental conditions shape microbial community structure stronger than local forest management intensity[J]. Forest Ecology and Management, 2018, 409: 250−259. doi: 10.1016/j.foreco.2017.11.027
[39] Vitousek P. Ecosystem science and human-environment inter-actions in the Hawaiian Archipelago[J]. Journal of Ecology, 2006, 94(3): 510−521. doi: 10.1111/j.1365-2745.2006.01119.x
[40] Kong A Y Y, Scow K M, Córdova-Kreylos A L, et al. Microbial community composition and carbon cycling within soil microen-vironments of conventional, low-input, and organic cropping systems[J]. Soil Biology Biochemistry, 2011, 43(1): 20. doi: 10.1016/j.soilbio.2010.09.005
[41] Urbanová M, Šnajdr J, Baldrian P. Composition of fungal and bacterial communities in forest litter and soil is largely determined by dominant trees[J]. Soil Biology & Biochemistry, 2015, 84: 53−64.
[42] Bardgett R D, Lovell R D, Hobbs P J, et al. Seasonal changes in soil microbial communities along a fertility gradient of temperate grasslands[J]. Soil Biology & Biochemistry, 1999, 31(7): 1021−1030.
[43] Lv F L, Xue S, Wang G L, et al. Nitrogen addition shifts the microbial community in the rhizosphere of Pinus tabuliformis in Northwestern China[J/OL]. PLoS One, 2017, 12(2): e0172382[2018−07−18]. https://doi.org/10.1371/journal.pone.0172382.
[44] 郭芸, 孙本华, 王颖, 等. 长期施用不同肥料塿土PLFA指纹特征[J]. 中国农业科学, 2017, 50(1):94−103. Guo Y, Sun B H, Wang Y, et al. PLFA fingerprint characteristics of an anthropogenic loess soil under long-term different ferti-lizations[J]. Scientia Agricultura Sinica, 2017, 50(1): 94−103.
-
期刊类型引用(2)
1. 卢翠香,兰俊,陈健波,吴永富,邓紫宇,周维. 尾巨桉树轮异常结构的解剖学分析. 西南大学学报(自然科学版). 2019(04): 72-77 .  百度学术
百度学术
2. 易敏,赖猛,张露,陈伏生,胡松竹. 人工林刨花楠木材主要特性的径向变异及其对气象因子的响应. 应用生态学报. 2018(11): 3677-3684 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: