Reproductive allocation and compensation mechanism for reproductive costs of dioecious shrub Rhamnus davurica
-
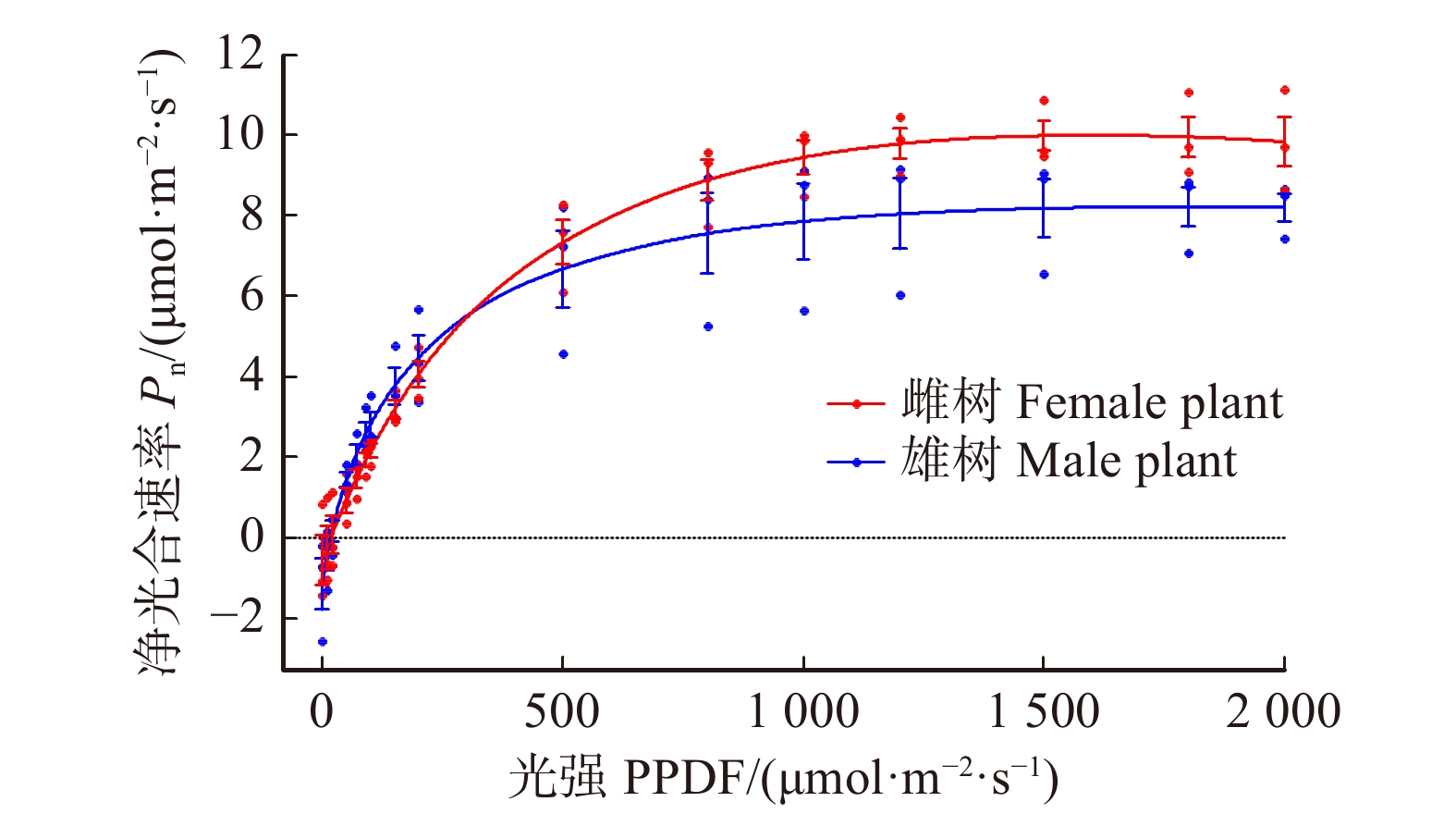
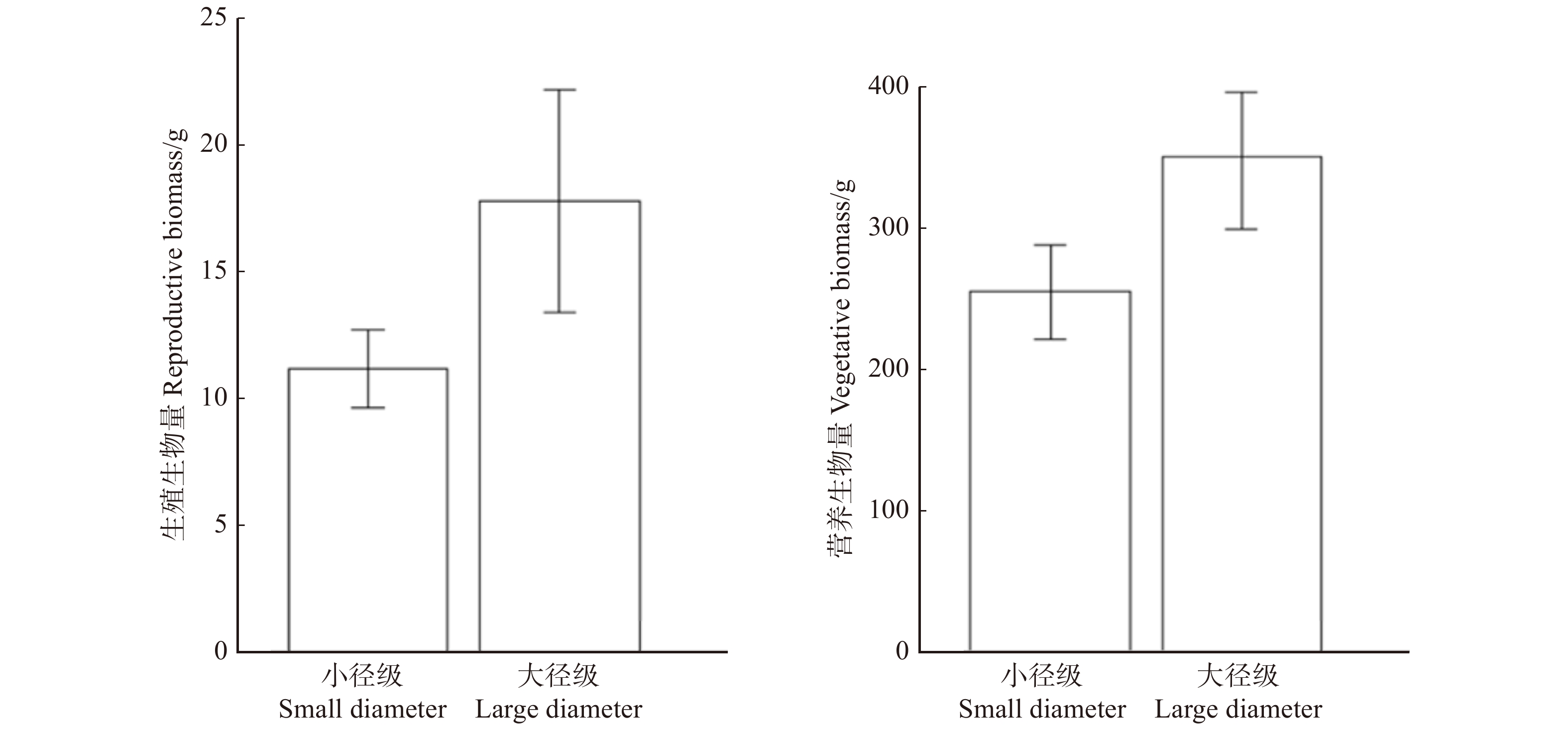
摘要:目的检验鼠李个体大小对其生殖分配的影响,比较相同径级雌雄鼠李生殖分配的差异,探讨鼠李可能存在的生殖耗费补偿机制, 对今后雌雄异株植物生理生态学方面的研究提供论据支撑。方法在鼠李的花期和果期选择当年进行繁殖活动且生长状况与立地条件类似的植株作为调查样本,对每株鼠李的性别、叶生物量、花生物量(花期)、果生物量(果期雌株)进行了调查,通过Li-6400 便携式光合作用测定仪比较不同性别鼠李叶片的光合能力。结果(1) 大径级鼠李的生殖生物量与营养生物量均显著大于小径级鼠李(P < 0.05)。(2) 相同径级鼠李雌株的生殖生物量均显著高于雄株(P < 0.05),雌雄鼠李的营养生物量没有显著差异(P > 0.05)。(3) 当光强处于500 ~2 000 μmol/(m2∙s)时,鼠李雌株单位叶面积的光合速率大于雄株。结论研究区域内鼠李的个体大小对其生殖分配有显著影响,这是不同个体可利用资源总量不同造成的。鼠李雌株相较于雄株,并没有因较高的生殖耗费而缩减对营养生长的投入。鼠李雌株通过光合作用获得了更多的可利用资源来满足其生殖和营养生长过程需要,这种较强的光合能力是雌株在较高繁殖压力下进化出的一种生殖耗费补偿机制。Abstract:Objective The trade-offs between reproductive and vegetative processes have an important role in the life-history theory. Dioecious species afford an excellent opportunity to detect the trade-offs in resource allocation.Method This research selected the dioecious shrub Rhamnus davurica to examine trade-offs between reproduction and vegetative growth, and determine whether females reduce vegetative growth with the higher reproductive allocation. If female hadn’t showed less vegetative growth than male, whether compensation mechanism led to that or not. The investigated R.davurica was divided into 4 groups based on genders and DBH. The differences of reproductive allocation between genders were compared by ANOVA and multiple comparisons. We did photosynthetic experiment of R.davurica on early June 2012 using LI-6400 portable photosynthesis system.Result The main results were showed as: diameter level was positively correlated with reproductive biomass and foliage biomass (P < 0.05). In the same diameter level, the reproductive biomass (including flower and fruit biomass) was significantly different between genders (P < 0.05), but there was no significant difference between genders regarding the foliage biomass (P > 0.05). Photosynthetic capacity and the estimated light photosynthetic curves were different between the male and female.Conclusion We conclude that the relationship between vegetative growth and reproductive growth does not agree with trade-off theory, this is a result of difference in the total available resources, R.davurica in large diameter-class has more total available resources. Although in the same diameter level, females do not show less vegetative growth than males. It is due to their higher photosynthetic efficiency and carbon fixation capacity. This higher photosynthetic capacity is a compensatory mechanism for females whit higher reproductive pressure.
-
Keywords:
- Rhamnus davurica /
- reproductive allocation /
- dioecy /
- compensation mechanism /
- photosynthesis
-
森林火灾是一种突发性强、破坏性大、处置救助较为困难的自然灾害,被世界公认为八大自然灾害之一[1]。世界范围内每年平均发生森林火灾的次数超过20余万次[2]。随着全球气候变暖,厄尔尼诺现象的影响,森林火灾在全球呈多发态势,发生频率和强度也在增加[3]。森林燃烧会产生大量的烟雾及有毒物质,并释放到大气中,对全球变暖、生物地球化学循环、空气质量和人体健康都会产生严重的负面影响[3]。研究数据显示,1997—1998年印尼森林火灾,累计向大气层排放了约10亿t CO2,造成严重的烟雾污染,引发国际社会广泛关注[4];2010年俄罗斯大火释放了255.76 Tg CO2(1 Tg=106 t)[5]。森林火灾产生的烟雾不仅严重影响大气质量,而且对人体的呼吸系统产生不良影响[6]。尤其是烟雾中的有毒物质,会对扑火队员的生命安全造成威胁[7]。研究表明,西伯利亚火灾产生的烟雾,可以被远距离传输到韩国和日本等国家,甚至波及到北美西海岸,严重影响到达区域的空气质量[8]。由此可见,开展森林燃烧排放物研究具有重要的现实意义。
森林火灾排放物的研究起步较晚,关于森林火灾碳排放的研究始于20世纪60年代[3, 9],随着遥感等新技术的应用,研究的内容和尺度不断深入。本文在广泛收集国内外相关文献的基础上,针对4种森林燃烧排放物(含碳气体、含氮气体、PM2.5和气溶胶),从研究内容、计算方法、排放量估算参数(火灾面积、可燃物载量、可燃物含碳率、燃烧效率、排放比和排放因子)等方面进行了综述,分析研究中存在的问题,对今后的发展趋势进行展望,以期为制定科学合理的林火管理政策,开展森林燃烧排放物的定量研究提供参考。
1. 森林火灾排放物
森林火灾在短时间内,释放出巨大的能量,产生火灾烟气羽流,受气流浮力的驱动,排放出大量的有毒有害气体,主要有无机类(CO、CO2、NOX、HCI、H2S、HN3、HCN、P2O5、HF、SO2和O3等)和有机类(CH4、CH3CI、NMHC等),以及悬浮颗粒物(炭黑粒子、灰分、PM2.5和PM10等)[10-11]。其中,含碳气体是森林火灾最主要的排放物,目前关于排放的研究也多集中在碳排放[10, 12-14]。森林火灾排放的含氮气体不多,但产生的影响不可忽视,因其可以造成长时间的污染[8, 15-17]。近年来,关于PM2.5与气溶胶的研究备受关注[16, 18-21]。因此,本文针对上述4种排放物的研究进展作综述。
1.1 森林火灾排放含碳气体
森林火灾排放的含碳气体是大气和环境污染的主要来源之一,全球每年源于自然火灾的直接碳排放量约为2.0×109 t[22, 41-42]。我国森林火灾年均消耗林地生物量5.000×106~7.000×106 t,直接排放碳2.024×107~2.856×107 t[23]。森林火灾排放物中,主要为温室气体,大约90%的碳都是以CO2或CO的形式排放到大气中[12],还有一小部分以甲烷、多碳烃和挥发性有机氧化物的形式排放到大气中[13]。在全球范围内,虽然森林火灾排放量呈现出显著的年际变化,但总体而言,森林火灾对温室气体排放的贡献率大约是23%[15]。基于碳质量平衡方法开展的排放研究结果表明,碳汇中的63%~74%是以CO2形式被排放到大气中,5.7%~13%以CO的形式被排放到大气中,0.36%~0.53%以CH4的形式被排放到大气中[15]。CH4是非常活跃的温室气体,对全球温室效应的贡献率仅次于CO2[24]。
森林火灾排放的含碳气体危害严重且持续时间长[14]。森林火灾燃烧了林下植被和枯枝落叶层,是植被碳库的释放,对大气碳平衡及全球气候变化均具有重要影响[16, 25]。森林火灾是温室气体的重要来源,能够改变陆地和大气之间的碳交换,导致全球气候和大气组成在时间和空间上的剧烈变化[10]。此外,森林火灾排放的CO和CH4还会对大气对流层臭氧浓度产生影响[26]。火是对森林造成影响和破坏最为剧烈的因子,会造成森林生态系统几十年甚至上百年碳储存的损失[14]。森林火灾排放的气体在大气中滞留时间很长,甚至长达数百年[11]。但森林生态系统能够在火烧后得到恢复,大气中的CO2可通过植物的光合作用从大气中固定下来[16, 25]。
森林群落树种组成、林火强度、燃烧过程等因素均会导致温室气体排放量的不同[27-28]。研究发现,中等强度火灾时单位面积碳释放量更大[29]。燃烧的不同阶段,排放量也有所不同,阴燃阶段释放CO、CH4和NMHC较多,焰燃阶段的碳被氧化成CO2排出较多[15]。李玉昆等[30]对大兴安岭的枯枝、草本和半分解层的排放量进行了研究,结果发现相同林型的不同部位排放量也有差异。
1.2 森林火灾排放含氮气体
森林火灾排放的含氮气体量虽然较少,但危害较大[15-16]。森林火灾会造成土壤氮释放,改变土壤蒸发与地表迳流,影响水分循环,成为全球变化的一个驱动力[16]。火干扰排放的NO作为主要含氮活性气体之一,经过化学反应产生的HNO3是酸雨的成分之一,加剧温室效应,改变自然演替的过程,产生一系列的负面影响。研究表明,氮的排放中0.35%~0.57%是以N2O的形式排放到大气中[15]。不同森林类型释放的含氮气体也不相同。通过对大兴安岭25年间林火排放的研究发现,白桦(Betula platyphylla)—落叶松(Larix gmelinii)林、白桦(Betula platyphylla)—杜鹃(Rhododendron simsii)林和蒙古栎(Quercus Mongolica)—胡枝子(Lespedeza bicolor)林是气体释放量较多的林型,约占总排放量的70%以上[31]。
在全球变暖条件下,林火排放物对氨浓度的贡献不断增大。2007年美国东南部气温升高和广泛的干旱导致森林火灾,林火产生的排放物引起了氨的浓度异常升高[18]。随着全球气候变化,在温暖的气候条件下,植被会向北扩展到以前冰雪覆盖的地区,林火排放物对氨浓度的影响将进一步增大[32]。
1.3 森林火灾排放PM2.5
PM2.5指的是空气动力学直径小于2.5 μm的大气颗粒物[19],是一个复杂的混合物质,包含如碳质组件,SO42-、NO3-、NH4+和一些金属[8]。火干扰造成的颗粒物质浓度的升高,会对局部地区乃至全球范围内的气候系统产生影响[16]。自《环境空气质量标准》增加细颗粒物(PM2.5)浓度限值监测指标以来,国内围绕PM2.5已经开展了一系列研究,但关于森林火灾排放的颗粒物的研究报道较少[20]。
森林火灾排放PM2.5的研究方法不多。NOAA/NESDIS开发了一种基于遥感的火灾PM2.5排放检测方法,即对PM2.5排放量进行建模,使用多个卫星仪器反演其空间分布常数[21]。在世界的许多地方,森林可燃物燃烧是颗粒物质的主要来源。2008—2009年,美国北卡罗来纳州森林火灾的颗粒物残余对PM2.5质量的影响显著[33]。研究表明,森林火灾排放物对地表微量气体的混合比会产生影响,NO2混合比的增加与可吸入颗粒物(PM)具有相关性(R=0.83),NO2和PM之间紧密的相关性可以进一步提高统计回归模型的性能[34]。
森林发生火灾后PM2.5浓度变化明显。火灾后PM2.5浓度与居民健康是北美国家研究的热点。2002年7月加拿大魁北克森林火灾的烟雾波及到美国东海岸,泊松回归分析的结果表明,24 h环境PM2.5浓度与每日居民死亡率无相关性。在波士顿都市区和纽约市,森林火灾的烟雾导致短期内PM2.5浓度大幅度提升,但之后的居民死亡率没有明显增加[35]。2013年加利福尼亚森林火灾后,在加利福尼亚和内华达州,通过研究临时和永久空气监测点收集的PM2.5浓度数据,评价了火灾烟雾中的PM2.5对空气质量的影响[3, 6]。
1.4 森林火灾排放气溶胶
气溶胶是指长时间悬浮在空气中能被观察或测量的液体或固体粒子[18]。黑碳气溶胶一般是碳质燃料(包括化石燃料、生物燃料等)不完全燃烧过程中产生的[37],仅占大气气溶胶中的0.2%~1.0%。黑碳的直接辐射强迫作用超过CH4,能够吸收更多的太阳辐射,成为影响全球变暖的仅次于CO2的重要成分。气溶胶排放物危害严重,特别是来自于生物质燃烧的烟雾微粒,是空气质量预报不确定性的主要来源之一。研究表明,林火烟气羽流中,光化学活性会增强,能够显著改变气溶胶的成分和微观物理学性质,导致气溶胶的光学特性和辐射特性改变[38]。随着节能减排的广泛开展以及森林火灾的不断加剧,今后森林火灾排放的黑碳量,在黑碳排放总量中的比例将进一步增大[39]。
森林火灾排放气溶胶研究方法较多。Drooge等[40]运用有机分子的化学分析方法,收集了来自2012年7月巴塞罗那森林火灾烟羽流到达城市的大气气溶胶,并进行光探测和激光雷达的光学测量。化学成分分析表明,几个小时内生物质燃烧对城市空气质量影响巨大。典型的生物质燃烧的示踪剂,如左旋葡聚糖,脱氢枞酸和多环芳香烃(PAH)增强,同时在边界层气溶胶浓度增加。之后的时间里,虽然激光雷达在高空中探测到了粒子,但在城市空气中,没有发现显著的森林火灾烟雾的影响。
林火对大气中气溶胶的增加有显著影响,但由于森林火灾发生时间和区域都很集中,在短时间小范围内,迅速大量释放排放物会对小区域的环境产生影响。研究发现,持续30 h的烟羽流比持续3 h的烟羽流产生的气体和气溶胶的浓度更高[39]。
2. 森林火灾排放物估算的主要参数
由于森林可燃物和燃烧条件的不确定性,估算森林火灾的排放物是非常复杂的,使用单一的示踪剂评估其来源的准确性也是很复杂的。全球每年来自自然火灾的直接碳排放量约为2.0×109 t[22, 41-42]。因此科学准确估算森林火灾排放物排放量,对制定科学有效的林火管理措施具有重要的意义。森林火灾排放估算研究中的主要参数包括火灾面积、可燃物载量、可燃物含碳率、燃烧效率、排放比和排放因子等。火灾面积、可燃物载量、可燃物含碳率都可直接或间接测得,国内外研究相对成熟;而燃烧效率是一个争议较大的参数,目前尚缺乏统一标准;排放因子和排放比是目前研究碳排放的热点。
2.1 森林火灾面积
森林火灾面积是估算排放量的重要参数,也是最不确定的因子,单因素方差分析表明,总体上森林类型对林火面积的影响并不明显[31, 43-45]。森林火灾面积获取方法主要包括小尺度范围的航空地图勾绘法和地面实地调查法,以及大尺度范围的统计资料、经验公式和遥感估测法。地面实地调查精度高,但成本也高。经验公式估算方便快捷,但因地区差异存在一些误差,且缺乏时空信息[46]。随着遥感技术的发展,因其分辨率较高,覆盖范围广,成本低等优势,在林火领域得到了广泛的应用,发展前景非常广阔。特别是对于森林火灾开放燃烧,可以考虑结合卫星观测的火点数据,估算森林火灾的受害面积和草原火灾的过火面积。目前使用较多的主要是NOAA-AVHRR、SPOT、Landsat、MODIS、ATSR数据和多光谱遥感影像等。
2.2 可燃物载量
森林可燃物是森林燃烧的物质基础[47],可燃物载量是计量火灾排放的基础。但由于森林生态系统其本身的多样性和复杂性,加上地域差异和火行为差异,导致各类型可燃物载量处在不断变化的状态[48]。可燃物载量获取的方法主要是地面调查法和遥感图像法[49]。遥感图像是目前运用最广泛的方法,研究中使用的遥感图像从航空照片、NOAA-AVHRR、LandsatTM,发展到MSS、LISSII、LIDAR、SPOT、多光谱遥感影像等[49]。
可燃物载量的数据受各种因素的交互作用,加之实测数据的获取尚缺乏统一标准,不同学者的研究方法差别较大。目前常见的可燃物载量研究多借助模型、回归方程或者先进的激光雷达等手段[49-51]。
由于植被生产力、分解率和火灾发生时间和频率的变化,不同季节的可燃物载量不同。在很长的时间尺度上,CO2的肥效作用影响着植被生产力,可利用JSBACH模型作为一个工具,来监测可燃物载量的季节性变化,相关研究表明,在较长的时间尺度上,CO2的肥效作用是不可忽略的,它间接影响着可燃物载量的变化[52]。
2.3 可燃物含碳率
可燃物含碳率是可燃物的干质量中碳所占的比重[43]。更为精确可靠的可燃物含碳率估算,应来自不同林型条件下所开展的实验测定。植被类型和植物部位不同,其含碳量也会不同[28],凋落物和粗木质残体由于受外部环境的影响较大,在不同林型中的平均含碳率波动较大[42]。目前关于不同区域森林群落组成树种的含碳率研究较多,大多采用45%或50%作为所有森林类型的平均含碳率[31, 43, 45]。如果在借鉴以往研究结果的基础上,能够再开展一些针对性的室内实验,将会明显减少在尺度转换过程中形成的误差[28]。
2.4 燃烧效率
燃烧效率于1979年由Wong[43]提出,是指燃烧消耗的可燃物占总可燃物载量的比例,它是影响可燃物消耗量和火灾排放量的重要因子[53-54],对准确估算森林火灾排放量具有重要作用,但也是一个争议较大的参数[14],目前普遍采用IPCC的经验估计值45%。更为准确的燃烧效率应基于大量的室内外实验数据[44],但由于室内控制环境下的燃烧实验和野外燃烧实验难度大、费用高,且实验环境和野外实际环境存在差异较大,因此这方面研究文献较少。
燃烧效率受火灾强度、火灾类型、植被类型以及气候条件等因素的影响。众多研究表明,不同的生态环境不同森林类型的燃烧效率不同[17, 28, 43, 55-56],不同的火灾面积燃烧效率也不同[57],不同的燃烧程度燃烧效率不同[28],不连续燃烧面积的燃烧效率比连续燃烧面积的燃烧效率低[58],北方林中树叶和小枝的燃烧效率比树干高,可燃物载量与燃烧效率呈负相关[48, 50]。目前燃烧效率缺乏确定标准,许多学者采用平均燃烧效率与燃烧物质总量之间的回归方程进行研究[51]。应用遥感技术,将野外调查和表征林火烈度的dNBR(differenced normalized burn ratio,差分归一化燃烧率)指数相结合的方法,可以更准确的估算森林火灾可燃物的消耗量,进而推算出燃烧效率。在利用高分辨率遥感影像估测森林火灾燃烧效率方面:Lambin等[58]研究了中非地区森林火灾的燃烧效率;French等[59]建立了火灾面积与燃烧效率的相关关系。由于遥感数据的客观性、宏观性和实效性等优点,基于遥感估测森林火灾排放物是未来发展方向,但由于空间分辨率等问题,其精度需进一步提高[50, 60]。
2.5 排放比和排放因子
排放比是指森林火灾排放气体中扣除相应气体背景浓度的某种含碳气体量与CO2释放量的比值[14]。排放因子指单位干可燃物在燃烧过程中所排放的某种气体量[9]。排放比法和排放因子法是森林火灾排放物估算中最常用,也是最简便的两种方法,在国内已经广泛应用。从理论上讲,排放因子法的估算较为可靠,而排放比法估算误差较大[44]。目前应用排放比法估算温室气体释放量的报道较多[61],主要因为排放因子一般只能在实验中获取,但在野外和大规模火灾发生时,排放比法因容易测定,因此应用更为广泛。
排放比的计算,通常选取CO2、CO、CH4作为参考气体。CO2作为一个参考气体,因为它是烟羽流中的主要含碳化合物,也是一个测量相对简单的气体[46]。排放比也会因火灾发生区域、燃烧阶段和燃烧组分的不同而有差异[3, 14]。目前用于测定含碳气体排放比的主要方法有微型燃烧实验、受控环境燃烧实验、地面采样实验、空中采样实验、卫星遥感技术等[60, 62]。
3. 展望
基于森林燃烧排放物研究现状及存在问题,今后研究建议围绕以下方向:1)森林火灾间接排放的估算将是今后研究热点,应当加强火烧迹地的调查和观测,掌握火烧后森林中碳库转化规律和枯死木分解速率,把间接排放因子设置成参数进行估算,为森林燃烧间接排放的研究提供支持。2)结合遥感等技术,对不同尺度森林燃烧排放物进行深入研究。3)研究森林燃烧排放物与气候变化的相互作用机制。4)研究如何提高森林燃烧排放物估算精度。借助新的遥感平台,提高分辨率,改进算法,发挥“3S”集成技术的作用。随着高分辨率卫星传感器的应用,以及技术处理和估算方法的改进和提高,估算准确度将大大提高。
-
表 1 个体大小对生殖生物量和营养生物量的方差分析
Table 1 Results of ANOVA examining the effect of tree size on the reproductive biomass and vegetative biomass
项目 Item 生殖生物量 Reproductive biomass 营养生物量 Vegetative biomass F P F P 个体大小 Individual size 10.17 0.001 92** 6.349 0.013 4* 残差 Residuals 2.89 0.753 表 2 不同个体大小的雌雄植株各组分生物量
Table 2 Biomass of different compoents and reproductive ratio of sample tree for different genders and tree size
项目 Item 小径级雌株
Small diameter female plant小径级雄树
Small diameter male plant大径级雌株
Large diameter female plant大径级雄树
Large diameter male plant胸径 DBH/cm 3.39 ± 0.14b 3.17 ± 0.10b 4.90 ± 0.20a 5.16 ± 0.18a 花生物量 Flower biomass/g 2.10 ± 0.50a 4.38 ± 1.55a 5.82 ± 2.07a 4.66 ± 1.07a 生殖生物量 Reproductive biomass/g 23.86 ± 9.16a 4.38 ± 1.55b 41.18 ± 16.26a 4.66 ± 1.07b 营养生物量 Vegetative biomass/g 264.72 ± 72.51a 279.74 ± 42.46a 407.46 ± 109.55a 318.35 ± 51.88a 注:数据为平均值 ± 标准误,同一行字母不同者表示差异显著(P < 0. 05)。Notes: valules are mean ± SE, data followed by different letters within a row differ significantly (P < 0. 05). -
[1] Vandepitte K, Honnay O, De Meyer T, et al. Patterns of sex ratio variation and genetic diversity in the dioecious forest perennial Mercurialis perennis[J]. Plant Ecology, 2010, 206(1): 105−114. doi: 10.1007/s11258-009-9627-y
[2] Zhang D Y, Jiang X H. Size-dependent resource allocation and sex allocation in herbaceous perennial plants[J]. Journal of Evolutionary Biology, 2002, 15: 74−83. doi: 10.1046/j.1420-9101.2002.00369.x
[3] Obeso J R. The costs of reproduction in plants[J]. New Phytologist, 2002, 155: 321−348. doi: 10.1046/j.1469-8137.2002.00477.x
[4] Silvertown J, Dodd M. The demographic cost of reproduction and its consequences in balsamfir(Abies balsamea)[J]. American Naturalist, 1999, 154: 321−332. doi: 10.1086/303238
[5] Liu F, Chen J M, Wang Q F. Trade-offs between sexual and asexual reproduction in a monoecious species Sagittaria pygmaea (Alismataceae): the effect of different nutrient levels[J]. Plant Systematics and Evolution, 2009, 277: 61−65. doi: 10.1007/s00606-008-0103-2
[6] Teitel Z, Pickup M, Field D L. The dynamics of resource allocation and costs of reproduction in a sexually dimorphic, wind-pollinated dioecious plant[J]. Plant Biology, 2016, 18: 98−103. doi: 10.1111/plb.12336
[7] Hartemink N, Jongejans E, De Kroon H. Flexible life history responses to flower and rosette bud removal in three perennial herbs[J]. Oikos, 2004, 105: 159−167. doi: 10.1111/j.0030-1299.2004.12784.x
[8] 张大勇, 白伟宁, 任文伟, 等.植物生活史进化与繁殖生态学[M]. 北京: 科学出版社, 2004. Zhang D Y, Bai W N, Ren W W, et al. Plant life-history evolution and reproductive ecology[M]. Beijing: Science Press, 2004.
[9] Renner S S, Ricklefs R E. Dioecy and its correlates in the flowering plants[J]. American Journal of Botany, 1995, 82: 596−606. doi: 10.1002/j.1537-2197.1995.tb11504.x
[10] Lloyd D G, Webb C J. Secondary sex characters in plants[J]. Botanical Review, 1977, 43: 177−216. doi: 10.1007/BF02860717
[11] Cipollini M L, Whigham D F. Sexual dimorphism and cost of reproduction in the dioecious shrub Lindera benzoin (Lauraceae)[J]. American Journal of Botany, 1994, 81: 65−75. doi: 10.1002/j.1537-2197.1994.tb15410.x
[12] Bañuelos M J, Obeso J R. Resource allocation in the dioecious shrub Rhamnus alpinus: the hidden costs of reproduction[J]. Evolutionary Ecology Research, 2004, 6: 397−413.
[13] Ueno N, Kanno H, Seiwa K. Sexual differences in shoot and leaf dynamics in the dioecious tree, Salix sachalinensis[J]. Canadian Journal of Botany, 2006, 84: 1852−1859. doi: 10.1139/b06-142
[14] Ehrlen J, Van Groenendael J. Stroage and the delayed costs of reproduction in the understorey perennial lathyrus vernus[J]. Journal of Ecology, 2001, 89: 237−246. doi: 10.1046/j.1365-2745.2001.00546.x
[15] Sakai A K, Burris T A. Growth in male and female aspen clones: a twenty-five-year longitudinal study[J]. Ecology, 1985, 66: 1921−1927. doi: 10.2307/2937388
[16] Bazzaz F A, Ackerly D D, Reekie E G. Reproductive allocation in plants[M]. New York: CABI Publishing, 2000.
[17] Fox J F, Stevens G C. Costs of reproduction in a willow-experimental responses vs natural variation[J]. Ecology, 1991, 72: 1013−1023. doi: 10.2307/1940601
[18] Delph L F, Knapczyk F N, Taylor D R. Among-population variation and correlations in sexually dimorphic traits of Silene latifolia[J]. Journal of Evolutionary Biology, 2002, 15: 1011−1020. doi: 10.1046/j.1420-9101.2002.00467.x
[19] Tozawa M, Ueno N, Seiwa K. Compensatory mechanisms for reproductive costs in the dioecious tree Salix integra[J]. Botany, 2009, 87: 315−323. doi: 10.1139/B08-125
[20] Mandy L S, Todd N R, Sarah M E. Sex-specific morphological and physiological differences in the moss Ceratodon purpureus (Dicranales)[J]. Annals of Botany, 2017, 120: 845−854. doi: 10.1093/aob/mcx071
[21] 朱燕艳, 王娟, 赵秀海, 等. 雄全异株植物白牛槭功能性状与碳素含量关联性研究[J]. 西北植物学报, 2015, 35(10):2089−2095. doi: 10.7606/j.issn.1000-4025.2015.10.2089 Zhu Y Y, Wang J, Zhao X H, et al. Correlation of functional traits and carbon contents in androdioecy plant Acer mandshuricum[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(10): 2089−2095. doi: 10.7606/j.issn.1000-4025.2015.10.2089
[22] Prinsley R T, Leegood R C. Factors affecting photosynthetic induction in spinach leaves[J]. Biochim Biophys Acta, 1986, 849: 244−253. doi: 10.1016/0005-2728(86)90031-9
[23] Shiba A, Kudo G, Notes A. Size-dependent sex allocation and reproductive investment in a gynodioecious shrub[J]. Aob Plants, 2016, 9: 89.
[24] Barradas M C D, Zunzunegui M, Collantes M. Gender-related traits in the dioecious shrub Empetrum rubrum in two plant communities in the Magellanic Steppe[J]. Acta Oecologica, 2014, 60(10): 40−48.
[25] Hesse E, Pannell J R. Sexual dimorphism in a dioecious population of the wind-pollinated herb Mercurialis annua: the interactive effects of resource availability and competition[J]. Annals of Botany, 2011, 107: 1039−1045. doi: 10.1093/aob/mcr046
[26] Cornelissen T, Stiling P. Sex-biased herbivory: a meta-analysis of the effects of gender on plant-herbivore interactions[J]. Oikos, 2005, 111(3): 488−500. doi: 10.1111/j.1600-0706.2005.14075.x
[27] Rocheleau A F, Houle G. Different cost of reproduction for the males and females of the rare dioecious shrub Corema conradii(Empetraceae)[J]. American Journal of Botany, 2001, 88: 659−666. doi: 10.2307/2657066
[28] Leigh A, Cosgrove M J, Nicotra A B. Reproductive allocation in a gender dimorphic shurb: anomalous females investment in Gynatrix pulchella[J]. Journal of Ecology, 2006, 94(6): 1261−1271. doi: 10.1111/j.1365-2745.2006.01164.x
[29] Zhang C Y, Zhao X H, Gao L S, et al. Gender, neighboring competition and habitat effects on the stem growth in dioecious Fraxinus mandshurica trees in a northern temperate forest[J]. Annals of Forest Science, 2009, 66(8): 812. doi: 10.1051/forest/2009068
[30] Cedro A, Iszkuło G. Do females differ from males of European yew (Taxus baccata L.) in dendrochronological analysis?[J]. Tree-Ring Research, 2011, 67: 3−11. doi: 10.3959/2009-9.1
[31] Rovere A E, Aizen M A, Kitzberger T. Growth and climatic response of male and female trees of Ausrocedrus chilensis, a dioecious conifer from the temperate forests of southern south America[J]. Ecoscience, 2003, 195: 203.
[32] Popp J W, Reinartz J A. Sexual dimorphism in biomass allocation and clonal growth of Xanthoxylum americanum[J]. American Journal of Botany, 1988, 75: 1732−1741. doi: 10.1002/j.1537-2197.1988.tb11249.x
[33] Correia O, Barradas M. Ecophysiological differences between male and female plants of Pistacia lentiscus[J]. Plant Ecology, 2000, 149: 131−142. doi: 10.1023/A:1026588326204
[34] Obeso J R, Alvarez-Santullano M. Sex ratio, size distributions, and sexual dimorphism in the dioecious tree Ilex aquifoium (Aquifoliaceae)[J]. American Journal of Botany, 1998, 85: 1602−1608. doi: 10.2307/2446488
[35] Dawson T E, Ehleringer J R. Gender-specific physiology, carbon isotope discrimination, and habitat distribution in box elder, Acer negundo[J]. Ecology, 1993, 74: 798−815. doi: 10.2307/1940807
[36] Gehring J L, Monson R K. Sexual differences in gas exchange and response to environmental stress in dioecious Silene latifolia (Caryophyllaceae)[J]. American Journal of Botany, 1994, 81: 166−174. doi: 10.1002/j.1537-2197.1994.tb15426.x
-
期刊类型引用(3)
1. 张露月,刘艳红,韩冬青. 连香树雌雄株生长及适应性策略差异. 北京林业大学学报. 2024(12): 71-81 .  本站查看
本站查看
2. 亢红伟,岳康杰,刘慧欣,王佳丽,田旭平. 性别和叶形对圆柏气体交换参数和叶绿素荧光特征的影响. 植物科学学报. 2024(06): 791-799 .  百度学术
百度学术
3. 孙晓伟,王兴昌,孙慧珍,全先奎,杨青杰. 雌雄异株树种山杨、水曲柳和东北红豆杉光合特性对比. 南京林业大学学报(自然科学版). 2023(01): 129-135 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载: