Analysis of the fertilization response characteristics of improved variety for high yield and high quality Populus tomentosa
-
摘要:目的探寻林木最佳栽培方法是切实提高森林生产力的重要举措。由于毛白杨是杂种起源,其种内无性系间施肥响应特性差异显著。为保证人工林建设的速生丰产特性,同时减轻环境保护压力,应该大量推广毛白杨良种配制最佳施肥配比。方法以3个毛白杨良种为研究对象,利用不同施肥处理探明影响其重要生长性状的最佳施肥配比,并对高产优质毛白杨良种施肥响应特性相关的候选基因表达模式进行系统解析。结果‘毅杨1号’最佳施肥配比为N(3 g) + P2O5(2. 25 g) + K2O(1 g);‘毅杨2号’最佳施肥配比为N(3 g) + P2O5(2. 25 g) + K2O(0.5 g);‘毅杨3号’最佳施肥配比为N(7 g) + P2O5(2. 25 g) + K2O(0.5 g)。其中,氮元素是影响毛白杨毅杨良种的苗高、地径以及生物量最为显著的营养元素。为进一步解析其遗传调控基础,对与氮素运输、同化、代谢相关的16个重要候选基因在不同氮肥施肥水平下在叶片以及根系中的表达模式进行了解析。候选基因表达模式分析结果表明,毛白杨良种氮素相关候选基因在叶片以及根中聚类成不同的模块,并且无性系之间表达模式差异显著。结论本研究阐明了毅杨毛白杨良种的施肥响应特性,系统分析其转录调控特异性将有利于解析其氮肥响应特性形成的分子机制,并对进一步针对氮素吸收利用效率开展遗传改良的分子设计育种具有重要意义。Abstract:Objective The most suitable cultivation method for forest trees has an important impact on the improvement of forest productivity. Based on hybrid origin, Populus tomentosa individuals are significantly different in fertilization treatment response. In order to ensure the rapid growth and high-yield of plantation forest and reduce the pressure on environmental protection, the most suitable fertilization proportion should be formulated for elite of P. tomentosa.Method In this study, three improved varieties of P. tomentosa were used for different fertilization treatments. The most suitable fertilization proportion affecting their important growth traits were profiled. And the candidate gene expression patterns related to fertilizer utilization were systematically analyzed.Result The experimental results showed that the optimum fertilization proportion of ‘Yiyang 1’ is N (3 g) + P2O5 (2.25 g) + K2O (1 g); the optimum fertilization proportion of ‘Yiyang 2’ was N (3 g) + P2O5 (2.25 g) + K2O (0.5 g); ‘Yiyang 3’ was the best fertilization proportion of N (7 g) + P2O5 (2.25 g) + K2O (0.5 g). Among them, nitrogen is the most significant nutrient element affecting the seedling height, ground diameter and biomass of the improved species of P. tomentosa. To analyze the genetic basis of nitrogen utilization in poplar, the expression patterns of 16 candidate genes related to assimilation and metabolism of nitrogen transport in leaves and roots under different nitrogen fertilization levels were analyzed. The candidate genes’ expression pattern analysis indicated that the nitrogen-related candidate genes of P. tomentosa were clustered into different modules in leaves and roots, and the expression patterns of clones were significant different.Conclusion This study preliminarily clarified that three improved forest varieties of P. tomentosa has significantly different fertilization response characteristics. Systematic analysis of their transcriptional regulation specificity will facilitate the analysis of molecular mechanism of their nitrogen fertilizer response characteristics and help for further molecular design of genetic improvement of nitrogen absorption and utilization efficiency in P. tomentosa.
-
林木良种配合最佳施肥方法是提高森林生产力的关键因素。以往的研究表明林木最佳栽培方法对于森林生产力的提高约为60%[1]。探明苗木最佳施肥配比可以显著提高苗高、地径、生物量、净光合速率、整株叶面积等性状[2-5],进而改良苗木质量。因此,阐明主要造林树种的最佳施肥配比是对速生丰产林经营的关键技术环节[6]。杨树(Populus)作为我国速生丰产林经营的主要造林树种,其与生长速率和环境营养条件相互作用显著。通过优化施肥配比可以显著提升杨树大田生长特性。其中,氮肥对于毛白杨(Populus tomentosa)生长具有显著的促进作用,钾肥其次,磷肥作用不显著[7]。曹帮华等[8]通过施肥处理实验,得出三倍体毛白杨最佳氮、磷、钾施肥配比为 N(9 g) + P2O5(5 g) + K2O(5 g),而毛白杨杂种无性系S86和46号的最佳施肥配比则分别为N(3 g) + P2O5(2. 25 g) + K2O(0 g)和 N(5 g) + P2O5(4. 5 g) + K2O(1 g)。研究结果表明杨树不同基因型对氮、磷、钾施肥响应特性迥异,为适应不同基因型的生长速率,应配置不同的施肥配比[9-11]。
植物氮、磷、钾响应特性是建立在精准的基因转录调控基础之上。目前,大量与矿质元素吸收、转运和代谢相关的基因被陆续发掘,并对其分子功能进行解析[12-14]。在杨树中已有16个与氮素吸收、转运和代谢相关的基因被鉴定[15-16]。Luo等[11]通过对生长特性迥异的两个杨树品种的16个氮素吸收、转运和代谢相关的候选基因表达模式进行解析,显示氮运输和氮同化相关基因在不同杨树无性系间表达模式差异显著。因此,若阐明杨树施肥响应特性的分子机制,应对不同杨树基因型相关候选基因的表达模式进行系统解析。
本研究以3个毛白杨良种为试验材料,通过不同的施肥处理探明影响其重要生长性状的最佳施肥配比,旨在为高产优质毛白杨良种推广配套速生丰产、环保节约的培育体系。同时,通过对高产优质毛白杨良种施肥特性相关的候选基因表达模式进行解析,为进一步阐明高产优质毛白杨良种施肥响应特性的分子机制以及构建高产优质毛白杨良种高效栽培技术体系提供理论基础。
1. 材料与方法
1.1 试验材料
‘毅杨1号’‘毅杨2号’和‘毅杨3号’是由母本毛新杨(P. tomentosa × P. bolleana)与父本‘截叶毛白杨’(P. tomentosa ‘Truncata’)杂交选育获得的国家级审定良种。2017年3月25日,将‘毅杨1号’‘毅杨2号’和‘毅杨3号’一年生插条扦插至装有16 kg沙壤土的花盆中。沙壤土基本理化性质为:全氮0.3 g/kg、速效磷6.7 mg/kg、速效钾31.5 mg/kg、pH 8.17、密度1.51 g/cm、田间持水量14.89%。利用尿素(含氮量 46. 4%)作为氮肥,过磷酸钙(含P2O5量 12. 1%)作为磷肥,硫酸钾(含K2O 50%)作为钾肥。
1.2 试验设计
采用三因素三水平的正交试验设计[17],氮、磷、钾施肥用量见表1。根据正交表将氮、磷、钾分别置于L9(34)的第1、4、3列上(表2),对照(不施肥)设置单列,共计10个处理,每个处理3次重复[2]。氮、磷、钾于6、7、8 月中上旬分3次伴随浇水平均施入土壤。
表 1 氮、磷、钾施肥水平及全年施肥量Table 1. Fertilization levels and the fertilization amounts in the whole yearg 施肥水平 Total fertilization level 施肥总量 Fertilization amount N P2O5 K2O 1 3 0 0 2 5 2.25 0.5 3 7 4.5 1 表 2 施肥处理Table 2. The fertilizing treatmentg 处理 Treatment N P2O5 K2O 1 3 0 0 2 3 2.25 0.5 3 3 4.5 1 4 5 4.5 0.5 5 5 0 1 6 5 2.25 0 7 7 2.25 1 8 7 4.5 0 9 7 0 0.5 1.3 测定方法
1.3.1 毛白杨良种苗高、地径与生物量测定
于试验结束日期(9月20日)进行苗高、地径与生物量测定。每个系号选取3株个体作为重复,共测定90株(3个无性系 × 10个处理 × 3个重复)。生物量测定是将个体分为根、茎、叶分别取样,置于70 ℃烘箱中烘干至恒质量后称量。
1.3.2 候选基因表达模式分析
差异表达基因的荧光定量分析,使用TaKaRa公司的SYBR green dye以及ExTaq R PCR试剂对目的基因序列进行实时荧光定量PCR检测。使用MJ Research公司的DNA Engine Opticon 2 实时荧光定量PCR仪完成基因表达分析。扩增程序为94 ℃、30 s;然后运行40个循环(94 ℃、5 s;58 ℃、15 s;72 ℃、20 s);94 ℃、15 s;60 ℃、1 min;94 ℃、15 s。根据在70 ~ 94 ℃区间荧光定量PCR产物的熔解曲线,判断扩增产物的稳定性。每个实验样品进行3次生物学重复,4次技术重复。利用Opticon Monitor Analysis软件处理荧光定量数据,根据相对定量的2− ΔΔCt 法对表达数据进行相对定量分析并作图。引物设计如表3所示。通过对每对引物的扩增效率进行估算,然后选用扩增效率相近的引物组合。对每对引物的扩增产物进行克隆测序来验证其特异性[13]。内参基因为在杨树中稳定表达的PtACTIN[18]。
表 3 氮运输、同化、代谢候选基因荧光定量引物序列列表Table 3. Real time-PCR primer sequence list of nitrogen transport, assimilation, metabolic candidate gene基因模型
Gene model基因名称
Gene name引物序列
Primer sequencesPotri.009G045200 AMT1.6 F:5′-TTCAGGTGAGGCGGGAGT-3′ R: 5′-CCAAAGCGCCAATGATACAG-3′ Potri.006G102800 AMT2.1 F:5′-GTTATAGGTTGGAACGTGGTGT-3′ R: 5′-TCAATATTACATGCGTCAAGATTC-3′ Potri.003G111500 NRT1.1 F:5′-CTAAACCAAGGGAGGCTCCATGAT-3′ R: 5′-CCCAACACAAAAGTAGGCGAAAAG-3′ Potri.012G070700 NRT1.2 F:5′-TCTTTGGTAGCAACTTGAACAA-3′ R: 5′-TCTCTCTCTCTCTCGTCTCCCT-3′ Potri.009G008500 NRT2.4B F:5′-AATAGAGGAAGGGAATGGCTG-3′ R: 5′-TGAGGTTGTCCCGAATGATAG-3′ Potri.009G008600 NRT2.4C F:5′-CAGTCCCGACAGATACAAC-3′ R: 5′-CTTCCCACTACAACGATTTC-3′ Potri.015G085000 NRT3.1B F:5′-TCATAGCCTCTTCTTCTACCTTTCC-3′ R: 5′-CCACCTTTCAATACTTGTCCG-3′ Potri.015G085100 NRT3.1C F:5′-AGAGGTCTCAGTGAAGCGAACAAG-3′ R: 5′-CGCAAATACAAACGCAATTATCAT-3′ Potri.005G172400 NR F:5′-ATCATCGGATCGGAGAGTTGG-3′ R: 5′-GACGGT-GCTAGTTGGCGTATAG-3′ Potri.004G140800 NiR F:5′-ACAAGTTGCCGATATTGGGTTCAT-3′ R: 5′-CCTCTATCACCCGTCGTAGTCCTG-3′ Potri.017G131100 GS1.3 F: 5′-GGCGCAGACCAAGCTTCTC-3′ R: 5′-GCGAAGTGACAGATTTAGGATTGC-3′ Potri.010G029100 GS2 F: 5′-ATCAGGTGGGTCCCAGTGTG-3′ R: 5′-GCGAAGTGACAGATTTAGGATTGC-3′ Potri.016G036900 Fd-GOGAT F: 5′-AACCCAAAGGCATCAGACTCAG-3′ R: 5′-AGTAAAGCAGGTCCATCCCAAG-3′ Potri.012G011700 NADH-GOGAT F: 5′-GGTGTTGTGGATATTCCTCCTG-3′ R: 5′-TCAGATGCGGCGACAACCC-3′ Potri.013G058300 GDH F: 5′-ATTTATGCTAACTCAGGAGGCGTT-3′ R: 5′-GAGGAGGAAACTAGGGCAATACAT-3′ Potri.018G006000 VHA1.1 F: 5′-CCGCTCAGACCAACACTATCTT-3′ R: 5′-TCCTCTGGGCTTGAATGGTAG-3′ Potri.018G090300 VHA2.2 F: 5′-GGCTCCAACCACCTGAGACAG -3′ R: 5′-AGCACAGCCCTTTCTCTTCCA-3′ 内参基因 Normalized gene Actin 2/7 F: 5′-CCCATTGAGCACGGTATTGT-3′ R: 5′-TACGACCACTGGCATACAGG-3′ 1.3.3 统计结果与分析
实验数据通过R软件(3.4.2)进行One-way ANOVA分析,利用Fisher’s Least Significant Difference(LSD)进行多重比较。图表绘制采用Excel软件(2018)。
2. 结果与分析
2.1 氮、磷、钾配施对苗高的影响
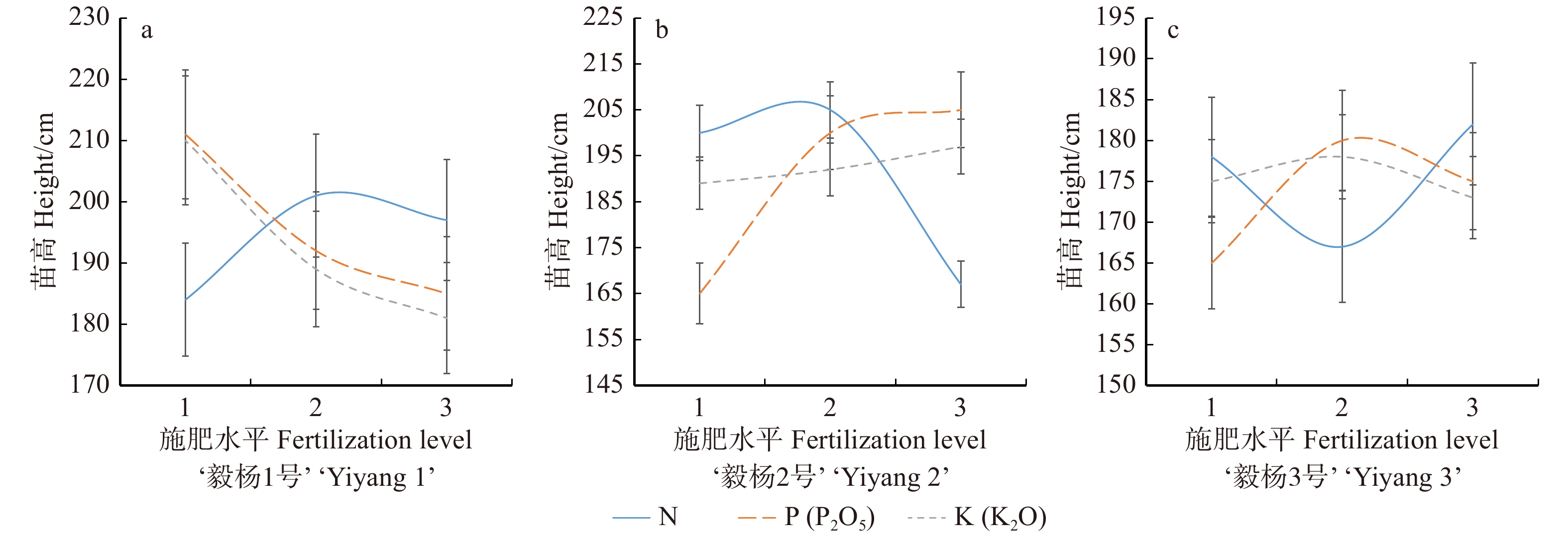
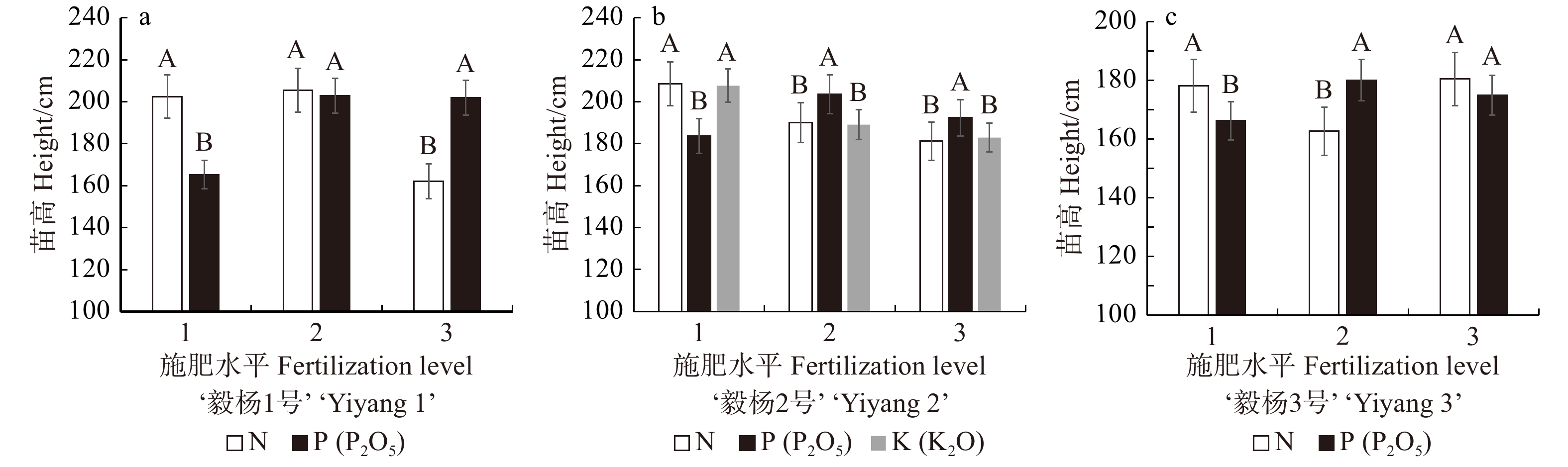
高产优质毛白杨良种‘毅杨1号’‘毅杨2号’和‘毅杨3号’各处理间苗高差异极显著(图1)。由表4可知:‘毅杨1号’绝大部分施肥处理苗高大于对照,只有处理9苗高仅为对照的79.4%,可能是该处理未施磷肥,导致苗木矿质元素吸收不均衡,进而抑制了苗高。‘毅杨2号’各施肥处理组苗高显著高于对照组,其中处理6苗高为229.45 cm,显著高于其他处理组合,而处理4苗高最小,为165.14 cm,仅高出对照组25.27%。‘毅杨3号’各施肥处理组苗高同样显著高于对照组,其中处理7苗高为189.22 cm,比对照组高出98.5%;处理5苗高最小,为150.91 cm,比对照高58.35%。施肥对于‘毅杨3号’苗高的促进作用较为明显。
表 4 不同施肥处理对高产优质毛白杨良种无性系苗高的影响Table 4. Effects of different fertilization treatments on clone seedling height of improved variety for high yield and high quality P. tomentosacm 处理
Treatment‘毅杨1号’
‘Yiyang 1’‘毅杨2号’
‘Yiyang 2’‘毅杨3号’
‘Yiyang 3’1 176.85 ± 11.25B 192.35 ± 13.15AB 180.1 ± 5.12AB 2 215.22 ± 8.13A 219.13 ± 10.19A 189.22 ± 5.09A 3 211.55 ± 3.35A 209.17 ± 8.51AB 167.22 ± 4.71C 4 215.12 ± 10.14A 165.14 ± 7.197C 175.18 ± 6.2BC 5 185.71 ± 7.31B 173.87 ± 10.15C 150.91 ± 5.13CD 6 212.25 ± 9.54A 229.45 ± 2.51A 164.13 ± 8.23CD 7 174.55 ± 3.41B 166.25 ± 7.22C 194.12 ± 6.25A 8 175.16 ± 11.25B 197.05 ± 7.15AB 184.21 ± 5.61AB 9 129.65 ± 7.15C 183.71 ± 4.23C 163.75 ± 4.13C CK 163.2 ± 11.04B 131.82 ± 5.81D 95.3 ± 7.91E 注:在P < 0. 01水平上差异显著。下同。Notes: significant difference at P < 0. 01 level. Same as below. 氮、磷、钾因素对苗高影响的平均值与施肥水平建立简单的对应关系(图1)。由图1可知:氮素对3个毛白杨良种的苗高影响最大。随着氮素施用量升高,‘毅杨1号’苗高呈现出先略微增高后又出现降低的趋势;‘毅杨2号’随着氮肥施用量的增加,苗高随之减小,从209.17 cm减小到183.71 cm;对于‘毅杨3号’,施加氮素后,株高先从175.18 cm较大幅度地减小到最低点163.75 cm后又较大幅度增大到最高点180.1 cm。为了进一步优化施肥用量,利用多重比较对影响苗高生长的矿质元素处理水平进行分析(图2)。由图2可知:‘毅杨1号’氮水平1(3 g)和2(5 g)显著高于水平3,且氮水平1与2之间无显著差异,因此‘毅杨1号’氮的最佳水平为3 ~ 5 g;‘毅杨2号’氮水平1(3 g)与水平2(5 g)和3(7 g)之间分别呈显著差异与极显著差异,因此‘毅杨2号’的氮最佳施肥水平被认定为3 g;‘毅杨3号’氮水平1(3 g)和3(7 g)无显著差异,但都显著高于水平2(5 g),可认为‘毅杨3号’氮的最佳水平为3或7 g。‘毅杨1号’‘毅杨2号’‘毅杨3号’磷水平2(2.25 g)与3(4.5 g)之间无显著差异但是均显著高于水平1(0 g),可认为磷的最佳水平是2.25 ~ 4.5 g;‘毅杨2号’钾水平1(0 g)与水平2(0.5 g)和与3(1 g)分别成显著和极显著差异,可认为‘毅杨2号’钾的最佳施肥水平为0 g,即过多的施加钾肥可能抑制‘毅杨2号’苗高生长。
以上分析表明氮、磷、钾对‘毅杨2号’苗高影响的最佳水平依次为3 g、2.25 ~ 4.5 g、0 g; 氮、磷对‘毅杨1号’苗高影响的最佳水平依次为3 ~ 5 g、2.25 ~ 4.5 g;氮、磷对‘毅杨3号’苗高影响的最佳水平依次为3 g或7 g、2.25 ~ 4.5 g。
2.2 氮、磷、钾配施对地径的影响
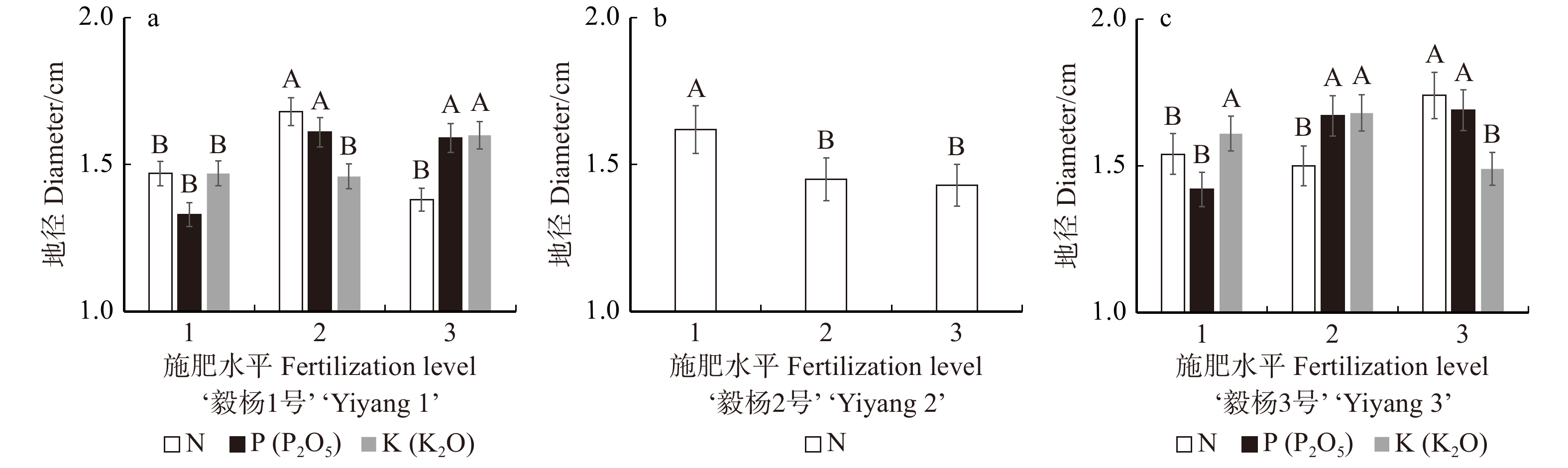
无性系‘毅杨1号’ ‘毅杨2号’和‘毅杨3号’各地径方差均达到极显著水平(表5)。由表5可知:‘毅杨1号’仅处理9低于对照,其地径为1.12 cm,为对照的99.1% 。‘毅杨2号’各施肥处理地径均显著高于对照组,其中施肥处理2地径为对照组的1.67倍,是地径最大的处理组合,而施肥处理7地径仅为对照组的1.31倍,为地径最小的处理组合。‘毅杨3号’各施肥处理地径极显著大于对照组,其中地径最大的处理组合为施肥处理8,是对照组地径的1.89倍;最小的处理组合是施肥处理5,仅为对照组的1.2倍。
表 5 不同施肥处理对高产优质毛白杨毅杨良种无性系地径的影响Table 5. Effects of different fertilization treatments on the clone diameter of improved variety for high yield and high quality P. tomentosacm 处理
Treatment‘毅杨1号’
‘Yiyang 1’‘毅杨2号’
‘Yiyang 2’‘毅杨3号’
‘Yiyang 3’1 1.14 ± 0.12C 1.58 ± 0.13A 1.39 ± 0.09B 2 1.63 ± 0.06A 1.66 ± 0.12A 1.72 ± 0.08A 3 1.62 ± 0.04A 1.62 ± 0.05A 1.55 ± 0.13A 4 1.60 ± 0.05A 1.33 ± 0.12AB 1.69 ± 0.11A 5 1.69 ± 0.07A 1.38 ± 0.14AB 1.24 ± 0.03C 6 1.71 ± 0.12A 1.60 ± 0.13A 1.63 ± 0.07A 7 1.47 ± 0.14AB 1.30 ± 0.12B 1.71 ± 0.07A 8 1.52 ± 0.06AB 1.60 ± 0.04A 1.84 ± 0.13A 9 1.12 ± 0.05C 1.40 ± 0.06B 1.67 ± 0.07A CK 1.13 ± 0.12C 0.99 ± 0.06C 0.97 ± 0.06D ‘毅杨1号’‘毅杨2号’和‘毅杨3号’的地径极差值结果(图3)说明3种元素对‘毅杨1号’地径影响的大小依次为N > P > K,对‘毅杨2号’地径影响的大小依次为N > K > P,对‘毅杨3号’地径影响的大小依次为P > N > K。营养元素对于地径的影响排序存在较大差异,推测可能是由土壤养分差异、不同品种本身的需肥特性不同导致。
从图3可以看出:仅有氮肥对‘毅杨2号’地径生长影响显著,说明氮肥是促进‘毅杨2号’地径生长的最重要因素;‘毅杨1号’和‘毅杨3号’地径生长则同时受氮、磷、钾的显著影响。针对地径生长进一步优化施肥用量,利用多重比较对影响其生长的营养元素处理水平进行分析(图3)。‘毅杨1号’氮水平2(5 g)与水平1(3 g)、3(7 g)都呈极显著差异,可认为氮的最佳水平为5 g;‘毅杨2号’氮水平1(3 g)与水平2(5 g)、3(7 g)呈显著差异,水平2与3之间差异不显著,可认为氮的最佳施肥水平为3 g;‘毅杨3号’氮水平3(7 g)与1(3 g)、2(5 g)差异极显著,水平1与2无显著差异,可认为氮的最佳水平为7 g。‘毅杨1号’和‘毅杨3号’磷水平2(2.25 g)与3(4.5 g)无显著差异,但均显著高于水平1(0 g),因此对于‘毅杨1号’和‘毅杨3号’,其地径生长的磷肥最优施用量为2.25 ~ 4.5 g;‘毅杨1号’钾水平1(0 g)与2(0.5 g)差异不显著,两者都显著低于水平3(1 g),因此对于‘毅杨1号’,其地径生长的钾肥最优施用量为1 g;‘毅杨3号’钾水平1(0 g)与3(1 g)无显著差异,两者都低于水平2(0.5 g),因此对于‘毅杨3号’,其地径生长钾肥最优施用量为0.5 g。
综上所述,对‘毅杨1号’地径生长最优的施肥用量为氮肥5 g、磷肥2.25 ~ 4.5 g、钾肥1 g。对‘毅杨2号’,其地径生长最优的施肥用量为氮肥3 g。氮、磷、钾对‘毅杨3号’地径影响的最佳水平依次为7 g、2.25 ~ 4.5 g、0.5 g。
2.3 氮、磷、钾配施对生物量的影响
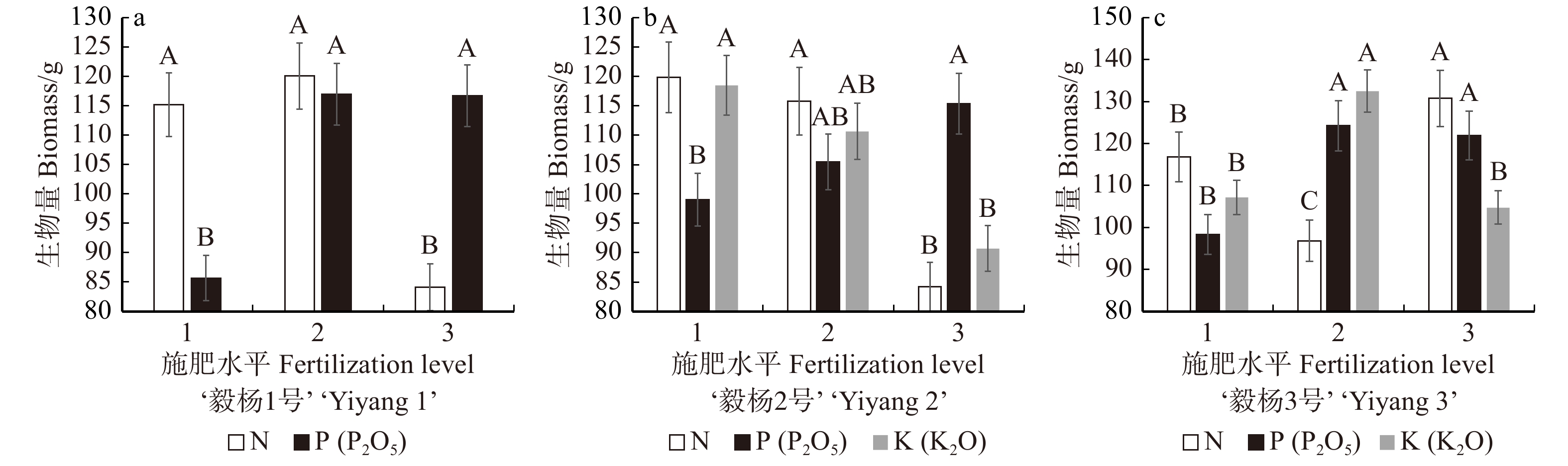
生物量指标代表了植物生长发育产生的物质总量,是反映苗木生产力水平的重要指标之一。对‘毅杨1号’‘毅杨2号’和‘毅杨3号’各处理间的生物量进行方差分析,结果显示‘毅杨1号’施肥处理下仅有处理9生物量与对照组无显著差异。‘毅杨2号’在各施肥处理下的生物量均极显著大于对照,其中处理6生物量比对照组高出245%,为最大的处理组合,而处理7生物量仅超出对照组120%,为最小的处理组合。‘毅杨3号’在各施肥处理下的生物量同样极显著大于对照,其中处理7比对照组高出493.8%,为最大处理组合;处理5生物量仅比对照组高出248.4%,为最小的处理组合(表6)。氮肥对于‘毅杨1号’‘毅杨2号’和‘毅杨3号’的生物量影响最大,对‘毅杨1号’生物量影响的大小依次为N > P > K,对‘毅杨2号’生物量影响的大小依次为N > K > P,对‘毅杨3号’生物量影响的大小依次为N > K > P。方差分析结果显示,‘毅杨1号’生物量生长受氮、磷肥影响极显著;‘毅杨2号’生物量生长受氮、钾肥极显著影响,受磷肥显著影响;‘毅杨3号’生物量生长受氮、磷、钾极显著影响。对影响显著的元素进行多重比较,结果见图4。
表 6 不同施肥处理对高产优质毛白杨毅杨良种无性系生物量的影响Table 6. Effects of different fertilization treatments on the clone biomass of improved variety for high yield and high quality P. tomentosacm 处理
Treatment‘毅杨1号’
‘Yiyang 1’‘毅杨2号’
‘Yiyang 2’‘毅杨3号’
‘Yiyang 3’1 98.16 ± 8.21BC 121.05 ± 11.58A 111.97 ± 3.21C 2 112.36 ± 10.14AB 124.51 ± 12.06A 143.82 ± 6.92A 3 134.24 ± 8.83A 113.61 ± 10.28A 95.73 ± 5.21D 4 125.23 ± 11.65AB 123.24 ± 11.21A 138.8 ± 7.58A 5 101.35 ± 12.81BC 95.31 ± 9.65BC 72.35 ± 4.95E 6 134.18 ± 6.75A 125.56 ± 4.54A 78.46 ± 7.21E 7 103.81 ± 12.24BC 61.49 ± 8.15D 143.25 ± 4.33A 8 92.21 ± 8.11C 106.78 ± 4.16B 130.14 ± 9.52A 9 59.18 ± 2.43D 82.65 ± 6.71BC 113.86 ± 8.12B CK 52.97 ± 4.87D 51.38 ± 5.16D 29.12 ± 3.41F ‘毅杨1号’和‘毅杨2号’氮水平1(3 g)与2(5 g)无显著差异,水平1、2与水平3(7 g)呈极显著差异,可认为氮对‘毅杨1号’生物量影响的最佳水平为3 ~ 5 g;‘毅杨3号’氮水平3(7 g)与水平1(3 g)、2(5 g)呈极显著差异,可认为氮对‘毅杨3号’生物量影响的最佳水平为7 g。‘毅杨1号’‘毅杨2号’和‘毅杨3号’磷水平2(2.25 g)、3(4.5 g)生物量显著高于水平1(0 g),且水平2和3无显著差异,可认为毅杨对于生物量的影响最佳磷水平为2.25 ~ 4.5 g。‘毅杨2号’和‘毅杨3号’钾水平2(0.5 g)的生物量显著高于水平1(0 g)和3(1 g),因此钾对‘毅杨2号’生物量影响的最佳水平为0.5 g。
由此可见,氮、磷、钾对‘毅杨1号’生物量的影响大小依次为N > P > K。氮、磷、钾对‘毅杨2号’和‘毅杨3号’生物量影响的大小依次为N > K > P。影响‘毅杨1号’生物量的氮、磷最佳水平依次为3 ~ 5 g、2.25 ~ 4.5 g;氮、钾对‘毅杨2号’生物量影响的最佳水平依次为3 ~ 5 g、0.5 g;氮、磷、钾对‘毅杨3号’生物量影响的最佳水平依次为3 ~ 5 g、2.25 ~ 4.5 g、0.5 g。
2.4 响应氮肥的基因表达模式
以上研究结果表明氮素对于‘毅杨1号’‘毅杨2号’和‘毅杨3号’苗高、地径、生物量均具有显著影响。为进一步解析其遗传调控基础,对与氮素运输、同化、代谢相关的16个重要候选基因在不同氮肥施肥水平下的在叶片以及根系中的表达模式进行解析。聚类分析结果(图5)显示在叶片中,16个候选基因被聚成4个亚类(Sub-cluster)。第一亚类(Sub-cluster 1)包括AMT2.1和NRT1.2;第二亚类包括GDH、NRT1.1、NRT2.4B以及NRT3.1B;第三亚类包括Gs1.3、AMT1.6以及NADH-GOGAT;第四亚类包括GS2、NiR、NRT2.4、NR、Fd-GOGAT以及NRT3.1C。在‘毅杨1号’中,第四亚类基因在氮水平1(3 g)下显著表达,但随着氮肥水平升高,氮同化基因NiR、NR、Fd-GOGAT以及氮代谢基因GS2基因表达量逐渐下调,氮运输基因NRT2.4C和NRT3.1C先下调后上升。在‘毅杨2号’和‘毅杨3号’中,第二亚类基因表达显著,氮运输基因NRT1.1、NRT2.4B以及NRT3.1B随着氮肥水平升高而显著上调。
在根中,16个候选基因被聚成3个亚类(Sub-cluster),见图5。第一亚类(Sub-cluster 1)包括NADH-GOGAT、NiR以及NRT2.4C;第二亚类(Sub-cluster 2)包括GDH、NRT1.2、NRT2.4B;第三亚类(Sub-cluster 3)包括AMT2.1、NRT1.1、NRT3.1B、GS1.3、AMT1.6、GS2、NR、Fd-GOGAT以及NRT3.1C。在‘毅杨1号’中,第三亚类基因在第一氮水平(3 g)下显著表达,但随着氮肥水平升高,氮代谢基因GS1.3、GS2,氮运输基因AMT1.6、NRT3.1C、NRT3.1B、AMT2.1以及氮同化基因Fd-GOGAT表达量逐渐下降。除此之外,氮运输基因NRT1.1一直保持较高的表达水平。AMT2.1基因呈现先降低后升高的模式。在‘毅杨2号’和‘毅杨3号’中,第二亚类基因显著表达。其中,氮代谢基因GDE受氮肥水平升高而显著上调。与之不同的是,氮运输基因NRT1.2与NRT2.4B在第3水平氮肥(7 g)出现显著下调。
3. 讨论与结论
3.1 毛白杨毅杨良种的最佳施肥配比
毛白杨由于其杂种起源特性,无性系间生长发育、生理特性等性状差异显著[19]。赵燕等[2]对毛白杨杂种无性系S86和46号的氮、磷、钾施肥配比分析发现影响毛白杨苗高、地径、生物量、光合速率等性状的最佳施肥配比具有显著差异,表明林木施肥响应特性差异较大。氮、磷、钾肥对于植物形态建成、光合作用、根系生长以及维持细胞渗透势等方面具有重要的调控作用[20]。同时,氮、磷、钾是通过有机物的形成与转化得到相互联系的,在植物体内还存在复杂的交互作用。因此,合理的氮、磷、钾比例可以促进林木均衡吸收营养元素,进而正调控植物生长发育。施肥比例失调则会导致营养元素吸收障碍,造成显著的生长抑制效应。
本研究结果显示,‘毅杨1号’苗高在不施磷肥(处理9)的情况下苗高仅为对照的79.1%,地径在不施氮肥和磷肥(处理1)的情况下与对照没有显著差异。证实不协调的施肥比例对毛白杨良种生长发育呈现显著的抑制作用,因此在施肥过程中要注意协调氮、磷、钾施肥比例。为了给良种推广制定精准施肥配方,本研究通过对毛白杨毅杨良种‘毅杨1号’‘毅杨2号’和‘毅杨3号’的施肥响应特性分析探明‘毅杨1号’最佳施肥配比为N∶P(P2O5)∶K(K2O) = 3 g∶2.25 g∶1 g;‘毅杨2号’最佳施肥配比为N∶P(P2O5)∶K(K2O) = 3 g∶2.25 g∶0.5 g;‘毅杨3号’最佳施肥配比为N∶P(P2O5)∶K(K2O )= 7 g∶2.25 g∶0.5 g。‘毅杨1号’‘毅杨2号’和‘毅杨3号’苗高最高分别可达215.22、229.45和194.12 cm,地径最大分别可达1.71、1.64和1.84 cm,生物量最大分别可达134.18、125.56和143.82 g。本研究通过优化毛白杨良种施肥配比,为良种推广过程中同时实现经济效益与生态效益提供了技术支持。
3.2 毛白杨毅杨良种氮肥响应转录调控模式
大量的研究表明氮元素是最为基础的矿质营养元素,对于植物细胞分裂、发育以及形态建成等重要过程具有重要的调控作用[11]。本研究结果显示氮、磷、钾肥对‘毅杨1号’和‘毅杨3号’生长的顺序为N > P > K;对于‘毅杨2号’生长顺序为N > K > P。实验结果表明氮元素是影响毛白杨毅杨良种的苗高、地径以及生物量最为显著的营养元素。氮元素的运输、同化与代谢都是基于精准的转录调控作用。为了进一步解析毛白杨毅杨良种的氮肥响应转录调控模式,本研究解析了16个与氮元素利用相关的重要候选基因的表达模式,结果表明毛白杨毅杨良种候选基因在叶片中与根系中的表达模式差异显著。在叶片中16个候选基因被聚成4个亚类(Sub-cluster),除Sub-cluster 1仅包含氮运输相关基因以外,其他3个亚类均包含氮运输、同化以及代谢基因。其中,Sub-cluster 4基因在‘毅杨1号’显著上调表达;在‘毅杨2号’与‘毅杨3号’中,Sub-cluster 2基因表达显著,结果表明在不同的毛白杨良种中可能依赖不同的基因模块完成氮素吸收与利用。在根系中,16个候选基因被聚成3个亚类(Sub-cluster),Sub-cluster 1包含氮运输与氮同化相关基因,Sub-cluster 2包含氮运输与氮代谢相关基因,Sub-cluster 3包含氮运输、同化以及代谢基因。Sub-cluster 3在‘毅杨1号’中显著表达;Sub-cluster 2 在‘毅杨2号’和‘毅杨3号’中显著表达,结果表明在毛白杨良种中与氮素吸收与利用相关的基因模块表达模式具有组织特异性。
氮元素吸收与利用相关基因之间同样存在复杂的交互作用。有实验证据表明,在杨树响应不同氮水平下 NRT3.1B与NRT3.1C对于氮元素运输存在相互促进作用[15]。本研究结果显示仅在毛白杨良种根系中NRT3.1B与NRT3.1C存在相似的表达模式;在叶片中NRT3.1B与NRT3.1C被分别聚类到Sub-cluster 2以及Sub-cluster 4中。本研究结果表明,氮元素运输相关基因的相互作用同样具有组织特异性。毛白杨毅杨良种具有显著不同的施肥响应特性,系统分析其转录调控特异性将有利于解析其氮肥响应特性形成的分子机制,并对进一步针对氮素吸收利用效率开展遗传改良的分子设计具有重要指导意义。
-
表 1 氮、磷、钾施肥水平及全年施肥量
Table 1 Fertilization levels and the fertilization amounts in the whole year
g 施肥水平 Total fertilization level 施肥总量 Fertilization amount N P2O5 K2O 1 3 0 0 2 5 2.25 0.5 3 7 4.5 1 表 2 施肥处理
Table 2 The fertilizing treatment
g 处理 Treatment N P2O5 K2O 1 3 0 0 2 3 2.25 0.5 3 3 4.5 1 4 5 4.5 0.5 5 5 0 1 6 5 2.25 0 7 7 2.25 1 8 7 4.5 0 9 7 0 0.5 表 3 氮运输、同化、代谢候选基因荧光定量引物序列列表
Table 3 Real time-PCR primer sequence list of nitrogen transport, assimilation, metabolic candidate gene
基因模型
Gene model基因名称
Gene name引物序列
Primer sequencesPotri.009G045200 AMT1.6 F:5′-TTCAGGTGAGGCGGGAGT-3′ R: 5′-CCAAAGCGCCAATGATACAG-3′ Potri.006G102800 AMT2.1 F:5′-GTTATAGGTTGGAACGTGGTGT-3′ R: 5′-TCAATATTACATGCGTCAAGATTC-3′ Potri.003G111500 NRT1.1 F:5′-CTAAACCAAGGGAGGCTCCATGAT-3′ R: 5′-CCCAACACAAAAGTAGGCGAAAAG-3′ Potri.012G070700 NRT1.2 F:5′-TCTTTGGTAGCAACTTGAACAA-3′ R: 5′-TCTCTCTCTCTCTCGTCTCCCT-3′ Potri.009G008500 NRT2.4B F:5′-AATAGAGGAAGGGAATGGCTG-3′ R: 5′-TGAGGTTGTCCCGAATGATAG-3′ Potri.009G008600 NRT2.4C F:5′-CAGTCCCGACAGATACAAC-3′ R: 5′-CTTCCCACTACAACGATTTC-3′ Potri.015G085000 NRT3.1B F:5′-TCATAGCCTCTTCTTCTACCTTTCC-3′ R: 5′-CCACCTTTCAATACTTGTCCG-3′ Potri.015G085100 NRT3.1C F:5′-AGAGGTCTCAGTGAAGCGAACAAG-3′ R: 5′-CGCAAATACAAACGCAATTATCAT-3′ Potri.005G172400 NR F:5′-ATCATCGGATCGGAGAGTTGG-3′ R: 5′-GACGGT-GCTAGTTGGCGTATAG-3′ Potri.004G140800 NiR F:5′-ACAAGTTGCCGATATTGGGTTCAT-3′ R: 5′-CCTCTATCACCCGTCGTAGTCCTG-3′ Potri.017G131100 GS1.3 F: 5′-GGCGCAGACCAAGCTTCTC-3′ R: 5′-GCGAAGTGACAGATTTAGGATTGC-3′ Potri.010G029100 GS2 F: 5′-ATCAGGTGGGTCCCAGTGTG-3′ R: 5′-GCGAAGTGACAGATTTAGGATTGC-3′ Potri.016G036900 Fd-GOGAT F: 5′-AACCCAAAGGCATCAGACTCAG-3′ R: 5′-AGTAAAGCAGGTCCATCCCAAG-3′ Potri.012G011700 NADH-GOGAT F: 5′-GGTGTTGTGGATATTCCTCCTG-3′ R: 5′-TCAGATGCGGCGACAACCC-3′ Potri.013G058300 GDH F: 5′-ATTTATGCTAACTCAGGAGGCGTT-3′ R: 5′-GAGGAGGAAACTAGGGCAATACAT-3′ Potri.018G006000 VHA1.1 F: 5′-CCGCTCAGACCAACACTATCTT-3′ R: 5′-TCCTCTGGGCTTGAATGGTAG-3′ Potri.018G090300 VHA2.2 F: 5′-GGCTCCAACCACCTGAGACAG -3′ R: 5′-AGCACAGCCCTTTCTCTTCCA-3′ 内参基因 Normalized gene Actin 2/7 F: 5′-CCCATTGAGCACGGTATTGT-3′ R: 5′-TACGACCACTGGCATACAGG-3′ 表 4 不同施肥处理对高产优质毛白杨良种无性系苗高的影响
Table 4 Effects of different fertilization treatments on clone seedling height of improved variety for high yield and high quality P. tomentosa
cm 处理
Treatment‘毅杨1号’
‘Yiyang 1’‘毅杨2号’
‘Yiyang 2’‘毅杨3号’
‘Yiyang 3’1 176.85 ± 11.25B 192.35 ± 13.15AB 180.1 ± 5.12AB 2 215.22 ± 8.13A 219.13 ± 10.19A 189.22 ± 5.09A 3 211.55 ± 3.35A 209.17 ± 8.51AB 167.22 ± 4.71C 4 215.12 ± 10.14A 165.14 ± 7.197C 175.18 ± 6.2BC 5 185.71 ± 7.31B 173.87 ± 10.15C 150.91 ± 5.13CD 6 212.25 ± 9.54A 229.45 ± 2.51A 164.13 ± 8.23CD 7 174.55 ± 3.41B 166.25 ± 7.22C 194.12 ± 6.25A 8 175.16 ± 11.25B 197.05 ± 7.15AB 184.21 ± 5.61AB 9 129.65 ± 7.15C 183.71 ± 4.23C 163.75 ± 4.13C CK 163.2 ± 11.04B 131.82 ± 5.81D 95.3 ± 7.91E 注:在P < 0. 01水平上差异显著。下同。Notes: significant difference at P < 0. 01 level. Same as below. 表 5 不同施肥处理对高产优质毛白杨毅杨良种无性系地径的影响
Table 5 Effects of different fertilization treatments on the clone diameter of improved variety for high yield and high quality P. tomentosa
cm 处理
Treatment‘毅杨1号’
‘Yiyang 1’‘毅杨2号’
‘Yiyang 2’‘毅杨3号’
‘Yiyang 3’1 1.14 ± 0.12C 1.58 ± 0.13A 1.39 ± 0.09B 2 1.63 ± 0.06A 1.66 ± 0.12A 1.72 ± 0.08A 3 1.62 ± 0.04A 1.62 ± 0.05A 1.55 ± 0.13A 4 1.60 ± 0.05A 1.33 ± 0.12AB 1.69 ± 0.11A 5 1.69 ± 0.07A 1.38 ± 0.14AB 1.24 ± 0.03C 6 1.71 ± 0.12A 1.60 ± 0.13A 1.63 ± 0.07A 7 1.47 ± 0.14AB 1.30 ± 0.12B 1.71 ± 0.07A 8 1.52 ± 0.06AB 1.60 ± 0.04A 1.84 ± 0.13A 9 1.12 ± 0.05C 1.40 ± 0.06B 1.67 ± 0.07A CK 1.13 ± 0.12C 0.99 ± 0.06C 0.97 ± 0.06D 表 6 不同施肥处理对高产优质毛白杨毅杨良种无性系生物量的影响
Table 6 Effects of different fertilization treatments on the clone biomass of improved variety for high yield and high quality P. tomentosa
cm 处理
Treatment‘毅杨1号’
‘Yiyang 1’‘毅杨2号’
‘Yiyang 2’‘毅杨3号’
‘Yiyang 3’1 98.16 ± 8.21BC 121.05 ± 11.58A 111.97 ± 3.21C 2 112.36 ± 10.14AB 124.51 ± 12.06A 143.82 ± 6.92A 3 134.24 ± 8.83A 113.61 ± 10.28A 95.73 ± 5.21D 4 125.23 ± 11.65AB 123.24 ± 11.21A 138.8 ± 7.58A 5 101.35 ± 12.81BC 95.31 ± 9.65BC 72.35 ± 4.95E 6 134.18 ± 6.75A 125.56 ± 4.54A 78.46 ± 7.21E 7 103.81 ± 12.24BC 61.49 ± 8.15D 143.25 ± 4.33A 8 92.21 ± 8.11C 106.78 ± 4.16B 130.14 ± 9.52A 9 59.18 ± 2.43D 82.65 ± 6.71BC 113.86 ± 8.12B CK 52.97 ± 4.87D 51.38 ± 5.16D 29.12 ± 3.41F -
[1] Zhao D, Kang M, Teskey R, et al. Maximum response of loblolly pine plantations to silvicultural management in the southern United States[J]. Forest Ecology and Management, 2016, 375: 105−111. doi: 10.1016/j.foreco.2016.05.035
[2] 赵燕, 董雯怡, 张志毅, 等. 施肥对毛白杨杂种无性系幼苗生长和光合的影响[J]. 林业科学, 2010, 46(4):70−77. doi: 10.11707/j.1001-7488.20100411 Zhao Y, Dong W Y, Zhang Z Y, et al. Effects of fertilization on seedling growth and photosynthesis of hybrid clone seedling of Populus tomentosa[J]. Scientia Silvae Sinicae, 2010, 46(4): 70−77. doi: 10.11707/j.1001-7488.20100411
[3] 刘勇, 陈艳, 张志毅, 等. 不同施肥处理对三倍体毛白杨苗木生长及抗寒性的影响[J]. 北京林业大学学报, 2000, 22(1):38−44. doi: 10.3321/j.issn:1000-1522.2000.01.009 Liu Y, Chen Y, Zhang Z Y, et al. Effects of fertilizer treatments on seedling growth and cold resistance of triploid Populus tomentosa[J]. Journal of Beijing Forest University, 2000, 22(1): 38−44. doi: 10.3321/j.issn:1000-1522.2000.01.009
[4] Jeyanny V, Rasip A A, Rasidah K W, et al. Effects of macronutrient deficiencies on the growth and vigour of Khaya ivorensis seedlings[J]. Journal of Tropical Forest Science, 2009, 21(2): 73−80.
[5] Albaugh T J, Lee A H, Dougherty P M, et al. Long term growth responses of loblolly pine to optimal nutrient and water resource availability[J]. Forest Ecology and Management, 2004, 192(1): 3−19. doi: 10.1016/j.foreco.2004.01.002
[6] 孙时轩, 张振江, 孙小丽, 等. 毛白杨在沙地造林的施肥量及其配比(Ⅱ)[J]. 北京林业大学学报, 1995, 17(1):31−36. Sun S X, Zhang Z J, Sun X L, et al. Fertilization amounts applied to the artificial young forest of Populus tomentosa Carr. on sandy soil and their ratios[J]. Journal of Beijing Forest University, 1995, 17(1): 31−36.
[7] 姜岳忠, 吴晓星, 马玲. 毛白杨苗期生长特性及需肥量研究[J]. 甘肃农业大学学报, 2004, 39(4):423−426. doi: 10.3969/j.issn.1003-4315.2004.04.015 Jiang Y Z, Wu X X, Ma L. Relationship of growth and nutrient requirement of Populus tomentosa seedlings[J]. Journal of Gansu Agricultural University, 2004, 39(4): 423−426. doi: 10.3969/j.issn.1003-4315.2004.04.015
[8] 曹帮华, 巩其亮, 齐清. 三倍体毛白杨苗期不同配方施肥效应的研究[J]. 山东农业大学学报(自然科学版), 2004, 35(4):512−516. doi: 10.3969/j.issn.1000-2324.2004.04.009 Cao B H, Gong Q L, Qi Q. Study on effects of different fertilizer scheme on seedlings of triploid Populus tomentosa[J]. Journal of Shandong Agricultural University (Natural Science), 2004, 35(4): 512−516. doi: 10.3969/j.issn.1000-2324.2004.04.009
[9] Miller B D, Hawkins B J. Nitrogen uptake and utilization by slow- and fast-growing families of interior spruce under contrasting fertility regimes[J]. Canadian Journal of Forest Research, 2003, 33(6): 959−966. doi: 10.1139/x03-017
[10] Mckeand S E, Grissom J E, HandestT J A, et al. Responsiveness of diverse provenances of loblolly pine to fertilization-age 4 result[J]. Journal of Sustainable Forestry, 1999, 10(1−2): 87−94. doi: 10.1300/J091v10n01_10
[11] Luo J, Li H, Liu T, et al. Nitrogen metabolism of two contrasting poplar species during acclimation to limiting nitrogen availability[J]. Journal of Experimental Botany, 2013, 64(14): 4207−4224. doi: 10.1093/jxb/ert234
[12] Wang Y Y, Cheng Y H, Chen K E, et al. Nitrate transport, signaling, and use efficiency[J]. Annual Review of Plant Biology, 2018, 69(1): 85−122.
[13] Song Y, Chen Q, Ci D, et al. Effects of high temperature on photosynthesis and related gene expression in poplar[J]. BMC Plant Biology, 2014, 14: 111−131. doi: 10.1186/1471-2229-14-111
[14] Kotur Z, Mackenzie N, Ramesh S, et al. Nitrate transport capacity of the Arabidopsis thaliana NRT2 family members and their interactions with AtNAR2.1[J]. New Phytologist, 2012, 194(3): 724−731. doi: 10.1111/j.1469-8137.2012.04094.x
[15] Li H, Li M, Luo J, et al. N-fertilization has different effects on the growth, carbon and nitrogen physiology, and wood properties of slow- and fast-growing Populus species[J]. Journal of Experimental Botany, 2012, 63(17): 6173−6185. doi: 10.1093/jxb/ers271
[16] Dluzniewska P, Gessler A, Dietrich H, et al. Nitrogen uptake and metabolism in Populus × canescens as affected by salinity[J]. New Phytologist, 2007, 173(2): 279−293. doi: 10.1111/j.1469-8137.2006.01908.x
[17] 续九如, 黄智慧. 林业试验设计[M]. 北京: 中国林业出版社, 1995. Xu J R, Huang Z H. Experimental design for forestry[M]. Beijing: China Forestry Publishing House, 1995.
[18] Brunner A M, Yakovlev I A, Strauss S H. Validating internal controls for quantitative plant gene expression studies[J]. BMC Plant Biology, 2004, 4(1): 14−21. doi: 10.1186/1471-2229-4-14
[19] 朱之悌. 毛白杨遗传改良[M]. 北京: 中国林业出版社, 2006. Zhu Z T. Genetic improvement of Populus tomentosa Carr[M]. Beijing: China Forestry Publishing House, 2006.
[20] 武维华. 植物生理学[M]. 北京: 科学出版社, 2003. Wu W H. Plant phytophysiology[M]. Beijing: Science Press, 2003.
-
期刊类型引用(2)
1. 魏红洋,张一帆,董灵波,刘兆刚,陈莹. 帽儿山主要林分类型空间结构状态综合评价. 中南林业科技大学学报. 2021(10): 131-139 .  百度学术
百度学术
2. 刘文桢,袁一超,张连金,赵中华. 基于林分内部状态与邻域环境的油松林稳定性评价. 林业科学. 2021(09): 76-86 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: