Selection of elite transgenic lines of BpGH3.5 in Betula platyphylla
-
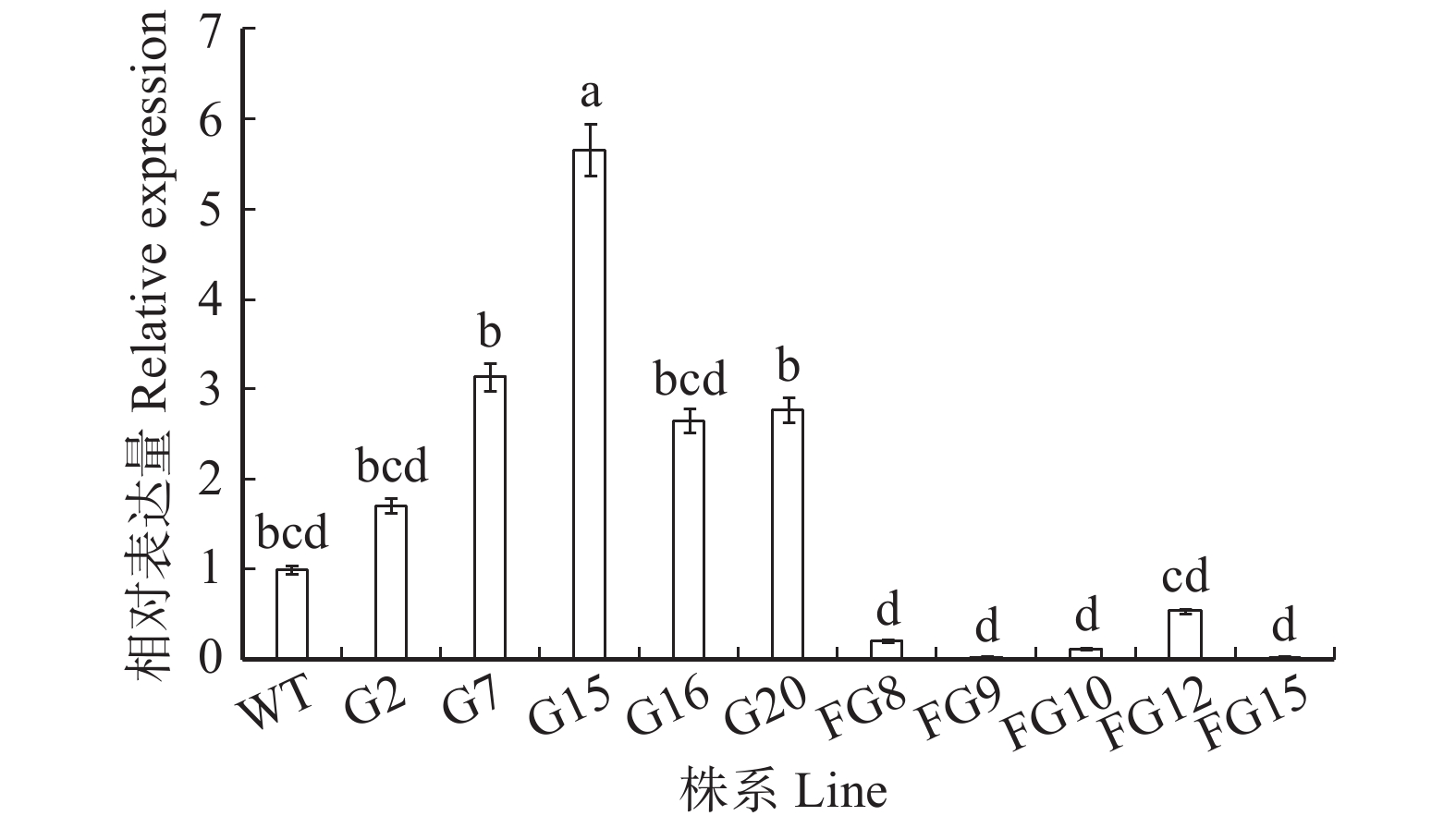
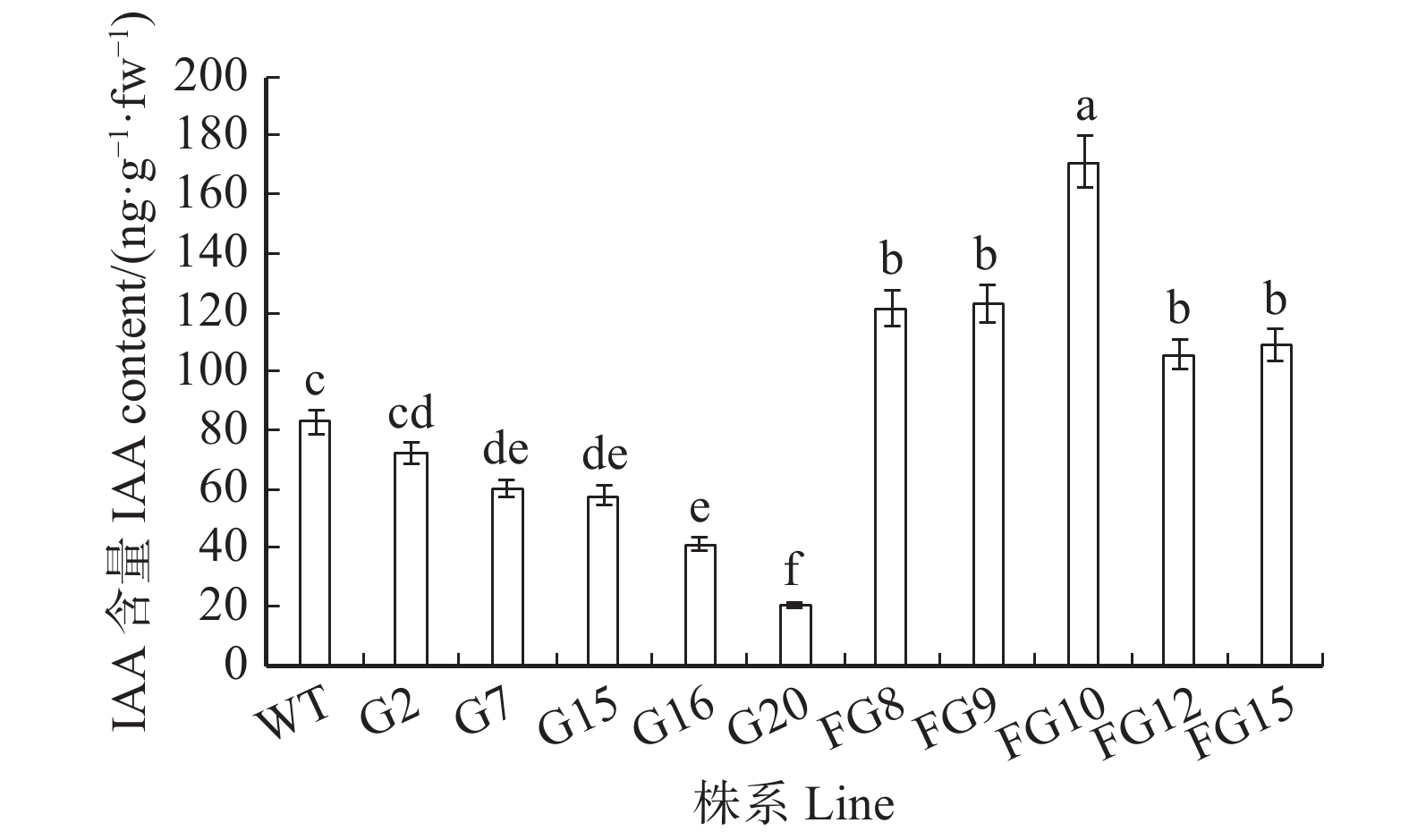
摘要:目的植物生长素酰胺合成酶基因家族(GH3s)为典型的植物生长素初级/早期响应基因,多数家族基因可通过调节植物体内游离IAA的浓度实现对生长发育的调控。故此,采用基因工程育种技术将BpGH3.5正义链、反义链导入白桦基因组中,预期获得速生转基因白桦新品种。方法以7年生白桦转BpGH3.5基因的54个正、反义链株系及对照(WT)株系为研究对象,测定树高、胸径及材积等生长指标,采用PCR及qRT-PCR技术分别检测转正、反义链各5个株系目标基因的遗传稳定性及相对表达量,同时采用ELISA技术测定游离IAA含量。结果PCR扩增显示,转基因株系中的nptⅡ外源基因均为阳性;qRT- PCR分析显示,5个转正义链株系中BpGH3.5基因表达量均显著高于WT株系,相反,5个转反义链株系中内源BpGH3.5基因表达量均显著下调,即BpGH3.5反义链导入白桦基因组后干扰了白桦BpGH3.5基因的表达。内源游离IAA含量测定显示,转BpGH3.5正义链株系的IAA含量低于或显著低于WT株系,5个转反义链株系均显著高于WT株系(P < 0.01),其IAA含量均值高于WT株系的52.26%。7年生转BpGH3.5白桦的树高、胸径及材积生长性状在株系间的差异达到了极显著水平(P < 0.01),在树高、胸径及材积生长指标高于群体均值的转基因株系中,转反义链株系占80%以上,认为BpGH3.5反义链导入白桦基因组中通过抑制BpGH3.5基因的表达,削弱IAA氨基酸化的能力,进而释放更多游离IAA从而促进白桦的生长。采用主成分分析法,选出10个速生的转反义链株系,这些株系的树高、胸径及材积均值较群体均值分别高8.55%、19.28%、50.42%,材积的平均遗传增益为36.3%。上述入选株系为后续转BpGH3.5白桦的环境释放提供参考。结论BpGH3.5反义链导入白桦基因组中,能够抑制BpGH3.5基因的表达,同时释放更多游离IAA而促进白桦的生长,采用主成分分析法,选出10个优良株系。
-
关键词:
- 白桦 /
- 转基因,生长素酰胺合成酶基因(GH3.5) /
- IAA /
- 优良株系
Abstract:ObjectiveThe auxinamide synthase gene family (GH3s) is a typical auxin primary/early response gene. Most family genes can regulate growth and development by regulating the concentration of free IAA in plants. Therefore, genetic engineering was used to introduce the BpGH3.5 sense and antisense strand into the Betula platyphylla genome in order to obtain fast-growing transgenic Betula platyphylla variety.MethodIn total, 54 sense, antisense and control (WT) transgenic lines of BpGH3.5 were used in the study. Tree height, DBH and volume were measured. The genetic stability and relative expression of the target gene of five sense and antisense lines were detected by PCR and qRT-PCR, respectively. The free IAA content was determined by enzyme-linked immunosorbent assay.ResultPCR showed that the nptII exogenous genes in the transgenic lines were all positive. qRT-PCR analysis showed that the BpGH3.5 gene was significantly higher in the five sense lines than in the WT line. In contrast, the endogenous BpGH3.5 was significantly down-regulated in the five antisense lines. The genome interfered the expression of BpGH3.5 in Betula platyphylla. The content of endogenous free IAA showed that the IAA content of the transgenic BpGH3.5 sense lines was significantly lower than that of the WT line. IAA content of the five antisense lines was significantly higher than that of the WT line (P< 0.01), and their average IAA content was 52.26% higher than the WT line. The differences in tree height, DBH and volume growth of 7-year-old transgenic BpGH3.5 Betula platyphylla were significant among lines (P< 0.01). Height, DBH and volume of transgenic lines were higher than the population mean, the antisense lines accounted for above 80%. In conclusion, transgenic BpGH3.5 antisense lines of Betula platyphylla can inhibit the expression of BpGH3.5, and reduce the ability of amino acid production resulting release more free IAA to promote the growth of Betula platyphylla. Ten fast growing trees were selected from antisense lines using principal component analysis. The average tree height, DBH and volume of these lines were 8.55%, 19.28%, and 50.42% higher than the population mean, respectively. The average genetic gain of tree volume was 36.3%. Results of selected lines provide useful information for future release transgenic BpGH3.5 lines in Betula platyphylla.ConclusionTransgenic BpGH3.5 antisense lines of Betula platyphylla can inhibit the expression of BpGH3.5, and release more free IAA to promote the growth of Betula platyphylla. Ten fast growing trees were selected from antisense lines using principal component analysis. -
随着我国现代工农业的快速发展,农药和化肥的过度利用造成大量重金属排放到环境中并在农田土壤中积累,大面积的农田被重金属和其他有害物质污染后,不仅会对作物的产量和品质产生深远影响,而且会通过食物链的形式最后进入人体,最终危害人类的身体健康,重金属污染土壤的修复问题引发了人们的广泛关注[1-2]。据了解,我国有30%的土壤已受到不同程度的重金属污染,而这些农田是运用污水灌溉的方式来处理的,其中以镉(Cd)污染为主,其在土壤中平均含量为 0.2 mg/kg[3-5]。进一步研究表明,土壤或水污染物的净化可以通过植物蒸发、根过滤和降解的机制来实现,从而达到净化的目的,因此植物修复土壤具有很强的潜力,逐渐成为近年来重金属污染修复的国内外讨论和研发的热点[6-7]。
杨树是杨柳科(Salicaceae)杨属(Populus)树种的统称,是世界上分布和栽培面积较大的树种,也是重要的工业用材林、生态防护林和生物质能源树种,其根系发达,对外来毒性物质耐受性强,具富集及转运重金属到地上部分的能力[8-9]。杨树可做短轮伐或超短轮伐栽培,也可与浅根系草本植物间作,分别修复不同深度土壤的重金属。因此,在北美洲杨树已被广泛应用于修复重金属污染的土壤[10]。黑杨派(Aigeiros)的美洲黑杨(P. deltoides)及其杂交种欧美杨(P. × euramericana)是世界上栽培面积较大、经济价值较高的杨树种类,也是中国广泛栽培的重要树种,具有显著的经济、生态和社会效益[11]。张春燕等[12]通过利用杨树修复被镉污染的土壤,得出在一个生长期内能够使土壤中Cd含量减少16 ~ 112 mg/L结论;何佳丽探索了不同杨树品种对Cd积累、转运和耐受性上的差异,随后深入研究了杨树对Cd吸收、转运和积累的分子生理调控机制[13];郑慧芳[14]以欧美杨97号为研究对象进行沙培试验,通过对相关生理指标的测定,对Cd胁迫杨树耐受性的生理响应及对生长影响规律进行总结。杨传宝等研究白杨派无性系在NaCl及NaHCO3胁迫下的生长生理响应时发现,白杨派无性系具有一定的耐盐碱能力,并初步选育出3个耐盐碱较强的无性系[15-16];在对白杨派无性系进行干旱胁迫时研究发现,白杨派无性系也具有一定的抗旱能力,并选育出2个抗旱性较强的无性系[17]。以上研究仅局限在杨树对不同重金属离子的积累、转运、分子生理调控、耐盐碱、抗干旱等方面,而对不同重金属离子浓度胁迫黑杨派不同无性系生理生化特性和生长量的研究未见报道。本研究通过不同质量浓度Cd2+对黑杨派5个无性系进行胁迫,测定其生理生化特性和生长量,探讨杨树不同无性系对Cd胁迫的响应差异,筛选出对重金属Cd耐受性强的无性系,从而为杨树修复重金属污染土壤提供技术支撑。
1. 材料和方法
1.1 试验材料
2018年3月上旬于山东省长清区育苗基地采集试验材料,包括黑杨派5个无性系:I-107(P. × euramericana ‘Neva’)、L35(P. × euramericana ‘L35’)、中菏1号(P. deltoides ‘Zhonghe 1’)、鲁林9号(P. deltoides ‘Lulin 9’)和鲁林16号(P. deltoides ‘Lulin 16’)。
1.2 试验方法
采用盆栽试验方法。先在具有透水孔的塑料盆底部铺设一层无纺布,然后装入消毒后的细沙,将6个塑料盆放入同一塑料箱中;配制0.44%的MS营养液(不含琼脂和蔗糖),用该营养液和Cd(NO3)2·4H2O配制6种质量浓度的Cd2+溶液[18]:0 mg/L、5 mg/L、10 mg/L、15 mg/L、20 mg/L 和25 mg/L,其中0 mg/L Cd2+溶液为对照(CK),将这6种质量浓度的溶液(pH值为7.0)分别倒入6个塑料箱中。
2018年4月26日选取上述杨树无性系的粗度一致的1年生苗干,剪成长度15 cm左右的插穗,每个塑料盆中插入1个插穗,每个无性系重复6次。扦插完毕后,随即在温室内进行胁迫试验,做好标记,置于温室,同时采用称质量法定期补充塑料箱内的MS营养液。温室内的温度夜间在25 ℃左右,白天在30 ℃左右;相对湿度60%左右;光合有效辐射强度150 μmol/(m2·s)左右。
1.3 指标测定
1.3.1 苗高和地径测定
苗木落叶后,选取3盆生长势较一致的植株,测量每株苗高(cm)和地径(mm),采用米尺测量苗高,用游标卡尺测量地径。
1.3.2 生理生化指标测定
在8月上旬,每个无性系选取3盆生长势较一致的植株,采样时每株苗木均剪取从顶端数第6、7、8这3个功能叶片,将每株样品分别放入密封袋,置于冰壶中带回实验室,立即将每个单株的3个叶片剪碎混合均匀后进行生理生化指标测定。试验设3次重复。过氧化氢酶(CAT)的活性运用高锰酸钾滴定法检测,MDA含量利用硫代巴比妥酸与丙二醛(MDA)反应法的方式测定,过氧化物酶(POD)活性通过比色法对比测定,超氧化物岐化酶(SOD)活性采取氮蓝四唑(NBT)染色剂测定[19],通过美国2265FS型电导率仪来测定电导率,同时细胞膜透性使用DDS-12A型电导仪测定,可溶性糖含量通过蒽酮光度法进行测定,脯氨酸(Pro)含量采用茚三酮反应显色法进行检测[20],叶绿素的含量则采取丙酮乙醇混合液萃取法对其进行测定[20 -21]。
1.4 数据处理
本试验的数据使用Microsoft Excel进行运算处理,并进行柱状图的绘制,用SPSS 21.0软件进行单因素方差分析及主成分分析,运用主成分分析对5个黑杨派无性系对重金属Cd的抗性能力进行综合评价。
2. 结果与分析
2.1 镉胁迫对黑杨派无性系地径与苗高的影响
经不同质量浓度Cd2+ 胁迫,不同无性系的地径生长量见图1。无性系I-107在Cd2+ 质量浓度为10 mg/L时,地径均值最大,为7.9 mm;中菏1号与鲁林16号均在Cd2+ 质量浓度为0 mg/L时,地径均值最大,分别为8.18 mm、8.02 mm;L35与鲁林9号均在Cd2+ 质量浓度为20 mg/L时,地径均值最大,分别为7.31 mm、8.56 mm。与CK相比,在Cd2+ 质量浓度达到25 mg/L时,各无性系地径均值均有不同程度变化,其中无性系鲁林16号较CK下降最多,较CK下降33.44%;其次为无性系中菏1号与I-107,较CK分别下降26.63%、5.63%;而L35与鲁林9号较CK分别上升23.58%、4.3%。研究表明,黑杨派各无性系间的平均地径在Cd2+ 质量浓度20 mg/L胁迫下存在差异,鲁林9号和中菏1号的差异达显著水平,而在其他质量浓度处理下,无性系间的平均地径差异均未达到显著水平。
![]() 图 1 不同Cd2+质量浓度对不同无性系地径的影响不同小写字母表示同一处理不同无性系间差异显著(P < 0.05)。下同。Different lowercase letters indicate that there are significant differences among different clones in the same treatment (P < 0.05). The same below.Figure 1. Effects of Cd2+ with different mass concentrations on ground diameter of different clones
图 1 不同Cd2+质量浓度对不同无性系地径的影响不同小写字母表示同一处理不同无性系间差异显著(P < 0.05)。下同。Different lowercase letters indicate that there are significant differences among different clones in the same treatment (P < 0.05). The same below.Figure 1. Effects of Cd2+ with different mass concentrations on ground diameter of different clones经不同Cd2+ 质量浓度胁迫,不同无性系的苗高生长量见图2。无性系中菏1号与鲁林16号均在Cd2+ 质量浓度为0 mg/L时,苗高均值最大,分别为60.68 cm、89.40 cm;I-107在Cd2+ 质量浓度为15 mg/L时,苗高均值最大,为102.76 cm;L35在Cd2+ 质量浓度为20 mg/L时,苗高均值最大,为103.52 cm;而鲁林9号在Cd2+ 质量浓度为25 mg/L时,苗高均值最大,为96.22 cm。与CK相比,在Cd2+ 质量浓度达到25 mg/L时,各无性系苗高均值均有不同程度变化,其中无性系鲁林16号较CK下降最多,较CK下降23.96%;其次为无性系I-107与中菏1号,较CK分别下降7.82%、1.04%;而L35与鲁林9号较CK分别上升11.14%、16.24%;这与各无性系在Cd2+ 胁迫下平均地径变化趋势是一致的。研究表明,与CK相比,黑杨派各无性系间的平均苗高在相同质量浓度Cd2+ 胁迫下存在差异,且差异达到显著水平,表明参试无性系苗高性状较地径对Cd2+ 的胁迫更为敏感。
2.2 镉胁迫对5个黑杨派无性系过氧化氢酶(CAT)活性的影响
随着Cd2+ 质量浓度的升高,中菏1号和鲁林9号的CAT活性呈逐渐增加的趋势,其他3个无性系表现出先增加后减少的趋势,而且均在Cd2+ 质量浓度为15 mg/L时达到最大值(图3)。其中鲁林16号的CAT活性明显而且始终高于其他4个无性系。由图3可知在Cd2+ 质量浓度达25 mg/L时,各无性系CAT活性均高于CK,其中无性系中菏1号较CK上升3.43倍,其次为L35、鲁林9号、I-107、鲁林16号,分别上升102.0%、79.1%、35.88%、21.51%;说明黑杨派无性系在不同Cd2+ 胁迫下,其CAT活性均有增加。
2.3 镉胁迫对5个黑杨派无性系丙二醛(MDA)含量的影响
随着Cd2+ 质量浓度的升高,5个无性系的MDA含量均呈现出先增加后减少的趋势,并且都在Cd2+ 质量浓度为20 mg/L时含量达到最高,与CK相比明显增加(图4)。在整个试验期间,鲁林16号的MDA含量一直呈现较低水平,在质量浓度为25 mg/L处理时明显低于其他4个无性系,鲁林9号、I-107、中菏1号在20 mg/L处理时MDA含量增加显著,并明显高于另外2个无性系。在Cd2+ 质量浓度达到25 mg/L时,与CK相比,各无性系MDA含量均有明显上升趋势,其中无性系中菏1号上升最明显,较CK上升16.14倍;其次为无性系L35、鲁林9号、I-107、鲁林16号,较CK分别上升12.24倍、11.3倍、3.91倍、2.19倍,并且无性系间的差异达到显著水平。
2.4 镉胁迫对5个黑杨派无性系过氧化物酶(POD)活性的影响
随着Cd2+ 质量浓度的升高,L35、鲁林16号和鲁林9号3个无性系的POD活性呈现先增加后减少的趋势,而I-107和中菏1号的POD活性一直处在较低状态,明显低于其他3个无性系,而且随着Cd2+ 质量浓度升高POD活性没有明显变化(图5)。除了I-107以外,其余4个无性系POD活性均在10 mg/L处理下达到最大值,其中鲁林16号的活性最高。从10 mg/L处理之后直到Cd胁迫末期,4个无性系的POD活性均表现了降低的趋势。在Cd2+ 质量浓度达到25 mg/L时,与CK相比,除中菏1号有上升趋势外,其余无性系均有下降趋势,其中无性系I-107较CK下降最明显,较CK下降52.43%;其次为鲁林16号、鲁林9号、L35,较CK分别下降35.3%、26.06%、17.34%。在相同质量浓度处理下,黑杨派无性系间的POD含量差异达显著水平。
2.5 镉胁迫对5个黑杨派无性系超氧化物歧化酶(SOD)活性的影响
随着Cd2+ 质量浓度的升高,5个无性系的SOD活性均呈现出先增加后减少的趋势(图6)。其中,鲁林16号SOD活性最大值处于20 mg/L处理中,鲁林9号的最大值位于10 mg/L处理中,其余3个无性系的最大值均在15 mg/L处理下。在各个质量浓度的Cd处理下,5个无性系SOD活性相差不大,均没有达到显著水平。在Cd2+ 质量浓度达到25 mg/L时,与CK相比,除无性系I-107有下降趋势外,其他无性系均有上升趋势,其中无性系鲁林9号较CK上升最明显,上升24.94%;其次为中菏1号、鲁林16号、L35,较CK分别上升18.64%、14.07%、3.22%。
2.6 镉胁迫对5个黑杨派无性系电导率的影响
随着Cd2+ 质量浓度的升高,I-107、中菏1号、L35和鲁林9号4个无性系的电导率均呈现出逐渐升高的趋势(图7)。鲁林16号在5个Cd2+ 质量浓度处理下,电导率整体变化不大,在Cd2+ 质量浓度变化范围内呈先增加后减少趋势,且在质量浓度为25 mg/L时电导率略低于CK。其余4个无性系的电导率随着Cd2+ 质量浓度的增加不仅表现出升高的趋势,而且增幅明显,其中L35在25 mg/L处理下电导率较CK上升了11.97倍,增幅与其他无性系相比最为显著。在相同质量浓度处理下,黑杨派无性系间的电导率差异均达显著水平。
2.7 镉胁迫对5个黑杨派无性系可溶性糖含量的影响
随着Cd2+ 质量浓度的升高,中菏1号和L35的可溶性糖含量呈现出持续增加的趋势,I-107、鲁林16号和鲁林9号所表现出来的趋势是先增加后减少(图8)。在Cd2+ 质量浓度为15 mg/L处理下,I-107和鲁林16号可溶性糖含量达最大值。在Cd2+ 质量浓度达到25 mg/L时,与CK相比,各无性系均有上升趋势,其中无性系L35较CK上升最明显,上升82.45%;其次为I-107、中菏1号、鲁林16号、鲁林9号,较CK分别上升31.29%、30.62%、18.21%、11.57%;在该质量浓度处理下,中菏1号和L35的可溶性糖含量与其他3个无性系的差异达显著水平。
2.8 镉胁迫对5个黑杨派无性系脯氨酸含量的影响
随着Cd2+ 质量浓度的升高,I-107、中菏1号和L35的脯氨酸含量呈现出持续增加的趋势,鲁林16号和鲁林9号所表现出来的趋势是先增加后减少(图9)。I-107、中菏1号和L35在较低的Cd2+ 质量浓度下,脯氨酸含量虽然有所增加,但增幅不明显;在25 mg/L处理下,I-107的脯氨酸含量最高,其次为L35;在最高质量浓度处理下,各无性系均有上升趋势,其中无性系I-107较CK上升最明显,较CK上升1.87倍,其次为L35、中菏1号、鲁林16号、鲁林9号,较CK分别上升76.91%、58.79%、55.79%、8.66%。在相同质量浓度处理下,黑杨派无性系间的脯氨酸含量差异均达显著水平。
2.9 镉胁迫对5个黑杨派无性系叶绿素含量的影响
随着Cd2+ 质量浓度的升高,5个无性系的叶绿素含量均呈现出先增加后减少的趋势(图10)。叶绿素含量最大值位于10 mg/L处理,其中以L35的变化最为显著,增幅明显,说明在较低的Cd质量浓度下有利于叶绿素的积累。但若Cd2+ 质量浓度继续升高,则会抑制叶绿素的积累,导致含量下降,在25 mg/L处理下,5个无性系的叶绿素含量都下降到最低,且都低于CK组,其中无性系鲁林9号较CK下降最明显,下降70.8%;其次为I-107、鲁林16号、中菏1号、L35,较CK分别下降37.41%、31.12%、14.37%、7.86%。在相同质量浓度处理下,黑杨派无性系间的叶绿素含量差异均达显著水平。
2.10 主成分分析
在Cd2+ 质量浓度为25 mg/L时,用5个无性系的苗高和地径生长量以及8个生理生化指标进行主成分分析,对各个无性系的抗Cd胁迫能力进行综合评价。表1列出了前4个主成分的分析结果,前3个主成分的累计贡献率为86.63%,其中第一主成分的贡献率为46.22%;根据各个性状对应的特征向量值大小可知,对第一主成分影响较大的性状有超氧化物歧化酶、可溶性糖、脯氨酸、叶绿素等性状,这些性状的向量值均为正值,说明第一主成分值越大,无性系的这些性状值就越大。根据第一主成分值的大小对5个无性系进行综合评价,5个无性系的抗性由强到弱依次为L35、中菏1号、I-107、鲁林9号、鲁林16号(表2)。
表 1 黑杨派无性系Cd胁迫下的主成分分析Table 1. Principal component analysis on Aigeiros clones under Cd stress测定指标 Testing index 第一主成分 Prin1 第二主成分 Prin2 第三主成分 Prin3 第四主成分 Prin4 特征根 Characteristic root 4.622 4 2.583 4 1.457 2 1.336 9 累计贡献 Cumulative contribution rate/% 46.224 8 72.059 2 86.631 5 100.000 0 苗高 Seedling height 0.076 6 0.536 2 0.381 8 −0.115 6 地径 Ground diameter −0.462 7 0.046 6 0.053 4 −0.022 2 过氧化氢酶 CAT −0.348 5 −0.281 2 −0.009 1 0.418 7 丙二醛 MDA 0.177 7 0.000 1 −0.710 0 −0.299 0 过氧化物酶 POD −0.085 6 0.490 2 −0.024 2 0.507 6 超氧化物歧化酶 SOD 0.246 7 −0.401 6 0.387 6 0.249 3 电导率 Electrical conductivity 0.354 3 0.305 5 −0.197 6 0.301 8 可溶性糖 Soluble sugar 0.414 4 0.059 1 −0.108 2 0.367 3 脯氨酸 Proline 0.352 2 0.067 4 0.381 7 −0.389 4 叶绿素 Chlorophyll 0.371 0 −0.358 2 0.003 1 0.155 2 表 2 5个无性系的主成分值及其排序Table 2. Principal component values and ranking of 5 Aigeiros clones项目
ItemI-107
P. × euramericana ‘Neva’中菏1号
P. deltoides‘Zhonghe 1’L35
P. × euramericana ‘L35’鲁林16号
P. deltoides‘Lulin 16’鲁林9号
P. deltoides‘Lulin 9’主成分值
Principal component value0.225 6 1.783 0 2.363 4 −2.427 6 −1.944 4 排序 Order 3 2 1 5 4 3. 讨论与结论
Cd胁迫对不同杨树无性系均具有一定的影响,但是其影响程度受不同无性系和处理浓度的影响。李子芳等[22]提出Cd胁迫下无性系地径、苗高等指标的变化是判断苗木抗胁迫能力最直接最有效的鉴定方法。本研究表明,黑杨派无性系间地径和苗高在相同质量浓度Cd2+ 胁迫下存在差异,苗高变化达到显著水平,随着Cd2+ 质量浓度增加,各个无性系的地径和苗高变化不大,表明黑杨派无性系对Cd2+ 的胁迫均有一定的抗性。这与Rom等[23]研究Cd对杨树幼苗生长影响的结论不一致:低浓度Cd对杨树幼苗生长有明显的促进作用;与顾颉刚[24]研究Cd胁迫对杨树无性系植株生长发育影响的结论也不一致:低浓度Cd对杨树生长影响不大,而高浓度Cd对无性系生长产生毒害作用;当然,不同研究所采用不同杨树品种、树龄及土壤类型的差异均会对Cd胁迫造成一定的影响。
丙二醛(MDA)作为膜脂过氧化作用后产生的最终产物,可破坏细胞质膜,致使大量胞内电解质外渗,其含量的多少可来表示植物在受到逆境时的细胞膜系统受到损害的程度[25]。黄玉敏等研究Cd胁迫对大麻幼苗生长及生理生化影响发现,20 μmol /L、50 μmol /L Cd2+ 处理大麻幼根组织和叶片,其MDA含量升高均达显著和极显著水平,可能是由于高浓度Cd胁迫下过氧化产物在植物体内过量积累导致膜结构损伤所致[26]。本研究表明,随着Cd2+ 质量浓度不断增加,各无性系MDA含量均有大幅度增加,在20 mg/L时达到最高值,说明各无性系过氧化较明显,苗木受害较重。
已有研究发现,在胁迫环境下植物体内的过氧化氢酶(CAT)活性变化幅度能够作为衡量抗性强弱的指标[27]。本研究表明,随着Cd2+ 质量浓度的升高,无性系I-107、L35、鲁林16号的CAT活性表现出先增加后减少的趋势,说明在Cd2+ 在较低质量浓度时(5 ~ 15 mg/L)时,3个无性系并未受到明显伤害,说明植物自身开启CAT系统用于抵御Cd胁迫带来的损害,表明这些无性系对Cd2+ 有一定的抗性,这与尹大川等[28]对Cd2+ 胁迫下外生菌根菌对樟子松生理指标和根际土壤酶的影响结果类似。当Cd2+ 在较高质量浓度时(20 ~ 25 mg/L)时,CAT活性出现下降趋势,表明此时Cd2+ 质量浓度高于该无性系的承受阈值,已对无性系造成了一定的伤害,说明当Cd2+ 浓度超过了CAT的抗性调节程度时,将影响植株正常发育;而无性系中菏1号和鲁林9号的CAT含量随Cd2+ 质量浓度增加呈逐渐增加趋势,说明在本研究中Cd2+ 质量浓度并未超出这2个无性系的承受阈值,也反应出了这2个无性系对Cd2+ 胁迫具有较强抗性。
过氧化物酶(POD)具有清除自身体内由于环境胁迫所产生的自由基,对细胞进行保护和降低细胞损伤等方面发挥了重要作用[29]。本研究表明,在不同Cd2+ 质量浓度胁迫下,5个无性系的POD活性整体来看均呈现先增加后减少的趋势,其中无性系L35在20 mg/L与25 mg/L的Cd胁迫下POD活性均达到最高,说明无性系L35在高质量浓度Cd胁迫下具有较强抗性。Cd胁迫对黑杨派无性系造成了不同程度的氧化损伤,造成POD活性升高,通过清除自由基等来保护无性系免受伤害。超氧化物歧化酶(SOD)作为生物体内存在的一种抗氧化金属酶,在机体氧化与抗氧化平衡中起到至关重要的作用,其主要通过清除O2− 来降低膜脂的过氧化作用以保护细胞免受侵害[30]。本研究结果表明: 随着Cd2+ 质量浓度不断增大,各无性系SOD活性均表现为先升后降趋势,但总体变化不大,表明在Cd2+ 质量浓度变化范围内各无性系通过增加SOD活性清除了过量O2− ,有效的抵御了Cd的毒害。这与孙永娣等对Cd胁迫对茅苍术(Atractylodes lancea)生理生化特征的影响研究有一致的结论[31]。
在植物抵抗环境胁迫中渗透调节起到了至关重要的作用,其中可溶性糖和脯氨酸二者在维持植物细胞渗透压平衡方面充当着重要的角色[32]。本研究表明,随着Cd2+ 质量浓度的升高,5个无性系的脯氨酸和可溶性糖含量均有所增加,这表明植物会在受到渗透胁迫时利用脯氨酸和可溶性糖来增强其自身的渗透调节功能,因此,脯氨酸和可溶性糖的积累在黑杨派无性系抵抗Cd胁迫中起到了重要作用。叶绿素具有吸收、传递和转化光能的作用。在Cd胁迫下,叶绿素a、叶绿素b含量降低,最终破坏植物的光合作用从而抑制植物生长发育[33]。本试验中,5个无性系的叶绿素含量均呈现出先增加后减少的趋势,在较低的Cd2+ 质量浓度下有利于叶绿素的积累,而如果Cd2+质量浓度继续升高,则会抑制叶绿素的积累,导致含量下降;这与马晓华等对Cd与Cu胁迫下无柄小叶榕(Ficus concinna var. subsessilis)的生理响应研究有相似的结论[34]。
主成分分析是把多个指标化为少数几个综合指标的一种统计分析方法,常常用第一主成分值对无性系进行综合评价。本研究利用上述10个指标对黑杨派5个无性系进行主成分分析和综合评价,发现对第一主成分影响较大的性状有超氧化物歧化酶、可溶性糖、脯氨酸、叶绿素等性状,无性系L35、中菏1号和I-107的第一主成分值排在前三位,表现出较好的抗Cd胁迫能力。其中L35和I-107属于欧美杨无性系,中菏1号是美洲黑杨无性系,这3个无性系均是目前生产中推广应用的杨树优良品种,因此在其适生区域可以用于修复重金属Cd污染的土壤。
-
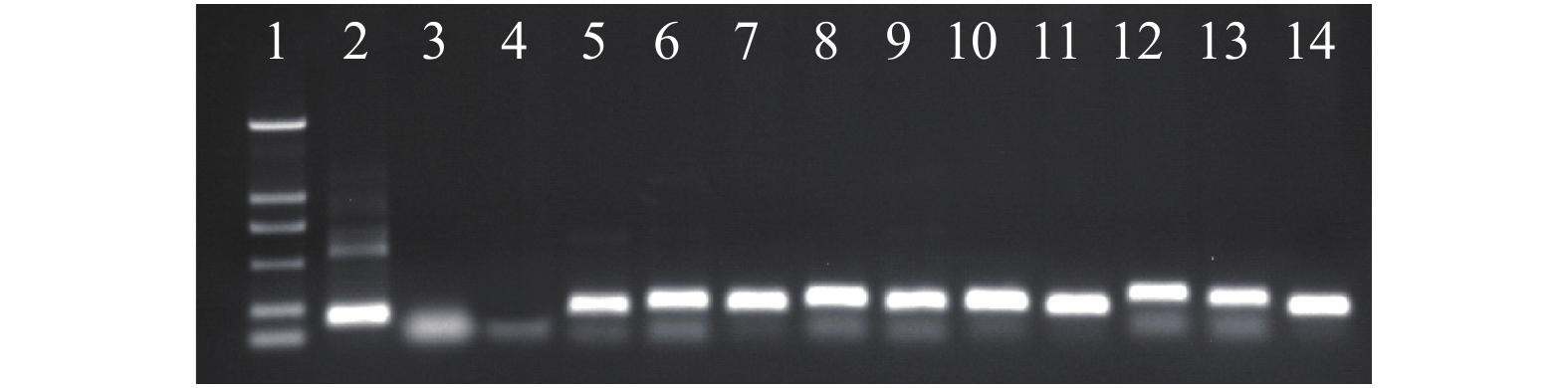
图 1 BpGH3.5转基因白桦中nptⅡ基因检测电泳图谱
1. Marker DL2000(2 kb、1 kb、0.75 kb、0.50 kb、0.20 kb、0.10 kb);2. 阳性质粒;3. 阴性水对照;4. WT株系;5. G2;6. G7;7. G15;8. G16;9. G20;10. FG8;11. FG9;12. FG10;13. FG12;14. FG15。1, Marker DL2000 (2 kb、1 kb、0.75 kb、0.50 kb、0.20 kb、0.10 kb); 2, positive plasmid; 3, negative control (water); 4, WT line; 5, G2; 6, G7; 7, G15; 8, G16; 9, G20; 10, FG8; 11, FG9; 12, FG10; 13, FG12; 14, FG15.
Figure 1. Electrophoresis map of nptII gene in BpGH3.5 transgenic Betula platyphylla
表 1 qRT-PCR引物序列
Table 1 qRT-PCR primer sequences
基因 Gene 正向引物(5′—3′) Forward primer (5′−3′) 反向引物(5′—3′) Reverse primer (5′−3′) 18SrRNA ATCTTGGGTTGGGCAGATCG CATTACTCCGATCCCGAAGG BpGH3.5 TCAGATTCTTAGGTTGGGAGCA GGCAGTAGGTGGATTGTTTGTAG 内源BpGH3.5 Endogenous BpGH3.5 AGCAAGCTCTCAACAGGAAACAG GAATCCGGCGAAGTGTTTGGG 表 2 参试株系间各性状方差分析及遗传参数
Table 2 Analysis of variance and genetic parameters of various traits among tested lines
性状 Trait 平方和
SS自由度
df均方
MSF 检验值
F显著性
P遗传参数 Genetic parameter 均值
Mean变幅
Amplitude变异系数
Coefficient of variation/%重复力
Repeatability树高 Tree height/m 47.619 54 0.882 3.136** 0.000 5.28 3.20 ~ 6.27 12.73 0.770 胸径 DBH/cm 45.270 54 0.838 2.169** 0.000 3.91 2.25 ~ 4.98 18.35 0.784 材积 Volume/m3 0.000 227 54 0.000 1.858** 0.002 0.003 6 0.001 0 ~ 0.006 6 46.06 0.820 注:**表示在0.01水平上差异显著。Note: ** indicates a significant difference at P < 0.01 level. 表 3 转BpGH3.5基因白桦参试性状多重比较
Table 3 Multiple comparisons of test traits of transgenic BpGH3.5 for Betula platyphylla
株系
Line树高
Tree height/m株系
Line胸径
DBH/cm株系
Line材积
Volume/m3FG15 6.27 ± 0.387a FG9 4.98 ± 1.106a FG15 0.006 6 ± 0.002 8a FG12 5.95 ± 0.141ab FG8 4.96 ± 1.524a FG8 0.006 4 ± 0.005 2ab FG31 5.75 ± 0.351abc FG15 4.90 ± 1.039abc FG9 0.006 0 ± 0.002 6abc FG1 5.70 ± 0.719abc FG4 4.60 ± 0.689abc FG12 0.005 3 ± 0.003 7abcd G24 5.70 ± 1.009abc FG14 4.55 ± 0.777abc FG4 0.005 1 ± 0.001 5abcde FG5 5.68 ± 0.283abc FG5 4.52 ± 0.782abc FG5 0.005 1 ± 0.002 0abcde FG13 5.65 ± 0.581abcd FG12 4.40 ± 1.211abc FG14 0.004 9 ± 0.001 2abcde FG14 5.65 ± 0.370abcd FG1 4.35 ± 0.646abc FG1 0.004 6 ± 0.001 3abcdef FG20 5.63 ± 0.324abcd FG13 4.30 ± 0.600abc FG13 0.004 5 ± 0.001 4abcdef G14 5.63 ± 0.265abcd FG10 4.16 ± 0.885abc FG10 0.004 2 ± 0.002 0abcdefg FG18 5.60 ± 0.100abcd FG11 4.16 ± 0.793abc FG11 0.004 2 ± 0.001 5abcdefg FG21 5.60 ± 0.472abcd FG2 4.16 ± 0.321abc FG2 0.004 1 ± 0.000 5abcdefg FG23 5.60 ± 0.126abcd FG7 4.06 ± 0.879abc FG7 0.004 0 ± 0.002 1abcdefgh FG4 5.60 ± 0.346abcd FG16 4.05 ± 0.071abcd G8 0.003 9 ± 0.000 4abcdefgh FG9 5.58 ± 0.647abcd G10 4.05 ± 0.451abcd FG16 0.003 8 ± 0.000 3abcdefgh G8 5.58 ± 0.462abcd G8 4.05 ± 0.208abcd FG23 0.003 8 ± 0.000 7abcdefgh FG25 5.57 ± 0.351abcd FG23 3.95 ± 0.354abcd FG33 0.003 7 ± 0.000 2abcdefgh FG27 5.57 ± 0.153abcd G9 3.95 ± 0.208abcd G10 0.003 7 ± 0.000 9abcdefgh FG19 5.55 ± 0.173abcd FG33 3.93 ± 0.116abcd FG18 0.003 6 ± 0.000 8abcdefgh FG33 5.53 ± 0.283abcd FG28 3.90 ± 0.173abcd FG31 0.003 6 ± 0.000 5bcdefgh FG2 5.52 ± 0.141abcd FG32 3.90 ± 0.265abcd G14 0.003 6 ± 0.000 3bcdefgh FG11 5.50 ± 0.141abcd G11 3.90 ± 0.283abcd FG19 0.003 5 ± 0.000 8bcdefgh FG10 5.48 ± 0.071abcd G14 3.88 ± 0.126abcd FG24 0.003 5 ± 0.000 2bcdefgh FG24 5.48 ± 0.451abcd FG24 3.85 ± 0.129abcd FG27 0.003 5 ± 0.000 6bcdefgh G22 5.47 ± 0.666abcd G3 3.84 ± 0.167abcde FG28 0.003 5 ± 0.000 2bcdefgh FG8 5.44 ± 0.231abcd FG18 3.83 ± 0.404abcde FG32 0.003 5 ± 0.000 4bcdefgh FG16 5.40 ± 0.058abcd FG27 3.83 ± 0.208abcde G24 0.003 5 ± 0.000 1bcdefgh FG26 5.40 ± 0.071abcd FG3 3.82 ± 0.278abcde FG20 0.003 3 ± 0.000 1cdefgh FG29 5.40 ± 0.245abcd FG19 3.80 ± 0.424abcde FG21 0.003 3 ± 0.000 2cdefgh G5 5.38 ± 0.451abcd FG31 3.80 ± 0.283abcde FG3 0.003 3 ± 0.000 3cdefgh FG28 5.37 ± 0.205abcde G13 3.80 ± 0.316abcde G3 0.003 3 ± 0.000 1cdefgh FG32 5.37 ± 1.174abcde G24 3.80 ± 0.000abcde G5 0.003 3 ± 0.000 4cdefgh FG7 5.36 ± 0.208abcde G6 3.78 ± 0.236abcde G11 0.003 2 ± 0.000 5cdefgh G17 5.30 ± 0.141abcde G5 3.76 ± 0.321abcde G6 0.003 2 ± 0.000 5cdefgh G23 5.30 ± 0.690abcde FG6 3.74 ± 0.478abcde G9 0.003 2 ± 0.000 4cdefgh G10 5.25 ± 0.424abcde FG21 3.70 ± 0.100bcde FG25 0.003 1 ± 0.000 4cdefgh FG3 5.20 ± 0.409abcde G4 3.70 ± 0.557bcde G13 0.003 1 ± 0.000 6cdefgh G4 5.20 ± 0.436abcde FG20 3.67 ± 0.058bcde G4 0.003 1 ± 0.000 7cdefgh G6 5.20 ± 1.686abcde FG17 3.60 ± 0.283cde G12 0.003 0 ± 0.001 5cdefgh G3 5.18 ± 0.367bcde G12 3.60 ± 0.993cde FG17 0.002 9 ± 0.000 6defgh G18 5.10 ± 0.354bcdef G18 3.60 ± 0.566cde FG26 0.002 9 ± 0.000 5defgh FG17 5.05 ± 0.171bcdefg FG25 3.57 ± 0.116cde G17 0.002 9 ± 0.000 3defgh G19 5.05 ± 0.495bcdefg G23 3.57 ± 0.493cde G18 0.002 9 ± 0.000 8defgh G13 5.00 ± 0.200bcdefg G17 3.55 ± 0.071cde G22 0.002 9 ± 0.001 0defgh G11 4.90 ± 0.200bcdefg FG26 3.50 ± 0.265cde G23 0.002 9 ± 0.000 7defgh WT 4.87 ± 0.702cdefg WT 3.47 ± 0.252cde FG29 0.002 8 ± 0.001 0defgh G9 4.83 ± 1.980cdefg G22 3.43 ± 0.493cde FG6 0.002 8 ± 0.000 7defgh G12 4.76 ± 0.332cdefg FG29 3.40 ± 0.566cde WT 0.002 6 ± 0.000 6defgh FG6 4.60 ± 0.205defgh FG30 3.40 ± 0.100cde G19 0.002 5 ± 0.000 1defgh G15 4.60 ± 0.392defgh G15 3.37 ± 0.322cde G15 0.002 3 ± 0.000 5defgh FG30 4.33 ± 0.126efgh G7 3.37 ± 0.153cde FG30 0.002 2 ± 0.000 2efgh G16 4.13 ± 0.492fgh G19 3.35 ± 0.071cde G7 0.001 9 ± 0.000 4fgh G20 4.07 ± 0.141ghi G16 2.80 ± 0.781def G16 0.001 7 ± 0.001 2fgh G7 3.73 ± 0.586hi G20 2.60 ± 0.781ef G20 0.001 4 ± 0.000 9gh G2 3.20 ± 0.515i G2 2.25 ± 0.919f G2 0.001 0 ± 0.001 1h 均值 Mean 5.28 ± 0.67 均值 Mean 3.91 ± 0.72 均值 Mean 0.003 6 ± 0.001 7 注:数字表示方式为平均值 ± 标准差;不同处理变量差异采用Duncans multiple-range差异性检验进行分析;不同的小写字母表示处理间差异达到显著水平P < 0.05。Notes: data were mean ± SE; different lowercases represent significant differences among treatments using Duncans multiple-range test, P < 0.05. 表 4 特征根及标准化特征向量
Table 4 Characteristic roots and standardized eigenvectors
主成分
Principal
component特征根
Characteristic
root方差贡献率
Variance contribution rate/%累积贡献率
Cumulative contribution rate/%性状
Trait因子载荷
Factor
loading特征向量
Standardized eigenvector1 2.651 88.351 88.351 树高 Tree height/m 0.882 0.542 2 0.315 10.492 98.842 胸径 DBH/cm 0.964 0.592 3 0.035 1.158 100 材积 Volume/m3 0.971 0.596 表 5 参试株系综合评价
Table 5 Comprehensive evaluation of dtested clones
株系 Line Y 值
Y value1级通直度比率
Ratio of level 1
straightness/%综合评价
Comprehensive
evaluation株系 Line Y 值
Y value1级通直度比率
Ratio of level 1
straightness/%综合评价
Comprehensive
evaluationFG15 3.950 100.00 优秀 Good FG20 0.072 100.00 良好 Better FG8 3.091 85.71 优秀 Good G5 −0.069 85.71 一般 Common FG9 3.035 100.00 优秀 Good G3 −0.173 100.00 一般 Common FG12 2.337 100.00 优秀 Good FG3 −0.177 83.33 一般 Common FG4 2.117 100.00 优秀 Good FG25 −0.214 100.00 一般 Common FG5 2.102 100.00 优秀 Good G6 −0.278 100.00 一般 Common FG14 1.999 100.00 优秀 Good G11 −0.427 100.00 一般 Common FG1 1.650 100.00 优秀 Good G4 −0.434 100.00 一般 Common FG13 1.487 80.00 优秀 Good G9 −0.444 100.00 一般 Common FG10 1.010 83.33 优秀 Good G13 −0.507 100.00 一般 Common FG11 0.991 100.00 良好 Better G23 −0.573 100.00 一般 Common FG2 0.976 100.00 良好 Better FG26 −0.587 100.00 一般 Common G8 0.797 100.00 良好 Better G22 −0.590 100.00 一般 Common FG7 0.645 85.71 良好 Better G17 −0.613 100.00 一般 Common FG23 0.644 100.00 良好 Better FG29 −0.746 66.67 一般 Common FG16 0.564 50.00 良好 Better G18 −0.752 100.00 一般 Common FG31 0.507 100.00 良好 Better FG17 −0.802 66.67 一般 Common G14 0.497 100.00 良好 Better G12 −1.034 83.33 较差 Less FG33 0.483 100.00 良好 Better FG6 −1.137 100.00 较差 Less G24 0.403 100.00 良好 Better WT −1.296 100.00 较差 Less G10 0.394 80.00 良好 Better G19 −1.314 100.00 较差 Less FG18 0.361 100.00 良好 Better G15 −1.844 100.00 较差 Less FG27 0.310 100.00 良好 Better FG30 −2.130 100.00 较差 Less FG19 0.255 100.00 良好 Better G7 −2.923 80.00 较差 Less FG24 0.244 100.00 良好 Better G16 −3.307 80.00 较差 Less FG32 0.195 100.00 良好 Better G20 −3.765 100.00 较差 Less FG28 0.195 100.00 良好 Better G2 −5.255 33.33 较差 Less FG21 0.078 100.00 良好 Better -
[1] 王成, 滕文华, 李开隆, 等. 白桦5 × 5双列杂交子代生长性状的遗传效应分析[J]. 北京林业大学学报, 2011, 33(3):14−20. Wang C, Teng W H, Li K L, et al. Analysis of genetic effects on growth traits in a 5 × 5 diallel cross of Betula platyphylla[J]. Journal of Beijing Forestry University, 2011, 33(3): 14−20.
[2] Mu H Z, Liu Z J, Lin L, et al. Transcriptomic analysis of phenotypic changes in birch (Betula platyphylla) autotetraploids[J]. International Journal of Molecular Sciences, 2012, 13: 13012−13029. doi: 10.3390/ijms131013012
[3] 姜静, 杨光, 祝泽兵, 等. 白桦强化种子园优良家系选择[J]. 东北林业大学学报, 2011, 39(1):1−4. doi: 10.3969/j.issn.1000-5382.2011.01.001 Jiang J, Yang G, Zhu Z B, et al. Family selectionfrom intensive seed orchard of Betula platyphylla[J]. Journal of Northeast Forestry University, 2011, 39(1): 1−4. doi: 10.3969/j.issn.1000-5382.2011.01.001
[4] 刘超逸, 刘桂丰, 方功桂, 等. 四倍体白桦木材纤维性状比较及优良母树选择[J]. 北京林业大学学报, 2017, 39(2):9−15. Liu C Y, Liu G F, Fang G G, et al. Comparison of tetraploid Betula platyphylla wood fiber traits and selection of superior seed trees[J]. Journal of Beijing Forestry University, 2017, 39(2): 9−15.
[5] 刘宇, 徐焕文, 张广波, 等. 白桦半同胞子代多点生长性状测定及优良家系选择[J]. 北京林业大学学报, 2017, 39(3):7−15. Liu Y, Xu H W, Zhang G B, et al. Multipoint growth trait test of half-sibling offspring and excellent family selection of Betula platyphylla[J]. Journal of Beijing Forestry University, 2017, 39(3): 7−15.
[6] 徐焕文, 刘宇, 李志新, 等. 5年生白桦杂种子代多点稳定性分析及优良家系选择[J]. 北京林业大学学报, 2015, 37(12):24−31. Xu H W, Liu Y, Li Z X, et al. Analysis of the stability and superiority of five-year-old birch crossbreed families based on a multi-site test[J]. Journal of Beijing Forestry University, 2015, 37(12): 24−31.
[7] Huang H J, Wang S, Jiang J, et al. Overexpression of BpAP1 induces early flowering and produces dwarfism in Betula platyphylla×B. pendula[J]. Physiol Plant, 2014, 151: 495−506. doi: 10.1111/ppl.12123
[8] 詹亚光, 王玉成, 王志英, 等. 白桦的遗传转化及转基因植株的抗虫性[J]. 植物生理与分子生物学学报, 2003, 29(5):380−386. Zhan Y G, Wang Y C, Wang Z Y, et al. Genetic transformation of Betula platyphylla and Insect resistance of the transgenic plants[J]. Journal of Plant Physiology and Molecular Biology, 2003, 29(5): 380−386.
[9] 李园园, 杨光, 韦睿, 等. 转 TabZIP 基因白桦的获得及耐盐性分析[J]. 南京林业大学学报(自然科学版), 2013, 37(5):6−12. Li Y Y, Yang G, Wei R, et al. TabZIP transferred Betula platyphylla generation and salt tolerance analysis[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2013, 37(5): 6−12.
[10] Zhang W B, Wei R, Chen S, et al. Functional characterization of CCR in birch (Betula platyphylla × Betula pendula) through overexpression and suppression analysis[J]. Physiologia Plantarum, 2015, 154: 283−296. doi: 10.1111/ppl.12306
[11] 陈继英, 刘超逸, 王朔, 等. 白桦BpTOPP1基因功能[J]. 东北林业大学学报, 2018, 46(8):13−19. doi: 10.3969/j.issn.1000-5382.2018.08.003 Chen J Y, Liu C Y, Wang S, et al. A preliminary study on Function of BpTOPP 1 Gene in Betulla platyphylla × B.pendula[J]. Journal of Northeast Forestry University, 2018, 46(8): 13−19. doi: 10.3969/j.issn.1000-5382.2018.08.003
[12] 范志勇, 姜晶, 王芳, 等. 转BpCHS基因过量表达白桦叶片和韧皮部色素含量及植株表型分析[J]. 东北林业大学学报, 2018, 46(6):8−13. doi: 10.3969/j.issn.1000-5382.2018.06.002 Fan Z Y, Jiang J, Wang F, et al. Overexpression of BpCHS confers changes of pigment content in leaves and phloem and other phenotypic traits in transgenic birch[J]. Journal of Northeast Forestry University, 2018, 46(6): 8−13. doi: 10.3969/j.issn.1000-5382.2018.06.002
[13] Yang G, Chen S, Wang S, et al. BpGH3.5, an early auxinresponse gene, regulates root elongation in Betula platyphylla × Betula pendula[J]. Plant Cell Tissue and Organ Culture, 2015, 120(1): 239−250. doi: 10.1007/s11240-014-0599-9
[14] Guilfoyle T J, Ulmasov T, Hagen G. The ARF family of transcription factors and their role in plant hormone-responsive transcription[J]. Cellular and Molecular Life Sciences, 1998, 54(7): 619−627. doi: 10.1007/s000180050190
[15] Liscum E, Reed J W. Genetics of Aux/IAA and ARF action in plant growth and development[J]. Plant Molecular Biology, 2002, 49(3−4): 387−400.
[16] 黎颖, 左开井, 唐克轩. 植物 GH3 基因家族的功能研究概况[J]. 植物学报, 2008, 25(5):507−515. doi: 10.3969/j.issn.1674-3466.2008.05.001 Li Y, Zuo K J, Tang K X. A survey of functional studies of the GH3 gene family in plants[J]. Chinese Bulletin of Botany, 2008, 25(5): 507−515. doi: 10.3969/j.issn.1674-3466.2008.05.001
[17] Mellor N, Band LR, Pěnčík A, et al. Dynamic regulation of auxin oxidase and conjugating enzymes AtDAO1 and GH3 modulates auxin homeostasis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(39): 11022−11027. doi: 10.1073/pnas.1604458113
[18] Takase T, Nakazawa M, Ishikawa A, et al. ydk1-D, an auxinresponsive GH3 mutant that is involved in hypocotyl and root elongation[J]. The Plant Journal, 2004, 37: 471−483. doi: 10.1046/j.1365-313X.2003.01973.x
[19] Nakazawa M, Yabe N, Ichikawa T, et al. DFL1, an auxinresponsive GH3 gene homologue, negatively regulates shoot cell elongation and lateral root formation, and positively regulates the light response of hypocotyl length[J]. The Plant Journal, 2001, 25: 213−221. doi: 10.1046/j.1365-313x.2001.00957.x
[20] 刘晓东, 李月, 王若仲, 等. 过表达 GH3-5 提高拟南芥抗旱的分子机制[J]. 南京农业大学学报, 2016, 39(4):557−562. doi: 10.7685/jnau.201604019 Liu X D, Li Y, Wang R Z, et al. Molecular mechanism of drought tolerance conferred by overexpression of GH3-5[J]. Journal of Nanjing Agricultural University, 2016, 39(4): 557−562. doi: 10.7685/jnau.201604019
[21] 刘晓东, 王若仲, 焦彬彬, 等. 拟南芥IAA酰胺合成酶GH3-6负调控干旱和盐胁迫的反应[J]. 植物学报, 2016, 51(5):586−593. doi: 10.11983/CBB15223 Liu X D, Wang R Z, Jiao B B, et al. Indole acetic acid-amido synthetase GH3-6 negatively regulates response to drought and salt in Arabidopsis[J]. Bulletin of Botany, 2016, 51(5): 586−593. doi: 10.11983/CBB15223
[22] Zhang Z, Li Q, Li Z, et al. Dual regulation role of GH3.5 in salicylic acid and auxin signaling during Arabidopsis-Pseudomonas syringae interaction[J]. Plant Physiology, 2007, 145(2): 450−464. doi: 10.1104/pp.107.106021
[23] 杨光, 韦睿, 王姗, 等. 转基因白桦试管苗去琼脂生根培养及高效移栽技术[J]. 林业实用技术, 2011(4):33−34. Yang G, Wei R, Wang S, et al. Rooting culture without agar and efficient transplanting technique of transgenic plantlet in birch[J]. Practical Forestry Technology, 2011(4): 33−34.
[24] Yang G, Chen S, Jiang J. Transcriptome analysis reveals the role of BpGH3.5 in root elongation of Betula platyphylla × Betula pendula[J]. Plant Cell Tiss Organ Cult, 2015, 121(3): 605−617. doi: 10.1007/s11240-015-0731-5
[25] Zhang S W, Li C H, Zhang Y C, et al. Altered architecture and enhanceddrought tolerance in rice via the down-regulation of indole-3-acetic acid by TLD1/OsGH3.13 activation[J]. Plantphysiology, 2009, 151: 1889−1901.
[26] Du H, Wu N, Fu J, et al. A GH3 family member, OsGH3-2, modulates auxin andabscisic acid levels and differentially affects drought and cold tolerance in rice[J]. Journal of Experimental Botany, 2012, 63(18): 6467−6480. doi: 10.1093/jxb/ers300
[27] Ding X, Cao Y, Huang L, et al. Activation of the indole-3-acetic acid-amidosynthetase GH3-8 suppresses expansin expression and promotes salicylate-and jasmonate-independent basalimmunity in rice[J]. The Plant Cell, 2008, 20(1): 228−240. doi: 10.1105/tpc.107.055657
[28] Tam Y Y, Epstein E, Normanly J. Characterization of auxin conjugates in Arabidopsis, low steady-statelevels of indole-3-acetyl-aspartate, indole-3-acetyl-glutamate, and indole-3-acetyl-glucose[J]. Plant Physiology, 2000, 123: 589−596. doi: 10.1104/pp.123.2.589
[29] Campanella J J, Ludwig-Mueller J, Bakllamaja V, et al. ILR1 and sILR1 IAA amidohydrolase homologs differ in expression pattern and substrate specificity[J]. Plant Growth Regulation, 2003, 41: 215−223. doi: 10.1023/B:GROW.0000007501.27878.aa
[30] 陈敏. 超量表达生长素早期响应基因CsGH3增强柑橘溃疡病抗性[D]. 重庆: 西南大学, 2017. Chen M, Overexpressing early auxin-responsive gene CsGH3 enhances canker resistance in citrus[D]. Chongqing: Southwest University, 2017.
[31] Kwon-Chung K J. A new genus, filobasidiella, the perfect state of cryptococcus neoformans[J]. Mycological, 1975, 67(6): 1197−1200. doi: 10.1080/00275514.1975.12019866
[32] 谢兆辉. 天然反义转录物及其调控基因的表达机制[J]. 遗传, 2010, 32(2):122−128. doi: 10.3760/cma.j.issn.1673-4386.2010.02.014 Xie Z H. Natural antisense transcript and its mechanism of gene regulation[J]. Hereditas(Beijing), 2010, 32(2): 122−128. doi: 10.3760/cma.j.issn.1673-4386.2010.02.014
[33] Chen J J, Sun M, Hurst L D, et al. Genome-wide analysis of coordinate expression and evolution of human cis-eneoded sense-antisense transeripts[J]. Trende Genet, 2005, 21(6): 326−329. doi: 10.1016/j.tig.2005.04.006
[34] 李魏, 谭晓风, 陈鸿鹏. 植物肉桂酰辅酶A还原酶基因的结构功能及应用潜力[J]. 经济林研究, 2009, 27(1):7−12. doi: 10.3969/j.issn.1003-8981.2009.01.002 Li W, Tan X F, Chen H P. Structure, function and application potential of cinnamoyl-CoA reductase (CCR) gene in plant[J]. Nonwood Forest Research, 2009, 27(1): 7−12. doi: 10.3969/j.issn.1003-8981.2009.01.002
[35] Leple J, Dauwe R, Morreel K, et al. Downregulation of cinnamoyl-coenzyme a reductase in poplar: multiple-level phenotyping reveals effects on cell wall polymer metabolism and structure[J]. Plant Cell, 2007, 19(11): 3669−3691. doi: 10.1105/tpc.107.054148
[36] 张嫚嫚, 刘宝光, 顾宸瑞, 等. 转BpCCR1正义链及反义链对7年生盆栽白桦木质素的影响及优良株系选择[J]. 北京林业大学学报, 2019, 41(6):86−95. Zhang M M, Liu B G, Gu C R, et al. Effects of transgenic sense and antisense of BpCCR1 on 7-year-old potted birch and selection of excellent lines[J]. Journal of Beijing Forestry University, 2019, 41(6): 86−95.




 下载:
下载: