Populus euphratica PeREM6.5 regulating tolerance mechanism to water stress in Arabidopsis thaliana
-
摘要:目的 Remorin蛋白是广泛存在于苔藓、裸子和被子植物中的蛋白家族,在调控植物生长发育及生物胁迫反应方面具有重要作用,但有关remorin抵御非生物胁迫作用机制的研究较少。前期研究发现抗逆树种胡杨的remorin 6.5(REM6.5)可通过增强质膜质子泵活性提高植物耐盐性,在此基础上,本文研究了胡杨PeREM6.5在植物耐受水分胁迫中的作用,旨在进一步揭示植物抗旱的生理与分子机制。方法 以过表达PeREM6.5拟南芥(OE1和OE2)、野生型(WT)和转空载体对照(VC)拟南芥为试验材料,对各基因型拟南芥进行水分胁迫处理(包括渗透胁迫和土壤干旱)以及复水处理,从生理生化及分子生物学角度研究了胡杨PeREM6.5在拟南芥干旱胁迫中的响应机制。结果 甘露醇处理后,过表达PeREM6.5拟南芥的存活率、根长显著高于WT和VC,并且在渗透胁迫下细胞膜受损程度较小,这些表型差异主要与转基因拟南芥水分吸收、抗氧化防御能力增强有关。甘露醇处理后,过表达PeREM6.5拟南芥水通道基因AtPIP1;2和AtPIP2;1的表达量提高。甘露醇处理诱导WT和VC根细胞积累H2O2,对细胞膜造成氧化伤害。转基因株系在甘露醇处理后过氧化物酶基因POD和过氧化氢酶基因CAT表达量显著上调,能维持较高的POD和CAT酶活性,清除H2O2及其对细胞膜造成的损伤。在土壤干旱处理9 d后,转基因株系的叶绿素含量下降幅度低于WT和VC,复水后叶绿素含量恢复程度较高。另外,PeREM6.5转基因株系在干旱胁迫下维持PSⅡ实际光合量子产量的能力增强。结论 过表达胡杨PeREM6.5基因提高了拟南芥对水分胁迫的耐受性。Abstract:Objective Remorin is a protein family commonly found in bryophytes, gymnosperms and angiosperms, and plays an important role in regulating plant growth, development, and the response to biotic stress. The physiological mechanism of remorin in plant adapting to abiotic stress has rarely been investigated. We have previously shown that PeREM6.5, a remorin protein originated from stress-resistant Populus euphratica, increased salt tolerance through enhancing activity of plasma membrane (PM) H+-ATPase. The role of PeREM6.5
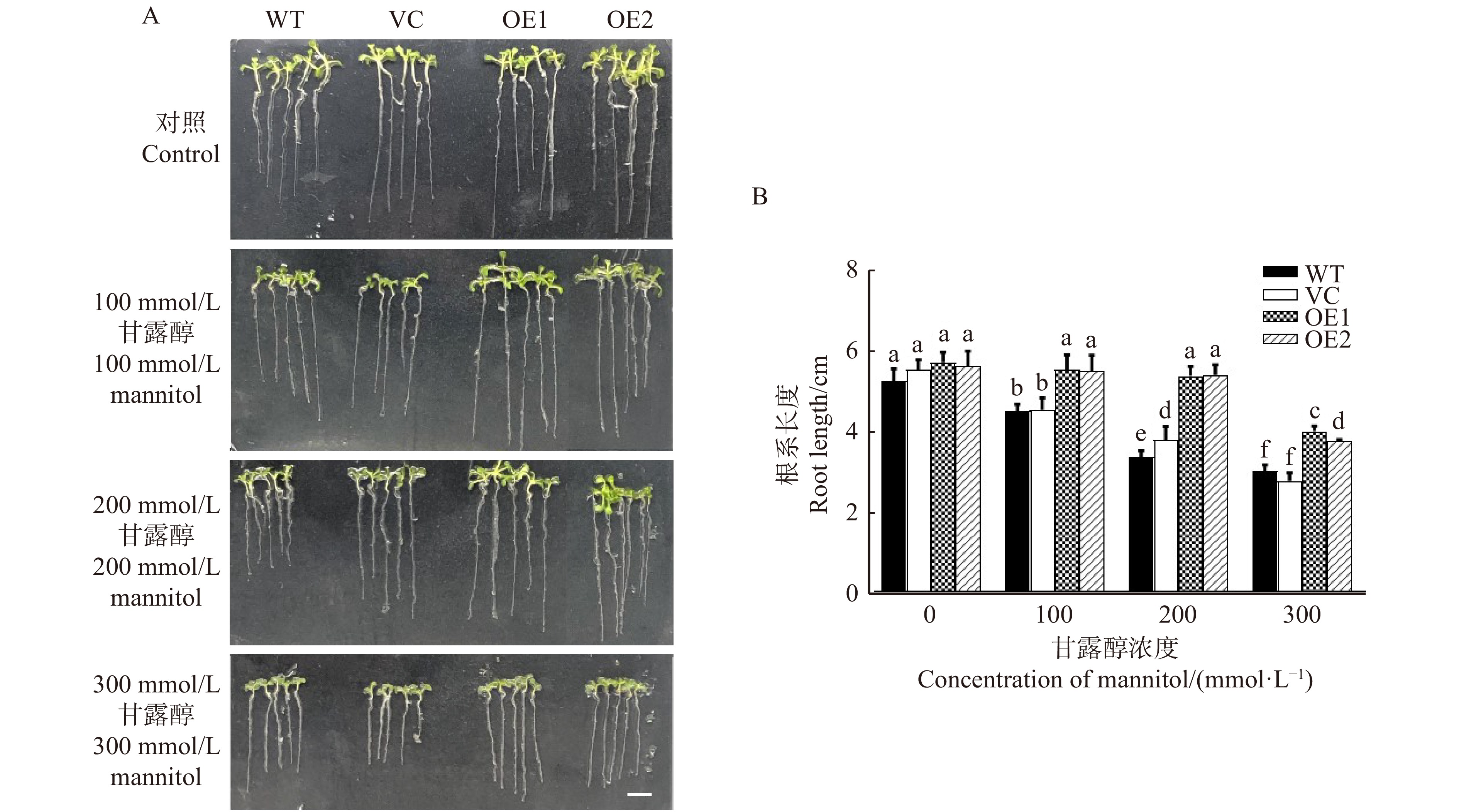
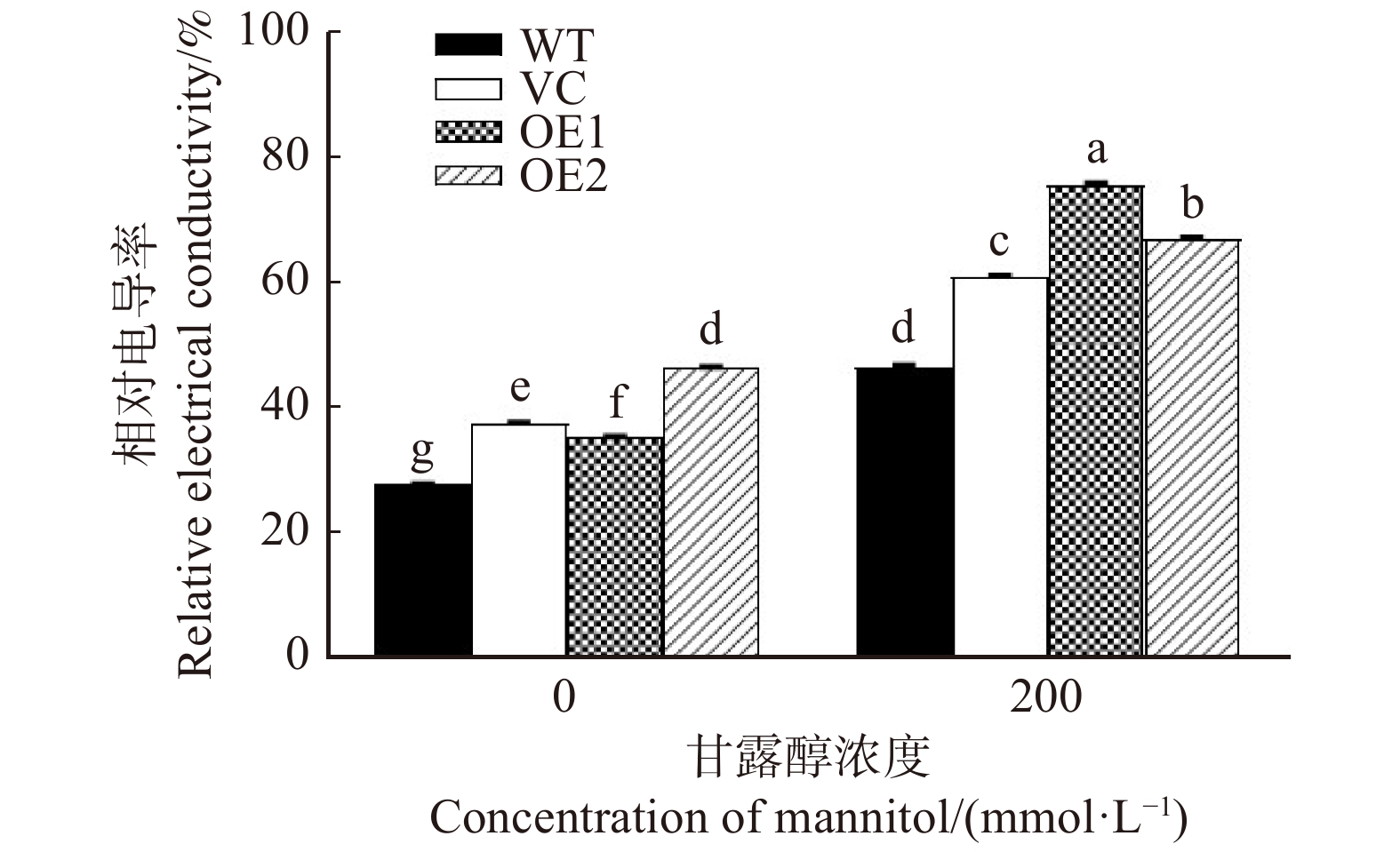
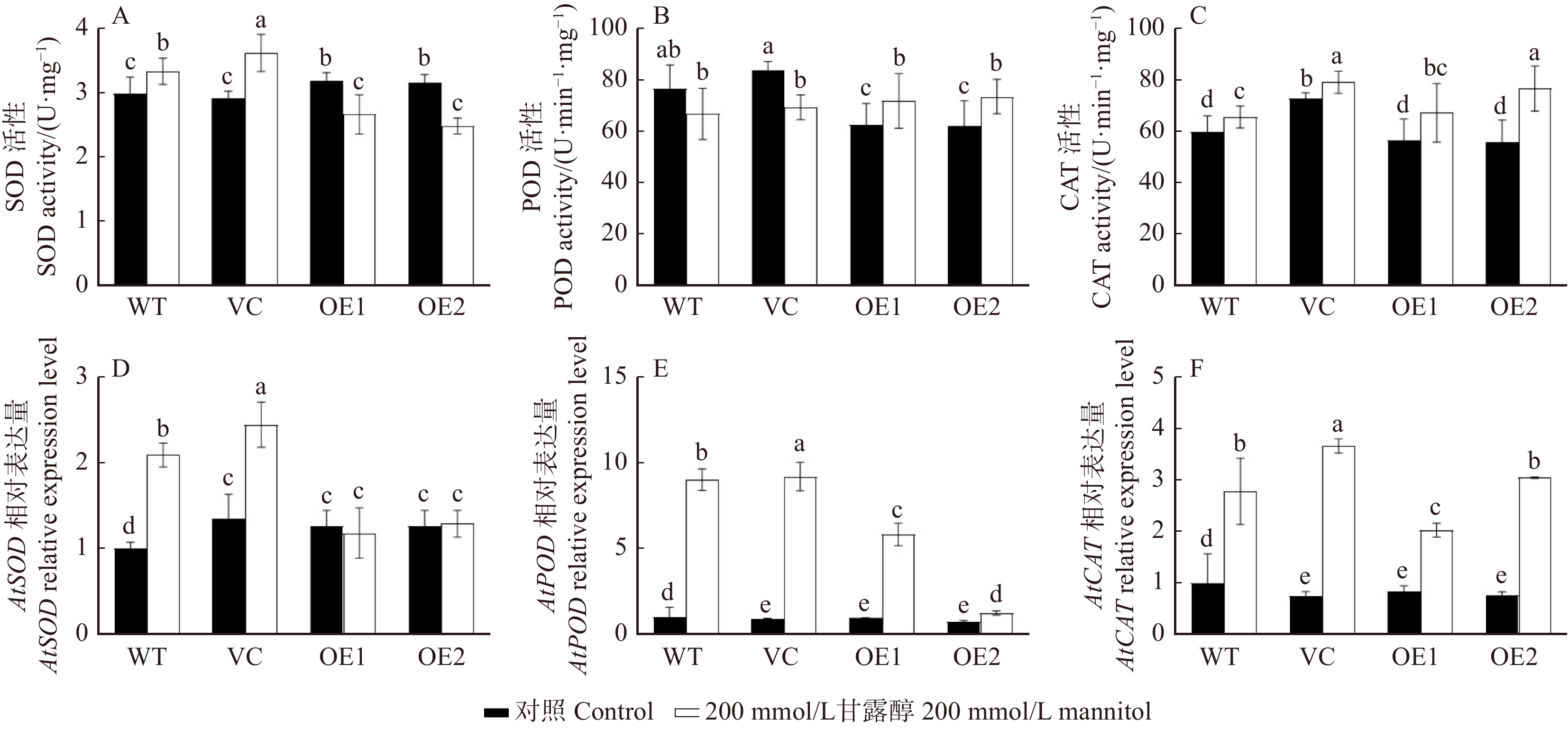
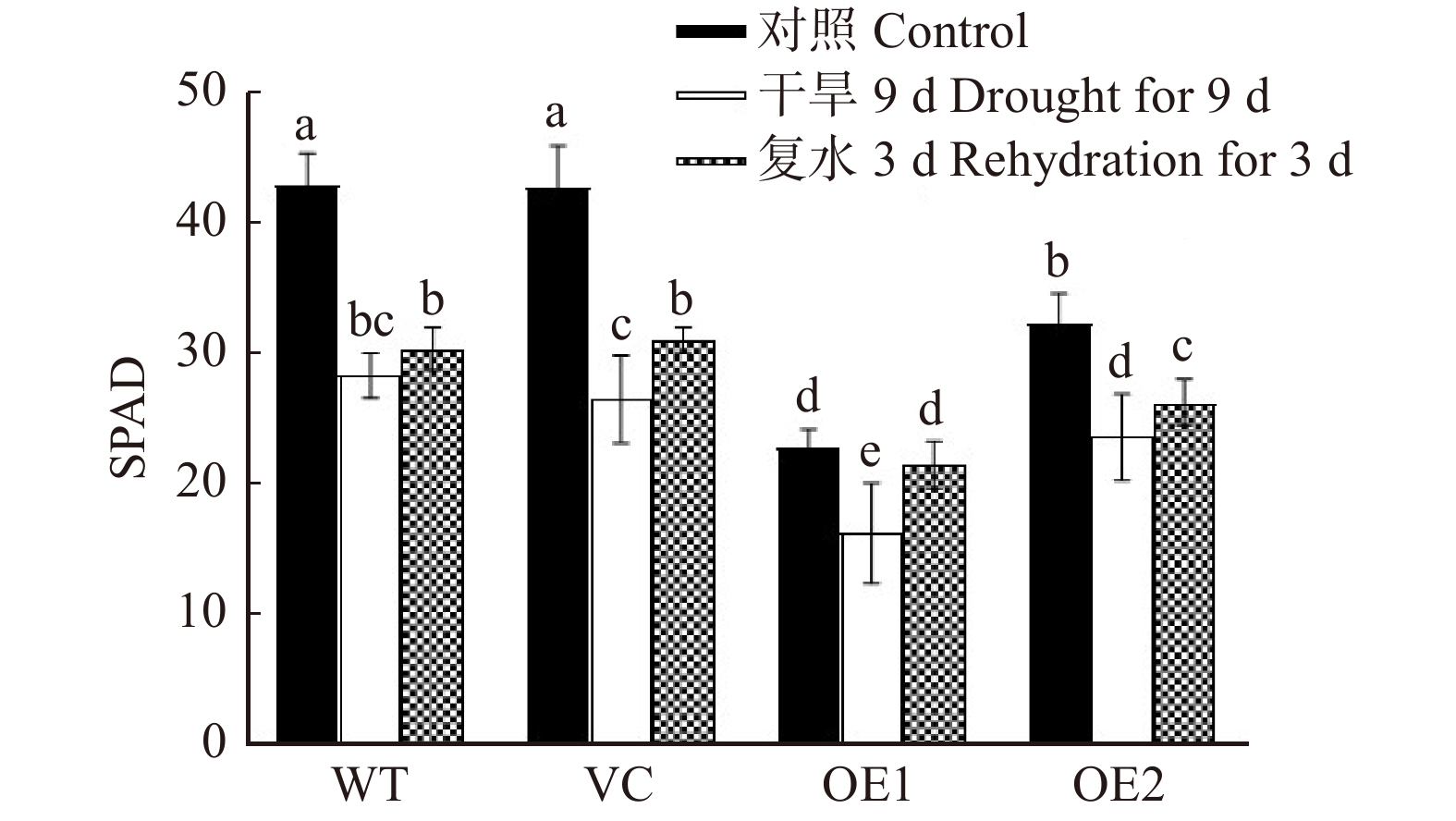
in water stress tolerance was investigated in this study. The aim is to elucidate the physiological and molecular mechanism underlying PeREM6.5 in plant adaptation to drought stress. Method The PeREM6.5-overexpressed Arabidopsis thaliana (OE1 and OE2), wildtype (WT), and vecter control (VC) were used in this study. These four genotypes of A. thaliana were treated with osmotic stress, soil drought and rehydration, respectively. The PeREM6.5-regulated drought response was evaluated at the physiological, biochemical and molecular levels. Result Under mannitol treatment, the seed survival rate and root length of PeREM6.5-overexpressed Arabidopsis thaliana were significantly higher than WT and VC, and the cell membrane was less damaged by osmotic stress. The phenotypic differences were mainly related to the enhanced ability for water uptake and antioxidant defence in the transgenic plants. The expression of water channel genes, AtPIP1;2 and AtPIP2;1 was upregulated by osmotic treatment in PeREM6.5-transgenic lines. Mannitol treatment induced the accumulation of H2O2, causing oxidative damage to the cell membrane in WT and VC. PeREM6.5-transgenic plants up-regulated the transcription of antioxidant enzyme genes, POD and CAT after mannitol treatment. The high activities of POD and CAT could eliminate H2O2, and thus reduce the membrane damage caused by reactive oxygen species. After 9 d of drought treatment, the decrease of chlorophyll content in soil-cultured transgenic lines was lower than that of non-transgenic lines. After rehydration, the recovery of chlorophyll content in transgenic plants was higher than WT and VC. Moreover, PeREM6.5-transgenic plants exhibited a higher ability to maintain PSⅡ actual photosynthetic quantum yield under drought. These results indicated that the overexpression of PeREM6.5 improved the plant capacity to tolerate water stress.Conclusion The above results indicate that the overexpression of PeREM6.5 gene enhances the tolerance to water stress in Arabidopsis thaliana plants.-
Keywords:
- Populus euphratica /
- PeREM6.5 /
- Arabidopsis thaliana /
- osmotic stress /
- drought stress /
- tolerance mechanism
-
树木种内不同地理起源的种群间在生长、适应性及形态特征上存在普遍的地理变异(geographic variation),不当的跨生态区调拨种子可导致林分稳定性与生产力降低。造林地区通过对不同原产地或种源的种群做种源试验(provenance trail),阐明种群间的性状变异特点与规律,为造林地区的人工林高效培育选择生长与适应性均佳的优良种源[1]。世界范围的林木种源试验始于20世纪初期[2-3],中国主要造林树种的种源试验多始于80年代,50年代到80年代大规模营造人工林未考虑地理种源因素,树种全分布区内的商业性调种造林现象十分普遍,对跨种子区(seed zone)营建的人工林苗期和幼树的研究显示该现象对林分的稳定性和质量产生不同程度的影响[4]。树木种群是经过数百万年复杂生境的进化产物,具备对环境变化的一定适应性调节能力,且树木种群中也存在较为丰富的个体间适应性遗传变异。引种地生境的选择效应会对外来种群的遗传结构产生影响,由适合个体组成的林分会有更好的稳定性。对不同树龄阶段侧柏(Platycladus orientalis)地理种群的研究显示,早晚期种群的适应性与生长表现了不同规律,且地理种群间的差异随树龄增加而减小,可能是适应性进化与驯化的效应[5]。
油松(Pinus tabuliformis)是有较高经济与生态价值的针叶树种,分布于中国东北、华北、中原和西部地区[6-7],曾是北京周边山区的重要乡土树种[8]。经数千年采伐利用和战乱破坏,至1949年北京及相邻河北北部大范围山地已为荒山或次生林,仅在人际罕至的山顶部有小面积的天然油松林,或皇家园林的百年古树(有可能是北京种源)。20世纪50年代后北京地区启动人工造林项目,至今利用外来种源营建的油松人工林面积已占北京人工林总面积的23.2%[4, 9]。根据有关资料记载1963年—1975年山西省支援北京市油松种子4 × 105 kg,其中关帝和太岳林区为主要供种地[10]。山西省是油松中心分布区,该省内油松主要分布在五山系即管涔山、中条山、太岳山、关帝山和太行山。北京位于油松种子区的东北区,而山西省主要位于中部区[4],不经种源试验的跨种子区用种可能对北京地区油松人工林未来的稳定性与生产力带来不确定影响。北京皇家园林的古油松多长势良好,而一些外来种源营建的人工林则表现了较差的树高长势。研究北京地区油松人工林的遗传多样性和遗传结构的特点与变异,对认识其林分的群体遗传基础、科学管理、利用油松种质以及林木种质遗传多样性的研究具有积极的理论和实际意义。
山西省油松的生长和适应性在山系内林分间近似,在山系间则有显著差异[11-12],各山系种群的遗传结构特征可用序列表达标签(EST-SSR)鉴别[13]。利用EST-SSR分子标记解析北京油松种群的遗传结构,并基于本课题组已有山西五山系地理种群的遗传资料,进一步构建北京种群和山西五山系种群的遗传关联,为推测北京人工林可能的地理种源提供参考。目前利用分子标记的人工林产地溯源鲜有报道,林业发达国家造林对种源有严格规范,很少有种源不清问题,中国除造林单位自采种和良种基地供种外,社会育苗和种子调拨很少关注种源。本研究以北京油松人工林和古油松为试验对象,山西五山系油松地理种群的遗传结构为参照,借助油松核基因组EST-SSR分子标记和种群遗传分析方法,拟(1)揭示北京油松人工林和古油松种群遗传多样性和遗传结构特点;(2)阐明北京油松人工林与古油松的遗传差异;(3)构建北京油松种群与山西五山系油松种群的遗传关联,追溯北京油松人工林种群可能的地理种源;(4)探讨影响人工林种群遗传结构变化的主要因素。为北京地区油松人工林的评价、培育和种质种源管理提供相应信息,对其他树种的人工林溯源亦有一定参考价值。
1. 材料与方法
1.1 试验样地与材料
北京地区油松人工林样本采自十三陵林场(SSL)、八达岭林场(BDL)、九龙山林场(JLS)、密云水库林场(MY)、鹫峰林场(JF)、西山林场(XS)、石湖峪林场(SHY)和妙峰山林场(MFS)共8个种群,北京古油松样本采自以香山公园为中心的皇家园林(GS1)、明十三陵(GS2)和戒台寺(GS3)共3个种群,山西五山系油松地理种群样地基本情况来源于张新波论文资料[14]。4—5月采集当年生针叶(随机取样每株40根),北京人工林的样株间距大于50 m,古油松采集树龄200年以上植株[15],标记样本信息并装于塑封袋,− 20 ℃冰箱中保存备用。各试验林种群地理位置、林龄、林分年均高和采集样本数量见表1。
表 1 供试油松种群基本情况Table 1. General information of sampling stands of Pinus tabuliformis项目
Item种群
Population经度
Longitude纬度
Latitude海拔
Altitude/m树龄/a
Stand age/year年均高
Annual average height/cm样本数
Sample plant number北京人
工林
Beijing plantationJF 116°28′ E 39°54′ N 450 69 14.493 36 JLS 115°59′ E 39°54′ N 751 43 24.419 36 MFS 116°01′ E 40°03′ N 180 45 27.333 30 MY 116°49′ E 40°29′ N 75 45 15.778 36 XS 116°05′ E 40°03′ N 145 64 12.969 35 SSL 116°16′ E 40°15′ N 170 30 21.667 30 BDL 115°56′ E 40°22′ N 676 45 17.111 33 SHY 116°32′ E 40°40′ N 600 59 20.339 36 古油松 Ancient P. tabuliformis GS1 116°10′ E 39°59′ N 135 > 100 — 31 GS2 116°14′ E 40°17′ N 180 > 200 — 102 GS3 116°04′ E 39°52′ N 300 > 200 — 18 山西五
山系
Five mountain populations in Shanxi ProvinceGCS 112°01′ E 38°36′ N 1 650 21 24.762 52 GDS 111°42′ E 37°29′ N 1 655 21 40.476 66 THS 113°31′ E 37°39′ N 1 412 21 27.143 32 TYS 112°04′ E 37°37′ N 1 496 21 33.333 20 ZTS 112°01′ E 35°44′ N 1 519 21 32.381 18 注:JF. 鹫峰林场; JLS. 九龙山林场; MFS. 妙峰山林场; MY. 密云水库; XS. 西山林场; SSL. 十三陵林场; BDL. 八达岭林场; SHY. 石湖峪林场; GS1. 以香山公园为中心的皇家园林; GS2. 明十三陵; GS3. 妙峰山; GCS. 管涔山; GDS. 关帝山; THS. 太行山; TYS. 太岳山; ZTS. 中条山. GS1, GS2, GS3树龄过大,暂不考虑胸径与树高的关系。下同。Notes: JF, Jiufeng Forest Farm; JLS, Jiulongshan Forest Farm; MFS, Miaofengshan Forest Farm; MY, Miyun Reservoir; XS, Xishan Forest Farm; SSL, Shisanling Forest Farm; BDL, Badaling Forest Farm; SHY, Shihuyu Forest Farm; GS1, royal garden centered by Xiangshan Park; GS2, Ming Shisanling Tombs; GS3, Miaofengshan Mountain; GCS, Guancenshan Mountain; GDS, Guandishan Mountain; THS, Taihangshan Mountain; TYS, Taiyuanshan Mountain; ZTS, Zhongtiaoshan Mountain. Since GS1, GS2, and GS3 are too old, the relationship between DBH and tree height is not considered. The same below. 1.2 油松基因组DNA的提取与浓度测定
植物基因组DNA提取试剂盒(离心柱型)(TIANGEN公司,北京)提取样本核基因组DNA。1%琼脂糖凝胶电泳和超微分光光度计(NanoDrop2000, Thermo Fisher Scientific, USA)检测样本DNA的完整性、质量和浓度,置于− 20 ℃冰箱冷冻保存待用。
1.3 引物筛选
引物筛选是在本课题组已有的油松核基因组EST-SSR引物的基础上[13, 16],重复筛选得到的7对多态性高、扩增稳定且重复性好的引物(表2),EST-SSR与传统的从核基因组开发的SSR相比具有低成本高转移性的优点。
表 2 油松PCR检测SSR引物Table 2. SSR primers for PCR detection of P. tabuliformis引物名称
Primer name前引物序列
Former primer sequence (5′→3′)后引物序列
Back primer sequence (5′→3′)荧光修饰
Fluorescent modification片段长度
Fragment length/bpJ9 GTTTGCAGTGAAAGCATGAAAG GCACCAATTCCTTCTCAAATTC HEX 244 ~ 253 J10 GTCGACACTCCAGGGTAGATTC ATATCATCAGCTAATTGTGCGG TAMRA 254 ~ 257 J20 CACCTCCGTAGTTTGATGTTCC CGATGTATCGTGTACACAGCCT FAM 150 ~ 170 J29 AGTCCGAATGTCTTCTTTCTGC TATGGAACGAATCAGAGATGACG FAM 182 ~ 200 J42 AACCTGTCATCCAGTTCCTGTT TTGTCAAATTCCAATTCAGCAC TAMRA 251 ~ 269 J48 GAAGAGGAAGACGAAATGGATG CTTTACATTTACCGCCTCTGCT ROX 262 ~ 268 J50 TCATCCATTTCAATAGCACGAC GTAGCTGCTTGGCCTGATTATC HEX 235 ~ 244 注:引自参考文献[16]。Note: cited from reference [16]. 1.4 SSR-PCR反应体系和程序
PCR体系分为两步,第一步反应体系为10 µL,包括样本DNA 1 µL,前、后引物各0.4 µL,优博兰2 × Taq Mixture 5 µL,ddH2O补足10 µL。PCR的扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,该过程循环35次;最后,72 ℃延伸10 min,4 ℃保存。第二步反应体系为20 µL,包括第一步产物3 µL,带有荧光染料的M13接头和后引物各0.6 µL,优博兰2 ×Taq Mixture 10 µL,ddH2O补足20 µL。PCR的扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,该过程循环33次;最后,72 ℃延伸10 min,4 ℃保存。
1.5 数据分析
PCR扩增产物由北京睿博兴科生物技术有限公司用毛细管电泳法检测,用GeneMarker 2.2.0(https://softgenetics.com/GeneMarker.php)软件进行峰值读取,Excel记录结果数据;通过POPGENE 1. 3. 1(https://www.biocompare.com/)软件,进行种群遗传变异与遗传多样性参数分析,包括观测等位标记数(Na)、有效等位标记数(Ne)、观测杂合度(Ho)、期望杂合度(He)和Shannon’s信息指数(I);对不同种群之间的遗传结构差异进行分析,包括群体内的固定指数(FIS)、总群体的固定指数(FIT)、群体间遗传分化系数(FST)和基因流(Nm),得到不同种群间的遗传一致度(genetic identity, GI)和遗传距离(genetic distance, GD)等参数,运用MEGA 7.0(https://www.megasoftware.net/)软件基于Nei’s遗传距离生成UPGMA聚类图;计算各位点间差异显著性。
2. 结果与分析
2.1 SSR位点在16个种群中扩增的多态性分析
7对引物检测北京和山西16个油松种群658株样本,扩增结果见表3,7个SSR位点在全部样本中共检测出23个等位标记数目,各种群等位标记数目范围为16 ~ 22个,种群JLS, GS3和ZTS的等位标记数最少只有16个,种群GCS的等位标记数最多有22个;除位点J29在种群JF、MFS、XS和GS3中无多态性,其余位点均在不同种群中扩增出2 ~ 4个等位标记数;位点J29在不同种群间的等位标记频率差异很小,各种群间扩增情况相似;等位标记J42-A和J42-D在不同种群中扩增频率差异大,依次波动于0.0% ~ 50.0%和40.3% ~ 94.8%之间;等位标记J10-A在北京人工林、古油松和山西五山系中频率差异很大,在北京人工林种群和古油松种群中约有90%的扩增,而在山西五山系中只有65%的扩增;等位标记J20-D、J50-C和J50-D在北京人工林种群和山西五山系中均有低频扩增,而在北京古油松中的扩增为0;即:同一位点在不同种群中的等位标记多态性存在差异,同样,各位点在同一种群中的等位标记多态性也存在差异。
表 3 16个油松种群各位点等位标记频率Table 3. Allele frequency of each locus in the 16 populations of P. tabuliformis引物 Primer 等位标记 Allele marker 北京人工林
Beijing plantation古油松
Ancient P. tabuliformis山西五山系
Five mountain populations
in Shanxi ProvinceJF JLS MFS MY XS SSL BDL SHY GS1 GS2 GS3 GCS GDS THS TYS ZTS J9 A 0.281 0.375 0.267 0.235 0.242 0.014 0.106 0.043 0.133 0.189 0.222 0.144 0.242 0.219 0.150 0.167 B 0.719 0.625 0.733 0.765 0.758 0.987 0.894 0.957 0.867 0.811 0.778 0.856 0.758 0.781 0.850 0.833 J10 A 0.941 0.985 0.981 0.956 0.982 0.865 0.879 0.917 0.983 0.995 0.972 0.692 0.677 0.609 0.675 0.750 B 0.059 0.015 0.019 0.044 0.018 0.135 0.121 0.083 0.017 0.005 0.028 0.308 0.323 0.391 0.325 0.250 J20 A 0.015 — 0.019 0.106 0.056 0.028 0.016 — 0.035 0.026 — 0.040 0.074 0.048 0.079 0.094 B 0.632 0.786 0.904 0.697 0.852 0.778 0.688 0.889 0.931 0.871 0.941 0.890 0.787 0.774 0.842 0.594 C 0.353 0.214 0.077 0.167 0.093 0.153 0.297 0.111 0.035 0.103 0.059 0.070 0.131 0.129 0.079 0.313 D — — — 0.030 — 0.042 — — — — — — 0.008 0.048 — — J29 A — — — 0.015 — 0.015 0.206 0.063 0.024 0.014 — 0.010 0.015 — — — B 1.000 0.881 1.000 0.970 1.000 0.941 0.677 0.906 0.857 0.892 1.000 0.933 0.879 0.984 0.950 0.944 C — 0.095 — 0.015 — — 0.118 0.031 0.119 0.081 — 0.048 0.099 — 0.050 0.056 D — 0.024 — — — 0.044 — — — 0.014 — 0.010 0.008 0.016 — — J42 A 0.167 0.500 0.017 0.329 — 0.014 0.210 0.014 0.050 0.015 0.028 0.010 — 0.016 — — B 0.046 — 0.017 0.014 0.016 0.069 0.032 0.014 0.050 0.069 0.056 0.039 0.048 0.177 0.025 0.028 C 0.015 — 0.017 0.043 0.047 0.264 0.210 0.306 0.383 0.157 0.250 0.206 0.318 0.403 0.225 0.222 D 0.773 0.500 0.948 0.614 0.938 0.653 0.548 0.667 0.517 0.760 0.667 0.745 0.635 0.403 0.750 0.750 J48 A 0.206 0.208 0.100 0.177 0.132 0.176 0.197 0.194 0.242 0.142 0.222 0.200 0.269 0.313 0.290 0.028 B 0.721 0.736 0.800 0.691 0.765 0.757 0.727 0.722 0.710 0.784 0.722 0.750 0.723 0.688 0.684 0.972 C 0.074 0.056 0.100 0.132 0.103 0.068 0.076 0.083 0.048 0.074 0.056 0.050 0.008 — 0.026 — J50 A 0.221 0.157 0.232 0.177 0.206 0.216 0.242 0.250 0.183 0.314 0.361 0.125 0.156 0.188 0.175 0.167 B 0.779 0.843 0.768 0.824 0.750 0.743 0.758 0.722 0.817 0.686 0.639 0.875 0.828 0.797 0.825 0.833 C — — — — 0.029 — — — — — — — 0.008 0.016 — — D — — — — 0.015 0.041 — 0.028 — — — — 0.008 — — — 合计Total 23 17 16 17 20 18 21 19 19 19 19 16 20 22 19 17 16 注:各等位SSR标记排序按照扩增产物片段从小到大的顺序;山西省五山系油松地理种群的各位点多样性数据来源于武文斌试验原始数据[13]。Notes: each allelic SSR markers are sorted according to the order of amplification product fragments from small to large; the diversity data of the geographical distribution of P. tabuliformis in Shanxi Province are derived from the original data of professor Wu Wenbin[13]. 对16个油松种群等位标记频率差异性进行卡方检验,7个位点等位标记频率差异显著(P < 0.05),试验数据可以用于进行下一步分析。
2.2 油松种群遗传多样性
对16个油松种群的遗传多样性分析见表4,Ne、He和I 3个指标常用来衡量遗传多样性。不同种群的Na和Ne依次是2.286 ~ 3.143和1.297 ~ 1.732,Na种群GDS最高,种群JLS和ZTS最低,Ne种群BDL最高,种群MFS最低;I变化于0.354 ~ 0.661,种群BDL最高,种群MFS最低;Ho和He分别为0.210 ~ 0.428和0.204 ~ 0.397,Ho种群TYS最高,种群XS和SSL最低,He种群BDL最高,种群MFS最低;Hardy-Weinberg平衡偏离指数(D)可由和计算得到D = (Ho − He)/He,D > 0时,表现为杂合子过剩,D < 0时,表现为杂合子缺失;计算各种群的Hardy-Weinberg平衡偏离指数,其中种群XS、SSL、BDL、GS1和GDS的D < 0,表现杂合子缺失,在剩余11个种群中D > 0,表现杂合子过剩;极值比可以反应各种群间遗传结构差异的程度,除在Na中表现为山西五山系种群 > 北京人工林种群 > 古油松,Ne、I、Ho和He均是北京人工林种群 > 山西五山系种群 > 古油松,说明北京油松人工林种群之间遗传差异最大,古油松之间的遗传差异最小。
表 4 16个油松种群遗传多样性Table 4. Genetic diversity of 16 P. tabuliformis populations项目 Item 种群 Population Na Ne I Ho He D 北京人工林
Beijing plantationJF 2.429 1.513 0.503 0.367 0.310 0.184 JLS 2.286 1.536 0.503 0.417 0.323 0.291 MFS 2.429 1.297 0.354 0.237 0.204 0.162 MY 2.857 1.569 0.562 0.343 0.327 0.049 XS 2.571 1.341 0.406 0.210 0.227 − 0.075 SSL 3.000 1.479 0.528 0.210 0.294 − 0.286 BDL 2.714 1.732 0.661 0.271 0.397 − 0.317 SHY 2.857 1.437 0.482 0.414 0.278 0.489 极值比
Extremum ratio1.312 1.335 1.867 1.985 1.946 — 古油松
Ancient P. tabuliformisGS1 2.857 1.487 0.496 0.239 0.285 − 0.161 GS2 2.857 1.423 0.488 0.310 0.277 0.119 GS3 2.286 1.467 0.449 0.303 0.227 0.094 极值比
Extremum ratio1.249 1.044 1.104 1.297 1.028 — 山西五山系
Five mountain populations in Shanxi ProvinceGCS 2.857 1.439 0.504 0.302 0.291 0.038 GDS 3.143 1.608 0.608 0.315 0.370 − 0.149 THS 2.714 1.731 0.617 0.400 0.382 0.047 TYS 2.429 1.494 0.517 0.428 0.321 0.333 ZTS 2.286 1.479 0.479 0.311 0.297 0.047 极值比
Extremum ratio1.374 1.202 1.288 1.417 1.312 — 注:Na. 观测等位标记数;Ne. 有效等位标记数;I. Shannon’s信息指数;Ho. 观测杂合度;He. 期望杂合度;D. Hardy-Weinberg平衡偏离指数;极值比:在同一大类地理种群中某一参数值的最大值与最小值的比值。Notes: Na, number of observed alleles; Ne, effective alleles; I, Shannon’s information index; Ho, observed heterozygosity; He, expected heterozygosity; D, Hardy-Weinberg balance deviation index; extremum ratio: ratio of the maximum value to the minimum value of a parameter value in the same large geographic population. 2.3 各位点在油松种群中遗传分化
7个位点在16个油松种群间的遗传分化结果见表5,除位点J20、J29和J50外,其余各位点FIS均为负值,平均为− 0.076,说明样本油松群体内杂合子过剩,其中古油松FIS为− 0.102,种群内杂合子过剩最多,而山西五山系FIS为− 0.068,种群内杂合子过剩最少;FIT在J9、J10和J48 3个位点中为负值,即FIT < 0,其余4个位点FIT > 0,平均为− 0.001,表明油松总样本种群杂合子过剩,其中古油松FIT是− 0.077,北京人工林FIT是− 0.001;FST在各位点间波动于0.021 ~ 0.151,平均为0.070,即平均遗传分化为7%,表明7%的遗传变异存在种群间,而93%的遗传变异存在种群内,种群内的变异是遗传变异的主要来源,其中人工林FST高达0.066,种群间存在中等程度的遗传结构变异,而古油松和山西五山系种群间遗传结构变异程度较低,FST依次是0.023和0.033[17],北京人工林种群之间遗传结构差异最大,古油松种群间遗传结构差异最小,该结果和极值比的结果一致。
表 5 16个油松种群中的F统计量Table 5. F-statistics in 16 P. tabuliformis populations参数
ParameterJ9 J10 J20 J29 J42 J48 J50 平均值 Mean 北京人工林 Beijing plantation 古油松
Ancient P. tabuliformis山西五山系
Five mountain populations
in Shanxi ProvinceFIS − 0.282 − 0.360 0.217 0.228 − 0.057 − 0.193 0.016 − 0.076 − 0.071 − 0.102 − 0.068 FIT − 0.217 − 0.155 0.266 0.287 0.068 − 0.162 0.005 − 0.001 − 0.001 − 0.077 − 0.033 FST 0.051 0.151 0.062 0.078 0.119 0.026 0.021 0.070 0.066 0.023 0.033 Nm 4.657 1.402 3.763 2.973 1.860 9.328 11.593 3.314 3.552 10.806 7.311 注:FIS. 群体内的固定指数;FIT. 总群体的固定指数;FST. 群体间遗传分化系数;Nm. 基因流。Notes: FIS, fixed index in population; FIT, fixed index of total population; FST, coefficient of genetic differentiation among populations ; Nm, gene flow. 2.4 种群间遗传距离与系统关系
遗传距离(GD)可衡量种群间亲缘关系远近,遗传一致度(GI)是衡量种群间遗传相似性参数,表6显示16个油松种群间遗传距离和遗传一致度变化范围为0.009 ~ 0.093和0.911 ~ 0.999,说明种群间遗传相似程度较高,遗传距离较小。基于样本16个油松种群间的Nei’s遗传距离通过软件MEGA7.0进行UPGMA聚类分析,结果见图1,可以看出当遗传距离在0.020左右时,16个油松种群可以分为3大类。第一大类(Ⅰ类)包括10个种群,其中古油松GS1、GS2和GS3与北京人工林SSL和SHY在遗传距离0.010处聚为第一亚类,而后与北京人工林JF、MY、MFS和XS一起聚为第一大类;第二大类(Ⅱ类)由山西的五山系种群构成,并显示山系种群间有一定遗传距离,其中位于山西省中部的3个种群GDS、GCS和TYS间具有较近遗传距离;北京人工林种群JLS单独构成第三大类(Ⅲ类)。
表 6 北京11个油松种群和山西五山系油松种群的遗传一致度和Nei’s遗传距离Table 6. Genetic identity and genetic distance of 11 P. tabuliformis populations in Beijing and P. tabuliformis populations in five mountain populations in Shanxi Province种群 Population JF JLS MFS MY XS SSL BDL SHY GS1 GS2 GS3 GCS GDS THS TYS ZTS JF — 0.971 0.981 0.988 0.983 0.967 0.966 0.962 0.950 0.977 0.969 0.960 0.958 0.931 0.960 0.970 JLS 0.030 — 0.951 0.986 0.949 0.932 0.956 0.935 0.946 0.952 0.948 0.932 0.934 0.911 0.927 0.927 MFS 0.019 0.051 — 0.975 0.999 0.969 0.950 0.973 0.961 0.991 0.983 0.971 0.959 0.922 0.967 0.962 MY 0.012 0.014 0.026 — 0.976 0.969 0.972 0.967 0.966 0.976 0.970 0.962 0.958 0.936 0.959 0.958 XS 0.017 0.053 0.001 0.024 — 0.974 0.953 0.976 0.964 0.992 0.983 0.973 0.962 0.926 0.970 0.964 SSL 0.034 0.070 0.032 0.031 0.027 — 0.978 0.996 0.983 0.984 0.981 0.984 0.978 0.965 0.983 0.976 BDL 0.034 0.046 0.051 0.028 0.048 0.022 — 0.979 0.973 0.972 0.961 0.962 0.963 0.942 0.959 0.964 SHY 0.039 0.067 0.028 0.033 0.024 0.004 0.021 — 0.991 0.989 0.989 0.982 0.976 0.959 0.980 0.964 GS1 0.059 0.055 0.040 0.035 0.037 0.017 0.028 0.009 — 0.982 0.985 0.972 0.974 0.960 0.970 0.948 GS2 0.023 0.049 0.009 0.025 0.008 0.016 0.029 0.011 0.018 — 0.994 0.973 0.968 0.939 0.970 0.965 GS3 0.032 0.053 0.018 0.030 0.017 0.019 0.040 0.012 0.016 0.006 — 0.970 0.969 0.953 0.971 0.951 GCS 0.041 0.070 0.029 0.039 0.027 0.016 0.039 0.019 0.028 0.027 0.030 — 0.994 0.975 0.998 0.976 GDS 0.043 0.069 0.041 0.043 0.039 0.022 0.038 0.025 0.027 0.033 0.032 0.006 — 0.987 0.995 0.976 THS 0.072 0.093 0.081 0.066 0.077 0.036 0.060 0.042 0.041 0.063 0.049 0.025 0.013 — 0.978 0.953 TYS 0.041 0.076 0.033 0.042 0.030 0.018 0.042 0.020 0.031 0.030 0.030 0.002 0.005 0.022 — 0.972 ZTS 0.030 0.076 0.039 0.043 0.036 0.025 0.037 0.036 0.053 0.036 0.050 0.025 0.024 0.048 0.029 — 注:对角线以上为遗传相似度,对角线以下为遗传距离。Notes: above diagonal represents Nei’s genetic identity, below diagonal represents genetic distance. 3. 讨 论
3.1 北京油松人工林的遗传结构及其与古油松种群差异
8个北京油松人工林种群在遗传结构上均表现出偏离遗传平衡的特点。种群JF、JLS、MFS、MY和SHY表现为杂合子过剩,种群XS、SSL和BDL则表现为杂合子不足的状态,说明引种地环境的选择效应与人工林培育过程的驯化作用对群体的遗传结构产生了不同的影响。样本中所有种群的期望杂合度远大于Vendramin等[18]所提出的遗传衰退临界值(H < 0.05),人工林各种群期望杂合度普遍大于古油松各种群期望杂合度有更高的遗传多样性,说明引入的外来油松种群在幼龄至成林阶段经受了较大的选择压力,而位点杂合度较高个体有更大的选择适合度。北京古油松主要分布于皇家园林、帝王陵墓或者寺庙等地,虽然为人工林,但其种源没有记载,由于百年以前北京周边山区仍有当地起源油松林,择优采种育苗,用于皇家园林营建是有可能的。且限于当时的交通条件,经由他省为古油松造林调种的可能性较小,故皇家园林的古油松可能源于北京本地。古油松种群的遗传结构亦均处于非遗传平衡状态,并表现出较高的杂合子过剩,反映了北京皇家园林的古油松种群经过数百年栽培驯化后的种群遗传结构特性,样本植株有较高的杂合度,推测利杂的适合度可能是较高杂合度主因,且景观需要也可能是其保留的人为因素。从一个侧面也反映了在油松人工林的生长过程中选择与驯化作用具有一定的利杂趋势[19-20]。
7对引物的分析结果表明北京油松人工林种群遗传多样性普遍大于古油松种群遗传多样性,也显示古油松有效种群的规模有限,遗传型有共同起源与选择效应的特点。北京油松人工林种群的有效等位标记数、期望杂合度和Shannon’s多样性指数3个指标在3类种群中均为最高值,故遗传多样性最高,这与人工林种质可能来自不同山系种源、人工林的抚育方法、不同种群间生境的差异以及不同来源种群的驯化效应不同有关。虽然油松人工林的遗传变异主要存在于种群内,符合大多数林木种群遗传变异的遗传结构特征和规律[21-22],但与山西五山系种群和古油松种群相比,有更高的种群间遗传变异,也从另一侧面说明了油松人工林种群的种质来源与进化因素影响的复杂性。
3.2 北京油松人工林和山西五山系油松种群的遗传结构差异及其遗传关联
同一位点在不同种群中等位标记频率差异是种群间遗传多样性和遗传结构变异的基础[23-24]。由表3不同位点在样本种群中的检测结果可知,各等位标记频率在不同类别油松种群中呈现出一定的差异趋势,等位标记J10-A在北京地区油松人工林和古油松种群中的扩增频率相似且很高,而在山西五山系油松种群中扩增频率较低;J42-A在北京人工林中频率较高,在古油松群体中频率则较低,而在山西五山系种群中有最低值且部分群体为零。位点J10、J20、J42和J50较位点J9、J29和J48在3类种群中的等位标记检测频率差别较大,可能对生境选择更敏感。同一位点不同等位标记在不同种群间、种群类别间检测到的频率差异是检测种群间遗传结构差异和遗传分化的基础,而非中性标记(如部分EST-SSR标记)检测结果在一定程度上可以反映生境对种群的选择效应。等位标记J20-B在北京人工林种群和山西五山系种群的扩增频率相似,与古油松存在明显差异,说明该等位标记为北京人工林和山西种群的共同特征,由于两者具有共同来源关系,该标记的稳定表现,可能没有受北京生境选择影响。
3类油松种群间的遗传距离表现了亲缘关系的相对远近。16个油松种群被分为3大类,其中古油松GS1、GS2和GS3位于第一大类(Ⅰ类)的第一亚类内,其他北京人工林(除JLS)同聚在第一大类内,而山西的五山系种群则均处于第二大类(Ⅱ类)内,显示北京地区的油松人工林和古油松间具有相对较近的亲缘关系,并与山西五山系油松种群间有一定亲缘差异,根据我们的调查资料显示[10],北京地区近代的油松人工林种子多来自山西种源,特别是当年主要供种的关帝山(GDS)和太岳山(TYS),从人工林的种质溯源分析角度看,两者间应该有较密切的亲缘关系,而我们的分析结果却不能提供可靠的溯源证据,这可能与我们采用的分子标记(EST-SSR)有关。
北京油松人工林种群未能按照试验预期与山西五山系种源溯源,导致这一结果的可能原因有:山西五山系的油松生长在夏季凉爽湿润的1 300 ~ 1 400 m高海拔气候环境,而北京油松引种地多是100 ~ 200 m低山,夏季高温湿热,较山西地区温度高且降水多。自然气候条件的差异对不同个体产生选择压力,种群内不同个体间的适合度存在差异,油松种子适应度差异表现在从种子发芽[25]、生长、发育到形成成熟植株,各个阶段能够存活下来的植株适应北京地区生境气候条件,不适应的则死亡或者被淘汰,试验选择的对象树龄多在40 ~ 60年,已经经过苗期到成林阶段的北京地区低海拔生境强度选择保留下来的种群,由于这个种群的许多个体遭到淘汰,种群的遗传结构势必要遭到改变[26]。本试验借助的EST-SSR分子标记是来源于核基因组编码区的非中性共显性标记,由于引入种群在较大差异生境下不同遗传型的适合度差异可导致其遗传结构改变,而所用编码区标记中一些可能与适合度关联,故表现了北京人工林种群有别与供种地种群的遗传结构特点。利用这些标记对山西各山系地理种群遗传结构解析中发现,种群遗传结构的变异与生境的湿热比密切相关[13],间接说明这些标记与生境存在一定关联,但因缺乏油松功能基因组信息,现尚不能找到这些EST-SSR标记所关联的基因功能。因此,对已有基因组信息物种的相关研究,在利用EST-SSR标记解析种群遗传结构和构建种群间系统学关系时,应尽量了解这些编码区标记所关联基因的功能,利用与适合度关联标记研究现实种群遗传结构与生态效应,利用与非适合度关联标记构建种群间系统关系。北京九龙山种群(JLS)在北京人工林种群中海拔位置最高(750 m),相对较高海拔高度与偏北的纬度效应,可能使引种地对外来种质的进化影响变小,故而与山西五山系种群间相对北京种群有更近遗传距离。
树高是评价森林生产力的重要指标[27],北京油松人工林年均高生长量在12.969 ~ 27.333 cm,山西五山系油松林年均高生长量在24.763 ~ 40.476 cm,显示为北京油松人工林树高生长显著低于山西油松生长水平,说明山西高海拔生境更适宜于油松林分生长,而北京的低山生境则对油松的生长量有显著的胁迫影响,两地海拔导致的气象因子显著差异可能是影响油松生产力的主因,而这种高、低海拔生境的差异势必对种群中个体的适合度产生显著影响,进而导致种群遗传结构的改变,使引入的人工林种群表现了普遍偏离遗传平衡状态的现象。因此,也从种群遗传结构变化角度,说明海拔高度对于油松的适应性与生长表现有较大的影响。
3.3 利用编码序列EST-SSR标记进行人工林亲缘关系鉴定的可能性与局限
北京人工林种群与古油松在遗传距离上更近,离山西五山系的遗传关系较远,山西五山系种质在北京引种地胁迫生境下的适合度差异导致部分植株被淘汰,因此保留下来的种群遗传结构发生一定程度的改变。而遗传结构改变的趋势将会有利于山西五山系种群逐步适应引入地生境,形成遗传结构区别于山西五山系和北京古油松的种群。本研究通过油松核基因组7对EST-SSR标记虽未能准确推断出与文献记载相一致的北京油松人工林种源,但可以确定不同种群之间的相对亲缘关系[28]。外来种质在引入地胁迫生境下的适合度差异导致部分植株被淘汰,因此保留下来的种群的遗传结构发生一定程度的改变,所以,用核基因组基因来进行种群溯源会存在一定程度的偏差,导致溯源结果不理想。种子的传播会对遗传的空间结构产生影响[29],而细胞质基因组突变率低、在上下代间传递很稳定,且油松线粒体DNA(mtDNA)属于母本遗传,mtDNA标记的空间结构完全由种子传播决定。所以,试验下一阶段将通过线粒体DNA的序列[30-31]构建人工林油松和山西五山系的亲缘关系,在已有核基因组SSR基础之上结合mtDNA遗传标记来研究北京油松种群的遗传多样性、遗传结构和溯源问题。同时扩大试验亲本种源区范围,为北京市的油松人工林最佳种源的选择提供理论基础。
本研究发现北京油松人工林种群较古油松种群变异更丰富,遗传多样性更高。北京油松人工林和古油松种群的分析表明遗传变异主要存在于种群内,种群间的变异低于种群内遗传变异。研究群体普遍存在偏离遗传平衡现象,位点J10、J20、J42和J50在北京人工林、古油松和山西五山系中位点扩增频率差异显著,可作为北京人工林种源溯源的关键引物。引种地对种群的选择效应可导致种群遗传结构改变,利用基因编码区的EST-SSR标记做种群溯源有局限性。研究结果为北京地区油松人工林的评价、培育和种质种源管理提供相应信息,对其他树种的人工林溯源亦有一定参考价值。
-
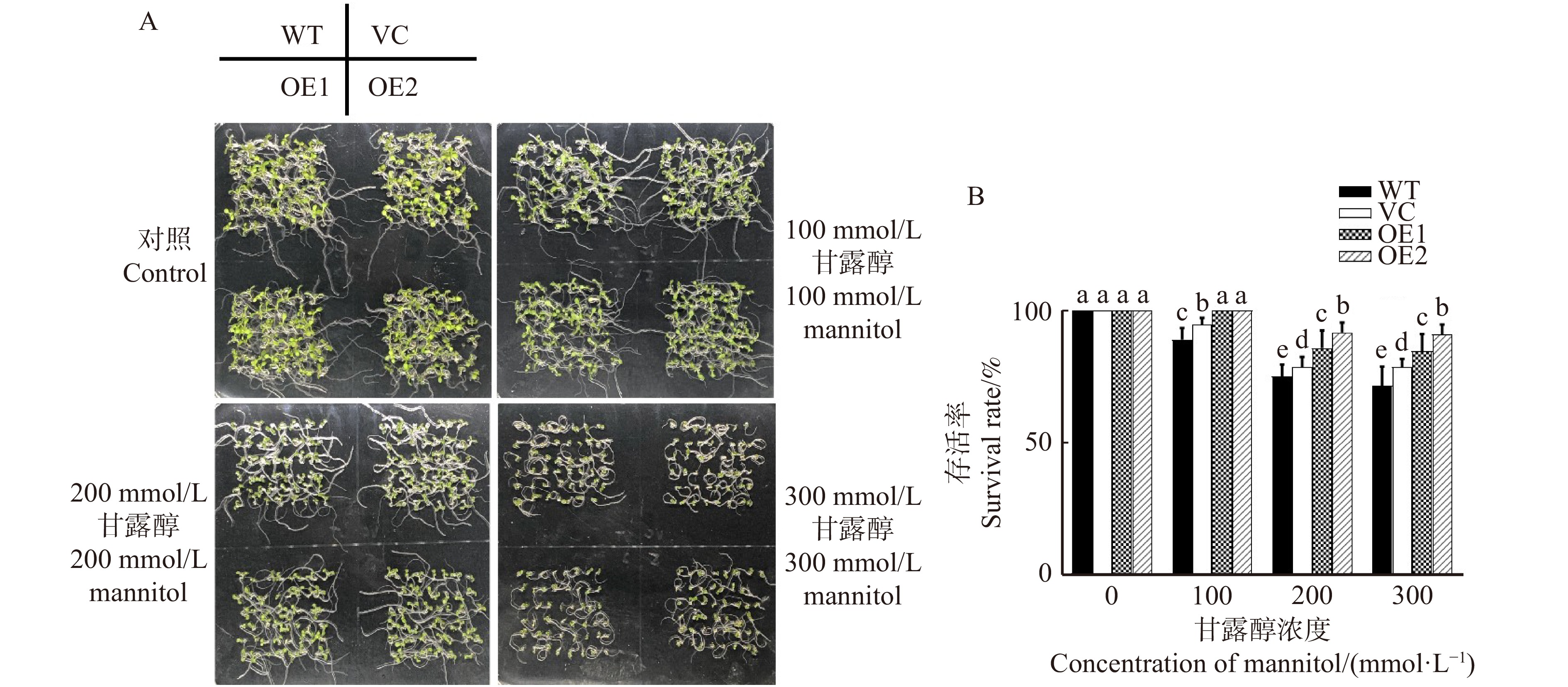
图 1 不同浓度甘露醇对不同拟南芥株系生长表型(A)和存活率(B)的影响
WT. 野生型,VC. 转空载体对照株系,OE1和OE2表示过表达PeREM6.5株系。不同字母表示差异显著P < 0. 05。下同。WT, wild type; VC, empty vector control line; OE1 and OE2 mean PeREM6.5-transgenic Arabidopsis thaliana lines。Different letters in the bar chat denote significant difference (P < 0.05). The same below.
Figure 1. Effects of different concentrations of mannitolon growth phenotype (A) and survival rate (B) on different Arabidopsis thaliana lines
图 4 甘露醇(200 mmol/L)对不同拟南芥株系根细胞H2O2水平变化的影响
A. 根尖细胞H2O2的绿色荧光。B. 根细胞H2O2荧光强度。比例尺 = 100 μm。A, green fluorescence of H2O2 in root cells. B, H2O2 fluorescence intensity in root cells. The scale bar = 100 μm.
Figure 4. Effects of 200 mmol/L mannitol on H2O2 fluorescence intensity in root cells of different Arabidopsis thaliana lines
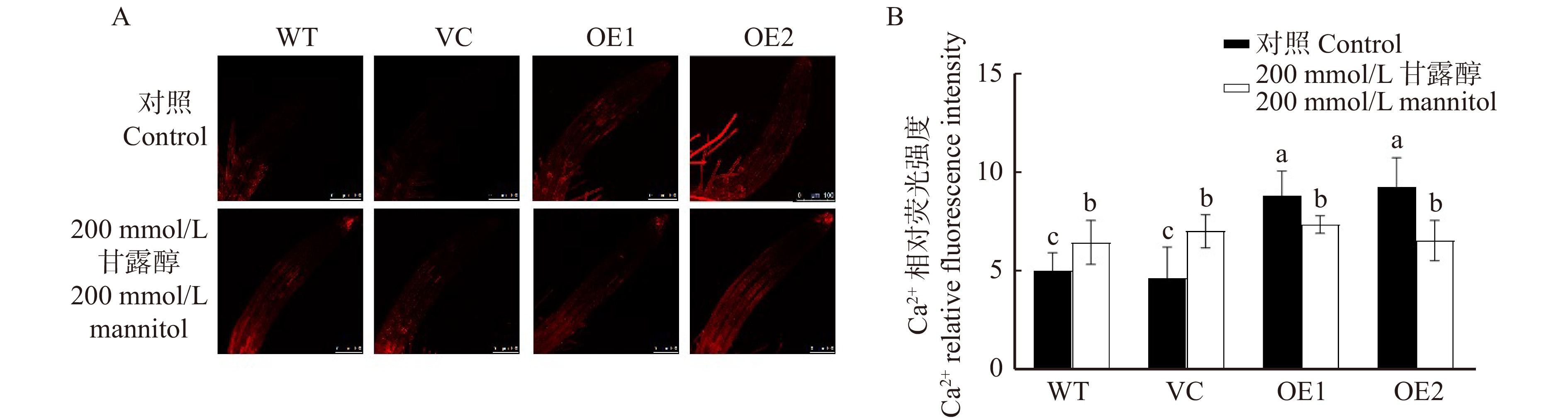
图 5 甘露醇(200 mmol/L)对不同拟南芥株系根细胞Ca2+含量的影响
A. 根尖细胞Ca2+的红色荧光,比例尺= 100 μm;B. 根细胞Ca2+荧光强度。A, red fluorescence of Ca2+ in root cells, scale bar = 100 μm. B, Ca2+ fluorescence intensity in root cells.
Figure 5. Effects of 200 mmol/L mannitol on Ca2+ fluorescence intensity in root cells of different Arabidopsis thaliana lines
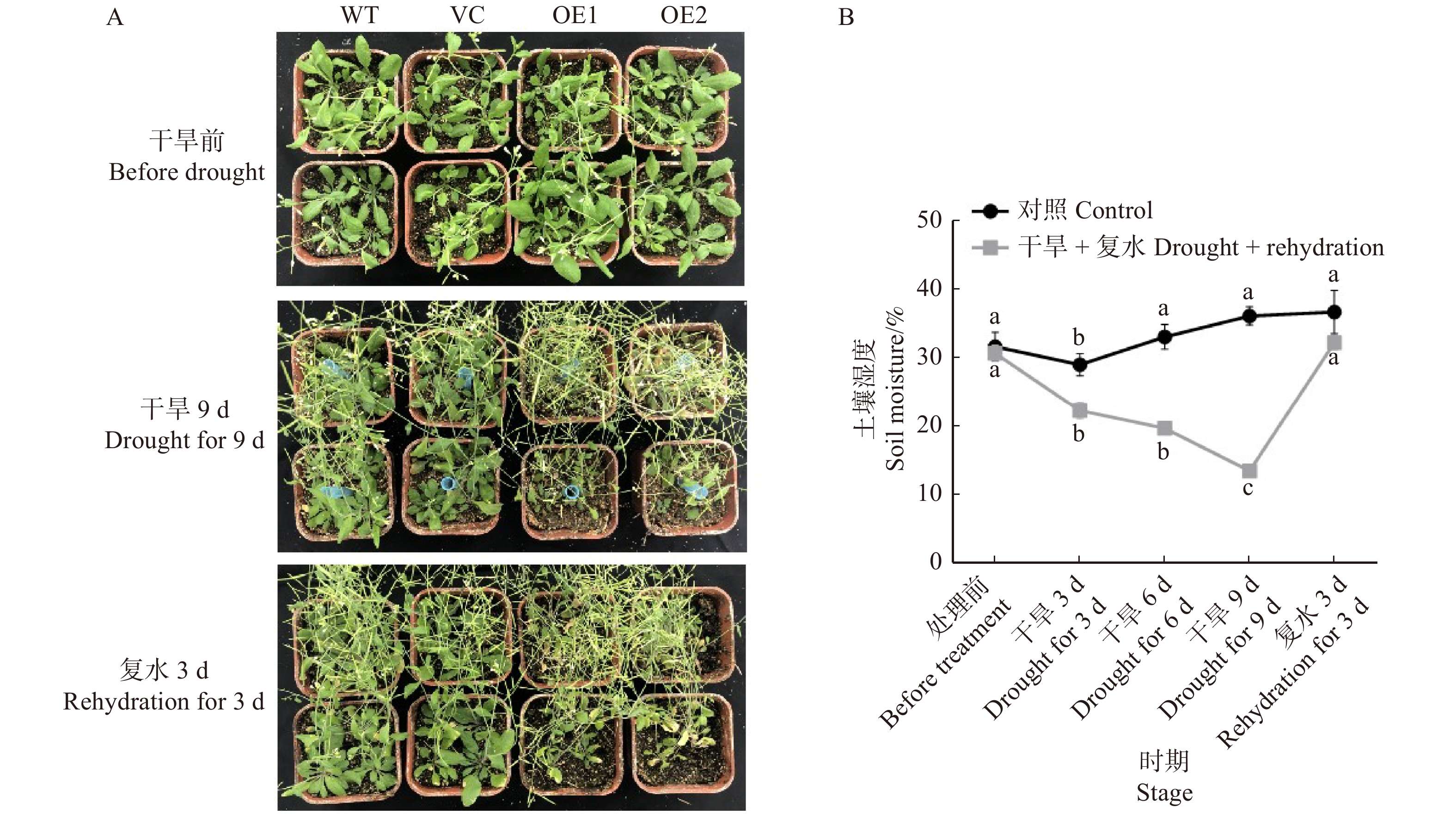
图 8 干旱和复水对不同拟南芥株系生长状况的影响
A. 干旱和复水处理后拟南芥生长状况;B. 干旱和复水处理后土壤湿度的变化。不同字母表示在P < 0.05水平上差异显著。A, plant performance of Arabidopsis thaliana after treatment of drought and rehydration; B, changes of soil moisture after drought and rehydration treatments. Different letters in the bar chat denote significant differences at P < 0.05 level.
Figure 8. Effects of drought and rehydration treatments on plant performance of different Arabidopsis thaliana lines
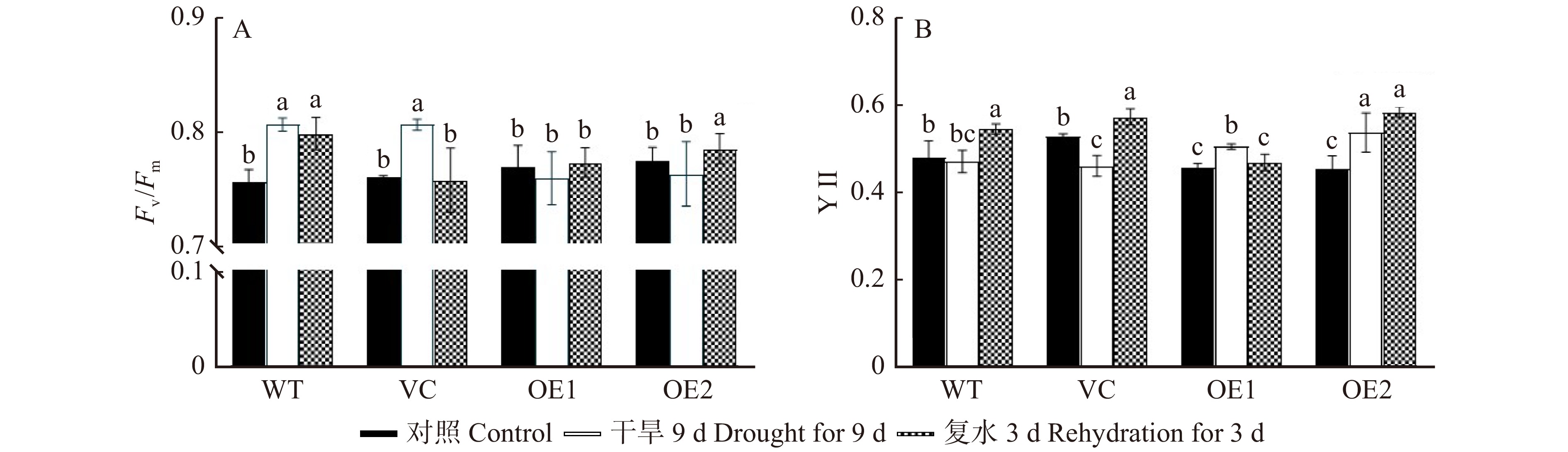
图 10 干旱和复水对不同拟南芥株系叶绿素荧光参数Fv/Fm(A)和YⅡ(B)的影响
Fv/Fm. PSⅡ最大光化学效率;YⅡ. 实际光合量子产量。Fv/Fm, maximum photochemical efficiency of PSⅡ; YⅡ, actual photosynthetic quantum yield.
Figure 10. Effects of drought and rehydration on chlorophyll fluorescence parameters Fv/Fm (A) and YⅡ (B) of different Arabidopsis thaliana lines
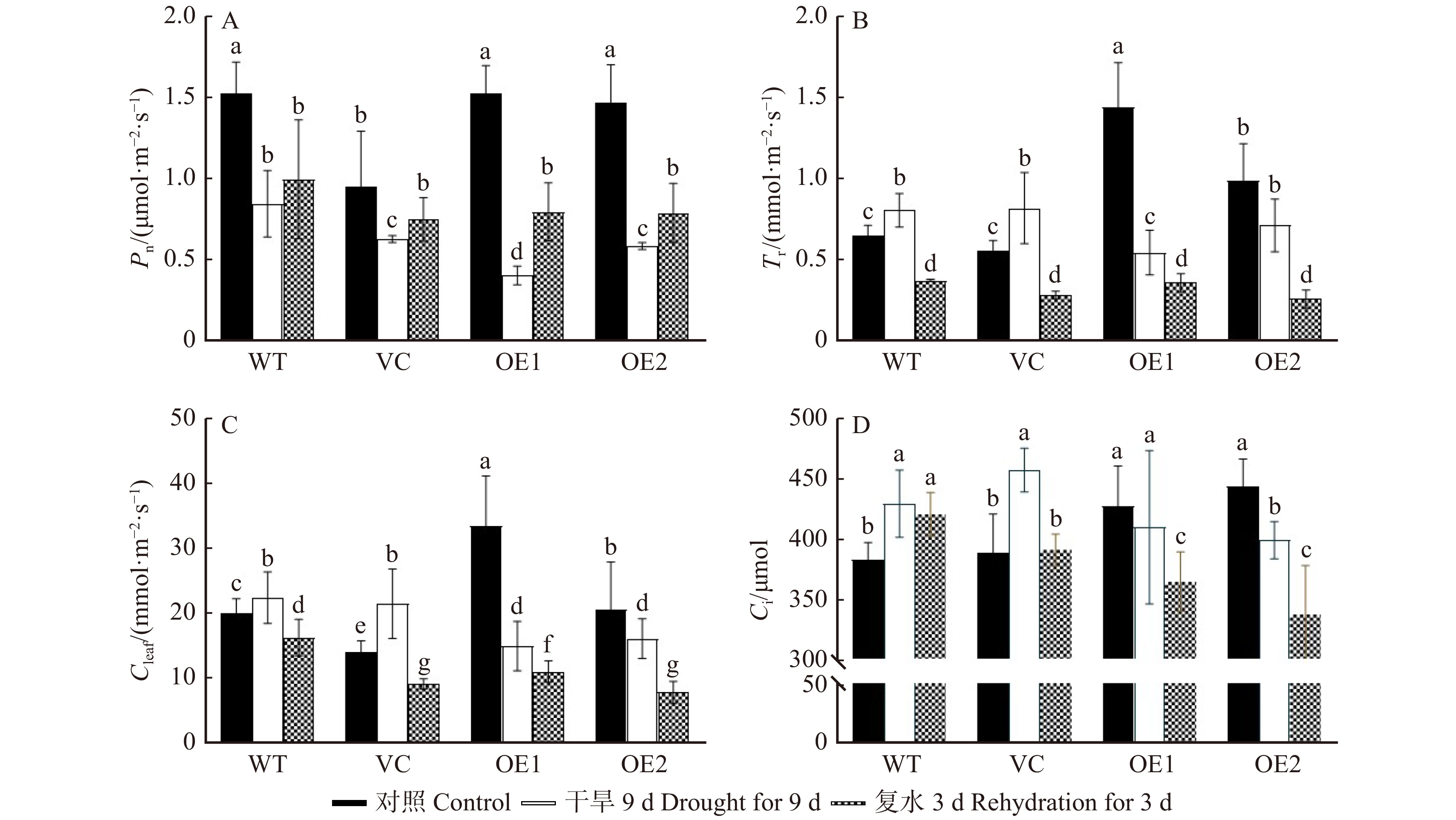
图 11 干旱和复水对不同拟南芥株系光合参数的影响
Pn. 光合速率;Tr.蒸腾速率;Cleaf. 气孔导度;Ci. 胞间二氧化碳浓度。Pn, photosynthetic rate; Tr, transpiration rate; Cleaf, stomatal conductance; Ci, intercellular carbon dioxide concentration.
Figure 11. Effects of drought and rehydration treatments on photosynthetic parameters of different Arabidopsis thaliana lines
表 1 RT-qPCR所用引物序列
Table 1 Sequences of gene-specific primers used for RT-qPCR
基因名称
Gene name正向引物(5′—3′)
Forward primer (5′−3′)反向引物(5′—3′)
Reverse primer (5′−3′)AtACTIN2 GGTAACATTGTGCTCAGTGGTGG AACGACCTTAATCTTCATGCTGC AtSOD AGGAAACATCACTGTTGGAGAT GAGTTTGGTCCAGTAAGAGGAA AtCAT AGGATCAAACTTTGAGGGGTAG CTTGTGGTTCCTGGAATCTACT AtPOD CGTGCCCTTCATATTGTTGG GACGCCATCAACAACGAGTC AtPIP1;2 ACTACCTGTGTGTAACGTGTGT TGCCTGCTTGAGATAAACCCA AtPIP2;1 GCTGCCAACGTCTAAACACA ACACAACGCATAAGAACCTCT -
[1] Caruso A, Chefdor F, Carpin S, et al. Physiological characterization and identification of genes differentially expressed in response to drought induced by PEG 6000 in Populus canadensis leaves[J]. Plant Physiology, 2008, 165: 932−941. doi: 10.1016/j.jplph.2007.04.006
[2] Reymond P, Kunz B, Paul-Pletzer K, et al. Cloning of a cDNA encoding a plasma membrane associated, uronide binding phosphoprotein with physical properties similar to viral movement proteins[J]. The Plant Cell, 1996, 8(12): 2265−2276.
[3] Raffaele S, Mongrand S, Gamas P, et al. Genome-wide annotation of remorins, a plant-specific protein family: evolutionary and functional perspectives[J]. Plant Physiology, 2007, 145(3): 593−600. doi: 10.1104/pp.107.108639
[4] Reymond P, Weber H, Damond M, et al. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis[J]. The Plant Cell, 2000, 12(5): 707−720. doi: 10.1105/tpc.12.5.707
[5] Bray E A. Abscisic acid regulation of gene expression during water-deficit stress in the era of the Arabidopsis genome[J]. Plant Cell and Environment, 2002, 25(2): 153−161. doi: 10.1046/j.1365-3040.2002.00746.x
[6] Reddy A R, Ramakrishna W, Sekhar A C, et al. Novel genes are enriched in normalized cDNA libraries from drought-stressed seedlings of rice (Oryza sativa L. subsp. indica cv. Nagina 22)[J]. Genome, 2002, 45(1): 204−211. doi: 10.1139/g01-114
[7] Checker V G, Khurana P. Molecular and functional characterization of mulberry EST encoding remorin (MiREM) involved in abiotic stress[J]. Plant Cell Reports, 2013, 32(11): 1729−1741. doi: 10.1007/s00299-013-1483-5
[8] Yue J, Cong L, Liu Y, et al. A remorin gene SiREM6, the target gene of SiARDP, from foxtail millet (Setaria italica) promotes high salt tolerance in transgenic Arabidopsis[J]. PLoS One, 2014, 9(6): e100772. doi: 10.1371/journal.pone.0100772
[9] Chen S, Li J, Wang S, et al. Effects of NaCl on shoot growth, transpiration, ion compartmentation, and transport in regenerated plants of Populus euphratica and Populus tomentosa[J]. Canadian Journal of Forest Research, 2003, 33(6): 967−975. doi: 10.1139/x03-066
[10] 张会龙. 胡杨PeREMs和PeJRL调控植物耐盐机制研究[D]. 北京: 北京林业大学, 2019. Zhang H L. The role of Populus euphratica PeREMs and PeJRL in the mediation of salt tolerance in higher plants[D]. Beijing: Beijing Forestry University, 2018.
[11] Abbott A G, Ainsworth C C, Flavell R B. Characterization ofanther differentiation in cytoplasmic male sterile maize using aspecific isozyme system (esterase)[J]. Theoretical and Applied Genetics, 1984, 67: 469−473. doi: 10.1007/BF00263415
[12] Kraus T E, Fletcher R A. Paclobutrazol protects wheat seedlings from heat and paraquat injury is detoxification of active oxygen involved[J]. Plant and Cell Physiology, 1994, 35: 45−52.
[13] Shen Z D, Yao J, Sun J, et al. Populus euphratica HSF binds the promoter of WRKY1 to enhance salt tolerance[J]. Plant Science, 2015, 235: 89−100. doi: 10.1016/j.plantsci.2015.03.006
[14] 武霞, 张一南, 赵楠, 等. 过表达胡杨PeAnn1负调控拟南芥的抗旱性[J]. 北京林业大学学报, 2020, 42(6): 14−25. doi: 10.12171/j.1000-1522.20200031 Wu X, Zhang Y N, Zhao N, et al. Overexpression of PeAnn1 from Populus euphratica negatively regulates drought resistance in transgenic Arabidopsis thaliana[J]. Journal of Beijing Forestry University, 2020, 42(6): 14−25. doi: 10.12171/j.1000-1522.20200031
[15] Lang Y, Wang M, Zhang G C, et al. Experimental and simulated light responses of photosynthesis in leaves of three tree species under different soil water conditions[J]. Photosynthetica, 2013, 51(3): 370−378. doi: 10.1007/s11099-013-0036-z
[16] 魏清江, 冯芳芳, 马张正, 等. 干旱复水对柑橘幼苗叶片光合、叶绿素荧光和根系构型的影响[J]. 应用生态学报, 2018, 29(8): 2485−2492. doi: 10.13287/j.1001-9332.201808.028 Wei Q J, Feng F F, Ma Z Z, et al. Effects of drought rehydration on leaf photosynthesis, chlorophyll fluorescence and root architecture of citrus seedlings[J]. Chinese Journal of Applied Ecology, 2018, 29(8): 2485−2492. doi: 10.13287/j.1001-9332.201808.028
[17] 张永刚, 韩梅, 姜雪, 等. 黄芩对干旱复水的生理生态响应[J]. 中国中药杂志, 2013, 38(22): 3845−3850. Zhang Y G, Han M, Jiang X, et al. Physiological ecology responses of Scutellaria baicalensis to drought rewatering[J]. China Journal of Chinese Materia Medica, 2013, 38(22): 3845−3850.
[18] 程彦伟, 韩建明, 徐晓燕, 等. 植物Remorin蛋白的研究进展[J]. 河南工业大学学报 (自然科学版), 2009, 30(4): 88−93. Cheng Y W, Han J M, Xu X Y, et al. The research progress of Remorin protein of plants[J]. Journal of Henan University of Technology (Natural Science Edition), 2009, 30(4): 88−93.
[19] Vranova E, Inze D, van-Breusegem F. Signal transduction during oxidative stress[J]. Journal of Experimental Botany, 2002, 53(372): 1227−1236. doi: 10.1093/jxb/53.372.1227
[20] Mahdieh M, Mostajeran A, Horie T, et al. Drought stress alters water relations and expression of PIP-type aquaporin genes in Nicotiana tabacum plants[J]. Plant and Cell Physiology, 2008, 49(5): 801−813. doi: 10.1093/pcp/pcn054
[21] Gilroy S, Trewavas A. Signal processing and transduction in plant cells: the end of the beginning[J]. Nature Reviews Molecular Cell Biology, 2001, 2(4): 307−314. doi: 10.1038/35067109
[22] 顾学花, 孙莲强, 高波, 等. 施钙对干旱胁迫下花生生理特性、产量和品质的影响[J]. 应用生态学报, 2015, 26(5): 1433−1439. doi: 10.13287/j.1001-9332.20150319.015 Gu X H, Sun L Q, Gao B, et al. Effects of calcium fertilizer application on peanut growth,physiological characteristics,yield and quality under drought stress[J]. Chinese Journal of Applied Ecology, 2015, 26(5): 1433−1439. doi: 10.13287/j.1001-9332.20150319.015
[23] 王顺喜. 玉米抗逆相关基因Zm-Remorin的克隆和功能分析[D]. 郑州: 河南农业大学, 2014. Wang S X. Cloning and function analysis of maize stress tolerance relate gene Zm-Remorin[D]. Zhengzhou: Henan Agricultural University, 2014.
[24] Zhang H, Deng C, Wu X, et al. Populus euphratica remorin 6.5 activates plasma membrane H+-ATPases to mediate salt Tolerance[J]. Tree Physiolohy, 2020, 6(6): 731−745.
[25] Sun J, Wang M J, Ding M Q, et al. H2O2 and cytosolic Ca2+ signals triggered by the PM H+-coupled transport system mediate K+/Na+ homeostasis in NaCl-stressed Populus euphratica cells[J]. Plant Cell Environment, 2010, 33(6): 943−958. doi: 10.1111/j.1365-3040.2010.02118.x
-
期刊类型引用(2)
1. 王博,杨雪清,蒋春颖,赖光辉,陈锋,刘晓东. 北京山区森林火灾蔓延风险评估. 生态学报. 2025(02): 813-821 .  百度学术
百度学术
2. 律江,贾玮,刘洋,刘阳. 城市与森林融合的国有林场森林防火地面防控新范式探索——以北京市西山试验林场为例. 森林防火. 2024(03): 42-45 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: