Pollen chromosome doubling induced by colchicine treatment and creation of hybrid triploids in Populus canescens
-
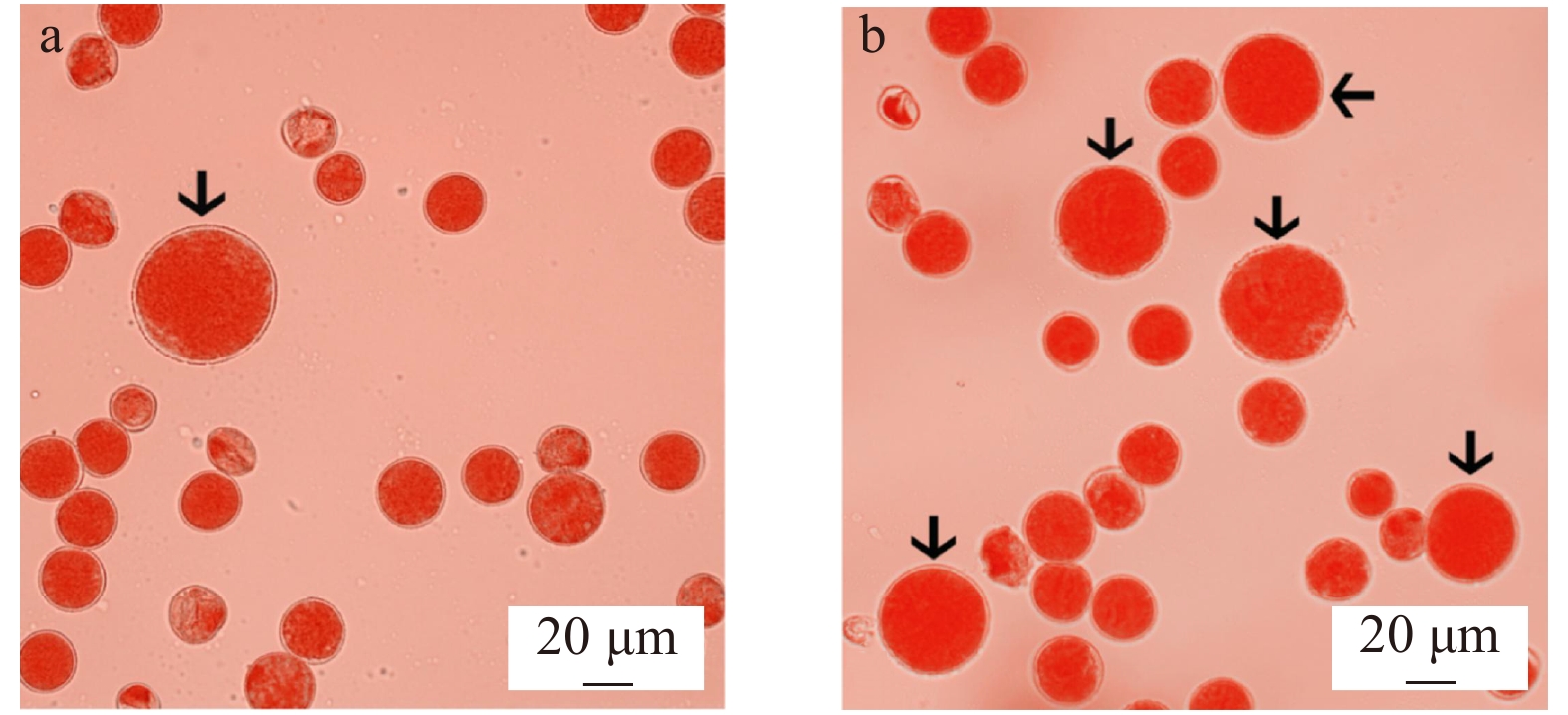
摘要:目的为创制银灰杨杂种三倍体新种质,研究完善银灰杨三倍体育种技术体系,筛选生长迅速、抗逆性强的银灰杨新品种。方法本研究以银灰杨、河北杨以及银腺杨为试验材料,在优化秋水仙碱诱导银灰杨花粉染色体加倍技术条件的基础上,开展了秋水仙碱注射处理对2n花粉粒表面结构的影响以及杂交创制杂种三倍体的研究。结果减数分裂时期、注射次数、减数分裂时期与注射次数的交互效应均对2n花粉诱导率具有极显著影响。利用0.5%的秋水仙碱溶液对发育至粗线期的花粉母细胞进行11次注射处理是秋水仙碱诱导银灰杨花粉染色体加倍的最佳处理组合,2n花粉平均诱导率最高可达(30.27 ± 8.69)%。与天然2n花粉粒相比,秋水仙碱诱导型2n花粉粒表面结构出现了明显的裂沟,说明秋水仙碱注射处理对2n花粉花粉壁形成具有一定的影响。选取含有一定2n花粉比例的花粉,分别与河北杨、银腺杨雌配子进行授粉杂交,共收获杂种苗木4 955株,检测出三倍体5株,其中,2株三倍体来源于河北杨 × 银灰杨的杂交组合;另3株三倍体来源于银腺杨 × 银灰杨的杂交组合。结论秋水仙碱能高效诱导银灰杨花粉染色体加倍并获得2n花粉,但是注射会影响2n花粉花粉壁的形成,使得2n花粉粒表面结构产生裂沟。秋水仙碱诱导的2n花粉可以用于授粉杂交,成功获得杂种多倍体植株。Abstract:ObjectiveImproving the technical system of triploid breeding to generate new triploid germplasm can serve for developing new varieties with fast growing and higher resistance in P. canescens.MethodBased on the optimization of technical conditions for inducing pollen chromosome doubling, effects of colchicine on induced 2n pollen of surface structure and triploid production by crossing induced 2n pollen were conducted by taking P. canescens, P. hopeiensis and P. alba × P. glandulosa as experimental materials.ResultThe results showed that meiotic stages, injection times and the interaction between meiotic stage and injection time had highly significant effects on frequency of colchicine-induced 2n pollen. The optimum treatment combination to induce pollen chromosome doubling was to inject 11 times with 0.5% colchicine solution when pollen mother cells were at pachytene. The highest mean frequency of colchicine-induced 2n pollen was (30.27 ± 8.69)%. Compared with natural 2n pollen, some narrow furrows on the surface of the colchicine-indued 2n pollen were observed, suggesting that colchicine did, to some extent, affect the formation of cell wall of induced 2n pollen. 4 955 hybrid offsprings were obtained by crossing induced 2n pollen with female gametes of P. hopeiensis and P. alba × P. glandulosa, and five real triploids were detected by flow cytometric analysis and somatic chromosome counting. Among the five triploids, two triploids were derived from the cross combination between P. hopeiensis and P. canescens, and three triploids were derived from the cross combination between P. alba × P. glandulosa and P. canescens.ConclusionColchicine could not only induce pollen chromosome doubling to produce 2n pollen but also affect the formation of cell wall of colchicine-induced 2n pollen and resulted in narrow furrows on ectexine structure in P. canescens. Hybrid polyploid offsprings were successfully obtained by crossing colchicine-induced 2n pollen.
-
Keywords:
- Populus canescens /
- colchicine /
- induction of 2n pollen /
- surface structure of 2n pollen /
- triploid
-
火是森林生态系统(特别是北方森林)的首要干扰因素,它通过影响其内部死亡与再生模式影响森林生态系统的结构与组成[1-2]。火干扰过程中土壤物理(团聚体稳定性、土壤孔隙系统、渗透速率等)化学(矿质养分有效性、酸碱性及离子交换能力等)性质发生变化,火烧频率、强度、季节等因素影响土壤理化性质变异程度及其恢复[3-5]。土壤密度指自然状态下单位容积土壤的烘干质量,是重要的土壤物理性质之一,与土壤孔隙度、结构、有机质含量、疏松程度等关系密切,是这些性质的综合反映,常作为评价土壤性质和肥力的重要指标[6-7]。火干扰后,有机物碳化、土壤动物逃逸等因素可能导致土壤密度下降[8];而燃烧过程中产生的植物源颗粒物及灰分输入、土壤有机质含量下降、有机胶结剂断裂产生的灰分和黏土矿物进入土壤孔隙,则导致土壤密度升高[5, 8-9]。目前,关于林火干扰下土壤密度的研究较多,因火烧强度、植被恢复时期、火烧类型、采样季节性等差异,尚无共识性的研究结论[1, 5, 10-18]。此外,目前火烧迹地多采用以“空间代替时间”的方法进行研究,研究过程中多模糊了研究地火烧前土壤密度的空间异质性,这也可能是导致研究结果迥异的重要原因。
大兴安岭森林火灾频发,是全球气候变化敏感、火源分布复杂、难控性大的重点火险地区[19]。本文从恢复生态学角度出发,以大兴安岭北部寒温带杜香(Ledum palustre)-杜鹃(Rhododendron dauricum)-落叶松(Larix gmelinii)林地为研究对象,采用连续定点监测的方法,排除火烧前土壤密度空间异质性这一不确定因素,系统研究时间序列上不同强度林火干扰下大兴安岭土壤密度的时空变化格局及其形成机制,旨在更好地认识火干扰后森林土壤密度的时空动态规律,为火烧迹地改造和生态恢复提供参考。
1. 研究方法
1.1 研究地概况
研究地位于大兴安岭北部塔河林业局沿江林场,地理坐标为124°25′02″E、53°06′52″N。寒温带大陆性季风气候,冬寒夏暖,年均气温-2.4℃,降水量460.3mm,主要集中在7—8月,全年无霜期仅98d。研究地属低山丘陵地貌,海拔312m,东坡,坡度5°~10°。杜香-杜鹃-落叶松林,主要树种为兴安落叶松,并混有数量不等的白桦(Betula platyphylla)。林冠郁闭度0.7,林下灌木盖度约70%~90%,森林凋落物厚度5~10cm,有明显的半泥炭化现象。土壤类型为漂灰土(漂白暗瘠寒冻雏形土,CST),腐殖质层厚度8~12cm,表层土壤有机质含量极高且疏松多孔,易引燃。根据营林历史记录,20世纪60年代择伐前,研究地为成熟的落叶松原始林,多年来未发生过林火干扰,是较理想的林火试验场所。所选样地面积20m×40m,矩形,长边顺坡向延伸。网格法布设66个间距4m的正方形固定监测(采样)点位(图 1)。
![]() 图 1 样地监测点位布设及林火强度格局数字2~9表示火烧强度等级,其中,2、3表示轻度火烧,4、5、6表示中度火烧,7、8、9表示重度火烧。Figure 1. Monitoring sites (small black dots) and the pattern of FI of sample plotNumber from 2 to 9 means fire intensity (FI) subclass, mild subclass includes 2 and 3; moderate subclass includes 4, 5 and 6; severe subclass includes 7, 8 and 9.
图 1 样地监测点位布设及林火强度格局数字2~9表示火烧强度等级,其中,2、3表示轻度火烧,4、5、6表示中度火烧,7、8、9表示重度火烧。Figure 1. Monitoring sites (small black dots) and the pattern of FI of sample plotNumber from 2 to 9 means fire intensity (FI) subclass, mild subclass includes 2 and 3; moderate subclass includes 4, 5 and 6; severe subclass includes 7, 8 and 9.1.2 林火点烧试验
10月下旬,在森林消防严密监控下,进行野外林火点烧试验。以地表可燃物自然状态点烧为主(因微地形差异等因素,地表可燃物载量约20~40t/hm2),部分点位添加森林可燃物(枝丫)以模拟高强度林火,以火焰高度不足2m的地表火为主,部分监测点位并发地下火。监测点位布设温度探头,测定地表 0、10cm与地下5、10cm温度与持续时间,自动采集监测数据。根据过火迹地实际烧焦情况,将林火强度分为3个等级,并绘制林火强度格局图(图 1,数字2~9表示火烧强度等级):轻度,仅地上植被过火(包括2地上植物烧焦1/2以下、3烧焦1/2以上);中度,地上植被全部过火或烧焦,凋落物层发生燃烧但并未完全烧毁(包括4凋落物层残留厚度2/3以上、5残留厚度2/3~1/3、6残留厚度1/3以下);重度,地上植被全部过火或烧焦,凋落物层完全烧毁,疏松的土壤腐殖质表层发生不同程度燃烧或烧焦(包括7腐殖质层损失0.5cm以下、8损失0.5~1.0cm、9损失1.0cm以上)[20]。经统计,66个监测点位中轻、中、重度火烧区分别包括20、27和19个监测点位。
1.3 土样采集与土壤密度测定
林火点烧试验前对监测点位进行号码标记,在已经布设好的监测点位插入钢钎,并记录凋落物层和腐殖质层上界位置。以火烧前采样为例,说明具体过程:以钢钎为中心,用圆形滚刀切取30cm×30cm圆形范围内的毡状半泥炭化凋落物层,保存原状凋落物;在圆周内随机选择3个取土点位,用特制微型钢制土钻(直径2cm)将0~10cm原状土样取出,烘干称质量,计算土壤密度[21];用细河沙回填取样孔,并将毡状半泥炭化凋落物层复位。所有监测点位土样采集完成后,立即进行林火点烧试验。
共设置4个土样采集时间节点,分别为:火前自然状态(T0),10月下旬林火点烧试验前1d;火后即时状态(T1),火烧试验后1d;融雪季冻融状态(T2),翌年6月中旬;雨季/生长季淋溶与恢复状态(T3),翌年8月下旬。为控制火烧后不同采样时间的空间误差,各时间节点取样均严格控制在监测点位中心30cm×30cm圆形范围内,采样方法同T0时段。
1.4 数据统计及作图
采用SPSS17.0软件进行数据统计,其中火烧时间序列土壤密度变化的常规统计分析采用单因素方差分析与均值比较分析,火烧时间序列土壤密度变化的成对数据比较采用成对数据t检验分析,火烧时间序列土壤密度及其变化率的空间格局相关性分析采用双变量相关分析。在Arc GIS支持下,采用反距离权重空间局部估计方法(inverse distance weighting)进行空间制图。
2. 结果与分析
2.1 火烧时间序列土壤密度变化的常规统计分析
火烧前,轻、中、重度火烧区土壤密度之间存在空间异质性。经单因素方差分析:T0时段各火烧区土壤密度表现为轻度>中度>重度,均值分别为0.672、0.652和0.636g/cm;其中轻度火烧区与中度火烧区差异显著(P < 0.05)、与重度火烧区差异极显著(P < 0.01),而中、重度火烧区之间差异不显著。
火烧后,T1、T2时段各火烧区土壤密度比较表现为重度>轻度>中度,T3时段表现为重度>中度>轻度;各时段重度火烧区土壤密度均极显著高于轻、中度火烧区(P < 0.01),轻、中度火烧区之间土壤密度差异不显著(图 2),这说明强烈地火烧导致土壤密度增加。
![]() 图 2 火烧时间序列土壤密度T0为火烧前1d,T1为火烧后1d,T2为融雪后,T3为雨季/生长季后。下同。总体即3个火烧强度区综合分析。Figure 2. Soil bulk density (SBD) in time seriesT0 means the day before fire, T1 means the first day after fire, T2 means after snowmelt season, and T3 means after rainy and growing season. The same below. The overall means all the fire intensity area.
图 2 火烧时间序列土壤密度T0为火烧前1d,T1为火烧后1d,T2为融雪后,T3为雨季/生长季后。下同。总体即3个火烧强度区综合分析。Figure 2. Soil bulk density (SBD) in time seriesT0 means the day before fire, T1 means the first day after fire, T2 means after snowmelt season, and T3 means after rainy and growing season. The same below. The overall means all the fire intensity area.火烧后,土壤密度的时间序列变化模式因火烧强度而异。经均值比较分析:(1)轻度火烧区,火烧后各时间节点土壤密度相对T0均无显著性差异,其均值表现为火烧后立即下降而后逐渐升高;(2)中度火烧区土壤密度未因火烧立即产生实质性变化而后持续升高(T2时段P < 0.05,T3时段P < 0.01);(3)重度火烧区(及3个火烧强度区综合分析)表现为火烧后土壤密度立即升高并持续增强(T1~T3时段P < 0.01)(图 2)。这说明火烧强度是导致火烧迹地土壤密度即时变化差异的直接原因;而后因气候、生物等因素,轻、中、重度火烧区土壤密度变化产生了趋同的衍生效果。
2.2 火烧时间序列土壤密度变化的成对数据比较
本研究采用网格法布设固定监测点位,建立点位间明确的对应关系,从而可计算并统计火烧后任一时间节点Tn相对于火烧前T0土壤密度的相对变化率,并进行更为精确的成对数据t检验(表 1)。
表 1 火烧后土壤密度点位变化率分级统计Table 1. Monitoring site classification statistics on post-fire soil bulk density change (SBDC)火烧强度
Fire intensity时间节点
Time node火烧后土壤密度相对于火烧前变化率的分级统计
Monitoring site classification statistics on post-fire soil bulk density change/%平均变化率及成对数据t检验
Average change rate and the result of paired t test/%-5%~0 0~5% 5%~10% 10%~15% 15%~20% 20%~25% 25%~30% 轻 T1 75.00 25.00 — — — — — -1.04** Mild T2 35.00 65.00 — — — — — -0.28ns n=20 T3 25.00 75.00 — — — — — 0.30ns 中 T1 74.07 25.93 — — — — — 0.24ns Moderate T2 3.70 88.89 3.70 3.70 — — — 2.61** n=27 T3 — 55.56 37.04 3.70 3.70 — — 5.41** 重 T1 — — 42.11 47.37 10.53 — — 10.93** Severe T2 — — 42.11 47.37 10.53 — — 11.13** n=19 T3 — — 5.26 31.58 42.11 10.53 10.53 16.87** 注:每个点位分别计算土壤密度变化率,即SBDCTn(%)=(SBDTn-SBDT0)/SBDT0×100,数据为各变化区间的点位分布频率%,即点位分布频率=(某变化区间的点位数/该火烧区点位数n)×100;点位平均变化率为Tn时段该火烧区各点位变化率的平均值;经成对数据t检验分析,**表示相对于T0时段土壤密度显著变化(P < 0.01),ns表示相对于T0时段无显著差异。Notes: SBDC of each monitoring site was calculated as follows: SBDCT n(%)=(SBDTn-SBDT0)/SBD T0×100, data was distribution frequency of monitoring site in each statistics classification, and was calculated as follows: distribution frequency (%)=(number of monitoring site in statistics classification/number of monitoring site in fire intensity area)×100; average change rate was average of SBDC at Tn time; ** means SBDC significant difference (P < 0.01) between Tn and T0, and ns means no significant difference by paired-samples t test. 轻度火烧区,T1时段75%的点位集中在土壤密度变化-5%~0负向点位范围,其余均分布在0~5%的正向点位范围,平均变化率为-1.04%,相对T0时段差异极显著(P < 0.01);T2、T3时段土壤密度变化集中在0~5%的正向点位范围,其余均分布在-5%~0的负向点位范围,平均变化率分别为-0.28%和0.30%,相对T0时段均无显著差异。
中度火烧区,T1时段点位分布统计与轻度火烧区相似,平均变化率为0.24%,相对T0时段均无显著差异;T2、T3时段点位分级产生了明显的正向移动,分别集中在0~5%与0~10%正向点位范围,平均变化率分别为2.61%和5.41%,相对T0时段差异极显著(P < 0.01)。
重度火烧区,T1、T2时段点位分布均集中在5%~15%正向点位范围,平均变化率分别为10.93%和11.13%,相对T0时段差异极显著(P < 0.01);T3时段点位分级产生了明显的正向移动,集中在10%~20%点位范围,平均变化率为16.87%,相对T0时段差异极显著(P < 0.01)。
相对于均值比较分析,成对数据t检验结果显示:T1时段轻度火烧区土壤密度较T0差异达极显著水平,而常规统计分析结果为差异不显著;T2时段中度火烧区土壤密度较T0差异达极显著水平,而常规统计分析的结果显示差异显著;其他分析结果与常规统计分析一致。这说明,相对于目前采用较多的“空间代替时间”的火烧迹地研究方法(将时间序列上某一节点作为相对独立的统计总体进行常规统计分析),本研究设计方案获得更多土壤变化信息。
同时,研究发现T2时段轻度火烧区40%点位、中度火烧区超过70%点位土壤密度变化率的分级产生了正向移动,而重度火烧区在该时段未发生变化;这说明冻融效应对火烧迹地土壤密度变化率的影响因火烧强度而异。而后,随着雨季到来,T3时段轻、中、重度火烧区土壤密度变化率分级均发生不同程度正向移动,这说明因淋溶作用对各火烧区土壤密度变化的作用结果一致。
2.3 火烧时间序列土壤密度及其变化率的空间格局
为进一步阐明土壤密度变化的时空特征,采用反距离权重法对监测点位不同时间节点土壤密度及其相对变化率进行空间插值,形成火烧时间序列上土壤密度(图 3)与其相对变化率(图 4)的空间格局图。
火烧强度空间格局影响土壤密度空间格局(图 1、3,表 2)。经双变量相关分析,火烧前土壤密度格局与火烧强度空间格局极显著负相关(P < 0.01);火烧后,时间序列上各节点土壤密度格局与火烧强度格局均极显著正相关(P < 0.01),且其相关系数(r)随时间节点递增。
表 2 土壤密度及其变化率与火烧强度相关性分析Table 2. Correlation analysis between SBD or SBDC and FI时间序列
Time series土壤密度与火烧强度相关性
Correlation analysis between SBD and FI土壤密度变化率与火烧强度相关性
Correlation analysis between SBDC and FI相关方程
Correlation equation相关系数
Correlation coefficient(r)相关方程
Correlation equation相关系数
Correlation coefficient(r)T0 SBD=-0.007FI+0.690 0.468** T1 SBD=0.005FI+0.642 0.361** SBDC=2.006FI-7.437 0.794** T2 SBD=0.005FI+0.652 0.370** SBDC=1.988FI-6.086 0.805** T3 SBD=0.011FI+0.637 0.670** SBDC=3.007FI-8.378 0.877** 注:**表示土壤密度(或土壤密度变化率)与火烧强度之间相关性显著(P < 0.01)。Note: ** means significant correlation (P < 0.01) between SBD (or SBDC) and fire intensity. 经双变量相关分析(图 1、4,表 2),火烧后,各时间节点土壤密度变化率空间格局与火烧强度空间格局均呈极显著正相关(P < 0.01),且其相关系数(r)随时间节点递增。
就相关系数而言,土壤密度变化率空间格局产生的相关系数远大于土壤密度格局,这说明相对于土壤密度,土壤密度变化率对火烧强度的响应更加敏感。
3. 结论与讨论
本研究固定样地面积相对较小且采样点位紧密相邻,因此认为3个火烧强度区温度、融雪、降雨等气候背景一致。就固定样地土壤本身性质而言,尽管火烧前各火烧区之间土壤密度存在空间异质性,且与火烧强度极显著负相关,然而火烧后各时段土壤密度与火烧强度的相关性呈现与火烧前完全相反的研究结果。因此,推测火烧强度是导致同一时间节点各火烧区土壤密度差异的直接因素。
3.1 火后即时土壤密度变化原因分析
T1时段,轻度火烧区土壤密度极显著下降(P < 0.01),中度火烧区土壤密度未发生显著变化(均值表现为微降),而重度火烧区土壤密度极显著升高(P < 0.01)。此时,轻度火烧区凋落物层未发生强烈的火干扰,地表温度升高导致部分土壤有机物碳化失水及生存环境骤变导致土壤动物逃逸使土壤孔隙度增加可能是土壤密度下降的主要原因,兴安落叶松轻度火烧迹地(火烧后9d和16d)的研究结果与本文研究结果一致[22],马尾松(Pinus massoniana)当年火烧迹地(火烧后2个月;统计结果中71.4%迹地乔木生存率超过88%,约60%迹地生物量损失不足10%,因此推测总体上研究样地火烧强度较弱)的研究结果也与本文结果相似[8];中度火烧区凋落物层火干扰加剧并产生部分植物燃烧颗粒物及灰分,但由于凋落物层没有完全烧尽且此时没有降水,因此其下土层孔隙被保护且没有受淋溶作用影响,土壤密度不显著变化可能是有机物碳化、土壤动物逃逸等下调因素与土壤颗粒组成(中度火烧后土壤砂粒、粉粒比例增加,黏粒比例下降[13, 17])上调因素综合作用的结果,兴安落叶松中度火烧迹地(火烧后9d和16d)的研究结果与本文结果一致[22];重度火烧区火干扰最为深刻,凋落物层全部烧毁,丧失了对其下层土壤的保护,并且腐殖质层有不同程度损失;这导致地上植被与凋落物燃烧产生的颗粒物及灰分直接进入采样层,降低采样部位总孔隙度,同时腐殖质层因剧烈燃烧导致采样层有机质含量下降以及有机胶结剂断裂,土壤结构被破坏[5, 9],由此产生的灰分和黏土矿物进入土壤孔隙,导致重度火烧区土壤密度极显著升高(P < 0.01)。
3.2 融雪季土壤密度变化原因分析
T2时段较T0时段,轻度火烧区土壤密度没有显著变化,中、重度火烧区土壤密度极显著升高(P < 0.01);其均值较T1时段均有不同程度升高,其中中度火烧区差异显著(P < 0.05)。关于融雪季后火烧迹地土壤密度的研究较少,就现有研究资料分析,除火烧因素外,季节性冻融作用与实际采样深度下延可能是导致这一结果的叠加原因。冻融作用效果因冻融前土壤密度而异,研究发现低密度土壤(1.01g/cm3)经冻融作用土壤密度增加,高密度土壤(1.32g/cm3)则相反[23];对黑土的研究发现季节性冻融后黑土表层土壤密度增加,而中、下层土壤则未得出此结论[24]。由此推测,由于本研究各火烧区T1时段土壤密度较低,冻融作用可能是土壤密度增加的原因之一。同时,火烧前采样时“0~10cm土层”因融雪和降水的机械作用、根分泌减少及土壤结构破坏等原因发生不同程度塌缩,实际采样深度下延,原来概念上10cm以下的“下层土壤”进入采样层[20],导致土壤密度升高。因此,此时轻度火烧区较T0时段土壤密度没有显著变化可能是T1时段下调性因素与T2时段上调性因素综合作用的结果;中度火烧区土壤密度极显著升高(P < 0.01)可能是T1时段较T0时段无显著变化与T2时段上调性因素综合作用的结果;而重度火烧区土壤密度则因T1时段与T2时段上调性因素叠加表现为极显著升高(P < 0.01)。此外,本研究还发现土壤密度变化率的季节性冻融效应因火烧强度而异,T2时段轻度火烧区40%点位、中度火烧区超过70%点位土壤密度变化率分级产生了正向移动,而重度火烧区未发生变化。这说明,轻、中度火烧区土壤密度变化率对季节性冻融效应的响应更为敏感。
3.3 雨季/生长季土壤密度变化原因分析
T3时段,轻、中、重度火烧区土壤密度的研究结果与T2时段相似;其均值较T2时段均有不同程度升高,其中,中、重度火烧区差异极显著(P < 0.01)。关于此时段火烧迹地的研究相对较多,其中金慧等[16]对长白山自然保护区轻度火烧区,孙龙等[11]对大兴安岭白桦落叶松混交林中度火烧区,胡海清等[12]对大兴安岭白桦林、落叶松林以及白桦落叶松混交林重度火烧区的研究结果与本研究一致。此时段,土壤动物活动频繁、植物根系生长迅速、根系分泌物增加,有利于表层土壤孔隙度增加,导致土壤密度下降;但这些下调因素不足以平衡此时频繁降雨导致的强烈淋溶作用、土层塌缩以及T1和T2时段土壤密度变化的积累结果。最终表现为各火烧区土壤密度进一步升高。
综上分析,火烧强度导致兴安落叶松林地土壤密度在时间序列上呈现不同的变化模式,并在雨季/生长季达到一致的变化方向,其中,中、重度火烧区土壤密度增幅显著。强烈的火干扰导致森林土壤有机质损失、结构破坏、孔隙度下降,并综合反映为火烧迹地恢复初期土壤密度升高,由此可能导致土壤保水、透水、通气、保肥能力下降以及土壤侵蚀加剧[5-9]。因此,在火烧迹地改造和生态恢复初期,应充分考虑土壤密度变化,加强土壤防蚀技术、迹地集水与保水技术调控。
-
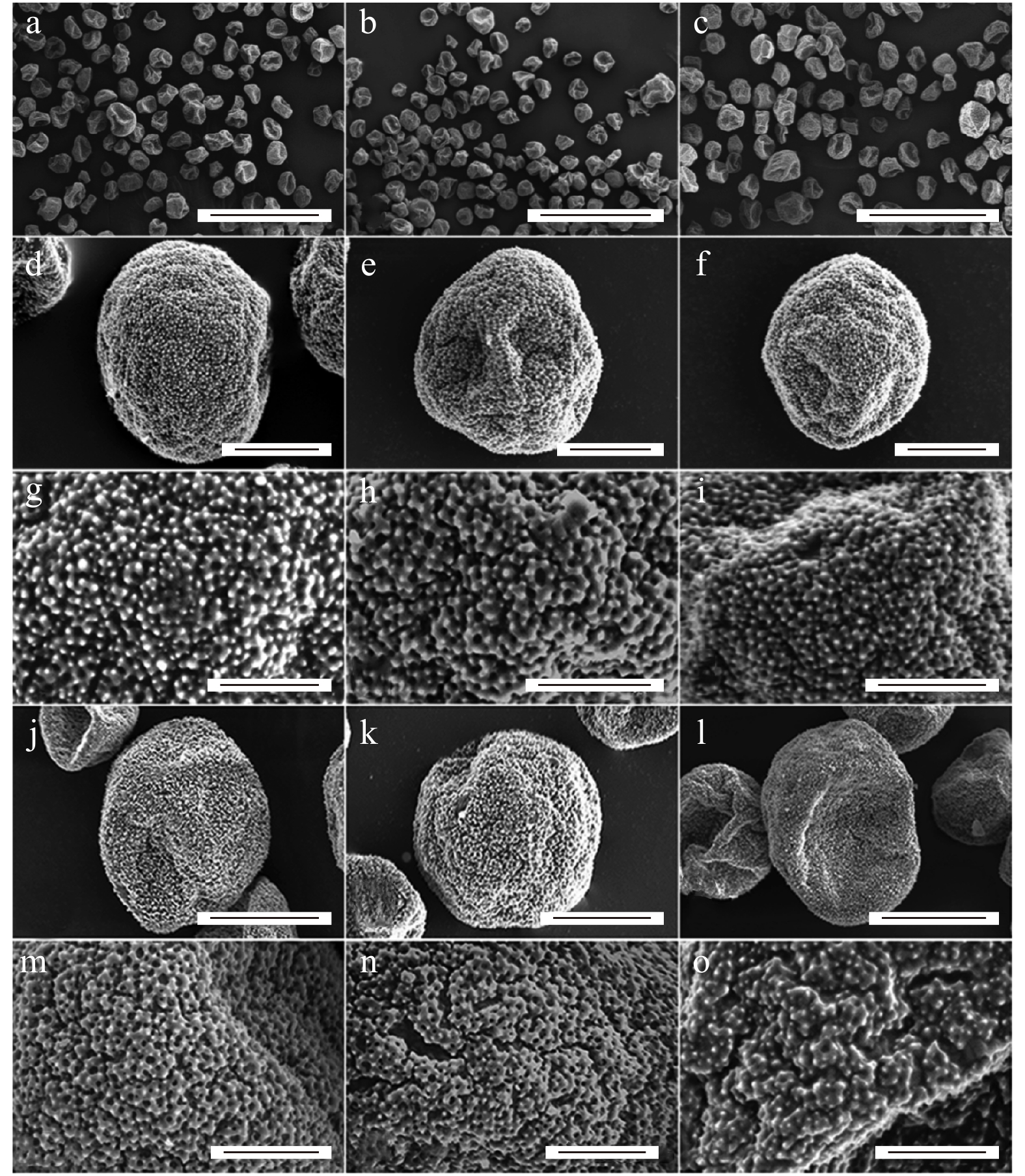
图 3 银灰杨单倍性花粉粒与2n花粉粒表面结构的电镜观察
a. 对照组花粉粒形态;b. 粗线期注射5次花粉粒形态;c. 粗线期注射11次花粉粒形态;d. 对照组单倍性花粉粒表面结构;e. 粗线期注射5次花粉粒表面结构;f. 粗线期注射11次花粉粒表面结构;g. 对照组单倍性花粉粒表面沉积;h. 粗线期注射5次花粉粒表面沉积;i. 粗线期注射11次花粉粒表面沉积;j. 天然2n花粉粒表面结构;k. 粗线期注射5次2n花粉粒表面结构;l. 粗线期注射11次2n花粉粒表面结构;m. 天然2n花粉粒表面沉积;n. 粗线期注射5次2n花粉粒表面沉积;o. 粗线期注射11次2n花粉粒表面沉积。标尺 = 100 µm(a ~ c),10 µm(d ~ f),20 µm(j ~ l),5 µm(g ~ i;m ~ o)。a, morphology of pollen grains in control group; b, morphology of pollen grains derived from the treatment with 5 injections at pachytene; c, morphology of pollen grains derived from the treatment with 11 injections at pachytene; d, ectexine structure of haploid pollen grains in control group; e, ectexine structure of haploid pollen grains derived from the treatment with 5 injections at pachytene; f, ectexine structure of haploid pollen grains derived from the treatment with 11 injections at pachytene; g, ectexine deposition of haploid pollen grains in control group; h, ectexine deposition of haploid pollen grains derived from the treatment with 5 injections at pachytene; i, ectexine deposition of haploid pollen grains derived from the treatment with 11 injections at pachytene; j, ectexine structure of natural 2n pollen grains; k, ectexine structure of 2n pollen grains derived from the treatment with 5 injections at pachytene; l, ectexine structure of natural 2n pollen grains derived from the treatment with 11 injections at pachytene; m, ectexine deposition of natural 2n pollen grains; n, ectexine deposition of 2n pollen grains derived from the treatment with 5 injections at pachytene; o, ectexine deposition of 2n pollen grains derived from the treatment with 11 injections at pachytene; scale bar = 100 µm (a−c), 10 µm (d−f), 20 µm (j−l), 5 µm (g−i; m−o).
Figure 3. Scanning electron micrographs of haploid pollen grains and 2n pollen grains in P. canescens
图 4 秋水仙碱诱导银灰杨花粉染色体加倍子代倍性分析
a. 二倍体与三倍体混样流式分析;b. 三倍体流式分析;c. 二倍体染色体数目;d. 三倍体染色体数目。a, flow cytometric analysis of the mixed sample of diploid plant and triploid plant; b, flow cytometric analysis of the triploid plant; c, chromosome number of the diploid (2n = 2x = 38); d, chromosome number of the tripliod (2n = 3x = 57).
Figure 4. Ploidy analysis of the offsprings derived from pollen chromosome doubling induced by colchicine
表 1 不同处理组合银灰杨2n花粉诱导率的方差分析
Table 1 Variance analysis on induction rates of colchicine-induced 2n pollen in P. canescens under different treatments
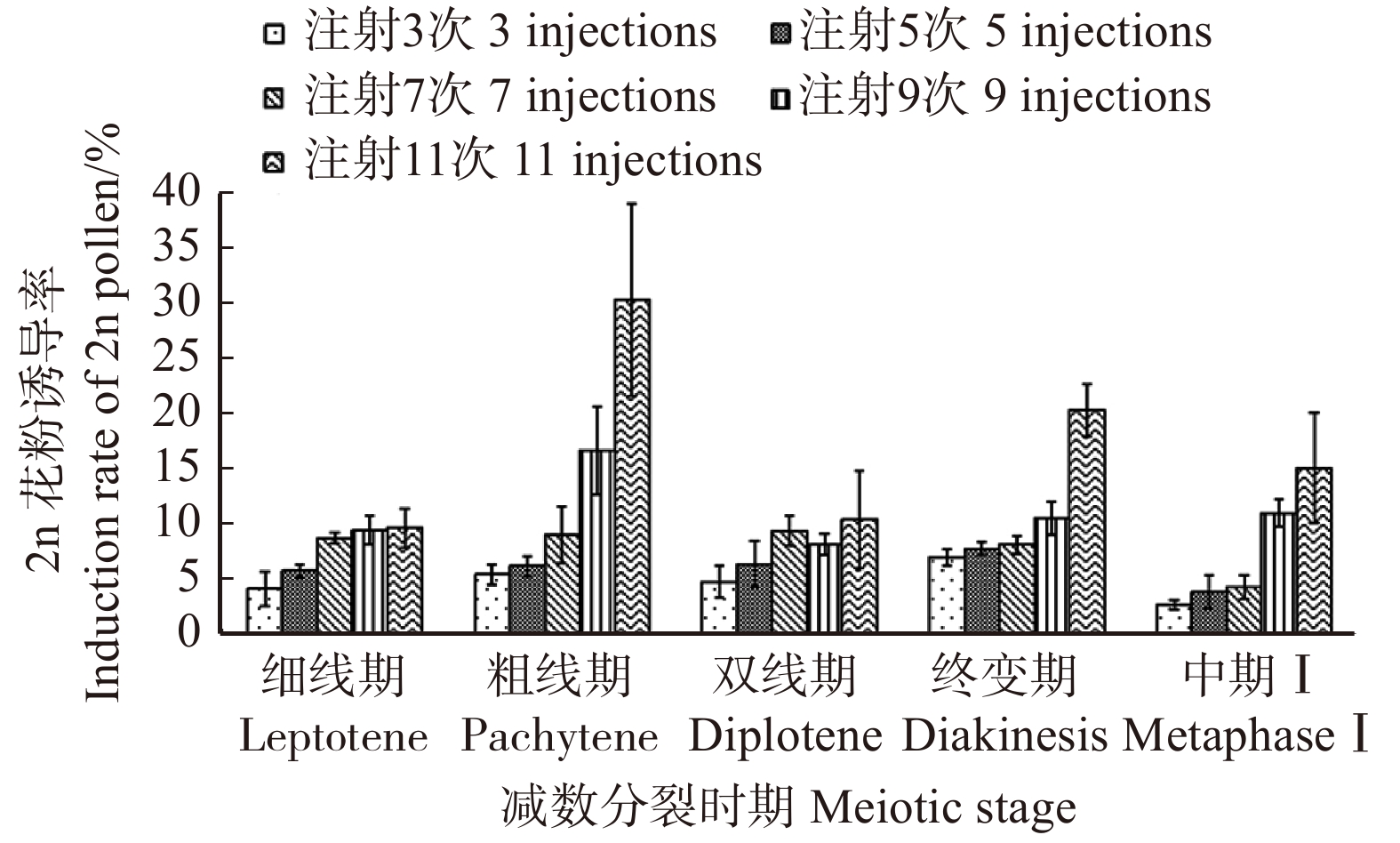
变异来源 Source of variation df MS F P 减数分裂时期 Meiotic stage 4 251.696 4.801** 0.009 注射次数 Injection time 4 652.650 12.449** 0.000 减数分裂时期 × 注射次数 Meiotic stage × injection time 16 52.427 3.006** 0.002 误差 Error 50 17.444 注:** 代表差异极显著(P < 0.01)。Note: ** represents highly significant differences (P < 0.01). 表 2 不同减数分裂时期和不同注射次数银灰杨2n花粉诱导率的多重比较
Table 2 Multiple comparisons in induction rates of 2n pollen under different meiotic stages and different injection times in P. canescens
减数分裂时期
Meiotic stage平均2n花粉诱导率
Average induction rate of 2n pollen/%注射次数
Injection time平均2n花粉诱导率
Average induction rate of 2n pollen/%细线期 Leptotene 7.57 ± 2.51b 3 4.83 ± 1.72d 粗线期 Pachytene 13.54 ± 10.30a 5 6.03 ± 1.70cd 双线期 Diplotene 7.84 ± 2.921b 7 7.94 ± 2.28bc 终变期 Diakinesis 10.77 ± 5.23ab 9 11.18 ± 3.51b 中期Ⅰ MetaphaseⅠ 7.42 ± 5.39b 11 17.17 ± 8.94a 注:不同小写字母代表差异显著(P < 0.05)。Note: different lowercase letters represent significant differences (P < 0.05). 表 3 银灰杨秋水仙碱诱导型2n花粉与河北杨、银腺杨雌配子杂交创制三倍体
Table 3 Crossing colchicine-induced 2n pollen in P. canescens with female gametes in P. hopeiensis and P. alba × P. glandulosa to produce triploids
序号
No.母本
Female parent2n花粉比率
Frequency of 2n pollen/%种子数
Number of seeds成苗数
Number of seedlings三倍体数
Number of triploids三倍体得率
Triploid production rate/%1 河北杨
P. hopeiensis30.27 38 6 1 16.67 2 20.36 33 9 1 11.11 3 16.70 64 21 0 0 4 15.11 31 16 0 0 5 11.03 52 20 0 0 6 10.53 27 4 0 0 7 银腺杨
P. alba × P. glandulosa9.05 912 610 2 0.33 8 8.76 1 027 864 1 0.12 9 6.22 704 563 0 0 10 5.79 975 623 0 0 11 5.46 1 217 964 0 0 12 4.34 694 552 0 0 对照 Control 2.08 967 703 0 0 总计 Total 6 741 4 955 5 -
[1] 徐秀琴. 银灰杨育种[J]. 中国林业, 2008(7A):57. Xu X Q. Breeding of Populus canescens[J]. Forestry of China, 2008(7A): 57.
[2] 郑书星, 张建国, 段爱国, 等. 新疆阿尔泰地区白杨派3个树种半同胞家系子代遗传多样性分析[J]. 林业科学研究, 2013, 26(3):366−372. doi: 10.3969/j.issn.1001-1498.2013.03.016 Zheng S X, Zhang J G, Duan A G, et al. The genetic diversity of half-sib family progenies of Populus (Section Leuce) in Altai of Xinjiang[J]. Forest Research, 2013, 26(3): 366−372. doi: 10.3969/j.issn.1001-1498.2013.03.016
[3] 李天权, 朱之悌. 白杨派内杂交难易程度及杂交方式的研究[J]. 北京林业大学学报, 1989, 11(3):54−59. Li T Q, Zhu Z T. Study on difficulty of hybridization and patterns of crossing within Leuce[J]. Journal of Beijing Forestry University, 1989, 11(3): 54−59.
[4] 田菊, 牛新月, 铁英, 等. 毛新杨×银灰杨杂种花粉母细胞减数分裂及花粉形态[J]. 东北林业大学学报, 2018, 46(7):33−37, 43. doi: 10.3969/j.issn.1000-5382.2018.07.007 Tian J, Niu X Y, Tie Y, et al. Meiosis of microsporocyte and morphology of pollen in hybrid of (Populus tomentosa × P. bolleana) × P. canescens[J]. Journal of Northeast Forestry University, 2018, 46(7): 33−37, 43. doi: 10.3969/j.issn.1000-5382.2018.07.007
[5] 田梦迪, 李燕杰, 张平冬, 等. 高温诱导银灰杨花粉染色体加倍创制杂种三倍体[J]. 林业科学, 2018, 54(3):39−47. Tian M D, Li Y J, Zhang P D, et al. Pollen chromosome doubling induced by high temperature exposure to produce hybrid triploids in Populus canescens[J]. Scientia Silvae Sinicae, 2018, 54(3): 39−47.
[6] 李燕杰. 高温诱导银灰杨产生2n花粉的细胞及分子机制[D]. 北京: 北京林业大学, 2017. Li Y J. Cytological and molecular mechanism of 2n pollen production induced by high temperature in Populus canescens[D]. Beijing: Beijing Forestry University, 2017.
[7] 董春波. 杨树同源重组特点及2n配子杂合性分析[D]. 北京: 北京林业大学, 2015. Dong C B. Analysis of homologous recombination characteristics and 2n gamate heterozygosity in Populus[D]. Beijing: Beijing Forestry University, 2015.
[8] Xi X, Li D, Xu W, et al. 2n egg formation in Populus × euramericana (Dode) Guinier[J]. Tree Genetics & Genomes, 2012, 8(6): 1237−1245.
[9] 李云, 朱之悌, 田砚亭, 等. 秋水仙碱处理白杨雌花芽培育三倍体植株的研究[J]. 林业科学, 2001, 37(5):68−74. doi: 10.3321/j.issn:1001-7488.2001.05.012 Li Y, Zhu Z T, Tian Y T, et al. Studies on obtaining triploids by colchicine treating female flower buds of white poplar[J]. Scientia Silvae Sinicae, 2001, 37(5): 68−74. doi: 10.3321/j.issn:1001-7488.2001.05.012
[10] 李艳华. 白杨雌配子染色体加倍技术研究[D]. 北京: 北京林业大学, 2007. Li Y H. Chromosome doubling of female gamates in white poplars[D]. Beijing: Beijing Forestry University, 2007.
[11] 康向阳, 张平冬, 高鹏, 等. 秋水仙碱诱导白杨三倍体新途径的发现[J]. 北京林业大学学报, 2004, 26(1):1−4. doi: 10.3321/j.issn:1000-1522.2004.01.001 Kang X Y, Zhang P D, Gao P, et al. Discovery of a new way of poplar triploids induced with colchicine after pollination[J]. Journal of Beijing Forestry University, 2004, 26(1): 1−4. doi: 10.3321/j.issn:1000-1522.2004.01.001
[12] Li D L, Kang X Y, Chen H W, et al. Induction of diploid eggs with colchicine during embryo sac development in Populus[J]. Silvae Genetica, 2010, 59(1−6): 40−48. doi: 10.1515/sg-2010-0005
[13] 王君, 康向阳, 石乐, 等. 理化处理诱导合子染色体加倍选育青杨派杂种四倍体[J]. 北京林业大学学报, 2010, 32(5):63−66. Wang J, Kang X Y, Shi L, et al. Tetraploid induction of Populus hybrid in section Tacamahaca through zygotic chromosome doubling with physical and chemical treatments[J]. Journal of Beijing Forestry University, 2010, 32(5): 63−66.
[14] Cai X, Kang X Y. In vitro tetraploid induction from leaf explants of Populus pseudo-simonii Kitag[J]. Plant Cell Reports, 2011, 30(9): 1771−1778. doi: 10.1007/s00299-011-1085-z
[15] Xu C P, Huang Z, Liao T, et al. In vitro tetraploid plants regeneration from leaf explants of multiple genotypes in Populus[J]. Plant Cell Tissue and Organ Culture, 2016, 125(1): 1−9. doi: 10.1007/s11240-015-0922-0
[16] Ewald D, Ulrich K, Naujoks G, et al. Induction of tetraploid poplar and black locust plants using colchicine: chloroplast number as an early marker for selecting polyploids in vitro[J]. Plant Cell Tissue and Organ Culture, 2009, 99(3): 353−357. doi: 10.1007/s11240-009-9601-3
[17] 张焕玲, 李俊红, 李周歧. 秋水仙素处理杜仲种子诱导多倍体的研究[J]. 西北林学院学报, 2008, 23(1):78−81. Zhang H L, Li J H, Li Z Q. Studies on polyploid induction in vitro of Eucommia ulmoides Oliv.[J]. Journal of Northwest Forestry University, 2008, 23(1): 78−81.
[18] Yang J, Wang J, Liu Z, et al. Megaspore chromosome doubling in Eucalyptus urophylla S.T. Blake induced by colchicine treatment to produce triploids[J/OL]. Forests, 2018, 9(11): 728 [2019−12−30]. https://doi.org/10.3390/f9110728.
[19] Zhao C G, Tian M D, Li Y, et al. Slow-growing pollen-tube of colchicine-induced 2n pollen responsible for low triploid production rate in Populus[J/OL]. Euphytica, 2017, 213(4): 94 [2019−12−30]. https://doi.org/10.1007/s10681-017-1881-9.
[20] Tian M D, Zhang Y, Liu Y, et al. High temperature exposure did not affect induced 2n pollen viability in Populus[J]. Plant Cell & Environment, 2018, 41(6): 1383−1393.
[21] 高鹏. 杜仲配子与合子染色体加倍技术研究[D]. 北京: 北京林业大学, 2006. Gao P. Gamete and zygote chromosome doubling of Eucommia ulmoides Oliv[D]. Beijing: Beijing Forestry University, 2006.
[22] Yang J, Yao P Q, Li Y, et al. Induction of 2n pollen with colchicine during microsporogenesis in Eucalyptus[J]. Euphytica, 2016, 210(1): 69−78. doi: 10.1007/s10681-016-1699-x
[23] Orjeda G, Freyre R, Iwanaga M. Production of 2n pollen in diploid Ipomoea trifida, a putative wild ancestor of sweet potato[J]. Journal of Heredity, 1990, 81(6): 462−467. doi: 10.1093/oxfordjournals.jhered.a111026
[24] Galbraith D W, Harkins K R, Maddox J M, et al. Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J]. Science, 1983, 220: 1049−1051. doi: 10.1126/science.220.4601.1049
[25] 谭德冠, 庄南生, 黄华孙. 林木多倍体诱导的研究进展[J]. 华南热带农业大学学报, 2005, 11(1):27−30. Tan D G, Zhuang N S, Huang H S. Research advances in tree polyploid induction[J]. Journal of South China University of Tropical Agriculture, 2005, 11(1): 27−30.
[26] 康向阳. 关于杨树多倍体育种的几点认识[J]. 北京林业大学学报, 2016, 32(5):149−153. Kang X Y. Some understandings on polypliod breeding of poplars[J]. Journal of Beijing Forestry University, 2016, 32(5): 149−153.
[27] 康向阳, 朱之悌, 林慧斌. 杨树花粉染色体加倍有效处理时期的的研究[J]. 林业科学, 1999, 35(4):21−24. doi: 10.3321/j.issn:1001-7488.1999.04.004 Kang X Y, Zhu Z T, Lin H B. Study on the effective treating period for pollen chromosome doubling of Populus tomentosa × P. bolleana[J]. Scientia Silvae Sinicae, 1999, 35(4): 21−24. doi: 10.3321/j.issn:1001-7488.1999.04.004
[28] 李开隆, 肖静, 刘桂丰, 等. 秋水仙素处理诱导大青杨2n花粉方法的优化[J]. 核农学报, 2006, 20(4):282−286. doi: 10.3969/j.issn.1000-8551.2006.04.007 Li K L, Xiao J, Liu G F, et al. Optimization of inducing 2n pollen grain of Populus ussuriensis by colchicines[J]. Journal of Nuclear Agriculture Sciences, 2006, 20(4): 282−286. doi: 10.3969/j.issn.1000-8551.2006.04.007
[29] 李赟, 郭倩, 王君, 等. 秋水仙碱诱导银白杨花粉染色体加倍及其细胞学效应研究[J]. 核农学报, 2014, 28(5):749−756. doi: 10.11869/j.issn.100-8551.2014.05.0749 Li Y, Guo Q, Wang J, et al. Colchicine-induced pollen chromosome doubling and its cytological effects in Populus alba L.[J]. Journal of Nuclear Agriculture Sciences, 2014, 28(5): 749−756. doi: 10.11869/j.issn.100-8551.2014.05.0749
[30] 赵鑫闻, 彭儒胜, 纪纯阳, 等. 秋水仙碱诱导美洲黑杨花粉染色体加倍的研究[J]. 西部林业科学, 2019, 48(1):135−138. Zhao X W, Peng R S, Ji C Y, et al. Inducing pollen chromosome doubling of Populus deltoid by colchicines[J]. Journal of Wast China Forestry Science, 2019, 48(1): 135−138.
[31] Pécrix Y, Géraldine R, Hélène F, et al. Polyploidization mechanisms: temperature environment can induce diploid gamete formation in Rosa sp.[J]. Journal of Experimental Botany, 2011, 62(10): 3587−3597. doi: 10.1093/jxb/err052
-
期刊类型引用(7)
1. 左壮,张韫,崔晓阳. 火烧对兴安落叶松林土壤氮形态和含量的初期影响. 南京林业大学学报(自然科学版). 2024(01): 147-154 .  百度学术
百度学术
2. 卢明,曹建林,缪春霞. 湿垃圾沼渣对草本植物土壤物理性质的影响. 浙江农业科学. 2022(03): 538-542 .  百度学术
百度学术
3. 张韫,于悦,崔晓阳,王海淇. 试验林火干扰下大兴安岭北部落叶松林土壤含水率的时空变化. 北京林业大学学报. 2020(08): 94-101 .  本站查看
本站查看
4. 周司涵,张韫,崔晓阳. 兴安落叶松林火烧迹地土壤速效钾时空动态分析. 南京林业大学学报(自然科学版). 2020(05): 141-147 .  百度学术
百度学术
5. 张韫,于悦,崔晓阳. 试验林火干扰下兴安落叶松林土壤有效磷的时空变化. 北京林业大学学报. 2019(02): 12-18 .  本站查看
本站查看
6. 薛伟,沙聪,张华超,郭德禹. 长白落叶松人工林采伐迹地土壤火灾温度场试验研究. 应用生态学报. 2019(03): 785-792 .  百度学术
百度学术
7. 顾国海,吕凤春,曾宪楠,李梦莎,张荣涛. 林下和林缘兴安胡枝子叶片PSⅡ行为对光强的快速响应. 北方园艺. 2018(23): 71-79 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: