Antioxidant activity on the pigments from acorn shell
-
摘要: 本研究以常见的抗氧化剂Vc为对照,对橡子壳色素主要成分和体内外抗氧化活性进行了研究分析。结果表明,橡子壳色素中含丰富的多酚类和黄酮类物质,其中总多酚含量达到27.8%,总黄酮含量8.6%。体外抗氧化实验结果表明,橡子壳色素对DPPH·的清除能力和对Fe3+的还原能力均与其质量浓度呈正相关,其中对DPPH·清除率的半数有效剂量(IC50=10 μg/mL)大于Vc组(IC50=5 μg/mL),当橡子壳色素质量浓度在40 μg/mL时达到了Vc的清除能力;当橡子壳色素质量浓度为1 mg/mL时,橡子壳色素还原能力(A710 nm为0.98)接近Vc的还原能力(A710 nm为1.17)。体内抗氧化实验采用对除空白组外的各组实施60Coγ照射进行氧化损伤实验,分析各组的抗氧化能力。结果表明,模型组小鼠体质量和各器官质量与空白组相比显著下降(P<0.05),并且辐照的各组小鼠都出现了食欲不振、精神萎靡等不良现象,表明氧化应激模型建立成功;橡子壳色素组的小鼠器官质量显著高于模型组(P<0.05),低于空白组但无显著差异(P>0.05),该结果表明橡子壳色素对经60Coγ射线照射的小鼠器官有一定的修复作用。实验小鼠血清中的抗氧化性相关酶以及氧化产物的测定结果进一步表明,橡子壳色素低、中、高剂量组均能显著提高小鼠血清中SOD和CAT的活性,并且显著降低MAD含量(P<0.05),其中100 mg/(kg·d)剂量组橡子壳色素的作用效果最好,与同质量浓度Vc作用效果相当。橡子壳色素具有较好的体内和体外抗氧化活性,并且体内100 mg/(kg·d)剂量的橡子壳色素与同剂量下Vc的抗氧化效果相当,作为天然抗氧剂具有较好的应用前景。Abstract: Using the common antioxidant Vc as control group, main ingredients and the antioxidant activity in vivo and in vitro of acorn shell pigment were researched in order to provide a theoretical basis for the development and utilization on antioxidant function of acorn shells. The results showed that the acorn shell pigment contained an abundance of polyphenols and flavones, the total content of polyphenols was 27.8%, and he total content of flavones was 8.6%. The antioxidant experiment in vitro showed that the DPPH free radical scavenging ability and the Fe3+ reduction ability of acorn shell pigment performed a positive correlation with the increase of its concentration, in which, the half effective dose (IC50=10 μg/mL) was higher than Vc group (IC50=5 μg/mL), and it could reach the scavenging ability of Vc once the concentration of acorn shell pigment was around 40 μg/mL; when the concentration of acorn shell pigment was 1 mg/mL, the reduction ability of it (A710 nm was 0.98) was nearly to Vc(A710 nm was 1.17). In vivo antioxidant experiment, it used 60Coγ irradiating the mice to establish an oxidative stress mice model except the blank group to analyze the antioxidant capacity of each group. The results showed that, to compare with the blank group, the body weight and the quality of organs of mice of model group had significantly decreased (P < 0.05), and it showed a bad phenomenon as loss of appetite, listlessness and so on, which indicated the oxidative stress model was succeed. The organ quality of acorn shell pigment group was significantly higher than the group of mice model (P < 0.05), but had no significantly different with the below blank group (P>0.05). It indicated that the acorn shell pigment had certain repair function to the mice organs irradiated by60COγ. The results of the determination of the antioxidant enzymes and the oxidation products in the serum of the test mice further showed that, the low, medium and high dose groups of acorn shell pigment could all improve the activity of SOD and CAT in mice serum and reduce the content of MAD significantly (P < 0.05). Meanwhile, the 100 mg/(kg·day) dosage acorn shell pigment had the best effect on antioxidant activity in vitro which was similar to the group of Vc. In summary, the acorn shell pigment had antioxidant activity in vitro and in vivo, the 100 mg/(kg·day) group of acorn shell pigment could be equaled with the same dose of Vc on antioxidant effect, which had a good application prospect as an natural antioxidant.
-
随着人们对食品安全关注度的提升,天然产品越来越受到人们的重视,从天然原料中寻找和开发活性成分逐渐成为学者的研究热点,其中天然色素因其安全性高、着色自然,常具有医药保健功能而受到人们更多的关注[1]。橡子是壳斗科(Fagaceae)植物果实的通称,我国是世界橡子的主要产地之一,拥有丰富的橡树资源,橡子的果实营养价值丰富,可加工成许多产品,然而橡子壳作为橡子加工副产物除了少部分用作活性炭加工外,大部分作为废弃物被直接抛弃或者焚烧,这不仅对环境造成了一定的污染,还是一种资源的浪费。研究表明,从橡子壳中提取的橡子壳色素是一种天然坚果果壳色素,是类似咖啡色的粉末状固体[2],可以用来代替焦糖色素,是一种优良的天然食用色素[3-4]。此外,橡子壳色素含有大量黄酮和多酚类物质,具有较好的抗肿瘤、抗突变、抑菌等作用[5],但是目前关于橡子壳色素的抗氧化活性的研究报道很少。抗氧化活性研究主要包括体外抗氧化活性和体内抗氧化活性研究[6]。本文以常见抗氧化剂Vc为对照,以还原力和1、1-二苯基苦基苯肼自由基清除率为考察指标,研究了橡子壳色素体外抗氧化作用;同时采用60Coγ射线辐照小鼠建立氧化损伤模型,测定小鼠血清中CAT活力、SOD活力、MDA的含量对橡子壳色素的体内抗氧化活性进行探究。通过对橡子壳色素体外和体内抗氧化活性的研究,可以为橡子壳色素作为天然抗氧剂在食品方面的应用提供理论依据。
1. 材料与方法
1.1 材料
选用产自小兴安岭9月成熟后的橡子,该橡子为辽东栎(Quercus wutaishanica)种子;昆明种小鼠,体重(18±2.0) g,黑龙江中医药大学,许可证号:SCXK(黑)2013-004。
1.2 试剂
1、1-二苯基苦基苯肼DPPH(0.04 mg/mL),西安沃尔森生物技术有限公司,无水乙醇均为分析纯;磷酸缓冲液(磷酸氢二钠+磷酸二氢钠+氯化钠配置成缓冲溶液),铁氰化钾(0.30 mol/mL),三氯乙酸(6.12 mol/mL),三氯化铁(0.062 mol/mL)均为分析纯;超氧化物歧化酶(SOD)测定试剂盒,过氧化氢酶(CAT)测定试剂盒,丙二醛(MDA)测定试剂盒南京建成生物工程研究所。其他试剂均为分析纯。
1.3 仪器与设备
FD-1A-80冷冻干燥机,上海比朗仪器有限公司;A1604电子天平,上海天平仪器厂;DK-8D电热恒温水槽,巩义市予华仪器有限责任公司;DHG-9030A电热恒温鼓风干燥箱,巩义市予华仪器有限责任公司;JH-722s可见分光光度计,上海精密科学仪器有限公司;RE-501旋转蒸发仪,郑州巩义;LXJ-ⅡB型离心机,上海安亭科学仪器厂。
1.4 方法
1.4.1 橡子壳色素的提取
橡子壳色素的提取是在张志建等[7]的提取方法基础上做一定的修改。具体提取方法如下:称取100 g橡子壳粉,按1:50(g/mL)的料液比,加入溶度为40%的乙醇提取溶剂,在60 ℃条件下提取5 h。浸提结束后自然冷却至室温,离心分离(3 000 r/min,5 min),得到1次色素提取液,残渣进行2次浸提,将2次色素提取液与1次色素提取液合并。将合并的色素提取液在50 ℃条件下真空旋转浓缩,浓缩至溶液呈粘稠状,浓缩液用真空冷冻法干燥,得到棕色粉末状橡子壳色素,备用。
1.4.2 橡子壳色素主要成分测定
1) 橡子壳色素多酚类物质含量的测定。根据GB/T8313—2008的方法,采用Folin-酚法,以没食子酸为标准品绘制标准曲线测定橡子壳色素中多酚成分的含量,以每克橡子壳色素中没食子酸当量计算多酚含量,并按下面公式计算橡子壳色素中多酚的含量。
橡子壳色素中多酚含量=C/M×100%,式中:C为橡子壳色素中多酚类物质的质量,mg;M为橡子壳色素质量,mg。
2) 橡子壳色素中黄酮类物质含量的测定。根据DB13T 385—1998的方法,采用硝酸铝方法,以芦丁为标准品绘制标准曲线,测定橡子壳色素中黄酮类物质含量,以每克样品中芦丁当量计,并按下面公式计算橡子壳色素中黄酮的含量。
橡子壳色素中黄酮含量=C/M×100%,式中:C为橡子壳色素中黄酮类物质的质量,mg;M为橡子壳色素质量,mg。
1.4.3 橡子壳色素体外抗氧化活性测定
1) 橡子壳色素对DPPH·的清除率测定。 本实验采用DPPH·比色法[8]测定橡子壳色素对DPPH·的清除能力。测定方法为:分别配置橡子壳色素与维生素C的浓度为:2、4、6、8、10、20、30、40、50 μg/mL水溶待测液,在测定管A1中加入2 mL待测液和2 mL DPPH·溶液,在对照管A2中加入2 mL待测液和2 mL的无水乙醇,在空白管A3中加入2 mL DPPH·溶液和2 mL的无水乙醇作空白。摇匀后,在室温下避光静置30 min,于517 nm处测定吸光值,分别记为A1、A2、A3,测定时用无水乙醇调零。按下列公式计算待测样品对DPPH·的清除能力。以Vc作为标准对照。做3次重复取平均值。
DPPH·清除率=[1-(A1-A2)/A3]× 100%。式中:A1为待测液和DPPH·试剂的吸光值;A2为待测液和空白溶剂的吸光值;A3为DPPH·试剂与空白溶剂混合液的吸光值。
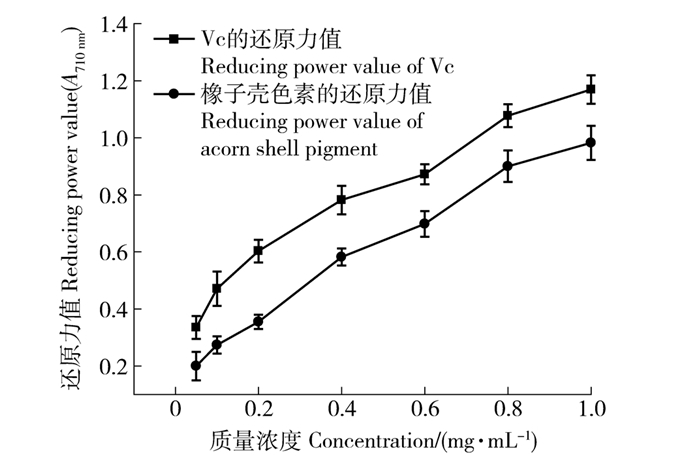
2) 橡子壳色素还原力的测定。 本实验采用普鲁士蓝生成法[9]测定橡子壳色素的还原力,测定方法为:分别配置橡子壳色素及维生素C质量浓度0.05、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的水溶样液。在试管中加入1 mL样液、1 mL磷酸缓冲液、1 mL铁氰化钾,摇匀,50 ℃水浴20 min。流水冷却。加1 mL三氯乙酸,吸取1 mL后加入6 mL蒸馏水和0.2 mL三氯化铁,反应10 min,在700 nm处检验溶液的吸光度,记录A值,重复3次取平均值。
1.4.4 橡子壳色素体内抗氧化活性测定
1) 实验动物的分组与模型建立。 昆明种小鼠48只,雌雄各半,随机分为6组,每组8只。分为空白组、模型组、橡子壳色素高(200 mg/(kg·d))、中(100 mg/(kg·d))、低(50 mg/(kg·d))剂量组、维生素C(100 mg/(kg·d))。灌胃4周后,除空白组外其余组均给予6.0 Gy的60Coγ射线一次性全身均匀照射12 min,正常饲养7 d后,对小鼠进行单独眼球取血、离心、获得血清以备指标测定,颈椎处死后取出小鼠的主要脏器器官(心脏、肝脏、脾脏、肾脏)进行称质量,并计算小鼠的脏器指数[10]。
计算公式为:脏器系数=器官质量小鼠体重×100% 2) 指标测定。 SOD活力测定:羟胺法;CAT活力测定:钼酸铵比色法。MDA含量测定:硫代巴比妥酸(TBA)法,以上各指标均按试剂盒说明对样品进行处理和测定。
1.5 统计方法
实验数据以X±SD表示,采用SPSS19.0软件进行一维方差分析(ANOVA)统计分析法分析,显著性检验采用LSD检验法,P<0.05表示差异显著,用Origin 8.5做图。
2. 结果与分析
2.1 橡子壳色素中主要活性成分测定
本实验所选橡子壳为小兴安岭9月成熟后的橡实外壳,该橡实属于辽东栎种。经过对橡子壳色素主要成分测定发现其中含丰富多酚类和黄酮类物质,总多酚含量达到27.8%,总黄酮含量达到8.6%,可见该品种橡子壳色素应该具有较好的抗氧化功能。
2.2 橡子壳色素体外抗氧化能力
2.2.1 橡子壳色素对DPPH·的清除率
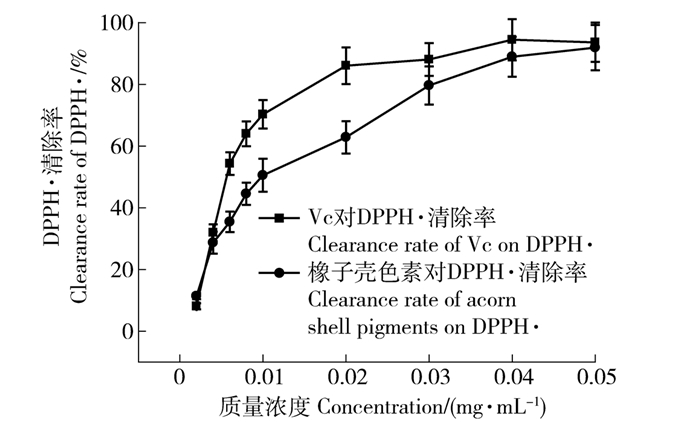
Vc有很强的抗氧化能力,通常用Vc作对照组,来比较待测物的抗氧化能力。本实验测定了样液对DPPH·清除率,DPPH·是一种比较稳定的脂性自由基,在517 nm处呈紫色,其N上有一个游离电子可与抗氧化剂中的一个电子配对,使紫色褪去。紫色褪去程度越大,表明对游离电子清除作用越强,即抗氧化能力越强[11]。由图 1可知,橡子壳色素及Vc溶液对DPPH·的清除率呈量效关系,橡子壳色素在质量浓度小于5 μg/mL时对DPPH·的清除率迅速增加,且低质量浓度下清除率接近于Vc。随着橡子壳色素浓度的增加清除率上升缓慢,其中橡子壳色素对DPPH·清除率达到50%时的质量浓度IC50=10 μg/mL,Vc对DPPH·清除率的IC50=5 μg/mL,橡子壳色素质量浓度在40 μg/mL左右时其清除率达到90%,几乎达到了Vc的清除能力,且要好于板栗壳色素抗氧化能力[12];由此可知橡子壳色素对DPPH·具有较强的清除能力。由于橡子树受地域气候影响而有很多品种,导致橡子壳中成分及含量亦不相同,因此不同来源橡子壳色素抗氧化活性可能存在显著差异[13]。
2.2.2 橡子壳色素还原Fe3+能力
以Vc为阳性对照,采用铁氰化钾法对橡子壳色素的还原力进行测定[14]。由图 2可知,橡子壳色素及Vc的吸光度随浓度升高呈直线上升趋势,即橡子壳色素对Fe3+的还原力随浓度升高而增大,其中色素的还原力稍弱于Vc,当样品质量浓度为1 mg/mL时,橡子壳色素还原能力(A710 nm为0.98)接近Vc的还原能力(A710 nm为1.17),这与栓皮栎橡子壳色素具有较强还原能力的结果基本一致[13]。
2.3 橡子壳色素体内抗氧化活性
2.3.1 橡子壳色素对小鼠主要内脏质量的影响
实验灌胃期间,每天观察小鼠皮毛光滑度,行动灵活性,进食及大便是否正常,并每周对小鼠称体重1次,结果见表 1。通过观察发现各组小鼠皮毛光滑润泽,行动灵活,进食及大便正常。由表 1可知,各组小鼠之间体重变化无明显差异,前21 d都呈现生长迅速的状态,第28天与第21天相比无显著差异(P>0.05),体重增长很少,已经达到稳定状态。小鼠的体重增长变化符合其生长规律,说明橡子壳色素对小鼠没有产生急性和亚急性毒性作用。而辐照7 d后与辐照前相比,模型组小鼠体重显著下降(P<0.05),较辐照前体重降低了16.75%,其他各组小鼠体重均下降不显著(P>0.05),其中未经辐照的空白组小鼠体重保持最大(P<0.05),这一现象说明辐照对小鼠生长产生了影响,而灌喂橡子壳色素和Vc对小鼠辐射损伤起到了一定的抑制和修复作用。
表 1 实验期间各组小鼠体重变化Table 1. Mass changes of mice during the experiment组别
Group剂量Dose/
(mg·kg-1·d-1)第1天
1st day/g第7天
7th day/g第14天
14th day/g第21天
21st day/g第28天
28th day/g辐照后7 d
7th day after irradiation/g模型组Model group 18.70±0.39aA 22.72±0.75aB 24.93±1.03aC 28.19±1.39aD 30.85±1.78aD 25.68±1.73aC 空白组Blank group 18.44±0.51aA 23.04±0.94aB 25.02±1.33aC 28.97±1.4aD 30.97±1.27aD 30.22±2.80cD Vc组Vc group 100 18.28±0.55aA 22.50±1.14aB 25.42±1.54aC 28.70±1.27aD 30.73±1.87aD 28.04±1.63bD 橡子壳色素组
Acorn shell pigment group50 18.63±0.78aA 22.59±0.53aB 25.77±1.25aC 28.69±1.08aD 30.24±1.65aD 28.23±1.34bD 100 18.98±0.99aA 22.91±0.86aB 24.28±1.77aC 28.31±2.00aD 29.88±1.90aD 27.93±1.71bD 200 18.88±0.48aA 22.91±0.69aB 24.66±1.58aC 28.05±1.52aD 29.01±2.11aD 28.45±1.98bD 注:不同小写字母表示每一组各列之间差异显著(P<0.05);不同大写字母表示各组每一行之间差异显著(P<0.05)。下同。Notes: different small letters within a column mean significant difference at P<0.05 level; different capital letters within a row mean significant difference at P<0.05 level. The same below. 辐照7 d后,与空白组相比,其他各组小鼠均出现精神萎靡、食量减少、大便颜色发黄且较臭现象。 解剖时对各组小鼠的心脏、肝脏和肾组织在色泽、形状等方面与空白组进行观察比较发现无明显差异。从表 2中各组小鼠的心脏指数、肝脏指数、脾脏指数和肾指数统计分析可以看出,与空白组相比,模型组小鼠的各项脏器指数均显著下降(P<0.05),而Vc组和橡子壳色素组小鼠的各项脏器指数下降不显著(P<0.05);说明辐照对小鼠内脏有一定的影响,损害了小鼠各脏器的功能,同时也说明橡子壳色素与和Vc对小鼠脏器有保护功能,即对小鼠的主要器官有一定的修复作用。
表 2 各实验组的小鼠脏器系数Table 2. Mouse organ coefficient of each experiment group组别
Group剂量Dose/
(mg·kg-1·d-1)心脏指数
Heart index/%肝脏指数
Hepatic index/%脾脏系数
Spleen index/%肾指数
Kidney index/%模型组Model group 0.48±0.008 8a 4.06±0.10a 0.20±0.007 5a 1.45±0.098a 空白组Blank group 0.67±0.005 9b 5.60±0.066b 0.25±0.009 4b 1.76±0.087b Vc组Vc group 100 0.62±0.007 9b 5.44±0.095b 0.24±0.008 6b 1.69±0.097b 橡子壳色素组
Acorn shell pigment group50 0.60±0.0090b 5.04±0.083b 0.25±0.0087b 1.74±0.078b 100 0.63±0.0054b 4.98±0.077b 0.24±0.0082b 1.73±0.092b 200 0.64±0.0074b 5.27±0.063b 0.24±0.0076b 1.74±0.088b 注:不同小写字母表示每一组各列之间有显著差异(P<0.05)。Note: different small letters within a column mean significant difference at P<0.05 level. 2.3.2 橡子壳色素对小鼠血清超氧化物歧化酶(SOD)活性的影响
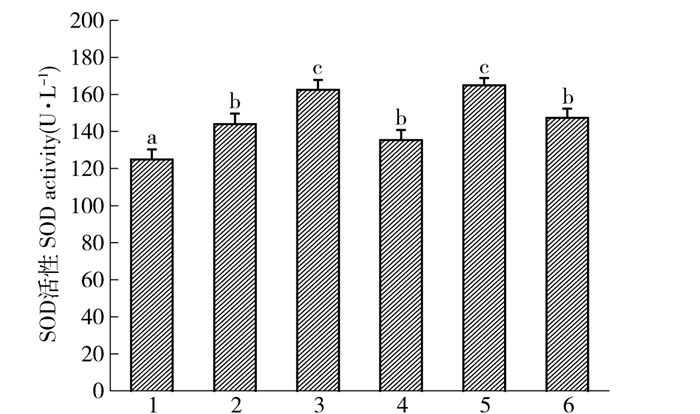
SOD是生物体内清除自由基的主要生物酶,能对抗与阻断因氧自由基对细胞造成的损害,并能够及时修复因自由基造成对细胞的损伤,因此SOD活性的大小可反应橡子壳色素体内抗氧化能力的大小,对小鼠血清SOD活性的测定结果见图 3。由图 3可知,与空白组相比,模型组小鼠血清中SOD活性下降了13.30%(P<0.05),表明60Coγ照射降低了小鼠血清中SOD的活性。而橡子壳色素低、中、高剂量组以及Vc组小鼠血清中SOD活性显著高于模型组(P<0.05),其中中剂量组及Vc组小鼠血清中SOD活性最高(P<0.05),分别达到了164.96、162.43 u/L。从实验结果可以看出,橡子壳色素对小鼠血清SOD有显著的修复作用,可以提高小鼠血清中SOD活性,且100 mg/(kg·d)剂量橡子壳色素与Vc效果一致。本实验与用黑高粱色素[15]和石榴皮多酚色素[16]灌胃小鼠显著提高了SOD酶活性,对脂质过氧化损伤有保护作用的实验结果相一致。
![]() 图 3 橡子壳色素对小鼠血清SOD活性的影响1.模型组;2.空白组; 3.维生素C组; 4.色素低剂量组; 5.色素中剂量组; 6.色素高剂量组; 不同小写字母表示各组之间有显著差异(P<0.05)。下图同此。Figure 3. Influence of acorn shell pigment on serum SOD activity of mice1, model group; 2, blank group; 3, Vc group; 4, low level group of acorn shell pigments; 5, middle level group of acorn shell pigments; 6, high level group of acorn shell pigments; different small letters within a group mean significant difference at P < 0.05 level. The same below.
图 3 橡子壳色素对小鼠血清SOD活性的影响1.模型组;2.空白组; 3.维生素C组; 4.色素低剂量组; 5.色素中剂量组; 6.色素高剂量组; 不同小写字母表示各组之间有显著差异(P<0.05)。下图同此。Figure 3. Influence of acorn shell pigment on serum SOD activity of mice1, model group; 2, blank group; 3, Vc group; 4, low level group of acorn shell pigments; 5, middle level group of acorn shell pigments; 6, high level group of acorn shell pigments; different small letters within a group mean significant difference at P < 0.05 level. The same below.2.3.3 橡子壳色素对小鼠血清过氧化氢酶(CAT)活性的影响
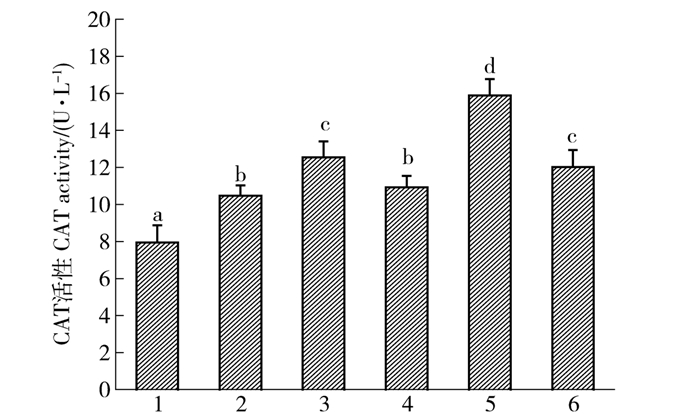
H2O2是细胞正常代谢的产物,而过氧化氢酶(CAT)可催化细胞内过氧化氢分解,防止过氧化,CAT活性越大,说明抗氧化能力越强。因此本实验研究了各实验组小鼠血清的CAT活性情况,结果见图 4。由图 4可知,模型组小鼠血清中CAT活性显著低于空白组(P<0.05),其活性下降了23.13%,表明辐射降低了小鼠血清中的CAT活性。橡子壳色素组和Vc组小鼠血清中CAT活性与模型组相比均有显著差异(P<0.05),表明对小鼠血清的CAT活性有一定的修复作用。橡子壳色素低剂量组小鼠血清中CAT活性与空白组相比无显著差异(P>0.05),而橡子壳色素中、高剂量组小鼠血清CAT活性显著高于空白组(P<0.05),说明色素可提高小鼠血清中CAT的活性。与Vc组小鼠血清中CAT活性相比,橡子壳色素中剂量组显著高于Vc组(P<0.05),而橡子壳色素高剂量组与Vc组相比无显著差异(P>0.05),可以看出橡子壳色素中剂量组提高CAT活性能力最强。从分析结果可以看出,橡子壳色素可使小鼠体内过氧化氢酶活性提高,且中剂量组效果最好,CAT活性可达到15.88 u/L。其结果与桑色素对全氟辛酸诱导小鼠肝损伤具有保护作用,其可显著提高肝中CAT水平的结果一致[17]。该结果表明SOD与CAT共同维持了机体的抗氧化能力,它们之间存在一定的协同作用。
2.3.4 橡子壳色素对小鼠血清丙二醛(MDA)含量的影响
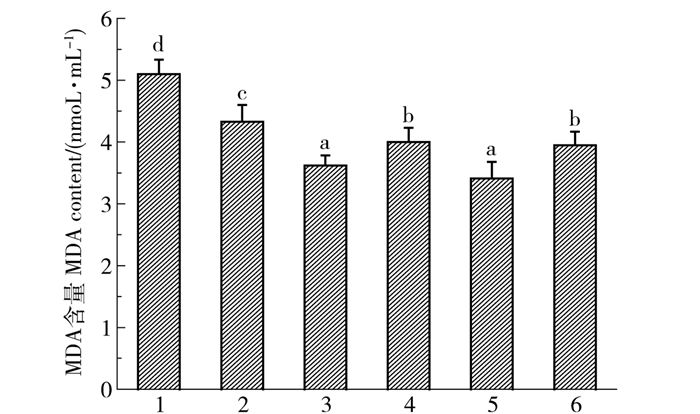
在生物机体内,氧自由基作用于生物膜上的不饱和脂肪酸发生过氧化反应,最终生成丙二醛(MDA),MDA含量的高低间接反映了机体受自由基影响氧化衰老的速度。因此本实验测定了各实验组小鼠血清中MDA含量,结果见图 5。由图 5可知,模型组小鼠的MDA含量明显高于空白组(P<0.05),已达到5.12 nmol/mL。而其他各组小鼠的MDA含量显著低于空白组(P<0.05),其中Vc组和橡子壳色素中剂量组小鼠血清中的MDA含量最低(P<0.05)。从数据分析结果可以说明,辐照作用能够使小鼠血清中的MAD含量增高,而Vc和橡子壳色素能够提高小鼠抗辐射能力,而且中剂量的橡子壳色素抗辐射作用与Vc作用效果一致,能够使小鼠血清中MDA水平降到3.48 nmol/mL。由此可知,橡子壳色素能够提高小鼠抗辐射能力而降低血清中MDA含量,并且具有量效关系。本实验结果与高璐等[18]用葡萄籽色素灌胃由D-半乳糖诱导的氧化衰老模型的小鼠,可显著降低MDA含量的结果相一致。从以上3个体内抗氧化指标可以看出中剂量橡子壳色素的抗氧化效果最好,这可能是橡子壳色素灌喂剂量过大,对小鼠产生一定的副作用。
3. 结论
橡子壳色素作为一种天然的坚果果壳色素,含有丰富的多酚类和黄酮类物质,本实验中橡子壳色素总多酚含量达到27.8%,总黄酮含量8.6%。体外抗氧化实验表明,当橡子壳色素浓度在40 μg/mL时对DPPH·清除率达到90%,在1 mg/mL时对Fe3+还原能力的吸光值达到0.98,抗氧化能力接近Vc。采用60Coγ射线照射小鼠的氧化伤害实验结果表明,橡子壳色素对小鼠辐射损伤具有一定的修复功能,并且能够提高血清中的SOD、CAT活性,降低MDA的含量,其中效果最好的为中剂量组(100 mg/(kg·d))橡子壳色素,并与相同剂量的Vc组相当。由此可知,橡子壳色素具有很好的抗氧化作用,可以应用到抗氧化保健品的开发应用中去,从而提高橡子资源的利用率。
-
图 3 橡子壳色素对小鼠血清SOD活性的影响
1.模型组;2.空白组; 3.维生素C组; 4.色素低剂量组; 5.色素中剂量组; 6.色素高剂量组; 不同小写字母表示各组之间有显著差异(P<0.05)。下图同此。
Figure 3. Influence of acorn shell pigment on serum SOD activity of mice
1, model group; 2, blank group; 3, Vc group; 4, low level group of acorn shell pigments; 5, middle level group of acorn shell pigments; 6, high level group of acorn shell pigments; different small letters within a group mean significant difference at P < 0.05 level. The same below.
表 1 实验期间各组小鼠体重变化
Table 1 Mass changes of mice during the experiment
组别
Group剂量Dose/
(mg·kg-1·d-1)第1天
1st day/g第7天
7th day/g第14天
14th day/g第21天
21st day/g第28天
28th day/g辐照后7 d
7th day after irradiation/g模型组Model group 18.70±0.39aA 22.72±0.75aB 24.93±1.03aC 28.19±1.39aD 30.85±1.78aD 25.68±1.73aC 空白组Blank group 18.44±0.51aA 23.04±0.94aB 25.02±1.33aC 28.97±1.4aD 30.97±1.27aD 30.22±2.80cD Vc组Vc group 100 18.28±0.55aA 22.50±1.14aB 25.42±1.54aC 28.70±1.27aD 30.73±1.87aD 28.04±1.63bD 橡子壳色素组
Acorn shell pigment group50 18.63±0.78aA 22.59±0.53aB 25.77±1.25aC 28.69±1.08aD 30.24±1.65aD 28.23±1.34bD 100 18.98±0.99aA 22.91±0.86aB 24.28±1.77aC 28.31±2.00aD 29.88±1.90aD 27.93±1.71bD 200 18.88±0.48aA 22.91±0.69aB 24.66±1.58aC 28.05±1.52aD 29.01±2.11aD 28.45±1.98bD 注:不同小写字母表示每一组各列之间差异显著(P<0.05);不同大写字母表示各组每一行之间差异显著(P<0.05)。下同。Notes: different small letters within a column mean significant difference at P<0.05 level; different capital letters within a row mean significant difference at P<0.05 level. The same below. 表 2 各实验组的小鼠脏器系数
Table 2 Mouse organ coefficient of each experiment group
组别
Group剂量Dose/
(mg·kg-1·d-1)心脏指数
Heart index/%肝脏指数
Hepatic index/%脾脏系数
Spleen index/%肾指数
Kidney index/%模型组Model group 0.48±0.008 8a 4.06±0.10a 0.20±0.007 5a 1.45±0.098a 空白组Blank group 0.67±0.005 9b 5.60±0.066b 0.25±0.009 4b 1.76±0.087b Vc组Vc group 100 0.62±0.007 9b 5.44±0.095b 0.24±0.008 6b 1.69±0.097b 橡子壳色素组
Acorn shell pigment group50 0.60±0.0090b 5.04±0.083b 0.25±0.0087b 1.74±0.078b 100 0.63±0.0054b 4.98±0.077b 0.24±0.0082b 1.73±0.092b 200 0.64±0.0074b 5.27±0.063b 0.24±0.0076b 1.74±0.088b 注:不同小写字母表示每一组各列之间有显著差异(P<0.05)。Note: different small letters within a column mean significant difference at P<0.05 level. -
[1] MUNAWAR N, JAMIL H. The Islamic perspective approach on plant pigments as natural food colourants[J]. Procedia-Social and Behavioral Sciences, 2014, 121(3): 193-203. https://www.sciencedirect.com/science/article/pii/S1877042814011379
[2] CHANG H, KIM S, JEE M. Functions of natural pigments on gastric ulcer and cancer[J]. New Biotechnology, 2014, 315(31): 110-117. https://www.sciencedirect.com/science/article/pii/S1871678414019438
[3] 张玥, 谢文霁, 杨可心, 等.我国橡子资源的开发利用[J].中国林副特产, 2014, 140(4): 85-88. doi: 10.3969/j.issn.1001-6902.2014.04.041 ZHANG Y, XIE W J, YANG K X, et al. The development and utilization of acorn resources in China[J]. Forest By-Product and Speciality in China, 2014, 140(4): 85-88. doi: 10.3969/j.issn.1001-6902.2014.04.041
[4] 董孝元.橡壳棕色素提取、纯化和性能研究武汉[D].武汉: 湖北工业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10500-1013245396.htm DONG X Y. Extraction, purification and properties of brown pigment from oak shell[D]. Wuhan: Hubei University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10500-1013245396.htm
[5] ELVIA J, MONTSERRAT D, LETICIA G, et al. Anthocyanin and phenolic characterization, chemical composition and antioxidant activity of chagalapoli (Ardisia compressa K.) fruit: a tropical source of natural pigments[J]. Food Research International, 2015, 70(4): 151-157. https://www.sciencedirect.com/science/article/pii/S0963996915000484
[6] KABO M, TRUST B. MOHAMMED H. Antioxidant properties of diverse cereal grains: a review on in vitro and in vivo studies[J]. Food Chemistry, 2016, 196(4): 90-97. https://www.sciencedirect.com/science/article/pii/S0308814615013643
[7] 张志健, 李新生.橡子壳色素提取技术研究[J].中国食品添加剂, 2010, 99(2): 105-110. doi: 10.3969/j.issn.1006-2513.2010.02.019 ZHANG Z J, LI X S. Study on extraction technology of acorn shell pigment[J]. China Food Additives, 2010, 99(2): 105-110. doi: 10.3969/j.issn.1006-2513.2010.02.019
[8] CENGIZ S, BEKTAS T, DENIZ K, et al. Evaluation of metal concentration and antioxidant activity of three edible mushrooms from Mugla, Turkey[J]. Food and ChemicalToxicology, 2010, 48(5): 1230-1233. doi: 10.1016/j.fct.2009.12.033
[9] 宋海燕, 程振玉, 马朝红.响应面优化酶法提取五味子多糖的工艺及抗氧化活性研究[J].食品工业, 2016, 37(3): 159-163. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=spgy201603044 SONG H Y, CHENG Z Y, MA C H. The response surface optimization of enzymatic extraction technology and the antioxidant activity of fructus schisandrae polysaccharide research[J]. Food Industry, 2016, 37(3): 159-163. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=spgy201603044
[10] 谢靖.紫薯素对60Coγ辐射导致的小鼠胸腺细胞损伤的抑制作用及机制[D].青岛: 中国海洋大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011231359.htm XIE J. Potato element of 60Coγ radiation inhibitory effect and mechanism of mice thymus cell damage[D]. Qingdao: Ocean University of China, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011231359.htm
[11] TERSINHA A, ANTONIA M. Antioxidant properties and chemical composition of technical cashew nut shell liquid (tCNSL)[J]. Food Chemistry, 2011, 126(3): 1044-1048. doi: 10.1016/j.foodchem.2010.11.122
[12] VAZQUEZ G, FONTENLA E, SANTOS J, et al. Antioxidant activity and phenolic content of chestnut (Castanea sativa) shell and eucalyptus (Eucalyptus globulus) bark extracts[J]. Industrial Crops and Products, 2008, 28 (3): 279-285. doi: 10.1016/j.indcrop.2008.03.003
[13] 罗强, 杨雪果, 施宝珠, 等.栓皮栎橡子壳色素理化性质和抗氧化活性[J].食品科学, 2016, 37(8): 1-11. http://d.old.wanfangdata.com.cn/Periodical/spkx201711021 LUO Q, YANG X G, SHI B Z, et al. Physical and chemical properties and antioxidation of Quercus variabilis acorn shell pigment[J]. Food Science, 2016, 37(8): 1-11. http://d.old.wanfangdata.com.cn/Periodical/spkx201711021
[14] JAVIER E, RICARDO Z, BEATRIZ S, et al. Anthocyanins and antioxidant capacities of six Chilean berries by HPLC-HR-ESI-TOF-MS[J]. Food Chemistry, 2015, 176(6): 106-114. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=bbdf5c2b45eae1f95496a50cc3e4cda3
[15] SHEN Y B, ZHANG H, CHEN L L, et al. In vitro and in vivo antioxidant activity of polyphenols extracted from black highland barley[J]. Food Chemistry, 2016, 194(3): 1003-1012. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=44141c199f8a5ddc7d797c1251e090f5
[16] 李建科, 李国秀, 赵艳红, 等.石榴皮多酚组成分析及其抗氧化活性[J].中国农业科学, 2009, 42(11): 4035-4041. doi: 10.3864/j.issn.0578-1752.2009.11.034 LI J K, LI G X, ZHAO Y H, et al. Composition of pomegranate peel polyphenols and its antioxidant activities[J]. Scientia Agricultura Sinica, 2009, 42(11): 4035-4041. doi: 10.3864/j.issn.0578-1752.2009.11.034
[17] 余舒文, 陶恩威, 苑洋洋, 等.桑色素对全氟辛酸诱导小鼠肝损伤的保护作用[J].南昌大学学报(医学版), 2016, 56(3): 35-39. http://d.old.wanfangdata.com.cn/Periodical/jxyxyxb201603002 YU S W, TAO E W, YUAN Y Y, et al. Protective effect of morin on perfluorooctanoic acid-induced liver injury in mice[J]. Journal of Nanchang University(Medical Sciences), 2016, 56(3): 35-39. http://d.old.wanfangdata.com.cn/Periodical/jxyxyxb201603002
[18] 高璐, 王滢, 饶胜其, 等.葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J].食品科学, 2014, 35(23): 253-256. doi: 10.7506/spkx1002-6630-201423049 GAO L, WANG Y, RAO S Q, et al. Effect of grape seed extract of grape seed extract on antioxidation in aging model mice[J]. Food Sciences, 2014, 35(23): 253-256. doi: 10.7506/spkx1002-6630-201423049
-
期刊类型引用(11)
1. 李鑫磊,杨传颖,石宝,敖乐根. 基于深度哈希与注意力机制的花卉图像检索. 计算机仿真. 2024(02): 207-211+532 .  百度学术
百度学术
2. 陈泽伟,乔印虎,周玉蝶. 基于机器视觉的白芍药材双面品质检测系统. 常州工学院学报. 2024(02): 1-7 .  百度学术
百度学术
3. 崔艳荣,卞珍怡,高英宁. 基于生成对抗网络的花卉识别方法. 江苏农业科学. 2022(22): 200-208 .  百度学术
百度学术
4. 何进荣,任维鑫,石延新,白宗文. 基于卷积神经网络的牡丹花品种识别. 系统仿真技术. 2021(02): 128-133 .  百度学术
百度学术
5. 吴丽娜,王林山. 改进的LeNet-5模型在花卉识别中的应用. 计算机工程与设计. 2020(03): 850-855 .  百度学术
百度学术
6. 黄清梅,杨晓洪,侯瑶,刘艳芳,吕宏斌. 显色图像分析技术在水稻叶耳花青甙显色目测分级中的应用. 食品安全质量检测学报. 2020(07): 2050-2056 .  百度学术
百度学术
7. 任意平,夏国强,李俊丽. 基于花蕊区域定位的花卉识别方法. 电子测量技术. 2020(07): 97-102 .  百度学术
百度学术
8. 李晓红,吴仲华,刘海秋,马慧敏. 基于卷积神经网络模型的多肉植物种类识别. 贵州师范学院学报. 2020(03): 9-15 .  百度学术
百度学术
9. 刘嘉政. 基于深度迁移学习模型的花卉种类识别. 江苏农业科学. 2019(20): 231-236 .  百度学术
百度学术
10. 刘文定,李安琪,张军国,谢将剑,鲍伟东. 基于ROI-CNN的赛罕乌拉国家级自然保护区陆生野生动物自动识别. 北京林业大学学报. 2018(08): 123-131 .  本站查看
本站查看
11. 张彤,刘志,庄新卿. 基于开发者平台和深度学习的智能识花与护花系统. 工业控制计算机. 2018(01): 90-92 .  百度学术
百度学术
其他类型引用(11)



 下载:
下载: