Isolation and functional analysis of CYC2d orthologous genes from several plants of the tribe Anthemideae
-
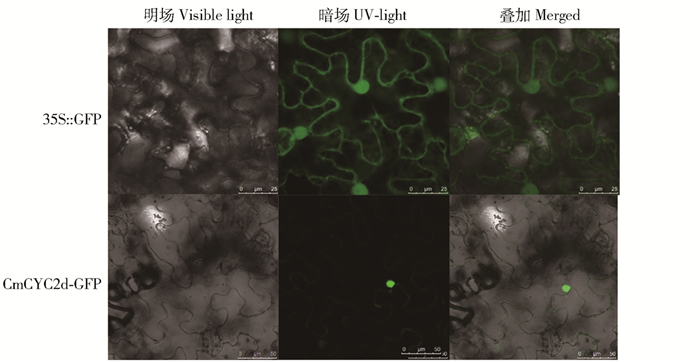
摘要: CYC同源基因作为控制花瓣对称性形成的关键基因,在菊科头状花序中主要调控着舌状花(两侧对称)的生长发育。菊科植物中舌状花的有或无及其分子调控机制和演化过程一直备受关注。本研究从花型不同的川甘亚菊、戈壁短舌菊和神农香菊中分别同源克隆了转录因子基因CYC2d。3个序列与菊花CmCYC2d基因氨基酸序列的比对结果显示其同源性均超过90%,且均含有保守的TCP和R结构域。半定量RT-qPCR结果显示,CYC2d在地被菊品种‘毛香玉’幼嫩花序中的表达量最高,而在川甘亚菊和戈壁短舌菊中的表达量非常微弱。因此,进一步通过实时荧光定量检测了CmCYC2d在‘毛香玉’6个发育时期舌状花和管状花中的表达情况,结果表明, CmCYC2d各个时期管状花中的表达量均很低,而在相应时期舌状花中的表达均很丰富。在不同花型的杂交F1代优株中,CmCYC2d也主要在不同位置的舌状花中高表达。通过农杆菌转化重组质粒pSUPER1300-CmCYC2d-GFP在烟草表皮细胞瞬时表达,亚细胞定位结果显示其定位于表皮细胞核。分别在野生型拟南芥和tcp1突变体(SALK-022364)中过表达CmCYC2d基因的结果表明,转基因阳性株系的营养生长受到抑制,花期延迟,花瓣大小和排列均发生了变化,使原本辐射对称的花瓣呈现两侧对称的趋势。从研究结果可知, 转录因子基因CmCYC2d对菊花舌状花的发育有重要调控作用。本研究为菊科舌状花演化的分子调控机制研究奠定了基础。Abstract: As the important gene of regulating flower symmetry, cyc-like proteins have been shown to mainly regulate the identity and development of ray floret (bilaterally symmetrical) in Asteraceae. The presence or absence of ray floret in Asteraceae and its molecular regulation mechanism as well as the evolutionary process have been highly concerned. Orthologous genes of CYC2d from Ajania potaninii, Brachanthemum titovii and Chrysanthemum indicum var. aromaticum were obtained by homology-based cloning. Their sequence alignment and conserved motif analysis were performed with the amino sequence of CmCYC2d, respectively. The results showed that their homology was more than 90% and all these proteins contained the conserved TCP and R domains. Furthermore, according to the result of semi-quantitative RT-PCR assay, CYC2d was strongly expressed in the young inflorescence of the groundcover chrysanthemum 'Mao xiangyu', while slightly expressed in that of A.potaninii and B.titovii. Therefore, the transcription levels of CmCYC2d were examined in ray and disc florets of 'Mao xiangyu' at six developing stages using quantitative real-time PCR. The results indicated that it was weakly expressed in disc florets of all stages, while highly expressed in ray florets of the corresponding stages. Moreover, in three F1 progenies with various whorls of ray florets, the CmCYC2d was expressed at much higher levels in ray florets of different whorls than in disc florets. The recombinant plasmid pSUPER1300-CmCYC2d-GFP was transiently expressed into the epidermal cells of Nicotiana benthamiana by agrobacterium-mediated transformation, and subcellular localization analysis revealed that the CmCYC2d protein mainly localized into the nucleus of epidermal cells. Furthermore, CmCYC2d was overexpressed in wild type Arabidopsis and the TCP1 mutant used the floral-dip method. The results showed that the vegetative growth and the flowering time of the positive transgenic lines were repressed and postponed. Moreover, the size and arrangement of the petals seemed to be changed, making the petal arrangement showed bilateral symmetry from original radial symmetry. These results indicate that the transcription factor CmCYC2d is essential in regulating ray floret identity in chrysanthemum. Our study lays a foundation for the research of molecular mechanisms for the evolutionary process of ray floret in Asteraceae.
-
Keywords:
- flower symmetry /
- Chrysanthemum /
- Anthemideae /
- CmCYC2d /
- ray floret /
- gene expression
-
杨树(Populus spp.)是东北地区农田防护林主要造林树种之一, 具有生长迅速、适应力强、容易繁殖、能尽早地发挥防护效益和经济效益等优点,但也存在着胁地面积大,使林带附近的农作物生长不良而造成减产等问题。引起林带胁地的2个主要原因是林木根系吸水和林带遮荫。而在东北地区,由于树木根系的吸收作用,使林带两侧的土壤水分、空气湿度、土壤养分等因子发生不利于农作物生长的变化是林带胁地的主要原因[1]。
为解决林带胁地问题,国内外学者做了很多有关方面的研究,并提出切根贴膜、挖沟断根、以松(Pinus spp.)改杨、物质补给、胁地盈留及林木修枝等解决措施[2-5]。其中,切根贴膜技术是解决东北地区林带胁地问题最有效的方法。切根贴膜通常是在距树干0.5~2 m处开一条深60~80 cm的沟,然后在沟壁一侧(靠近林带一侧)贴上一层厚约40 μm, 长度一定(林带长度)的塑料薄膜, 最后将土回填。切根贴膜技术有效的阻止了树木根系的水平延伸,在林带胁地范围内, 该项措施可使粮豆平均增产近50%,每公顷年均粮食产量提高了1 336.7 kg[6]。在目前研究中,人们更多关注的是切根贴膜技术的增产效果,却忽视了该技术对林带生长及光合生理特性等方面的影响。
林带切根贴膜后,林木根系遭到了损伤,水平延伸受到限制,吸收水分和养分的范围减小,可能会使林木处于水分亏缺状态。当植物受到干旱胁迫时,叶片作为高等植物光合作用的活动中心,也是植物对环境最为敏感的器官,可通过形态、结构和生理上的变化来抵御或减轻干旱损伤[7-9]。目前,切根贴膜技术对农田防护林光合生理特性及解剖结构特征的影响尚不明确,切根贴膜距离尚没有统一规范且缺乏理论支持。本文以黑龙江省黑土区农田防护林杨树为研究对象,研究不同切根贴膜距离对杨树叶片的光合生理特性、气孔形态特征和叶绿体超微结构的影响,旨在为切根贴膜技术的科学应用提供理论参考。
1. 研究地概况与研究方法
1.1 试验地概况
试验地位于黑龙江省拜泉县丰产乡长安村(47°63′ N、东经125°86′ E),地处小兴安岭余脉向松嫩平原过渡地带,属东北黑土漫岗区。中温带大陆性季风气候,年均降水量490 mm,年均蒸发量1 334 mm,年均气温1.2 ℃,年均日照2 730 h,全年无霜期122 d。土壤类型主要为黑土、黑钙土和草甸土,土壤质地为轻黏土,土壤pH 6.52,有机质含量48.25 g/kg,碱解氮136.5 mg/kg,有效磷31.7 mg/kg,速效钾211.5 mg/kg。
1.2 试验设计
试验选取的农田防护林树种为小黑杨(Populus simonii × P. nigra)。林带南北走向,2009年春季定植,苗木规格为2年生根1年生干。林带共3行,株行距为2 m×3 m,平均胸径(8.6±1.8) cm、平均树高(7.2±0.9) m、冠幅(东西×南北)3.6 m×2.8 m。试验于2015年5月末进行,采用对比试验设计,重复3次,每个小区30株树(10株×3株),小区之间设置2行保护行。试验共设4个处理,自北向南依次为:1)C0.5是在林带西侧树干50 cm处,开深80 cm、宽30 cm、长约20 m(10棵试验树木株距)的沟,然后用长约20 m、宽1 m、厚0.04 mm的塑料薄膜在沟内靠林带一边侧放, 并立即埋土填沟, 恢复地面原样。2)CK是未切根贴膜处理。3)C1是距树干1 m处切根贴膜。4)C2是距树干2 m处切根贴膜。详见图 1。
1.3 试验方法
1.3.1 光合特征参数测定
2015年7—9月,于每个月初晴朗无云的上午09:00—11:00之间,采用Li-6400便携式光合系统分析仪(美国Li-COR公司产)测定试验地平均标准木叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、细胞间隙CO2浓度(Ci)等生理指标。计算叶片水分利用效率(WUE=Pn/Tr)和气孔限制值(Ls=1-Ci/Ca, 式中:Ca为空气环境的CO2浓度)。每个处理在林带外侧(贴膜一侧)中部选3株平均标准木进行测定。为了减少因测定时间所引起的误差,每一处理的3株标准木采用首尾相接的方法循环测定,由于树木高大,采用取样枝的方法测定各项指标。每次均随机在树冠外围向阳面中上部剪下1个枝条插入水瓶中[10],选取4片成熟叶片,在自然光源下测定,测定过程中使叶片、量子传感器与日光保持垂直,CO2浓度为外界浓度。待系统稳定后,每一叶片读数重复3次。
1.3.2 气孔特征观察
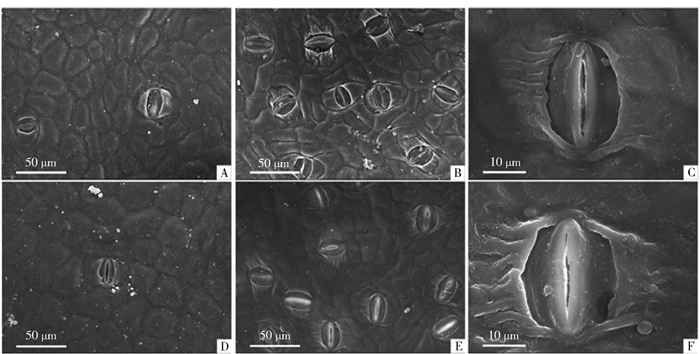
取样时间及所取材料与光合特征参数所测树木一致。剪取树冠外围向阳面中上部1个枝条,取1片(枝条顶端起第5片)成熟叶作为供试材料,在叶片中部主脉旁取材(3 mm×3 mm),置于2.5%戊二醛溶液固定24 h,用磷酸缓冲液漂洗4次,经过乙醇梯度脱水、乙酸异戊酯置换、临界点干燥后将样品粘在样品台上,置Eiko IB-3离子溅射仪中进行导电处理,在日立S-4800型扫描电镜下观察上、下表皮气孔形态特征,选取典型视野照相。统计单位视野内的气孔数目,计算气孔密度;利用电镜软件测量气孔(保卫细胞)的长度(纵轴长)和宽度(横轴长),每片叶随机观察5个视野。
1.3.3 叶绿体超微结构观察
与气孔形态特征观察所取材料一致,在叶片中部主脉旁取材(1 mm×2 mm),置于2.5%戊二醛溶液固定后带回试验室。样品经磷酸缓冲液漂洗4次后转入1%的锇酸固定液中固定2 h,再入磷酸缓冲液冲洗3次,经乙醇梯度脱水后,转入Epon 812环氧树脂内渗透和包埋。用Leica EM-UC6型超薄切片机切片(切片厚度50~60 nm),经醋酸铀和柠檬酸铅对切片双重染色后,置日立H-7650型透射电镜下观察并拍照。
1.4 数据分析
应用Excel软件进行数据分析以及图表绘制,应用SPSS19.0软件对试验数据进行单因素方差分析,新复极差法(Duncan,α=0.05)进行显著性多重比较检验。
2. 结果与分析
2.1 切根贴膜处理对杨树叶片光合生理特性影响
切根贴膜1个月后,小黑杨叶片的净光合速率、气孔导度和蒸腾速率显著下降,下降幅度随切根距离减小而增大(表 1)。C0.5~C2处理的Pn较CK分别下降43.30%、29.56%和14.86%,处理间差异显著;水分利用效率C0.5和C1处理较CK明显提高,C2处理较CK无明显变化。
表 1 切根贴膜处理对杨树叶片光合生理特性的影响Table 1. Effects of root excision mulched with plastic film treatments on photosynthetic characteristics of poplar leaves月份
Month处理
TreatmentPn/(μmol·m-2·s-1) GS/(mmol·m-2·s-1) Ci/(μmol·mol-1) Tr/(mmol·m-2·s-1) Ls WUE/(μmol·mmol-1) 7 CK 17.76±2.22a 266.46±35.05a 206.80±6.93a 6.36±0.60a 0.43±0.02b 2.79±0.16b C0.5 10.07±0.98d 124.72±8.71d 199.47±13.84a 3.41±0.12d 0.45±0.04b 2.96±0.23a C1 12.51±1.96c 148.52±30.06c 187.92±6.12b 4.07±0.63c 0.48±0.02a 3.08±0.10a C2 15.12±0.62b 218.62±29.62b 203.54±11.45a 5.55±0.52b 0.43±0.03b 2.74±0.19b 8 CK 12.57±1.39a 184.43±29.15a 226.86±21.27a 6.21±0.84a 0.41±0.06bc 2.03±0.23a C0.5 9.69±2.07b 130.03±15.85b 220.60±22.79a 5.55±0.75b 0.42±0.04bc 1.83±0.20a C1 10.35±2.39b 138.09±20.98b 212.42±26.63a 6.09±0.58a 0.44±0.06ab 1.72±0.19b C2 11.08±1.23b 139.31±19.35b 194.16±26.81b 6.01±0.53a 0.48±0.07a 1.93±0.19a 9 CK 13.11±1.10a 271.17±21.54a 255.79±18.80a 7.40±1.77a 0.32±0.04a 1.84±0.16a C0.5 12.05±1.62a 234.24±23.05b 253.65±21.47a 6.27±1.28b 0.32±0.03a 1.98±0.17a C1 12.13±1.42a 217.43±24.80c 246.70±26.14a 6.77±1.93ab 0.35±0.03a 1.86±0.09a C2 12.31±1.01a 229.24±19.62bc 250.64±26.30a 7.59±1.39a 0.34±0.02a 1.65±0.11b 注:7、8、9月份分别为切根贴膜后的第1、2、3个月, 数据为平均值±标准差,同一月份中同列不同字母代表处理间差异显著(P<0.05)。下同。Notes:July, August and September are the 1st, 2nd and 3rd month after root excision, respectively; Data represent mean standard ± deviation, different letters in the same month and column indicate significant difference among treatments at P<0.05 level. The same as below. 切根贴膜2个月后,小黑杨叶片的净光合速率、气孔导度和蒸腾速率依然低于对照。C0.5~C2处理的Pn较CK分别下降22.91%、17.66%和11.85%,差异显著;水分利用效率均低于CK,除C1处理外未达到显著水平。
切根贴膜3个月后,C0.5~C2处理的Pn较CK分别下降8.08%、7.48%和6.10%,差异不显著;气孔导度仍明显低于CK,蒸腾速率除C0.5处理仍明显低于CK外,C1和C2处理较CK无明显差异;水分利用效率C0.5和C1处理略高于CK,差异不显著,C2处理则明显低于CK。
生长旺季内(7—9月),切根贴膜处理后的小黑杨叶片气孔限制值较CK呈增加趋势,胞间CO2浓度变化趋势与气孔导度一致,说明净光合速率的下降是由气孔限制因素引起的。
2.2 切根贴膜处理对杨树叶片气孔特征的影响
扫描电镜观察发现,气孔在小黑杨叶片的上下表皮均有分布,CK小黑杨叶片上表皮气孔数量相对较少,表面无蜡质纹饰。皮气孔数量相对较多,部分气孔周围有条索状纹饰(图 2A~2C), 膜处理后的小黑杨叶片气孔特征与对照相比无明显差异(图 2D~2F)。
![]() 图 2 切根贴膜处理对杨树叶片气孔特征的影响A.处理的上表皮,500×;B.处理的下表皮,500×;C.处理的下表皮,2000×;D.贴膜处理的上表皮(以8月C0.5处理为例);E.贴膜处理的下表皮(以8月C0.5处理为例);F.贴膜处理的下表皮(以8月C0.5处理为例)2000×。Figure 2. Effects of root excision mulched with plastic film treatments on stomatal characteristics of poplar leavesA, daxial-CK, 500×; B, baxial-CK, ×500;C, baxial-CK, 2000×; D, daxial-C0.5, 500×(taking treatment in August as an example); E, baxial-C0.5, 500×(taking treatment in August as an example); F, axial-C0.5, 2000×(taking treatment in August as an example).
图 2 切根贴膜处理对杨树叶片气孔特征的影响A.处理的上表皮,500×;B.处理的下表皮,500×;C.处理的下表皮,2000×;D.贴膜处理的上表皮(以8月C0.5处理为例);E.贴膜处理的下表皮(以8月C0.5处理为例);F.贴膜处理的下表皮(以8月C0.5处理为例)2000×。Figure 2. Effects of root excision mulched with plastic film treatments on stomatal characteristics of poplar leavesA, daxial-CK, 500×; B, baxial-CK, ×500;C, baxial-CK, 2000×; D, daxial-C0.5, 500×(taking treatment in August as an example); E, baxial-C0.5, 500×(taking treatment in August as an example); F, axial-C0.5, 2000×(taking treatment in August as an example).生长旺季(7—9月)内小黑杨叶片上表皮气孔密度逐渐上升,叶片下表皮气孔密度呈先上升后略微下降趋势(表 2)。在7—8月,C0.5~C2处理的上表皮气孔密度平均值较CK分别下降约52.5%和23.3%,差异显著,不同程度切根贴膜处理间无明显差异;9月C0.5处理的上表皮气孔密度较CK下降19.9%,仍明显低于CK,而C1和C2处理的上表皮气孔密度略低于CK,差异未达到显著水平。C0.5~C2处理的下表皮气孔密度平均值在7月较CK下降约9.1%,8—9月较CK分别上升约15.1%和12.7%,差异显著,而C0.5~C2处理间无明显差异。
表 2 切根贴膜处理对杨树叶片气孔特征参数的影响Table 2. Effects of root excision mulched with plastic film treatments on stomatal characteristic parameters of poplar leaves月份
Month处理
Treatment气孔密度/(个·mm-2)
Density/(number·mm-2)气孔长度Stomata length/μm 气孔宽度Stomata width/μm 上表皮Adaxial 下表皮Abaxial 上表皮Adaxial 下表皮Abaxial 上表皮Adaxial 下表皮Abaxial 7 CK 19.3±1.9a 136.9±24.4a 24.2±3.1a 27.9±3.9a 15.1±2.8a 16.3±3.2a C0.5 9.7±1.7b 125.2±17.9b 23.7±3.8a 25.2±3.9b 14.4±2.9a 15.9±3.0a C1 9.5±1.5b 125.0±12.5b 22.8±3.9a 26.8±3.8b 14.5±2.4a 16.2±3.1a C2 8.3±1.1b 123.2±16.8b 23.6±3.5a 27.2±4.0ab 14.4±2.6a 15.8±3.1a 8 CK 22.0±2.0a 157.4±7.6b 25.0±3.2a 24.4±4.1a 14.8±2.3a 15.2±2.9a C0.5 17.3±1.1b 174.9±10.2a 25.6±3.5a 22.4±4.8c 15.2±2.3a 14.6±2.7b C1 17.3±1.2b 186.0±26.8a 26.0±4.1a 23.0±3.9bc 15.3±2.5a 14.6±2.7b C2 16.0±2.3b 168.2±8.7a 24.8±4.0a 23.6±4.0b 15.6±2.1a 14.9±2.9ab 9 CK 33.2±3.0a 151.0±4.6b 24.2±4.2a 23.3±3.9a 14.0±2.4a 14.4±2.8a C0.5 26.6±1.2b 168.8±25.8a 23.2±2.1a 21.0±4.0c 14.9±2.0a 13.3±2.6b C1 29.9±2.0ab 168.2±8.7a 23.5±2.7a 21.6±3.6bc 14.5±2.5a 13.4±2.3b C2 31.2±1.1a 173.6±7.1a 22.9±4.3a 22.0±3.4b 14.0±2.4a 13.5±2.6b 切根贴膜处理后的小黑杨叶片上表皮气孔大小(长度×宽度)在生长季内与CK相比无明显差异。小黑杨叶片下表皮气孔大小在生长季内逐渐减小,在7—9月,C0.5处理的下表皮气孔长度较CK分别减小9.7%、8.2%和9.9%,C1处理的下表皮气孔长度较CK分别减小3.9%、5.7%和7.3%,C2处理的下表皮气孔长度较CK分别减小2.5%、3.3%和5.6%;除7月C2处理未达到显著水平外,其他处理均明显低于CK。可见,切根贴膜距树干距离越近,叶片下表皮气孔长度越小,随着处理时间的延长,叶片气孔长度较CK差异越大。C0.5~C2处理的下表皮气孔宽度在生长季内逐渐小于CK,C0.5和C1处理的下表皮气孔宽度在8—9月明显低于CK,而C2处理的下表皮气孔宽度也在9月显著低于CK。
2.3 切根贴膜处理对杨树叶片叶绿体超微结构的影响
正常条件下,7月小黑杨的叶肉细胞中叶绿体紧贴细胞壁分布,多呈梭形或椭球形,叶绿体中淀粉粒清晰可见。基质中嗜锇颗粒数量较少(图 3A1)。8月小黑杨的叶绿体结构与7月相比变化不大,叶绿体片层清晰,排列整齐,基质中嗜锇颗粒数量有增加趋势(图 3A2)。9月小黑杨的叶绿体结构基本呈正常形态,但叶绿体与细胞壁相邻面积减小,出现质壁分离现象(图 3A3)。
![]() 图 3 切根贴膜处理对杨树叶片叶绿体超微结构的影响A1~A3.7—9月对照处理;B1~B3.7—9月C0.5处理;C1~C3.7—9月C1处理;D1~D3.7—9月C2处理;CP.叶绿体;SG.淀粉粒;N.细胞核;W.细胞壁; O.嗜锇颗粒。Figure 3. Effects of root excision mulched with plastic film treatments on the ultrastructure of chloroplasts of poplar leavesA1-A3,control treatment in July to September;B1-B3,C0.5 treatment in July to September;C1-C3,C1 treatment in July to September;D1-D3,C2 treatment in July to September; CP,chloroplasts;SG,starch grain;N,nucleus;W,cell wall; O,osmiophilic granules.
图 3 切根贴膜处理对杨树叶片叶绿体超微结构的影响A1~A3.7—9月对照处理;B1~B3.7—9月C0.5处理;C1~C3.7—9月C1处理;D1~D3.7—9月C2处理;CP.叶绿体;SG.淀粉粒;N.细胞核;W.细胞壁; O.嗜锇颗粒。Figure 3. Effects of root excision mulched with plastic film treatments on the ultrastructure of chloroplasts of poplar leavesA1-A3,control treatment in July to September;B1-B3,C0.5 treatment in July to September;C1-C3,C1 treatment in July to September;D1-D3,C2 treatment in July to September; CP,chloroplasts;SG,starch grain;N,nucleus;W,cell wall; O,osmiophilic granules.小黑杨经切根贴膜处理1个月后,与CK相比,其叶肉细胞内的叶绿体轻微膨胀,淀粉粒大小明显变小,数量减少(图 3B1~3D1)。C0.5处理的叶绿体片层变稀薄模糊,出现明显的质壁分离现象,基质中嗜锇颗粒数量大量增加(图 3B1);C1处理的类囊体略有膨胀,叶绿体片层空间变大,出现较小的透明腔,少部分片层出现轻微扭曲的现象,嗜锇颗粒数量增加(图 3C1);C2处理的叶绿体结构与CK相比无明显变化(图 2D1)。小黑杨经切根贴膜处理2个月后,除C0.5处理的嗜锇体数量和体积较CK增加外(图 3B2),其他处理的叶肉细胞内叶绿体结构与CK差异不明显(图 3C2、3D2),C2处理的淀粉粒数量有增加现象(图 3D2)。小黑杨经切根贴膜处理3个月后,C1和C2处理的叶绿体中淀粉粒的数量和体积明显增加(图 3C3、3D3),叶肉细胞内的叶绿体与其他结构CK相比已无明显差异(图 3B3~3D3)。
3. 结论与讨论
Pezeshki等[11]研究发现,断根能降低植物的光合作用。主要是由于断根造成植株根系生物量下降,在一段时间内吸收不到足够的水养,植株的光合速率随着断根程度的加重相应降低[12]。本研究得出相似结论。切根贴膜1个月后的杨树净光合速率显著下降,下降幅度随着断根强度的加大而增加。这可能是由于切根贴膜处理后的杨树处于干旱胁迫状态,根系将水力信号和化学信号传导到叶片,引起气孔关闭,气孔阻力升高,蒸腾速率下降导致光合速率降低[13]。切根贴膜距离树干位置越近,根系损伤越大,气孔导度和蒸腾速率下降越明显。切根贴膜2个月后的杨树净光合速率仍明显低于对照,但降低幅度有所减小。切根贴膜3个月后,杨树叶片的净光合速率略低于对照,未达到显著水平。应是经过一段时间的恢复,各断根处理的切口处萌发出新根,扩大了根系吸收面积,从而使水分吸收增加,可以推测光合速率的升高取决于新根的出现。
光合作用与植物的生长状况密切相关。一般将影响植物光合作用的因子分为气孔因子和非气孔因子。Farquhar等[14]认为,判断光合作用下降的主要原因,要看Gs和Ci的变化规律是否相同。如果光合速率下降时,Gs和Ci同时降低,则气孔限制是植物光合速率降低的主要原因;如果Gs下降时Ci升高,则说明光合速率的下降主要是由非气孔限制引起的。本研究中,切根贴膜处理后的杨树叶片气孔限制值增大,气孔导度和胞间CO2含量同时下降,说明气孔限制因素是处理后杨树净光合速率下降的主要原因,这与植物在受到轻度干旱胁迫时的光合参数变化规律一致。
气孔能够影响植物的光合作用,叶片单位面积上气孔数量的多少与植物的净光合速率、蒸腾速率和气孔导度等直接相关[15]。前人研究表明,气孔密度随着干旱胁迫程度的增加逐渐上升[16-17]。一些学者发现中度干旱胁迫能够促进植物单位叶面积上气孔数量的增加,而重度干旱胁迫则会降低植物的气孔密度[18-19]。本研究中,切根贴膜处理后的杨树叶片上下表皮气孔密度在7月均明显降低。可能是由于断根使杨树处于水分亏缺状态,影响了叶片气孔的发育,较少的气孔数量大幅度降低了由气孔引起的蒸腾作用,这样更有利于植物适应不利的环境条件。随后,叶片气孔密度不断增加,下表皮气孔密度在8—9月已明显高于对照,这可能是由于干旱胁迫降低了植物叶片生长速度,单位叶面积上的气孔数量因此提高,也可能是切根贴膜促进了气孔发育,直接增加了气孔数量。随着树木根系的恢复,水分吸收增加,单位面积上的气孔数目增多有利于提高净光合速率[20-21]。
叶绿体是光合作用的主要场所。在正常条件下,小黑杨叶肉细胞中叶绿体紧贴细胞壁分布,叶绿体中含有大量的淀粉粒, 用以叶片生长或作为物质贮备供给植株营养[22]。切根贴膜处理1个月后,小黑杨叶绿体超微结构受到明显影响,随着断根强度的加大,叶绿体发生膨胀,有明显质壁分离现象,叶绿体片层模糊,淀粉粒体积变小,数量减少,嗜锇颗粒数量大量增加。叶绿体中淀粉粒的降解、嗜锇颗粒的增加说明植物体对胁迫采取了积极的防御措施,促进淀粉粒降解,合成更多的有机溶质,以调节渗透压[23]。叶绿体中淀粉粒的多少与植物光合作用及其他代谢能力有紧密联系,一定程度上能够反映植株的生长状况及胁迫后的恢复情况[24]。本研究发现,C1和C2处理在切根贴膜3个月后叶绿体中淀粉粒的数量和体积有明显增加现象,说明当距树干≥1 m处切根贴膜时,小黑杨叶肉细胞中叶绿体的功能得到了较快的恢复。
切根贴膜技术方法简单,具有投资少、见效快、回报高、能长时间发挥作用等特点[25]。林带经过切根贴膜技术改良后,胁地范围内作物长势显著提高,可以达到正常农田的90%以上[26]。每公顷胁地贴膜成本费为615元,扣除成本,当年每公顷增收4 424元[27]。在自然条件下,切根贴膜处理的有效作用时间可达15年以上[6]。切根沟深度主要取决于树木根系在土壤中分布状况,根据树种、林龄的不同一般选择在距地表为60~80 cm之间。林带切根沟与林带距离尚没有统一标准且缺乏理论支持。在本研究中,杨树通过改变自身的光合生理特性来适应切根贴膜所导致的水分胁迫,叶片气孔形态及叶绿体超微结构都发生了适应性变化,叶片净光合速率在切根贴膜3个月后基本恢复到对照水平,说明杨树因切根贴膜而导致的叶片结构与功能的损伤是可逆的。因此,距树干0.5~2 m处切根贴膜是可行的。但是,切根贴膜位置与树干距离越近,对树木根系的伤害越大,根系吸收水分和养料的空间越小,所需恢复时间越长。所以在不过多占用耕地的前提下,应尽量增加断根沟与林带的距离,保证树木有充分的水分和养料吸收空间。
另外,本研究结果只是反映了不同距离的切根贴膜处理对杨树光合生理特性、气孔特征及叶绿体超微结构一年的短期影响,而关于多年的作用效果还有待进一步研究。
-
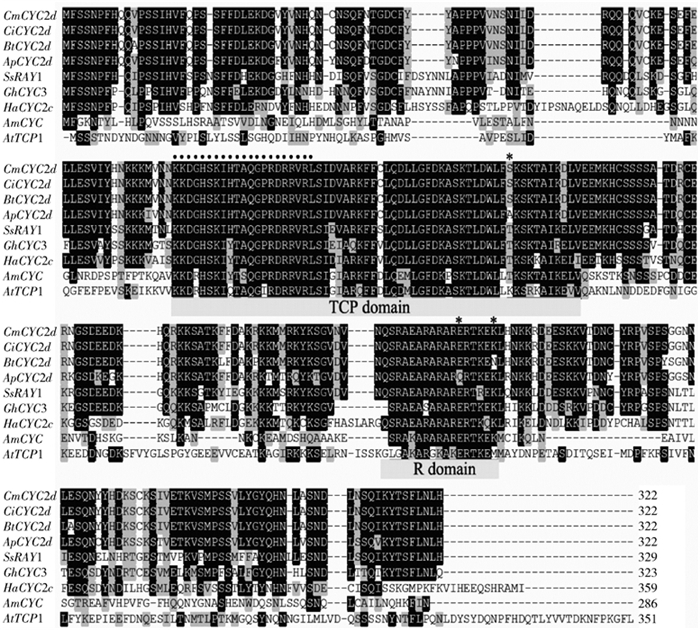
图 3 CYC2d同源基因氨基酸序列比对
*为川甘亚菊和戈壁短舌菊与菊花CYC2d基因在TCP和R结构域有差异的位点;黑圆点表示bHLH的核定位信号区。
Figure 3. Alignment of amino acid sequence of CYC2d homologues
* indicates the different sites in TCP and R domain of CYC2d proteins among Ajania potaninii, Brachanthemum titovii and Chrysanthemum; The black circle indicates the nuclear localization signal site.
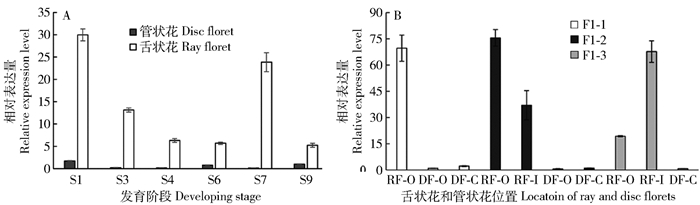
图 5 CmCYC2d在‘毛香玉’舌状花和管状花中的时空表达模式
A:小花不同发育时期CmCYC2d基因的表达分析。B: CmCYC2d在3个F1优株不同位置小花中的表达分析,其中:RF-O为外轮舌状花;RF-I为内轮舌状花;DF-O为外轮管状花;DF-C为中心管状花。
Figure 5. Temporal and spatial expression patterns of CmCYC2d in ray and disc florets of 'Mao xiangyu'
A: expression analysis of CmCYC2d during different stages of floret development. B: expression analysis of CmCYC2d at different floret locations of three F1 progenies. Tissues are outer ray florets (RF-O), inner ray florets (RF-I), outer disc florets (DF-O) and central disc florets (DF-C).
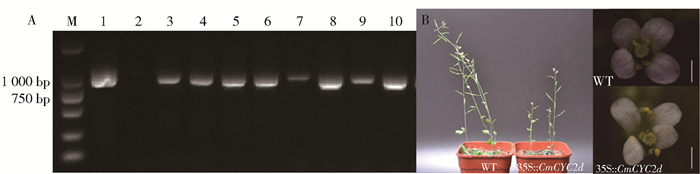
图 7 转基因拟南芥的PCR鉴定(A)及表型分析(B)
A: M,DNA Marker; 1和2分别为质粒和野生型对照; 3~10为转基因株系;B: CmCYC2d超表达影响了植株的营养、生殖生长及花瓣排列方式。标尺:1 mm。
Figure 7. PCR identification (A) and phenotype analysis (B) of CmCYC2d overexpressing Arabidopsis
A: M, DNA marker; 1 and 2 for plasmid and wild-type controls; 3-10 for transgenic lines. B: ectopic expression of CmCYC2d in Arabidopsis affecting vegetative and reproductive growth, as well as the arrangement of petals. Scale bars: 1 mm.
图 8 转基因拟南芥tcp1突变体的PCR鉴定及表型分析
A:M,DNA Marker 2000; 1为转空载对照; 2~11为CmCYC2d基因超表达tcp1突变体株系。B:CmCYC2d超表达抑制了根系的生长。C:CmCYC2d超表达推迟了花期。D和E:CmCYC2d超表达和空载株系的花。
Figure 8. PCR identification and phenotype analysis of CmCYC2d overexpressing Arabidopsis of tcp1 mutant
A: M, DNA marker; 1 for transgenic plants with empty vector; 2-11 for CmCYC2d overexpression tcp1 mutant lines. B: ectopic expression of CmCYC2d affecting growth of roots in positive transgenic lines; C: ectopic expression of CmCYC2d affecting flowering. D, E: flower types of the CmCYC2d overexpression lines and empty lines.
表 1 本研究所用引物序列
Table 1 Primer sequences used in this study
引物名称
Primer name引物序列(5′-3′)
Primer sequence (5′-3′)用途Use CYC2d -F1 ATGTTTTCCTCGAACCCTTTTCAT 同源克隆及半定量
RT-PCRHomology-based cloning and semi-quantitative RT-PCRCYC2d-R1 CTAGTGTAAATTTAGGAAACTTGTGTAC CnActin-F1 CACCTCTAAATCCTAAGGCTAACAG 半定量
RT-PCRSemi-quantitative RT-PCRCnActin-R1 GAACAATGGATGGGCCAGACTC CnActin-F2 CTGACAGGATGAGCAAGGAAATCAC 荧光定量
PCRQuantitative RT-PCRCnActin-R2 GAACAATGGATGGGCCAGACTC CmCYC2d-F1 TCCTCGAACCCTTTTCATCAACAG CmCYC2d-R1 GCTGCCTGTCCAAAATATTGCTGT CmCYC2d-F2 CCAAATCGACTCTAGAATGTTTTCCTCGAACCCTTTTC 亚细胞定位载体构建
Construction of pSUPER1300-CmCYC2d-GFPCmCYC2d-R2 TACCGGATCCACTAGTGTAGTGTAAATTTAGGAAACTTGTGTAC CmCYC2d-F3 GGACTCTTGACCATGGCTATGTTTTCCTCGAACCCTTTTC 转基因载体构建
Construction of pCAMBIA1304-CmCYC2dCmCYC2d-R3 CTTCTCCTTTACTAGTGTAGTGTAAATTTAGGAAACTTGTGTAC p1304-F1 ACACGGGGGACTCTTGAC 转基因植株鉴定
PCR identification of transgenic insertionp1304-R1 CAACAAGAATTGGGACAACTC p1300-F1 TCATAACCAATCTCGATACACCA p1300-R1 CTGAACTTGTGGCCGTTTACG 注:下划线处为酶切位点。Note:underlines are enzyme recognition sites. -
[1] GUSTAFSSON Å. Linnaeus' Peloria: the history of a monster[J]. Theoretical and Applied Genetics, 1979, 54(6): 241-248. doi: 10.1007/BF00281206
[2] LUO D, CARPENTER R, COPSEY L, et al. Control of organ asymmetry in flowers of Antirrhinum[J]. Cell, 1999, 99(1): 367-376. doi: 10.1016-S0092-8674(00)81523-8/
[3] LUO D, CARPENTER R, VINCENT C, et al. Origin of floral asymmetry in Antirrhinum[J]. Nature, 1996, 383: 794-799. doi: 10.1038/383794a0
[4] CUBAS P, VINCENT C, COEN E. An epigenetic mutation responsible for natural variation in floral symmetry[J]. Nature, 1999, 401: 157-161. doi: 10.1038/43657
[5] CUBAS P, LAUTER N, DOEBLEY J, et al. The TCP domain: a motif found in proteins regulating plant growth and development[J]. The Plant Journal, 1999, 18(2): 215-222. doi: 10.1046/j.1365-313X.1999.00444.x
[6] GAO Q, TAO J H, YAN D, et al. Expression differentiation of CYC-like floral symmetry genes correlated with their protein sequence divergence in Chirita heterotricha (Gesneriaceae)[J]. Development Genes and Evolution, 2008, 218(7): 341-351. doi: 10.1007/s00427-008-0227-y
[7] YANG X, PANG H B, LIU B L, et al. Evolution of double positive autoregulatory feedback loops in CYCLOIDEA2 clade genes is associated with the origin of floral zygomorphy[J]. The Plant Cell, 2012, 24(5): 1834-1847. doi: 10.1105/tpc.112.099457
[8] FENG X, ZHAO Z, TIAN Z, et al. Control of petal shape and floral zygomorphy in Lotus japonicus[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(13): 4970-4975. doi: 10.1073/pnas.0600681103
[9] REARDON W, GALLAGHER P, NOLAN K M, et al. Different outcomes for the MYB floral symmetry genes DIVARICATA and RADIALIS during the evolution of derived actinomorphy in Plantago[J]. The New Phytologist, 2014, 202(2): 716-725. doi: 10.1111/nph.12682
[10] KIM M, CUI M L, CUBAS P, et al. Regulatory genes control a key morphological and ecological trait transferred between species[J]. Science, 2008, 322: 1116-1119. doi: 10.1126/science.1164371
[11] CHAPMAN M A, LEEBENS-MACK J H, BURKE J M. Positive selection and expression divergence following gene duplication in the sunflower CYCLOIDEA gene family[J]. Molecular Biology and Evolution, 2008, 25(7): 1260-1273. doi: 10.1093/molbev/msn001
[12] BROHOLM S K, TAHTIHARJU S, LAITINEN R A, et al. A TCP domain transcription factor controls flower type specification along the radial axis of the Gerbera (Asteraceae) inflorescence[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(26): 9117-9122. doi: 10.1073/pnas.0801359105
[13] CHAPMAN M A, TANG S, DRAEGER D, et al. Genetic analysis of floral symmetry in Van Gogh's sunflowers reveals independent recruitment of CYCLOIDEA genes in the Asteraceae[J/OL]. PLoS Genet, 2012, 8(3): e1002628[2016-09-16]. http://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1002628.
[14] FAMBRINI M, SALVINI M, BASILE A, et al. Transposon-dependent induction of Vincent van Gogh's sunflowers: exceptions revealed[J]. Genesis, 2014, 52(4): 315-327. doi: 10.1002/dvg.22743
[15] JUNTHEIKKI-PALOVAARA I, TÄHTIHARJU S, LAN T, et al. Functional diversification of duplicated CYC2 clade genes in regulation of inflorescence development in Gerbera hybrida (Asteraceae)[J]. The Plant Journal, 2014, 79(5): 783-796. doi: 10.1111/tpj.12583
[16] GARC S H M P, SPENCER V M R, KIM M. Control of floret symmetry by RAY3, SvDIV1B and SvRAD in the capitulum of Senecio vulgaris [J/OL]. Plant Physiology, 2016, 10[2016-09-16]. http://www.plantphysiol.org/content/early/2016/05/12/pp.16.00395.abstract.
[17] HELARIUTTA Y, ELOMAA P, KOTILAINEN M, et al. Cloning of cDNA coding for dihydroflavonol-4-reductase (DFR) and characterization of dfr expression in the corollas of Gerbera hybrida var. regina (Compositae)[J]. Plant Molecular Biology, 1993, 22(1): 183-193.
[18] MANASSERO N G, VIOLA I L, WELCHEN E, et al. TCP transcription factors: architectures of plant form[J]. Biomolecular Concepts, 2013, 4(2): 111-127. https://www.ncbi.nlm.nih.gov/pubmed/25436570
[19] TAHTIHARJU S, RIJPKEMA A S, VETTERLI A, et al. Evolution and diversification of the CYC/TB1 gene family in Asteraceae: a comparative study in Gerbera (Mutisieae) and sunflower (Heliantheae)[J]. Molecular Biology and Evolution, 2012, 29(4): 1155-1166. doi: 10.1093/molbev/msr283
[20] HUANG D, LI X, SUN M, et al. Identification and characterization of CYC-like genes in regulation of ray floret development in Chrysanthemum morifolium [J]. Frontiers in Plant Science, 2016, 7[2016-09-16]. http://journal.frontiersin.org/article/10.3389/fpls.2016.01633.
[21] CITERNE H L, PENNINGTON R T, CRONK Q C. An apparent reversal in floral symmetry in the legume Cadia is a homeotic transformation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(32): 12017-12020. doi: 10.1073/pnas.0600986103
[22] TAKEDA T, SUWA Y, SUZUKI M, et al. The OsTB1 gene negatively regulates lateral branching in rice[J]. The Plant Journal, 2003, 33(3): 513-520. doi: 10.1046/j.1365-313X.2003.01648.x
[23] AGUILAR-MARTNEZ J A, POZA-CARRI N C, CUBAS P. Arabidopsis BRANCHED1 acts as an integrator of branching signals within axillary buds[J]. The Plant cell, 2007, 19(2): 458-472. doi: 10.1105/tpc.106.048934
[24] COSTA M M, FOX S, HANNA A I, et al. Evolution of regulatory interactions controlling floral asymmetry[J]. Development, 2005, 132(22): 5093-5101. doi: 10.1242/dev.02085
[25] HILEMAN L C. Bilateral flower symmetry: how, when and why?[J]. Current Opinion in Plant Biology, 2014, 17(3): 146-152. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0232220132/
[26] ALMEIDA J, ROCHETA M, GALEGO L. Genetic control of flower shape in Antirrhinum majus [J]. Development, 1997, 124(7): 1387-1392. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=HighWire000005683084
-
期刊类型引用(11)
1. 李鑫磊,杨传颖,石宝,敖乐根. 基于深度哈希与注意力机制的花卉图像检索. 计算机仿真. 2024(02): 207-211+532 .  百度学术
百度学术
2. 陈泽伟,乔印虎,周玉蝶. 基于机器视觉的白芍药材双面品质检测系统. 常州工学院学报. 2024(02): 1-7 .  百度学术
百度学术
3. 崔艳荣,卞珍怡,高英宁. 基于生成对抗网络的花卉识别方法. 江苏农业科学. 2022(22): 200-208 .  百度学术
百度学术
4. 何进荣,任维鑫,石延新,白宗文. 基于卷积神经网络的牡丹花品种识别. 系统仿真技术. 2021(02): 128-133 .  百度学术
百度学术
5. 吴丽娜,王林山. 改进的LeNet-5模型在花卉识别中的应用. 计算机工程与设计. 2020(03): 850-855 .  百度学术
百度学术
6. 黄清梅,杨晓洪,侯瑶,刘艳芳,吕宏斌. 显色图像分析技术在水稻叶耳花青甙显色目测分级中的应用. 食品安全质量检测学报. 2020(07): 2050-2056 .  百度学术
百度学术
7. 任意平,夏国强,李俊丽. 基于花蕊区域定位的花卉识别方法. 电子测量技术. 2020(07): 97-102 .  百度学术
百度学术
8. 李晓红,吴仲华,刘海秋,马慧敏. 基于卷积神经网络模型的多肉植物种类识别. 贵州师范学院学报. 2020(03): 9-15 .  百度学术
百度学术
9. 刘嘉政. 基于深度迁移学习模型的花卉种类识别. 江苏农业科学. 2019(20): 231-236 .  百度学术
百度学术
10. 刘文定,李安琪,张军国,谢将剑,鲍伟东. 基于ROI-CNN的赛罕乌拉国家级自然保护区陆生野生动物自动识别. 北京林业大学学报. 2018(08): 123-131 .  本站查看
本站查看
11. 张彤,刘志,庄新卿. 基于开发者平台和深度学习的智能识花与护花系统. 工业控制计算机. 2018(01): 90-92 .  百度学术
百度学术
其他类型引用(11)




 下载:
下载: